术前肺康复训练对肺癌患者术后肺炎的影响
2017-09-05周坤苏建华赖玉田李鹏飞吴砚铭车国卫
周坤 苏建华 赖玉田 李鹏飞 吴砚铭 车国卫
术前肺康复训练对肺癌患者术后肺炎的影响
周坤 苏建华 赖玉田 李鹏飞 吴砚铭 车国卫
目的 探讨术前肺康复训练是否有助于预防术后肺炎的发生。方法 回顾性分析华西医院胸外科2014年1月—2015年6月792例行手术治疗的肺癌患者的临床资料,其中肺康复训练组患者148例,常规治疗组644例患者,比较两组患者术后肺炎的发生率以及相关临床指标。同时,采用单因素和多因素分析术后肺炎的危险因素。 结果 肺康复训练组术后肺炎发生率显著低于常规治疗组,差异有统计学意义(8.1%vs15.8%,P=0.013);肺康复训练组抗生素使用时间、胸腔引流管留置时间、术后住院日及住院药费均显著低于常规治疗组,差异也均有统计学意义[(4.1±2.1)dvs(4.9±2.5)d,P<0.001;(3.8±2.3)dvs(4.3±2.8)d,P=0.023;(5.9±3.2)dvs(7.2±4.6)d,P<0.001; (7 354.3±2 743.2)元vs(8 265.2±3 126.5)元,P=0.001]。单因素和Logistic多元回归分析显示:术后肺炎发生的危险因素包括年龄>70岁(OR=6.998,95%CI:4.236~11.561,P<0.001)、吸烟史(OR=2.286,95%CI:1.145~4.456,P=0.019)、开胸手术(OR=1.990,95%CI:1.247~4.3.177,P=0.004)、手术时间>180 min(OR=7.228,95%CI:2.657~19.666,P<0.001);术前肺康复训练有助于降低术后肺炎的发生(OR=0.377,95%CI:0.188~0.756,P=0.006)。结论 术前肺康复锻炼能够降低肺癌患者术后肺炎的发生率,且有助于术后快速康复。
肺康复训练; 肺炎; 肺肿瘤; 加速康复外科
术后肺炎是肺癌患者术后严重的肺部并发症[1],也是延长术后住院日、增加住院费用的重要原因。文献报道肺切除术后肺炎发生率为6%~24%[2,3],是患者术后死亡的重要原因之一[4]。近年的研究表明,肺癌患者术后肺炎的高危因素主要包括高龄、较低的第一秒用力呼气量占用力肺活量百分率(percentage of forced expiratory volume in first second to forced vital capacity,FEV1%)、合并慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)、吸烟史、气道定植菌、手术时间延长等[5-8],而发生术后肺炎的患者长期预后也较差[9]。因此,对肺癌患者术后肺炎的预防一直是外科医师关注的重点之一。随着加速康复外科(enhanced recovery after surgery,ERAS)理念在临床地推广和深入,术前肺康复锻炼对肺癌患者的临床价值日益显现。有研究[10]显示,肺癌合并高危因素的患者进行肺康复锻炼可以减轻呼吸系统疾病的症状,增加运动耐力并且降低术后心肺并发症的发生率。本研究通过单中心大样本回顾分析,旨在评价术前肺康复训练对肺癌患者术后肺炎的影响,为肺癌患者术后加速康复提供循证学证据。
对象与方法
一、 研究对象
1. 资料来源:回顾性收集2014年1月—2015年6月在四川大学华西医院胸外科住院治疗的876例肺癌患者的临床资料。
2. 病例纳入和排除标准
(1) 纳入标准:①术后病理诊断为非小细胞癌;②手术方式为肺叶切除术+系统淋巴结清扫;③年龄>50岁。
(2) 排除标准:①术前存在心律失常、心肌梗死、脑梗死等心脑血管疾病史者;②术前接受过放化疗者;③术前存在明确肺部感染者;④术前1周内行抗生素治疗;⑤临床病历记录不完整者。
根据以上纳入和排除标准,最终排除84例,纳入792例。
3. 分组
(1) 肺康复训练组(n=148):入组标准满足以下1项高危因素者即可进入肺康复流程。①年龄>75岁;②吸烟史≥400年/支,戒烟≥15 d;③哮喘或气道高反应性(airway high response,AHR);④呼气峰流速(peak expiratory flow,PFE)≤250 L/min;⑤FEV1<1.0 L或PaCO2>45 mmHg(1 mmHg=0.133 kPa)。肺康复训练患者来自单个医疗组,均签署知情同意书,试验已通过四川大学华西医院临床试验与生物医学专委会伦理,并在中国临床试验注册中心注册,注册码为ChiCTR-IOR-16008109。术后分期采用国际抗癌联盟(Union for International Cancer Control,UICC)[11](第八版)肺癌分期标准。
(2) 常规治疗组(n=644):采用常规治疗方法,所有患者签署知情同意书。
二、 方法
1. 手术方法:采用开胸或单向式胸腔镜肺叶切除+系统淋巴结清扫,左侧必须清扫第5~10组淋巴结,右侧包括第2~4、7~10组淋巴结[12]。
2. 引流管应用方法:胸腔引流管统一选用扬州市邗江华飞医疗器件厂生产的一次性使用硅橡胶28F和16F引流管,应用单引流管将16F或28F硅橡胶引流管从第7肋间镜孔经后胸胸壁向上直达胸顶,不需另加侧孔,术后均应用相同的水封引流瓶,且不加用负压吸引[13];16F组不加用留置线,28F组需应用留置线。
三、 肺康复训练流程
肺康复训练于术前5~7 d开始。
1. 药物康复:①雾化吸入支气管扩张剂和糖皮质激素治疗:特布他林2 ml+布地奈德4 ml,每天2次,雾化吸入;②祛痰:福多司坦片0.4 g,每天3次,口服(术前3~5 d,术后5 d)。
2. 呼吸肌训练
(1) 腹式呼吸训练:患者取平卧位,腘窝处用枕头垫高,双腿并拢稍屈曲,双手贴紧腹部,经鼻缓慢深吸气到最大肺容量后稍屏气,然后用口缓慢呼气,吸气时腹部外凸,呼气时腹部内凹。连续进行20~30次(总时间10~15 min),每天2次。
(2) 激励式肺计量器(Voldyne 5000呼吸训练器):根据患者身高体重设定对应的目标值,将指针移到目标刻度。患者取坐位,用嘴自然呼气,尽可能呼出肺内气体,正常呼气后用嘴含紧吸气,缓慢深吸气,吸气速度不可过快,流速浮标应维持在推荐范围,直到吸气至最大限度,屏气2~3 s,然后移开吸气嘴正常呼气。重复练习,每次20 min,每天4次[14]。
3. 有氧耐力训练
(1) 四肢联动(Nustep)锻炼:根据患者肌力调控阻力,患者自行调控速度,在可承受范围内加快运动速度。运动量控制在BORG评分5~7分之间,若在运动过程中有明显气促、下肢疲倦、血氧饱和度下降(<88%)或其他并存疾病引起身体不适,嘱患者休息,待恢复原状后再继续进行训练。每次15~30 min,每天1次。
(2) 爬楼梯训练:在专业治疗师陪同下进行,运动过程中调整呼吸节奏,采用缩唇呼吸。用力时呼气,避免闭气,稍感气短时可坚持进行;若有明显呼吸困难,可做短暂休息,尽快继续运动。每次15~20 min,每天1次[14]。
四、 观察指标
1. 术后肺炎[15]:是指术后胸部X线片出现新发渗出、实变或空洞影,同时满足以下一项或更多条件:①出现脓痰或者有病原学证据;②体温>38 ℃;③白细胞计数<4 ×109/L或>12×109/L;④术后更换抗生素类别或延长使用时间。
2. 手术时间:切皮开始到关胸结束时间。
3. 抗生素使用时间:手术后第1天直至使用结束。
4. 住院费用:住院期间所产生的费用,不包括门诊检查或治疗所产生的费用。
5. 术后住院日:手术当日到出院当日时间(出院当日不计算在内)。
五、 统计学分析

结 果
一、 两组患者一般临床资料分析
肺康复训练组和常规治疗组患者在平均年龄、性别构成、肺功能、吸烟史、合并症、手术方式及肺癌临床分期方面比较,差异均无统计学意义(P>0.05)(表1)。
二、两组患者术后临床结果分析
肺康复训练组患者术后肺炎发生率显著低于常规治疗组(8.1%vs15.8%,P=0.016);术后抗生素使用时间、胸腔引流管留置时间和住院日均显著短于常规治疗组,差异也有统计学意义(P<0.05)。两组患者的手术时间、术中出血量比较,差异无统计学意义(P>0.05)。两组患者的住院总费用比较,差异也无统计学意义(P>0.05);但肺康复训练组的住院药费明显低于常规治疗组,差异有统计学意义[(7 354.3±2 743.2)元vs(8 265.2±3 126.5)元,P=0.023](表2)。
三、术后肺炎危险因素分析
1. 单因素分析:根据患者术后是否发生肺炎将患者分为术后肺炎组(n=114)和无术后肺炎组(n=678)。卡方检验显示,两组患者的年龄、性别、吸烟史、合并糖尿病和COPD、手术方式、FEV1、手术时间及临床分期比较,差异均有统计学意义(P<0.05);但两组间BMI和是否合并高血压比较,差异均无统计学意义(P>0.05)(表3)。
2. 多因素分析:Logistic多元回归分析显示,术前肺康复干预是术后肺炎的保护因素(OR=0.377,95%CI:0.188~0.756,P=0.006),而年龄>70岁(OR=6.998,95%CI:4.236~11.561,P<0.001)、吸烟史(OR=2.286,95%CI:1.145~4.456,P=0.019)、开胸手术(OR=1.990,95%CI:1.247~4.3.177,P=0.004)、手术时间>180 min(OR=7.228,95%CI:2.657~19.666,P<0.001)是术后肺炎的独立危险因素(表4)。
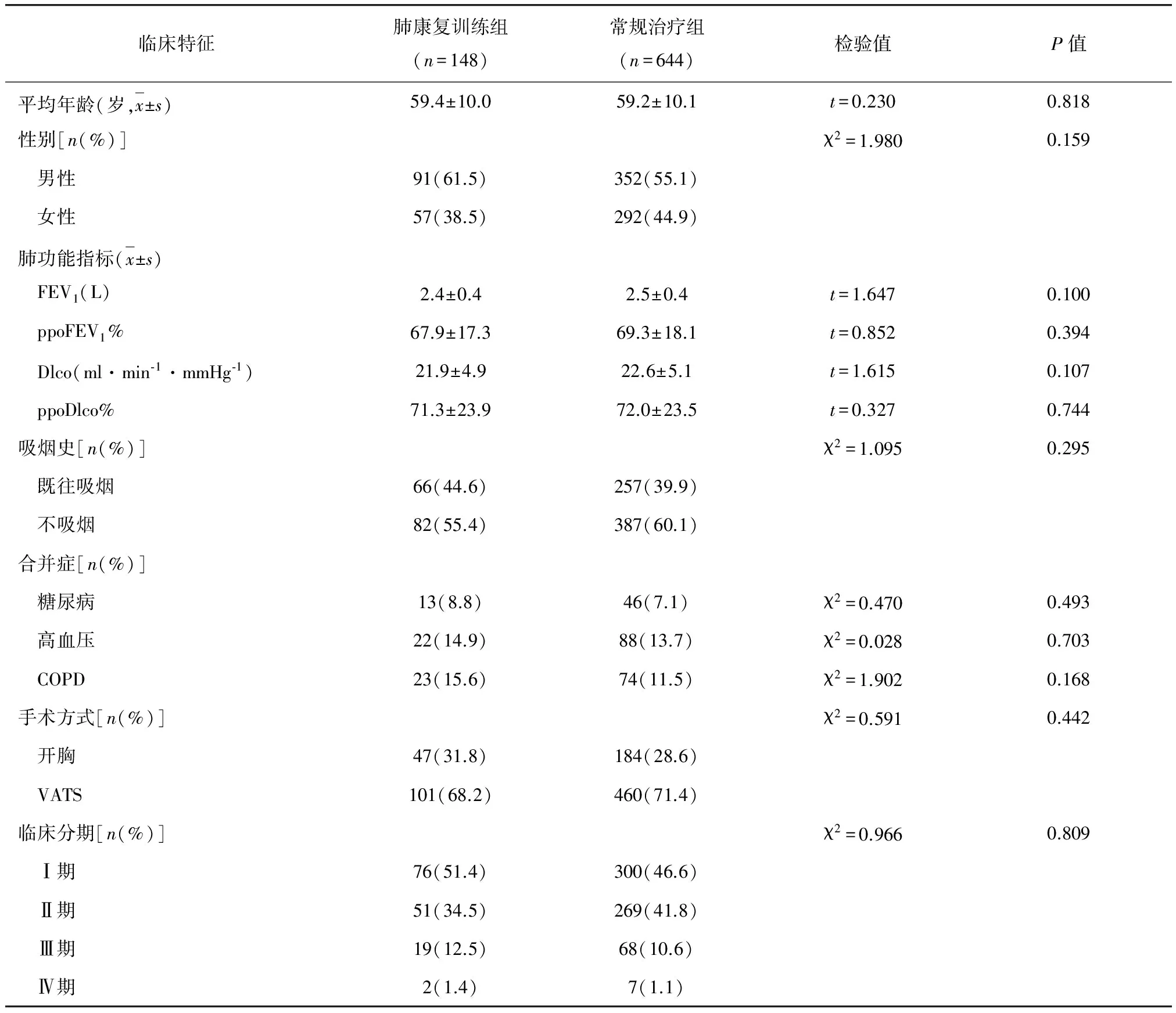
表1 肺康复训练组和常规治疗组患者一般临床资料比较
注:FEV1(一秒用力呼气容积);ppoFEV1%(术后预计一秒用力呼气容积百分比);Dlco(一氧化碳弥散量);ppoDlco%:(术后预计一氧化碳弥散量百分比);COPD(慢性阻塞性肺疾病);VATS(电视辅助胸腔镜手术)
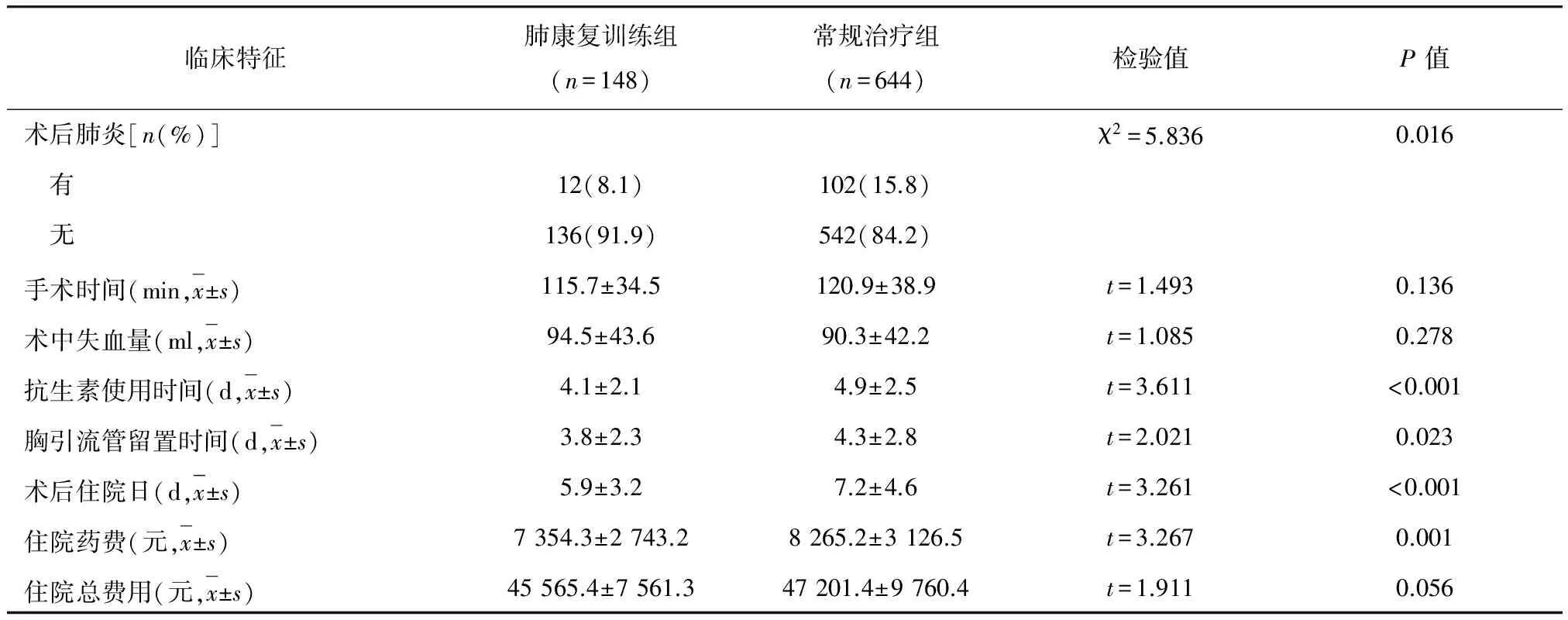
表2 两组患者术后相关临床指标比较
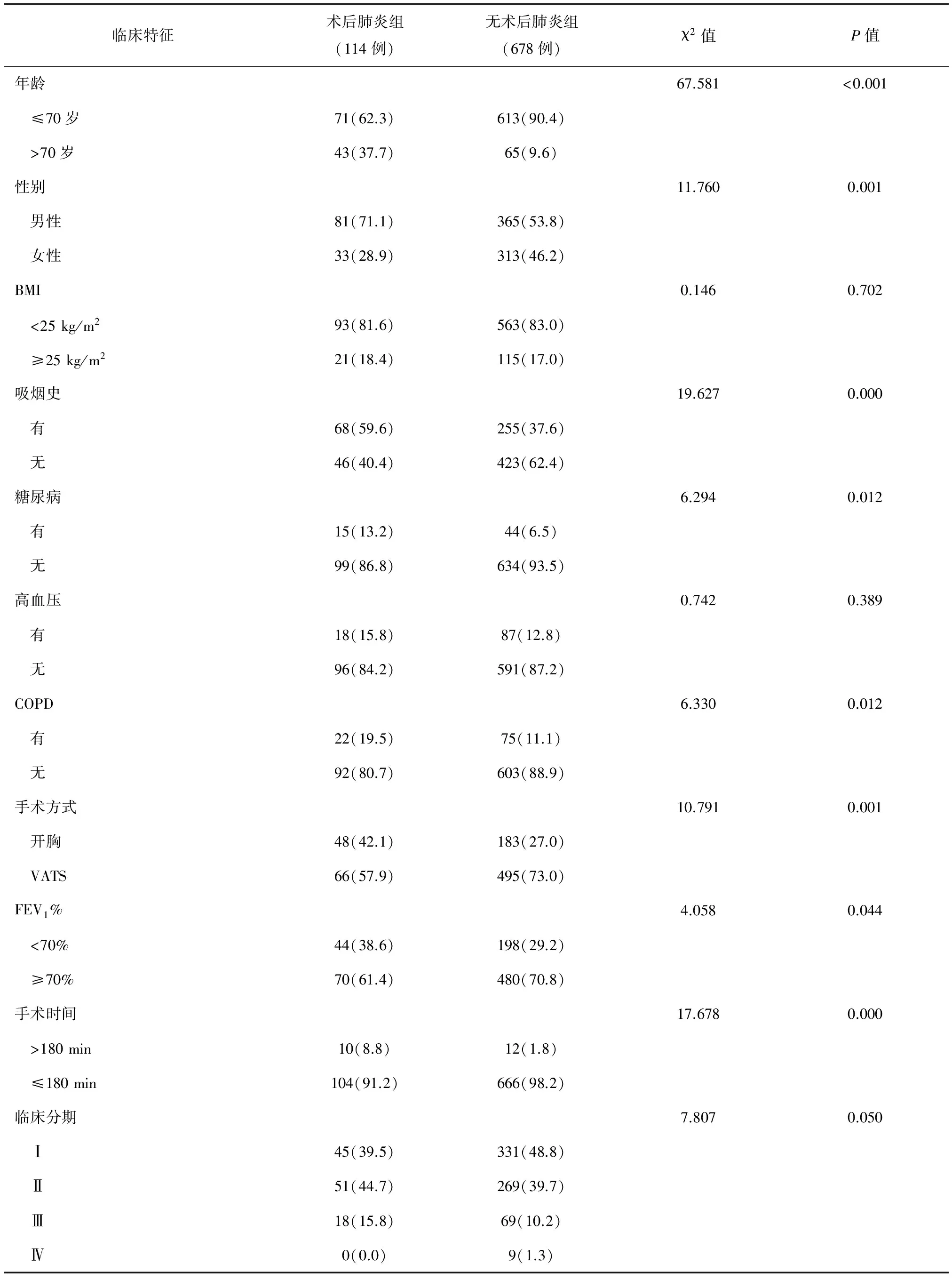
表3 单因素分析术后肺炎的危险因素[n(%)]
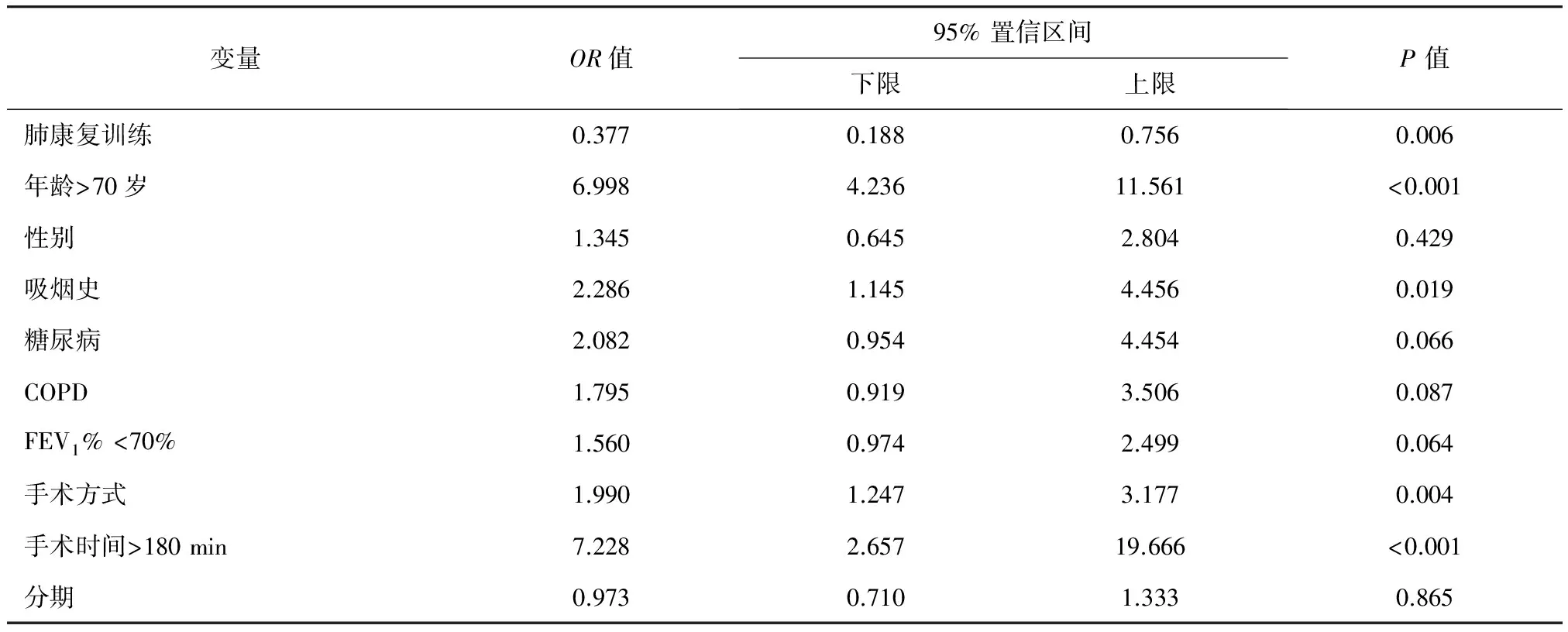
表4 Logistic多元回归分析术后肺炎危险因素
讨 论
肺癌患者肺切除术后是肺部感染的高发期,尽管预防性应用抗生素,但术后肺炎的发生率仍可高达20%[16]。随着医疗技术和管理的进步以及早期肺癌患者的比例不断提高[17],肺癌术后并发症谱也在不断变化,肺炎是肺切除术后最主要的肺部并发症[18]。Andalib等[9]发现,肺癌术后发生肺部感染的患者5年生存率显著低于未发生肺部感染的患者(56.3%vs64.1%,P<0.001)。因此,针对肺癌术后肺炎的危险因素进行适当干预,不仅符合ERAS的理念和实践,患者也会获得远期收益。
本研究发现,肺癌术后肺炎的独立危险因素包括年龄>70岁、有吸烟史、手术时间超过180 min以及手术方式。高龄是术后肺炎的重要原因,高龄患者肺功能和呼吸肌力量退化明显,术后咳嗽效率和呼吸代偿能力差。Lee等[2]的研究同样提示,年龄>70岁是术后肺炎的独立危险因素。吸烟是导致COPD最主要的原因,患COPD的风险与吸烟指数呈正比[19],非吸烟者术后肺炎发生率显著低于吸烟者。长期吸烟不仅可使支气管黏膜的纤毛受损,影响纤毛的清除功能,还使肺的储备功能下降。有研究[20,21]显示,仅仅短期(<1个月)戒烟并不能改善患者肺功能和术后肺炎的发生率。因此,在戒烟基础上进行肺康复训练是改善肺生理状态的重要手段。合并COPD的肺癌患者,体内炎症因子水平较高,咳嗽机制受损(呼气峰流速明显降低,纤毛摆动能力受损),上肢和下肢耐力差,且呼吸肌功能往往较虚弱,是肺康复训练的重点关注人群[22]。
本研究中肺康复包括药物康复和物理康复,药物康复可以抑制呼吸道炎症反应、缓解气道高反应、稀释痰液。激励式吸气训练和腹式呼吸可以使患者肺泡充分打开,有助于分泌物的排除[23]。上下肢的耐力锻炼可以增强呼吸肌力量和心肺功能,呼吸肌的强弱与呼吸困难程度、咳嗽、排痰能力有关[24]。通过对呼吸肌尤其是吸气肌训练,可以明显改善患者的呼吸功能,减轻患者的呼吸困难症状,促进患者术后咳嗽、排痰,降低术后肺部感染和肺不张的风险。四肢联动(Nustep)的康复运动功能特点包括:①主动运动,提高患者躯体控制能力、平衡能力以及核心肌群能力;②由于运动方式模拟功能性训练,可有效改善、维持各关节活动强度;③达到上下肢同时运动的效果。登楼梯试验是评估肺切除患者手术风险的良好指标[25],同时能够提高下肢耐力和最大耗氧量,并且简易经济,可操作性强。本研究结果显示,经过短期高强度的肺康复训练,患者术后肺炎发生率明显降低(8.1%vs15.8%,P=0.016),并且抗生素使用时间、胸引流管留置时间、术后住院日均短于常规治疗组。虽然肺康复增加了患者术前治疗费用,但降低了术后药费,总体住院费用反而低于常规治疗组。
综上所述,术前肺康复训练可有效降低肺癌患者发生术后肺炎,减少术后住院日,达到术后快速康复的目的。但本研究还存在一定的不足,如回顾性分析存在临床资料失真和偏倚;外科术后肺炎的诊断尚无统一的标准,因此存在高估或者低估术后肺炎发生率的可能;对肺康复的人群选择和锻炼时间需要进一步研究,达到经济和收益的平衡点;本研究为单中心回顾研究,仍需前瞻性、多中心实验加以论证。
1 Shiono S, Abiko M, Sato T. Postoperative complications in elderly patients after lung cancer surgery[J]. Interact Cardiovasc, 2013, 16(6):819-823.
2 Lee JY, Jin SM, Lee CH, et al. Risk factors of postoperative pneumonia after lung cancer surgery[J]. J Korean Med Sci, 2011, 26(8):979.
3 Radu D, Jaureguy FA, Foulon C, et al. Postoperative pneumonia after major pulmonary resections: an unsolved problem in thoracic surgery[J]. Ann Thorac Surg, 2007, 84(5):1669-1673.
4 Schussler O, Alifano M, Dermine H, et al. Postoperative pneumonia after major lung resection[J]. Am J Respir Crit Care Med, 2006, 173(10):1161-1169.
5 Nan DN, Fernández-Ayala M, Farias-Alvarez C, et al. Nosocomial infection after lung surgery: incidence and risk factors [J]. Chest, 2005, 128(4):2647-2652.
6 Yamada Y, Sekine Y, Suzuki H, et al. Trends of bacterial colonisation and the risk of postoperative pneumonia in lung cancer patients with chronic obstructive pulmonary disease[J]. Eur J Cardiothorac Surg, 2010, 37(4):752.
7 Shiono S, Yoshida J, Nishimura M, et al. Risk factors of postoperative respiratory infections in lung cancer surgery[J]. J Thorac Oncol, 2007, 2(1):34-38.
8 Mei J, Liu L, Tang M, et al. Airway bacterial colonization in patients with non-small cell lung cancer and the alterations during the perioperative period[J]. J Thorac Dis, 2014, 6(9):1200-1208.
9 Andalib A, Ramana-Kumar AV, Bartlett G, et al. Influence of postoperative infectious complications on long-term survival of lung cancer patients: a population-based cohort study[J]. J Thorac Oncol, 2013, 8(5):554-561.
10 赖玉田, 苏建华, 杨梅, 等. 术前短期综合肺康复训练对肺癌合并轻中度慢性阻塞性肺病患者的影响:一项前瞻性随机对照试验[J]. 中国肺癌杂志, 2016, 19(11): 746-753.
11 Goldstraw P, Chansky K, Crowley J, et al. The IASLC Lung Cancer Staging Project: Proposals for Revision of the TNM Stage Groupings in the Forthcoming (Eighth) Edition of the TNM Classification for Lung Cancer[J]. J Thorac Oncol, 2016, 11(1):39-51.
12 Liu L, Che G, Pu Q, et al. A new concept of endoscopic lung cancer resection: single-direction thoracoscopic lobectomy[J]. Surg Oncol, 2010, 19(2):e71-e77.
13 杨梅, 樊骏, 周红霞, 等. 胸腔镜肺癌肺叶切除术后16F较28F胸腔引流管应用的临床优势[J]. 中国肺癌杂志, 2015, 18(8):512-517.
14 苏建华, 喻鹏铭, 周渝斌, 等. 影响肺癌手术住院费用和快速康复的临床因素分析[J]. 中国肺癌杂志, 2014,17(7): 536-540.
15 Miskovic A, Lumb A B. Postoperative pulmonary complications[J]. Br J Anaesth, 2017. 118 (3): 317-34 (2017)
16 Bernard A, Ferrand L, Hagry O, et al. Identification of prognostic factors determining risk groups for lung resection[J]. Ann Thorac Surg, 2000, 70(4):1161-1167.
17 赖玉田, 田龙, 樊骏,等. 肺癌住院手术患者临床特征与就诊模式的关系[J]. 中国肺癌杂志, 2015(7):457-461.
18 Agostini P, Cieslik H, Rathinam S, et al. Postoperative pulmonary complications following thoracic surgery: are there any modifiable risk factors? [J] Thorax, 2010, 65(9):815.
19 Wang B, Xiao D, Wang C. Smoking and chronic obstructive pulmonary disease in Chinese population: a meta-analysis[J]. Clin Respir J, 2014, 9(2):165-175.
20 Barrera R, Shi W, Amar D, et al. Smoking and timing of cessation.Impact on pulmonary complications after thoracotomy[J]. Chest 2005;127:1977-1983
21 Groth SS, Whitson BA, Kuskowski MA, et al. Impact of preoperative smoking status on postoperative complication rates and pulmonary function test results 1-year following pulmonary resection for non-small cell lung cancer[J]. Lung Cancer, 2009, 64(3):352-7.
22 Celli BR, Decramer M, Wedzicha JA, et al. An official American Thoracic Society/European Respiratory Society statement: research questions in COPD[J]. Eur Respir J, 2015, 45(4):879-905
23 Sokol G, Vilozni D, Hakimi R, et al. The short-term effect of breathing tasks via an incentive spirometer on lung function compared with autogenic drainage in subjects with cystic fibrosis[J]. Respir Care, 2015, 60(12):1819-1825.
24 Beaumont M, Mialon P, Bermoy C L, et al. Inspiratory muscle training during pulmonary rehabilitation in chronic obstructive pulmonary disease: a randomized trial[J]. Chron Respir Dis, 2015, 12(4):101-103.
25 Brunelli A, Kim AW, Berger KI, et al. Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines[J]. Chest, 2013, 143(5):e166S.
(本文编辑:周珠凤)
Effect of preoperative pulmonary rehabilitation on postoperative pneumonia in patients with lung cancer
ZhouKun,SuJianhua,LaiYutian,LiPengfei,WuYanming,CheGuowei.
DepartmentofToracicSurgery,WestChinaHospital,SichuanUniversity,Chengdu610041,China
CheGuowei,Email:guowei_che@yahoo.com
Objective The purpose of this study was to investigate whether preoperative pulmonary rehabilitation could prevent postoperative pneumonia. Methods Retrospective research was conducted on 792 lung cancer patients who underwent lobectomy at the West China Hospital of Sichuan University from January 2014 to July 2015. The patients were divided into two group including 148 patients with pulmonary rehabilitation and 644 patients without pulmonary rehabilitation; the incidence of postoperative pneumonia and the related clinical data were compared between the two groups. ResultsThe incidence of postoperative pneumonia in the pulmonary rehabilitation group was significantly lower than that in the non-pulmonary rehabilitation group (8.1%vs15.8%,P=0.013); The antibiotic use time, chest tube duration, postoperative hospital stay and drug costs in pulmonary rehabilitation group were statistically lower than non-pulmonary rehabilitation group [(4.1±2.1)dvs(4.9±2.5)d,P<0.001; (3.8±2.3)dvs(4.3±2.8)d,P=0.023; (5.9±3.2)dvs(7.2±4.6)d,P<0.001; (7 354.3±2 743.2)¥vs(8 265.2±3 126.5)¥,P=0.001]. The risk factors of postoperative pneumonia include age>70 years (OR=6.998,95%CI:4.236-11.561,P<0.001) , smoking history(OR=2.286, 95%CI: 1.145-4.456,P=0.019),thoracotomy(OR=1.990, 95%CI: 1.247-4.3.177,P=0.004)and duration of surgery>180 min(OR=7.228, 95%CI: 2.657-19.666,P<0.001). Conclusions Preoperative pulmonary rehabilitation can reduce the incidence of postoperative pneumonia(OR=0.377, 95%CI: 0.188-0.756,P=0.006)and enhance recovery after surgery in patients with lung cancer.
Pulmonary rehabilitation; Pneumonia; Lung neoplasms; Enhanced recovery after surgery
10.3877/cma.j.issn.2095-8773.2017.03.07
四川省科技厅基金项目资助(2015SZ0158)
610041 成都,四川大学华西医院胸外科
车国卫,Email: guowei_che@yahoo.com
2017-05-10)
卢礼卿,程远大,张春芳.单孔胸腔镜手术无胸管留置在胸外科快速康复中的应用[J/CD]. 中华胸部外科电子杂志,2017,4(3):159-163.
