食管癌加速康复外科治疗的进展及展望
2017-09-05李印孙海波
李印 孙海波
食管癌加速康复外科治疗的进展及展望
李印 孙海波
加速康复外科(ERAS)是以病人为中心,以外科为主导,结合麻醉、护理、营养、心理等多学科团队,旨在减轻围手术期创伤应激反应,维护患者生理功能的一系列措施,从而达到促进患者康复的目的。ERAS的理念和模式最先是应用于结直肠外科领域,随后广泛应用于其他外科领域。由于食管癌外科手术的复杂性和较高的并发症发生率,极大限制了ERAS在食管癌中的应用和推广。究其根本,制约ERAS在食管癌外科领域推广的是术后并发症,尤其是外科技术并发症(如胸胃相关并发症)未得到有效控制。近年来,随着胸腹腔镜微创技术的日益成熟、组织器官保护理念的重视、管状胃技术的提高、吻合技术的突破和一些突破传统认识新理念的提出和应用,ERAS在食管癌外科领域取得了突破性进展。“昨天手术,今天吃饭,5~7天出院”,以“免管免禁”微创外科技术为特色的食管癌ERAS模式在个别中心已成为成熟的治疗模式。未来的关键在于对这一治疗模式不断完善并进行系统培训和推广,以期在更多医疗中心推广应用,促进多中心临床研究,以不断充实和完善,从而形成普遍的专家共识。
食管癌; 加速康复外科; 临床路径
食管癌是我们国家的特色性疾病,中国食管癌的新发病人数占全球食管癌新发病总人数的一半以上[1],我国食管癌患者高发区多分布在贫困山区[2]。对可切除的食管癌患者而言,食管切除、区域淋巴结清扫并消化道重建仍然是治疗食管癌的标准治疗方法。虽然现代麻醉及外科技术降低了食管切除的风险,但总体而言食管癌手术创伤大、术后并发症和病死率高。据统计,食管癌术后并发症发生率高达70%~80%,住院病死率也高达4%~7%[3]。最近,微创手术在食管癌外科治疗中占据越来越重要的地位[4-6]。尽管目前食管癌的外科治疗已经进入微创时代,但食管癌微创术后的恢复依然很慢。食管癌手术的创伤、各种管道,例如:尿管、胸管、腹腔管、胃管、鼻肠营养管(或空肠造瘘管)等的放置以及术后较长时间的禁食导致了患者术后应激反应重、恢复慢,这也是食管癌外科治疗的瓶颈。
加速康复外科(enhanced recovery after surgery,ERAS)是以病人为中心,以外科为主导,结合麻醉、护理、营养、心理等多学科团队,旨在减轻围手术期创伤应激反应、维护患者生理功能的一系列措施,从而达到促进患者康复的目的[7-9]。ERAS的理念和模式在临床上应用已有20多年历史,最先应用于结直肠外科领域,随后广泛应用于其他外科领域。ERAS理念及治疗模式可弥补传统外科原则的不足[7, 8]。ERAS在胃肠外科等其他外科领域中的应用和不断完善,为ERAS在食管癌外科这一手术复杂、并发症高的领域的探索和应用研究提供了极好的参考价值[10-12]。
一、 食管癌ERAS治疗的内容
1. 术前准备:有关食管癌ERAS治疗方案的术前准备见表1。ERAS措施能否施行的关键首先是让患者明白自己在整个ERAS中的作用。因此,除了向患者及家属介绍与手术相关的医学知识外,还要进行ERAS计划的宣教,使其有心理准备,减少焦虑和紧张,并取得配合[13]。对于传统的食管癌外科治疗术前都需要常规进行肠道准备,但由于口服强泻药和灌肠可导致或加重术前脱水及电解质平衡紊乱[14, 15],因此ERAS治疗方案中抛弃了传统灌肠等肠道准备。另外,ERAS方案中麻醉前不用药以避免不良反应[16]。目前关于超前镇痛尚存在颇多争议,但总体上来讲,应用硬膜外、非甾体抗炎药(nonsteroidal anti- inflammatory drug,NSAIDs)和局部浸润麻醉的方法进行超前镇痛还是行之有效的。
2. 术中措施:有关食管癌ERAS治疗方案的术中措施见表2。ERAS要求的麻醉需提供最好的术中条件、加快麻醉后恢复、避免术后不良反应及早期并发症、降低术后应激反应、充分止痛消除不适、加速术后功能重建等。全身麻醉加硬膜外麻醉可减少全身麻醉药物的使用,术后还可进行持续硬膜外给药止痛,以减少阿片类药物的使用,减少术后相关并发症,促进加速康复[17]。食管癌手术方式多种多样,根据我们的经验与开胸手术相比,采用微创手术方式更符合ERAS的要求。需要强调的是,食管癌ERAS治疗是以降低术后并发症为基础。无论开放或微创手术,只要能将术后并发症控制在较低的水平均可进行ERAS治疗模式。对于术中液体的控制是ERAS治疗方案中重要的一个环节[18],传统做法通常是在手术当天输入3 000~5 000 ml液体,这很容易引起液体潴留,组织水肿可引起胃肠道吻合口及切口愈合延迟。术中避免低温也是ERAS的重要措施,Sessler[19]的研究显示低温可以引起手术患者认知障碍并加剧术后应激反应。另外,ERAS治疗措施中限制了引流管的应用,如腹腔和颈部引流管。目前,在我们的ERAS治疗方案中,患者术后只保留一根较细的纵隔管,可以有效降低患者术后的疼痛评分,加速患者康复。

表1 食管癌患者ERAS与传统治疗术前准备的比较
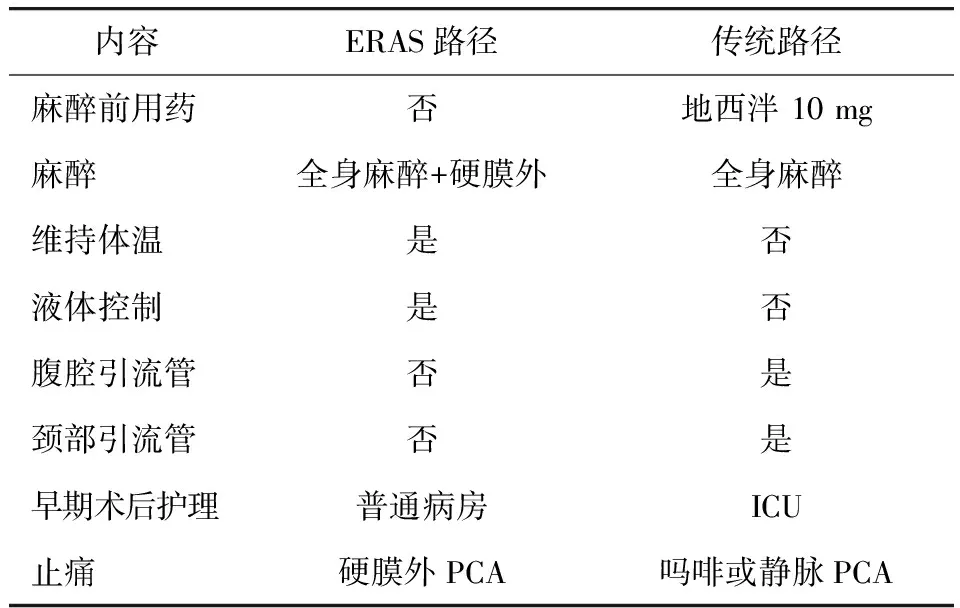
表2 食管患者癌ERAS与传统治疗术中措施比较
注:ICU表示重症监护病房;PCA表示患者自控镇痛
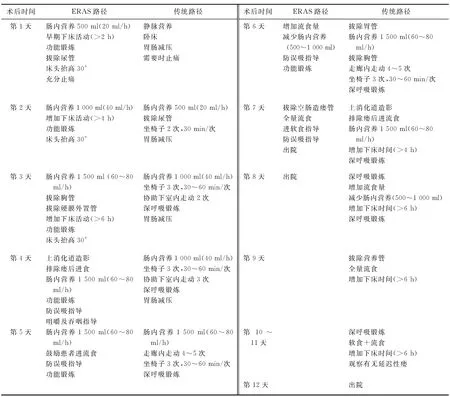
3. 术后措施:既往发表的有关食管癌ERAS治疗方案的术后措施见表3。充分止痛是ERAS计划中的一个重要环节,也是有利于早期下床活动及早期进食的必要前提,对减少手术应激反应很重要[20]。之前的研究提示,对术后患者选择性使用持续硬膜外止痛、患者自控止痛(patient controlled analgesia,PCA)及使用NSAIDs代替阿片类止痛药等多模式止痛方法,可明显减少恶心呕吐、腹胀便秘等不适反应[21]。我们推荐食管癌患者围手术期应用多模式镇痛方法,术前给予NSAIDs药物超前镇痛,关闭切口时应用罗哌卡因进行切口浸润麻醉、术后进行NSAIDs药物镇痛,尽量减少阿片类止痛药物的应用,从而减少由此类药物引起的肠功能延迟恢复的影响,加速患者康复。另外,经临床观察发现,剑突下切口是食管癌微创术后患者感觉最疼痛的切口,因此,我们采用剑突下切口留置局部浸润麻醉管道的方法降低患者的疼痛评分,取得了较好的临床效果。早期下床活动是所有ERAS治疗方案中需要强调的内容,下床活动以及功能锻炼可以让患者更快地恢复。术后早期肠内营养是食管癌ERAS的重要内容,传统治疗方案中以是否排气或肠鸣音作为应用肠内营养的指征。但是动物实验和临床观察已表明,术前功能正常的小肠大多在术后几小时便已恢复蠕动,约12 h就能吸收营养物质,因而为术后早期肠内营养的实施提供了理论依据[22]。尽管在既往的食管癌ERAS方案中提倡早期进行肠内营养,但对于术后经口进食的时间并不统一。另外,尽早拔除胸管、尿管以及胃肠减压管是食管癌ERAS治疗中的重要措施。我们既往的研究[23]提示,食管癌腔镜手术不常规留置胃肠减压管是安全、可行的,可减少患者不适,加速胃肠道功能早期恢复。
表3 食管癌患者ERAS与传统治疗术后路径比较
二、 食管癌ERAS治疗的现状
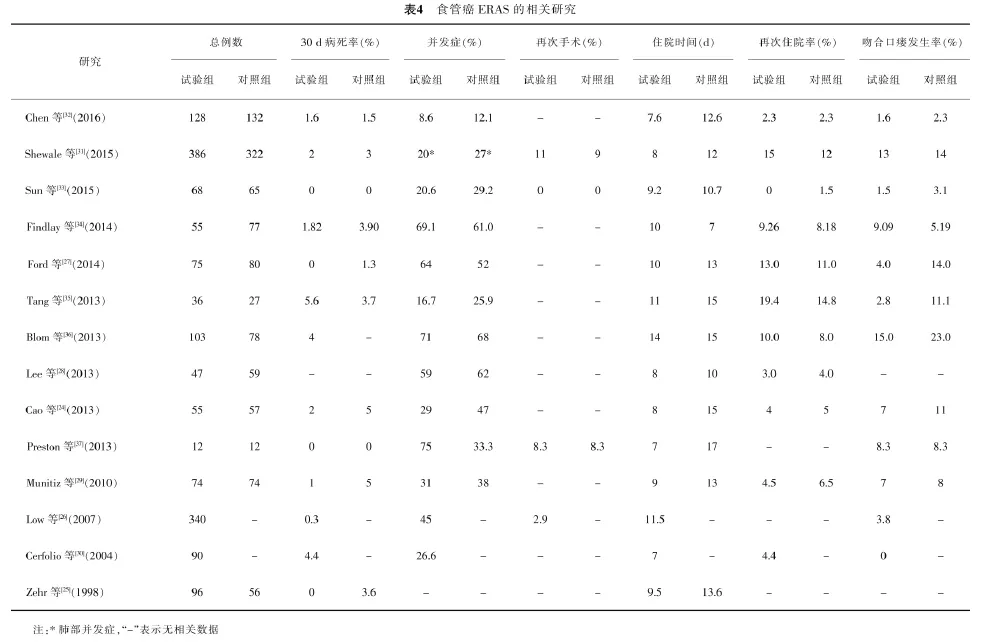
有关ERAS的研究多集中在普外科,特别是结直肠手术中的应用。既往有关食管癌ERAS相关的研究较少,表4总结了过去有关食管癌ERAS相关治疗的研究。其中Cao和Zehr等[24,25]的研究在术前并没有告知患者有关ERAS的治疗方案。在所列的研究中只有一项研究在术前应用了碳水化合物[24],说明术前应用碳水化合物在食管外科的治疗中并没有像结直肠ERAS治疗方案中那么普及。大部分研究应用了硬膜外止痛的方法。对于入住重症监护病房(intensive care unit,ICU)治疗的方案之前的研究并不一致。在早期食管癌ERAS研究中包含术后常规入住ICU[25];但在最近发表的相关ERAS方案多不常规入住ICU,并且在术后常规拔除气管插管。
既往的食管癌ERAS治疗方案中,几乎所有的研究都采用了早期下床活动的治疗措施,并且提倡早期肠内营养治疗和早期拔除胸管。但在术后是否常规行消化道造影的问题上观点并不一致。既往研究中胃管拔除时间从术后第1天到术后第6天不等,但多为术后第5天;ERAS方案中出院时间为术后7~10 d。对于食管癌ERAS研究方案的依从性既往报道并不一致,但样本量较大的研究[26]结果显示:99%为术后立即拔管,98.5%为硬膜外镇痛,85.9%为术后第1天活动。另外,ERAS失败的比例为20%~30%[24, 27-29],其中主要是因为术后并发症导致不能完成ERAS治疗方案。Cerfolio等[30]研究发现,新辅助放化疗是ERAS治疗方案失败的显著影响因素(新辅助组为33%,单纯手术组为11%,P=0.025),并且新辅助治疗组有更高的主要并发症(新辅助组为25%,单纯手术组为8%,P=0.048)。MD Anderson食管癌协作组报道了目前样本量最大的食管癌ERAS回顾性研究,386例接受ERAS的食管癌患者术后平均住院时间为8 d,而322例接受术后常规康复的患者则为12 d(P<0.001);ERAS组的肺部并发症发生率为20%,常规康复组为27%(P=0.027);ERAS组的住院费用为63 406美元,而常规康复组的为76 685美元(P<0.001)。可见,ERAS可显著缩短住院时间,降低并发症发生率和住院费用,值得推广[31-37]。
三、 食管癌患者术后早期经口进食作用
经口进食是最符合生理的营养给予方式,我们认为早期经口进食是食管癌ERAS治疗模式中重要的措施。传统的食管癌外科治疗方案中,为了让吻合口充分愈合,患者术后都要常规行胃肠减压并禁食5~7 d。有研究[38]显示,胃肠减压管会使70%的患者感到非常不适,从而降低患者的生活质量。前瞻性随机对照临床研究[39]结果表明,在结直肠手术后不必禁食,而应让患者在术后第1天自由进食。然而,胸外科医师仍然坚持食管癌术后早期禁食,而通过静脉或者肠内营养(空肠造瘘或鼻肠营养管)的方式对食管癌术后患者进行营养支持。尽管空肠造瘘的营养给予方式对食管癌患者有一定的益处,但这种方式毕竟不是生理状态的营养补充方式,并且空肠造瘘有其自身并发症;另外,空肠造瘘还会降低患者术后的生活质量[40, 41]。ERAS的中心内容是:让患者术后尽快恢复到生理状态。显然,食管癌术后长期禁食不符合ERAS的理念。
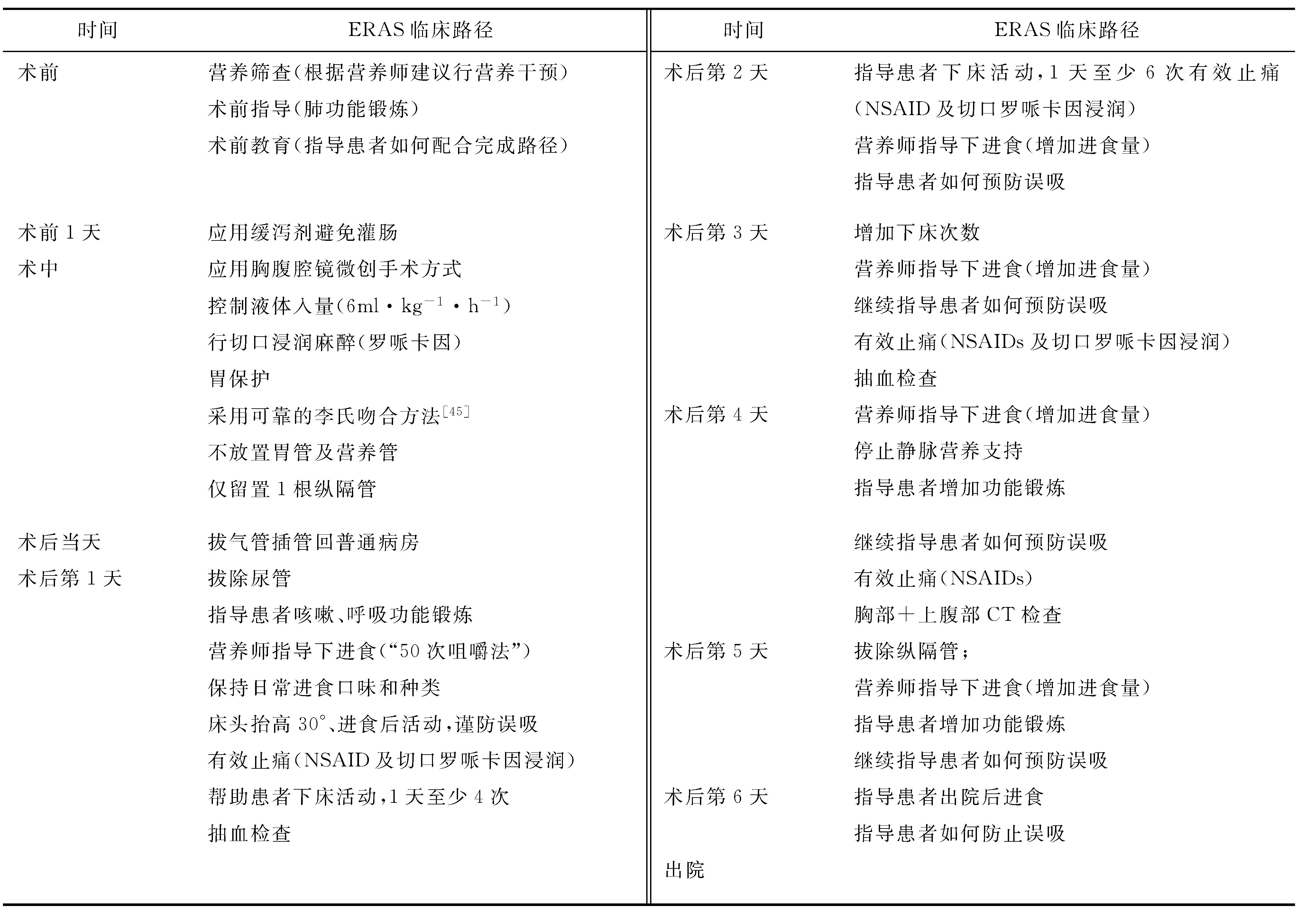
对于食管癌患者术后早期经口进食,外科医师的顾虑主要有两个方面:①术后早期进食后胃排空问题;②早期经口进食是否会增加吻合口瘘以及肺炎的风险。但这些担心并没有足够的临床证据支持。先前的研究[42]提示,正常人24 h的唾液分泌量为1~2 L,在禁食情况下对唾液的吞咽等同于进流食。另外,我们的研究[43]结果也显示,食管癌术后早期对流食的排空是明显增快的,食管癌术后早期胃排空依靠重力而非蠕动。我们的另一项前瞻性非随机对照临床研究[33]结果也提示,食管癌术后不常规放置胃管并术后第1天经口进食是安全可行的。在这些研究基础上,我们提出了“免管免禁”食管癌ERAS治疗模式——食管癌患者术后不放置胃管、鼻肠营养管或空肠造瘘管,术后第1天经口进食(表5)。
为了进一步探讨食管癌“免管免禁” 治疗模式的安全性和优势,我们设计了一项前瞻性随机对照临床研究(Clinical Trial.gov,注册号码:NCT01998230),从2014年2月—2015年10月,共入组280例行微创手术的食管癌患者。研究结果显示:与传统禁食1周的治疗方案相比,食管癌“免管免禁”治疗模式不会显著增加患者术后心、肺、消化道的并发症,而且可以显著降低术后应激反应,加快胃肠功能恢复,缩短术后住院时间,改善术后短期生命质量。这项研究结果于2017年5月10日被AnnalsofSurgery接受。我们研究的结果与最近发表的一项来自荷兰的研究结果相似。荷兰学者[44]的研究同样探讨了食管癌患者术后第1天进食的可行性。这项研究共前瞻性纳入了50例行微创Ivor-Lewis食管癌切除术的患者,患者术后当天即开始进水,术后第1天开始进流食,与我们的研究不同的是,他们让患者术后者1周才进食固体食物;而我们的临床研究方案中术后并不限制患者的进食,通过充分的咀嚼(“50次咀嚼法”)让患者在术后当天即可以进软食。另外,在荷兰的研究中,有30%的患者术后第5天由于并发症而需要禁食,而我们的研究结果提示在术后1周内只有7.1%(10/140)的患者中止了早期进食治疗方案。这与荷兰学者研究中术后并发症发生率较高有关,早期进食组患者术后吻合口瘘发生率为14%,对照组为24%;尽管他们的结论提示食管癌术后早期经口进食并不会增加术后吻合口瘘的发生率(P=0.202),但术后超过10%的吻合口瘘发生率对早期经口进食的临床实施来说是难以让外科医师接受的。同样的,荷兰研究者的数据显示早期经口进食组患者术后肺炎的发生率为28%,对照组为40%,食管癌术后早期进食不会增加术后肺炎的发生率(P=0.205),但高达30%的术后肺炎发生率同样是难以接受的。
四、 展望
对于食管癌的ERAS治疗我们已经有专家共识出版[46],这可以说是食管癌ERAS治疗中的里程碑。对于食管癌ERAS治疗的未来,有以下几个方面的展望。
(1)食管癌外科治疗具有非常复杂的手术步骤,对于大多数胸外科医师而言,具有风险大、术后并发症发生率高的特征。尽管目前微创技术已经广泛应用于食管癌外科治疗之中,但目前食管癌微创外科治疗依然存在很多问题:①手术时间长;②与传统开放手术相比,微创手术并没有显著降低术后并发症;③尽管应用了微创技术,但目前食管癌患者术后的恢复并没有得到很好地改善。
表5 “免管免禁”食管癌患者ERAS临床路径
(2) 可靠成熟的食管癌外科技术及标准化的流程是ERAS实施的基石。①标准的微创外科技术及流程:同样采用了微创技术,但之前文献报道的术后并发症发生率却千差万别,这其中可能包含了学习曲线的过程。因此,目前的问题是如何尽快缩短食管癌微创外科技术的学习曲线,这就需要有经验丰富的外科医师以及专门的培训机构来解决大家在学习食管癌微创手术过程中遇到的问题,进而缩短这一学习过程,尽快达到熟练操作以及流程化管理。②腔镜微创技术只是一个手段而并非目的。减少创伤应该是一个整体的概念,不仅限于皮肤切口的缩小,而是要贯穿整个手术过程的每一步精细操作,减少出血量和应激反应,同时缩短手术以及麻醉时间才能做到真正意义上的微创。开放手术中进行微创操作同样是微创。③术后胸胃相关并发症:临床中我们发现阻碍食管癌ERAS的真正瓶颈是术后胸胃相关并发症,包括吻合口瘘、胃穿孔、吻合口狭窄、胃扩张与潴留、幽门梗阻以及术后反流等。特别是吻合口瘘,是阻碍大多数外科医师实施早期经口进食治疗方案的瓶颈。但是根据我们的经验,完全可以通过提高技术和改进方法等措施来有效降低甚至避免这些并发症。其中包括在腹腔镜下游离胃的时候避免钳子对胃的直接夹持以减少对胃的刺激,充分保护胃壁黏膜的血管网;在制作管胃的时候,对管状胃切缘的双重加固缝合,以及在制作管胃整个过程中的热保护可避免胃壁血管的痉挛;另外,还可以采用更加可靠的吻合方法(李氏吻合法)来降低吻合口相关并发症的发生。在这些安全可靠的技术保障前提下才能使患者尽早地恢复到生理状态,以实施早期经口进食的ERAS方案。④技术难关仍需突破。从食管癌外科治疗的整个步骤而言,目前仍旧存在两大技术难关,即手术中的去迷走神经化和术后胃食管反流,会严重影响患者的术后生活质量。目前,我们正在探索解决这两大技术难点,最近已取得了一些进展,希望在不久的将来能有所突破。
(3) 推广食管癌ERAS的有效手段是建立目标为导向的规范化系统培训体系。由于缺乏规范化培训机制,系统的外科技术培训一直是困扰国内外科医师成长的短板。食管癌外科手术是一个极为复杂的系统工程,每一个步骤都关系到手术的成败。年轻医师可能需要很长的时间去领悟每个操作步骤的要点,而系统地培训能使他们尽快掌握所有的技术难点。我国现有的培训多以参观进修及短期手术观摩等为主要内容,这使得培训效率低下,难以达到培训的真正目的。因此,建立经过科学评估的目标为导向的规范化系统培训体系是突破食管癌技术瓶颈与难关、推广食管癌ERAS的有效手段。
(4) 制约食管癌ERAS推广应用的内在原因是传统的习惯性理念。我国是世界上食管癌发病率最高的国家之一,但发病率高低区域性差异显著。一些大的医疗中心每年食管癌手术例数甚至可以达到约2000例,而小的医疗中心可能不足20例。因此,不同中心的外科医师对食管癌手术不但存在明显的技术差异,还存在着显著的认识和理念差异。这其中包括以下几个方面:术后留置胃管和鼻肠管、术前长时间禁食、术后长期卧床、术中胸腹腔引流管以及颈部引流管(条)的放置、术后尿管的留置和大量补液等。我们先前的研究结论是食管癌术后早期胃排空主要靠重力作用而非胃的蠕动力、术后长期禁食并不能避免吻合口瘘的发生。另外,我们的研究结果证实“50次咀嚼法”(充分咀嚼可使固体食物变为流食)“自由(at will)进食理念”“免管(无胃管、营养管及常规胸管)免禁(术后第1天进食)理念”等方法和理念是切实可行并安全可靠的。
(5) 多中心临床研究是检验和推广食管癌ERAS的基础。尽管,食管癌ERAS从方法和理念上取得了一些进展,在某些方面也实现了一定的突破,但同行之间对食管癌ERAS的认识和外科技术水平相差还比较大。一些外科医师对传统食管癌外科治疗模式的固守以及对食管癌ERAS理念的排斥依然比较严重。为了进一步推广食管癌ERAS理念,在系统的技术推广和普及的基础上,还需要进行国内及国际多中心的临床研究,进一步探索和验证食管癌ERAS的治疗措施。
(6) ERAS是理念而非标准,是持续改进和开放的系统工程。ERAS的内容不是一成不变的,随着新材料、新技术、新器械、新设备、新方法、新理念的推广及应用,这一系统工程的内容会不断地充实并完善。另外,食管癌的ERAS治疗才刚刚起步,微创技术的应用以及早期经口进食理念的推广只是实现ERAS的手段之一。在不远的将来,会有更多新的技术以及理念将食管癌的ERAS治疗提到一个新的高度。
食管癌的ERAS理念、技术和模式代表了食管癌外科未来发展的趋势。我国是食管癌患者大国,因此,在我国广泛推广食管癌ERAS理念、技术和模式,前景光明、意义重大,我国胸外科医师也责任重大,任重而道远。
1 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108.
2 Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132.
3 Wouters MW, Wijnhoven BP, Karim-Kos HE, et al. High-volume versus low-volume for esophageal resections for cancer: the essential role of case-mix adjustments based on clinical data[J]. Ann Surg Oncol, 2008, 15(1): 80-87.
4 Biere SS, van Berge Henegouwen MI, Maas KW, et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: a multicentre, open-label, randomised controlled trial[J]. Lancet, 2012, 379(9829): 1887-1892.
5 Luketich JD, Pennathur A, Awais O, et al. Outcomes after minimally invasive esophagectomy: review of over 1000 patients[J]. Ann Surg, 2012, 256(1): 95-103.
6 Luketich JD, Pennathur A, Franchetti Y, et al. Minimally invasive esophagectomy: results of a prospective phase Ⅱ multicenter trial-the eastern cooperative oncology group (E2202) study[J]. Ann Surg, 2015, 261(4): 702-707.
7 Kehlet H, Wilmore DW. Multimodal strategies to improve surgical outcome[J]. Am J Surg, 2002; 183(6): 630-641.
8 Wilmore DW, Kehlet H. Management of patients in fast track surgery[J]. BMJ, 2001, 322(7284): 473-476.
9 李印. 快速康复外科在食管癌治疗中的应用[J]. 中华胃肠外科杂志, 2014, 17(9): 865-868.
10 Basse L, Hjort Jakobsen D, Billesbolle P, et al. A clinical pathway to accelerate recovery after colonic resection[J]. Ann Surg, 2000, 232(1): 51-57.
11 Basse L, Jacobsen DH, Billesbolle P, et al. Colostomy closure after Hartmann's procedure with fast-track rehabilitation[J]. Dis Colon Rectum, 2002, 45(12): 1661-1664.
12 Basse L, Jakobsen DH, Bardram L, et al. Functional recovery after open versus laparoscopic colonic resection: a randomized, blinded study[J]. Ann Surg, 2005, 241(3): 416-423.
13 Carter J, Szabo R, Sim WW, et al. Fast track surgery: a clinical audit[J]. Aust N Z J Obstet Gynaecol, 2010, 50(2): 159-163.
14 Wille-Jorgensen P, Guenaga KF, Matos D, et al. Pre-operative mechanical bowel cleansing or not? an updated meta-analysis[J]. Colorectal Dis, 2005, 7(4): 304-310.
15 Slim K, Vicaut E, Panis Y, et al. Meta-analysis of randomized clinical trials of colorectal surgery with or without mechanical bowel preparation[J]. Br J Surg, 2004, 91(9): 1125-1130.
16 Basse L, Thorbol JE, Lossl K, et al. Colonic surgery with accelerated rehabilitation or conventional care[J]. Dis Colon Rectum,2004,47(3): 271-277; discussion 7-8.
17 Foss NB, Kristensen MT, Kristensen BB, et al. Effect of postoperative epidural analgesia on rehabilitation and pain after hip fracture surgery: a randomized, double-blind, placebo-controlled trial[J]. Anesthesiology, 2005, 102(6): 1197-204.
18 Brandstrup B. Fluid therapy for the surgical patient[J]. Best Pract Res Clin Anaesthesiol, 2006, 20(2): 265-283.
19 Sessler DI. Mild perioperative hypothermia[J]. N Engl J Med, 1997, 336(24): 1730-1737.
20 Jin F, Chung F. Multimodal analgesia for postoperative pain control[J]. J Clin Anesth, 2001, 13(7): 524-539.
21 Gan TJ, Meyer T, Apfel CC, et al. Consensus guidelines for managing postoperative nausea and vomiting[J]. Anesth Analg, 2003, 97(1): 62-71.
22 Page CP, Ryan JA, Jr Haff RC. Continual catheter administration of an elemental diet[J]. Surg Gynecol Obstet, 1976, 142(2): 184-188.
23 王总飞, 张瑞祥, 刘先本, 等. 不常规经鼻胃肠减压在食管癌腔镜手术中应用的可行性研究[J]. 中国胸心血管外科临床杂志, 2014, 21(4): 494-497.
24 Cao S, Zhao G, Cui J, et al. Fast-track rehabilitation program and conventional care after esophagectomy: a retrospective controlled cohort study[J]. Support Care Cancer, 2013,21(3):707-714. .
25 Zehr KJ, Dawson PB, Yang SC, et al. Standardized clinical care pathways for major thoracic cases reduce hospital costs[J]. Ann Thorac Surg,1998,66(3):914-919.
26 Low DE, Kunz S, Schembre D, et al. Esophagectomy--it's not just about mortality anymore: standardized perioperative clinical pathways improve outcomes in patients with esophageal cancer[J]. J Gastrointest Surg, 2007, 11(11): 1395-1402; discussion 402.
27 Ford SJ, Adams D, Dudnikov S, et al. The implementation and effectiveness of an enhanced recovery programme after oesophago-gastrectomy: a prospective cohort study[J]. Int J Surg, 2014, 12(4): 320-324.
28 Lee L, Li C, Robert N, et al. Economic impact of an enhanced recovery pathway for oesophagectomy[J]. Br J Surg, 2013, 100(10): 1326-1334.
29 Munitiz V, Martinez-de-Haro LF, Ortiz A, et al. Effectiveness of a written clinical pathway for enhanced recovery after transthoracic (Ivor Lewis) oesophagectomy[J]. Br J Surg,2010, 97(5): 714-718.
30 Cerfolio RJ, Bryant AS, Bass CS,et al. Fast tracking after Ivor Lewis esophagogastrectomy[J]. Chest, 2004, 126(4): 1187-1194.
31 Shewale JB, Correa AM, Baker CM, et al. Impact of a fast-track esophagectomy protocol on esophageal cancer patient outcomes and hospital charges[J]. Ann Surg, 2015, 261(6): 1114-1123.
32 Chen L, Sun L, Lang Y, et al. Fast-track surgery improves postoperative clinical recovery and cellular and humoral immunity after esophagectomy for esophageal cancer[J]. BMC Cancer, 2016, 16: 449.
33 Sun HB, Liu XB, Zhang RX, et al. Early oral feeding following thoracolaparoscopic oesophagectomy for oesophageal cancer[J]. Eur J Cardiothorac Surg, 2015, 47(2): 227-233.
34 Findlay JM, Tustian E, Millo J, et al. The effect of formalizing enhanced recovery after esophagectomy with a protocol[J]. Dis Esophagus,2015, 28(6): 567-573.
35 Tang J, Humes DJ, Gemmil E, et al. Reduction in length of stay for patients undergoing oesophageal and gastric resections with implementation of enhanced recovery packages[J]. Ann R Coll Surg Engl, 2013, 95(5): 323-328.
36 Blom RL, van Heijl M, Bemelman WA, et al. Initial experiences of an enhanced recovery protocol in esophageal surgery. World JSurg, 2013, 37(10): 2372-2378.
37 Preston SR, Markar SR, Baker CR, et al. Impact of a multidisciplinary standardized clinical pathway on perioperative outcomes in patients with oesophageal cancer[J]. Br JSurg,2013, 100(1): 105-112.
38 Koukouras D, Mastronikolis NS, Tzoracoleftherakis E, et al. The role of nasogastric tube after elective abdominal surgery[J]. Clin Ter, 2001, 152(4): 241-244.
39 Han-Geurts IJ, Jeekel J, Tilanus HW, et al. Randomized clinical trial of patient-controlled versus fixed regimen feeding after elective abdominal surgery[J]. Br J Surg, 2001, 88(12): 1578-1582.
40 O'Keefe SJ. A guide to enteral access procedures and enteral nutrition[J]. Nat Rev Gastroenterol Hepatol, 2009, 6(4): 207-215.
41 Barlow R, Price P, Reid TD, et al. Prospective multicentre randomised controlled trial of early enteral nutrition for patients undergoing major upper gastrointestinal surgical resection[J]. Clin Nutr, 2011, 30(5): 560-566.
42 Heintze U, Birkhed D, Bjorn H. Secretion rate and buffer effect of resting and stimulated whole saliva as a function of age and sex[J]. Swed Dent J, 1983, 7(6): 227-238.
43 闫明, 李印, 秦建军,等. 食管癌术前及术后早期胸胃排空功能的对比观察[J]. 中国肿瘤临床, 2011,38(8): 452-454.
44 Weijs TJ, Berkelmans GH, Nieuwenhuijzen GA, et al. Immediate postoperative oral nutrition following esophagectomy: amulticenter clinical trial[J]. Ann Thorac Surg, 2016, 102(4): 1141-1148.
45 Sun HB, Li Y, Liu XB,et al. Embedded three-layer esophagogastric anastomosis reduces morbidity and improves short-term outcomes after esophagectomy for cancer[J].Ann Thorac Surg, 2016, 101(3): 1131-1138.
46 中国医师协会胸外科分会快速康复专家委员会. 食管癌加速康复外科技术应用专家共识(2016版)[J]. 中华胸心血管外科杂志, 2016, 32(12): 717-722.
(本文编辑:周珠凤)
Progress and prospect of enhanced recovery after surgery for esophageal cancer
LiYin,SunHaibo.
DepartmentofThoracicSurgery,HenanCancerHospital,TheAffiliatedCancerHospitalofZhengzhouUniversity,Zhengzhou450008,China
LiYin,Email:liyin825@aliyun.com
Enhanced recovery after surgery (ERAS) is a patient-centered, surgeon-led combined with anesthesia, nursing, nutrition, psychological and other multi-disciplinary team, aimed to reduce the perioperative wound stress response, to maintain the physiological function of patients, and to achieve the purpose of promoting patient rehabilitation. ERAS theory was first used in colorectal surgery, then widely used in other surgical fields. However, ERAS program was not used commonly in esophagectomy due to its surgical complexity and high postoperative complications. Basically, the main reason is that postoperative complications like gastric tube-associated complications limit the application of ERAS in the field of esophagectomy. In recent years, with the progression of minimally invasive esophagectomy, attention to tissue and organ protection concept, improvement of gastric tube technique, breakthrough of anastomotic technique and new theories, ERAS has made great progresses in the field of esophagectomy. “
surgery yesterday, eat normally today, and discharged in5-7 days”, ERAS program based on “no tube no abstaining” has been applied in some medical centers and is becoming more and more mature. In the future we will rely on the improvement, systemic training and promotion of this system. We expect more medical centers will apply ERAS program and multi-center clinical trials will be initiated.
Esophageal cancer; Enhanced recovery after surgery; Clinical pathway
10.3877/cma.j.issn.2095-8773.2017.03.03
450008郑州大学附属肿瘤医院胸外科
李印,Email: liyin825@aliyun.com
2017-04-10)
胡坚,马洪海. 肺癌加速康复外科的发展现状及展望[J/CD]. 中华胸部外科电子杂志,2017,4(3):136-139.
