姜黄素胡椒碱复配对拘束应激肝损伤的缓解作用
2017-09-04柏利霞张焜招敏聪文哲赵俊峰杜志云
柏利霞,张焜,招敏聪,文哲,赵俊峰,杜志云
(广东工业大学天然药物与绿色化学研究所,广东广州510006)
姜黄素胡椒碱复配对拘束应激肝损伤的缓解作用
柏利霞,张焜,招敏聪,文哲,赵俊峰,杜志云*
(广东工业大学天然药物与绿色化学研究所,广东广州510006)
以聚乙烯吡咯烷酮(Polyvinylpyrrolidone,PVP)为载体,制备姜黄素胡椒碱复配物(质量比为5:1)固体制剂,以姜黄素PVP固体分散体和姜黄素作为参比制剂,研究姜黄素胡椒碱复配固体制剂对拘束应激导致的小鼠肝损伤的缓解作用。研究结果表明,姜黄素+胡椒碱PVP包合物组、姜黄素PVP包合物组、及姜黄素组均可以降低由拘束应激导致的血浆ALT、AST活性和肝脏MDA含量的增加,增强肝脏组织中GSH-PX、SOD、CAT的活性,其中姜黄素+胡椒碱PVP包合物组最为显著。由此可以得出黄素胡椒碱复配固体制剂能显著改善拘束应激导致的小鼠肝脏损伤,姜黄素的药用功效增强的原因可能是由于胡椒碱能够增加姜黄素的生物利用度和PVP固体制剂的制备能够增加姜黄素胡椒碱复配物的水溶性。
姜黄素;胡椒碱;固体制剂;肝损伤
随着现代人们生活工作方式的改变,人们承受着环境变化、生活习惯改变及物理化学等各种应激源带给心理的压力。既往研究表明,压力会引发许多心理和生理健康问题和疾病[1]。当机体经受长期或者高强度的精神压力时,体内代谢便会失衡,产生各种各样的压力型疾病[2]。肝脏是人体主要的排毒器官,清理病原体、有毒化学物质和体内的代谢废物,它通过调节生理系统来维持体内平衡[3]。肝脏是氧化应激攻击的主要器官,所以开发潜在的健康产品缓解压力疾病保持健康提高生活质量是非常有必要的。
姜黄素(Curcumin)是中药姜黄(Curcuma longa L.)的主要活性成分,为植物界中稀少的具有二酮结构的天然酚类色素,其结构如图1所示。
姜黄素具有抗氧化、抗炎、保肝护肝、抗心血管疾病、抗肿瘤、抗菌等药理活性[4]。但是姜黄素存在着水溶性差、稳定性差、体内不易被吸收、生物利用度低等缺点[5],这致使姜黄素的应用研究受到限制。胡椒碱属于桂皮酞胺类生物碱,是一种天然的生物利用度增强剂,广泛存在于植物中,且其具有稳定性强、药用安全等优点[6]。Singh S等[7]研究发现,姜黄素和胡椒碱按质量比10∶1复配,可以提高姜黄素对3-NP所诱导的神经毒性的保护作用,这是由于姜黄素联合胡椒碱增加了生物利用度,导致其保护作用增强。固体分散体技术主要用于增加难溶性药物的溶解度和溶出速率,从而提高生物利用度。其常用的载体有羧丙基纤维素(Hydroxypropyl cellulose,HPC)、甘露醇、聚乙二醇(Polyethylene glycol,PEG)4000或6000、聚乙烯吡咯烷酮(PVP)等。本试验以PVP为载体,将姜黄素胡椒碱复配物制成固体分散体,以姜黄素固体分散体和姜黄素为参比制剂,研究姜黄素胡椒碱复配固体制剂对拘束应激导致的肝损伤的缓解作用。
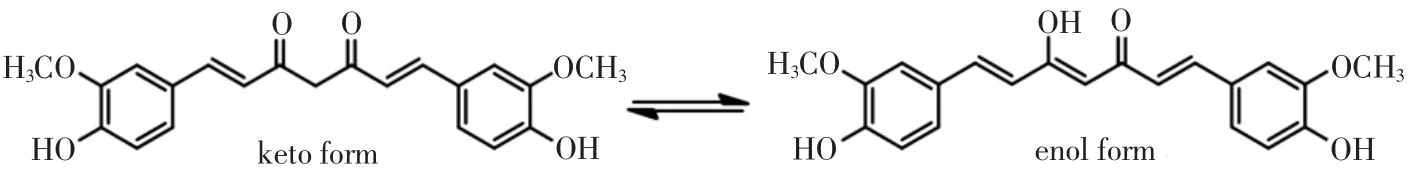
图1 姜黄素结构Fig.1 The chemical structure of curcumin
1 材料与方法
1.1 主要试剂与仪器
姜黄素、胡椒碱(分析纯):国药集团化学试剂有限公司;聚乙烯吡咯烷酮(PVP)、羧甲基纤维素钠(CMC):亚什兰辅料公司;谷丙转氨酶(Polyethylene glycol,ALT)试剂盒、谷草转氨酶(Polyethylene glycol,AST)试剂盒、丙二醛(Methane Dicarboxylic Aldehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-PX)试剂盒、超氧化物岐化酶(superoxide dismutase,SOD)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、BCA蛋白定量试剂盒:南京建成生物工程研究所;Lambda 25紫外-可见分光光度计:美国PERKINELMER公司;D2F-6090真空干燥箱:上海一恒科学仪器有限公司;R-1001N旋转蒸发仪:郑州长城科工贸有限公司;SpectraMax Paradigm酶标仪:澳大利亚Molecular Devices公司;JB-409六联双排数显恒温磁力搅拌器:常州普天仪器制造有限公司。
1.2 样品的制备
1.2.1 姜黄素+胡椒碱PVP固体制剂的制备
将分析纯姜黄素与胡椒碱按质量比5∶1的比例复配,再将姜黄素胡椒碱复配物与PVP按质量比1∶9加入无水乙醇中,超声至全部溶解,置于六联双排磁力搅拌器避光搅拌3 h,45℃条件下用旋转蒸发仪减压蒸发除去乙醇,再放50℃真空干燥箱中干燥24 h,粉碎,过 5 号筛[80 目,(180±7.6)μm]后保存在干燥器中备用。
1.2.2 姜黄素PVP固体制剂的制备
将分析纯姜黄素与PVP按质量比1∶9的比例加入到无水乙醇中,超声至全部溶解,置于六联双排磁力搅拌器避光搅拌3 h,45℃条件下用旋转蒸发仪减压蒸发除去乙醇,再放50℃真空干燥箱中干燥24 h,粉碎,过 5 号筛[80 目,(180±7.6)μm]后保存在干燥器中备用。
1.3 实验动物及模型
雄性昆明鼠,共50只,6周~8周龄,购自广东中医药大学动物中心。所有实验动物均在清洁级层流架中饲养,维持饲养温度在(23±2)℃,照明时间设置为每天 12 h(07:00~19:00),所有实验动物在适应性饲养一周后再进行实验。随机分成空白对照组、拘束应激模型组、姜黄素+胡椒碱PVP包合物组(姜黄素胡椒碱复配物含量100 mg/kg)、姜黄素PVP包合物组(姜黄素含量100 mg/kg)及姜黄素组(100 mg/kg),每组10只动物。对于实验组小鼠,每天下午3:00~4:00对小鼠按预定剂量进行灌胃给药1次,连续给药7 d。姜黄素胡椒碱包合物、姜黄素包合物及姜黄素都溶于0.5%的CMC中。同时,正常对照组与拘束应激模型组小鼠给予等量的0.5%CMC。在最后一次给药当天,除正常对照组外,其余各组小鼠置于透气的拘束装置中进行拘束应激 18 h(15:00~09:00),拘束装置参考文献[8]改制。实验期间,所有动物禁食禁水。拘束后对小鼠进行体重统计,乙醚麻醉小鼠,提取肝脏组织和心脏取血,称重后置冰上有待测定相关实验指标。
1.4 病理学切片
将新鲜的肝脏组织置于4%的对聚甲醛中固定24 h,然后嵌入石蜡中进行包埋。被石蜡包埋的组织切片,后进行HE染色。制作好的病理学切片在200倍光镜的光学显微镜(Olympus IX71,Tokyo,Japan)下进行观察,评估其病变程度[9]。
1.5 血浆AST、ALT活性
将所取的全血置于用肝素钠处理过的离心管,用离心机以7 000 r/min离心5 min分离血浆,测定血浆AST、ALT活性,血浆ALT和AST的活性是由赖氏(Reitman and Frankel)商业试剂盒测定,以SpectraMax Paradigm型酶标仪(Molecular Devices,Austrial)在510 nm下测定其吸光度,计算出AST与ALT的活性。
1.6 肝脏组织MDA水平测定
将新鲜取出的肝脏组织按照质量容积比1∶9加入生理盐水,在冰浴下用组织匀浆器,制成10%肝脏匀浆。匀浆后,在4℃下用冷冻离心机以9 000 r/min离心10 min,取上清液,用BCA蛋白定量试剂盒测定上清液蛋白含量。使用MDA商业试剂盒来进行测定,其原理为MDA在酸性和高温度条件下,可以与硫代巴比妥酸(TBA)反应生成红棕色的反应物(3,5,5-trimethyloxazolidine-2,4-dione),使用紫外-可见分光光度计在510 nm波长下测定MDA水平。
1.7 肝脏组织GSH-PX、SOD、CAT活性测定
将新鲜取出的肝脏组织按照质量容积比1∶9加入生理盐水,在冰浴下用组织匀浆器,制成10%肝脏匀浆。匀浆后,在4℃下用冷冻离心机以9 000 r/min离心10 min,取上清液,用BCA蛋白定量试剂盒测定上清液蛋白含量。
使用GSH-PX测定试剂盒检测GSH-PX活性,通过检测GSH-PX在酶促反应中消耗的GSH-PX的速度即可得出GSH-PX活性。使用SpectraMax Paradigm型酶标仪在412 nm处测定吸光度计算GXH-PX活性。
使用SOD测定试剂盒检测SOD活性,其原理为超氧阴离子能与氧化羟胺形成亚硝酸盐,后者能与显色剂反应生成紫红色反应物,可用SpectraMax Paradigm型酶标仪在550 nm处测定吸光度并进行活性测定。
使用CAT测定试剂盒检测CAT活性,其原理为过氧化氢能与钼酸铵作用并产生一种淡黄色的络合物,通过SpectraMax Paradigm型酶标仪在405 nm处测定吸光度能计算出CAT活性。
1.8 统计学处理
所有试验结果均为3次以上试验的平均结果,试验数据以平均值±标准差表示,采用SPSS13.0软件,利用Dunnett’s检验和ANOVA检验进行统计学处理,p<0.05即具有统计学显著意义。
2 结果
2.1 肝脏组织病理学分析
病理学分析结果如图2所示。
空白组组织形态完整,细胞核与细胞质比例较小,肝脏细胞排列均匀,无大面积细胞坏死与炎症浸润;模型组小鼠肝脏细胞排列紊乱,出现点状坏死区域与炎细胞浸润,这表明18 h的拘束应激能导致小鼠肝脏损伤。姜黄素组、姜黄素PVP包合物组、姜黄素+胡椒碱PVP包合物组小鼠肝脏细胞损伤及炎症浸润都有不同程度的减轻,其中姜黄素+胡椒碱PVP包合物组对肝损伤的缓解作用最为显著。
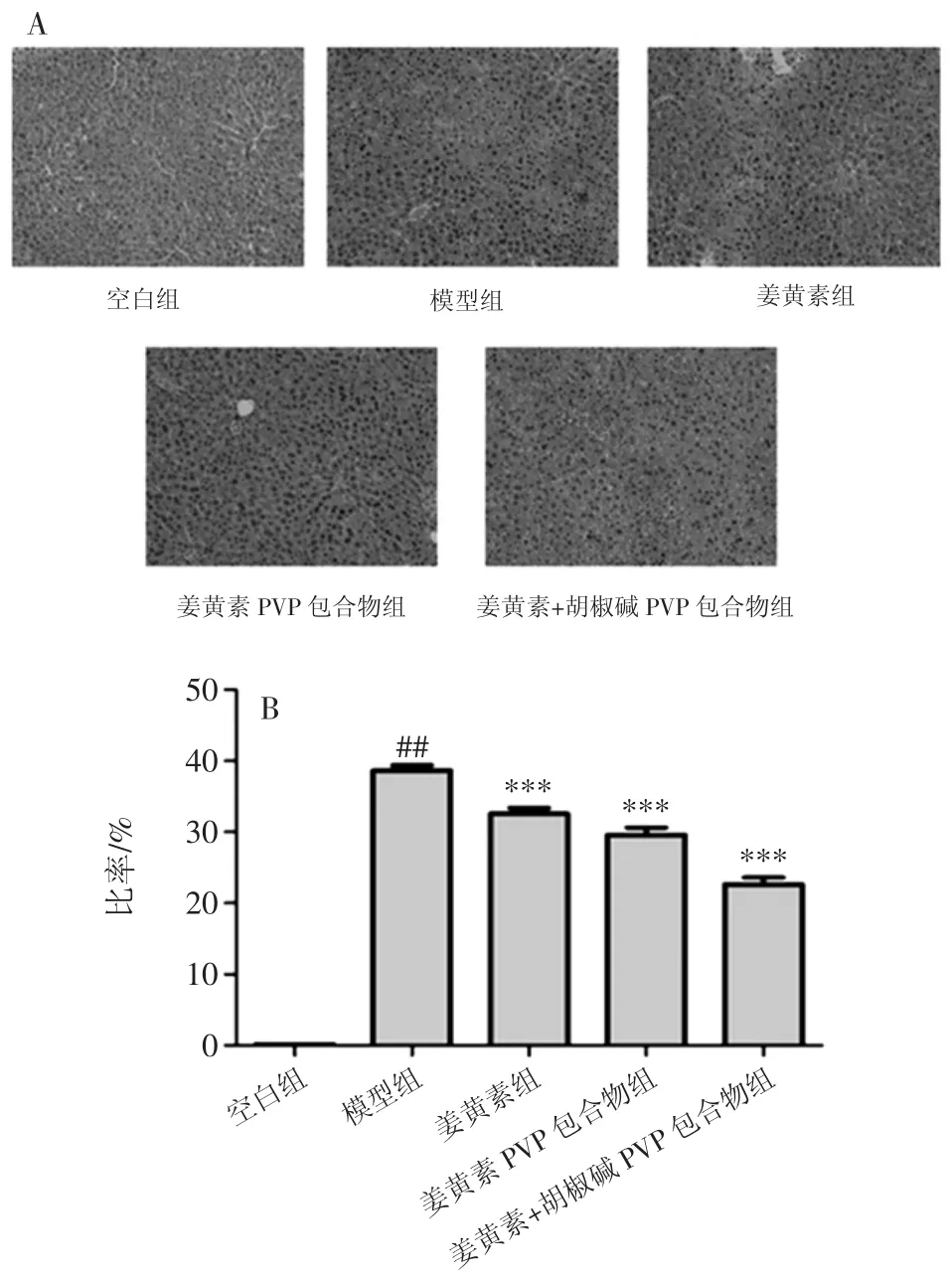
图2 病理学分析结果(,n=10)Fig.2 Pathology analysis results(,n=10)
2.2 对拘束应激小鼠血浆ALT、AST活性的影响
姜黄素胡椒碱对拘束应激小鼠血浆ALT、AST活性见表1。
表1 姜黄素胡椒碱对拘束应激小鼠血浆ALT、AST活性(,n=10)Table 1 Effect of curcumin and piperine on the activities of ALT and AST in plasma in liver of restraint-stressed mice(,n=10)
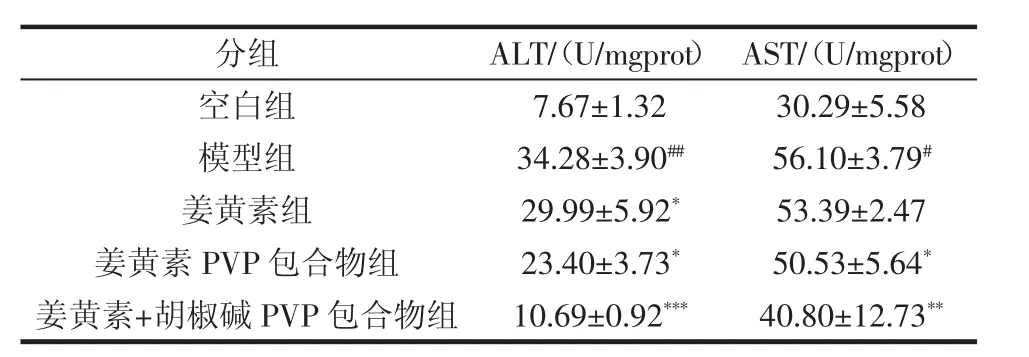
表1 姜黄素胡椒碱对拘束应激小鼠血浆ALT、AST活性(,n=10)Table 1 Effect of curcumin and piperine on the activities of ALT and AST in plasma in liver of restraint-stressed mice(,n=10)
注:与空白组相比具有统计学意义(#p<0.01,##p<0.001),与模型组相比具有统计学意义(*p<0.05,**p<0.01,***p<0.001)。
分组ALT/(U/mgprot)AST/(U/mgprot)空白组 7.67±1.32 30.29±5.58模型组 34.28±3.90## 56.10±3.79#姜黄素组 29.99±5.92* 53.39±2.47姜黄素 PVP 包合物组 23.40±3.73* 50.53±5.64*姜黄素+胡椒碱PVP包合物组 10.69±0.92*** 40.80±12.73**
由表1显示,与正常组相比,模型组小鼠血浆中ALT、AST 的活性均显著提高(p<0.05),这表明 18 h的拘束应激能导致小鼠肝脏损伤。与模型组相比较,姜黄素组、姜黄素PVP组、姜黄素+胡椒碱PVP包合物组均能降低小鼠血浆ALT、AST活性水平,缓解拘束应激导致的肝脏损伤,而姜黄素+胡椒碱PVP包合物组作用更为突出(p<0.05)。
2.3 对拘束应激小鼠肝脏MDA水平的影响
姜黄素胡椒碱对拘束应激小鼠肝脏MDA含量的影响见表2。
表2 姜黄素胡椒碱对拘束应激小鼠肝脏MDA含量的影响(s,n=10)Table 2 Effects of curcumin and piperine on the content of MDA in liver of restraint-stressed mice.(,n=10)

表2 姜黄素胡椒碱对拘束应激小鼠肝脏MDA含量的影响(s,n=10)Table 2 Effects of curcumin and piperine on the content of MDA in liver of restraint-stressed mice.(,n=10)
注:与空白组相比具有统计学意义(#p<0.01),与模型组相比具有统计学意义(*p<0.05,**p<0.01)。
分组肝脏MDA/(nmol/mgprot)空白组 1.45±0.25模型组 3.27±0.26#姜黄素组 3.10±0.29*姜黄素PVP包合物组 2.93±0.05*姜黄素+胡椒碱PVP包合物组 2.05±0.17**
由表2得出,与正常组相比较,模型组小鼠肝脏中MDA水平显著升高(p<0.01),这表明18 h拘束应激导致小鼠肝脏出现脂质过氧化。与模型组相比较,姜黄素组、姜黄素PVP组、姜黄素+胡椒碱PVP包合物组均能降低小鼠肝脏MDA水平,抑制肝脏组织的脂质过氧化,且姜黄素+胡椒碱PVP包合物组对MDA水平的降低作用更为显著(p<0.01)。
2.4 对拘束应激小鼠肝脏抗氧化酶GSH-PX、SOD、CAT活性的影响
姜黄素胡椒碱对拘束应激小鼠肝脏中抗氧化酶GSH-PX、SOD、CAT活性的影响见图3。
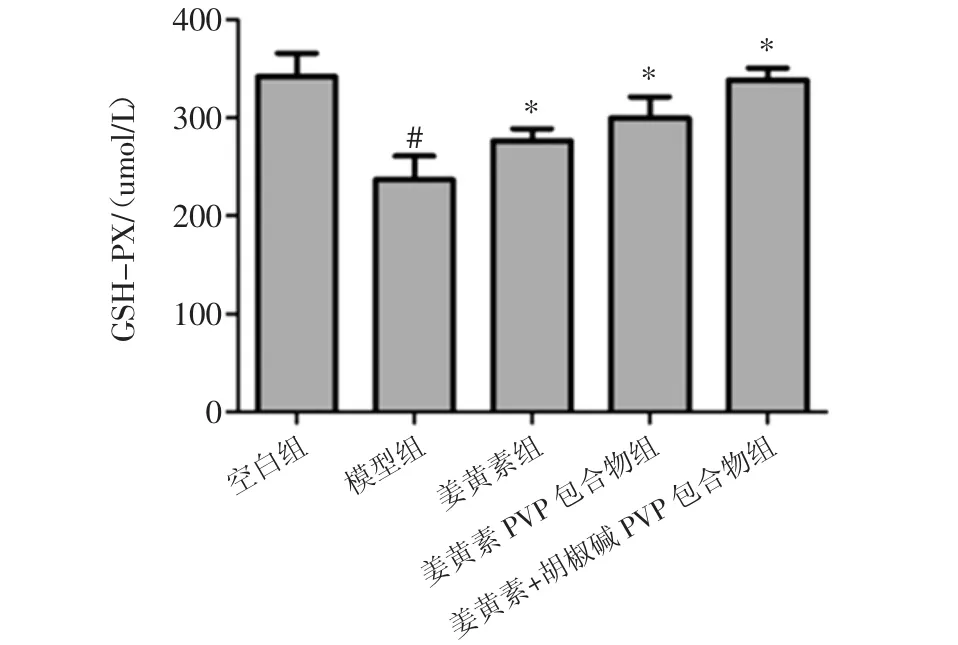
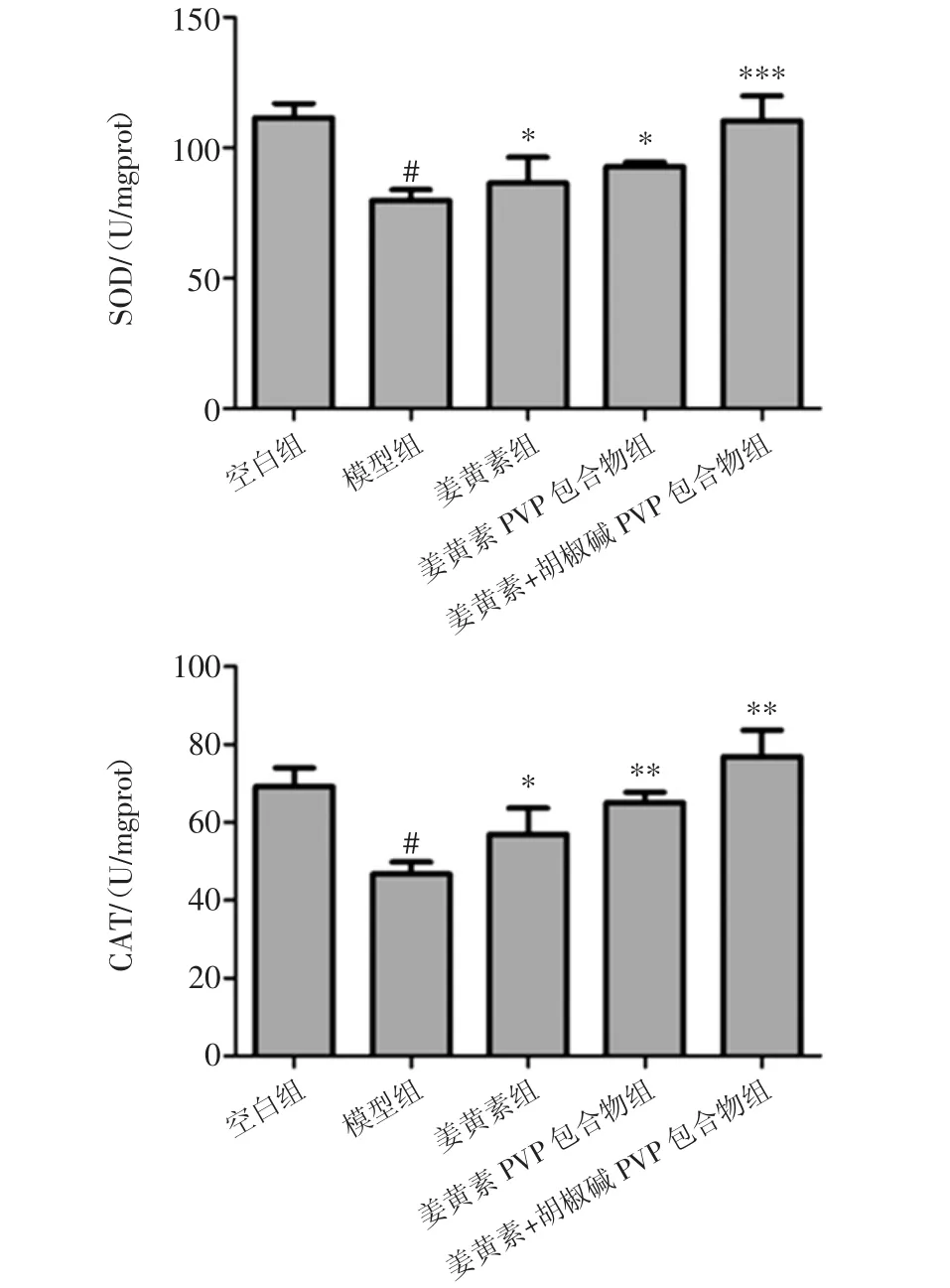
图3 姜黄素胡椒碱对拘束应激小鼠肝脏中抗氧化酶GSH-PX、SOD、CAT 活性的影响(,n=10)Fig.3 Effects of curcumin and piperine on GSH-PX,SOD,CAT activities in liver of restraint-stressed mice.(,n=10)
图3显示,与正常组相比较,模型组小鼠肝脏中抗氧化酶 GSH-PX、SOD、CAT 活性显著降低(P<0.01),这表明18 h拘束应激会降低小鼠肝脏中抗氧化酶活性,致使小鼠肝脏受到氧化损伤。与模型组相比较,姜黄素组、姜黄素PVP组、姜黄素+胡椒碱PVP包合物组均能对拘束应激导致的过氧化酶活性的降低有一定的改善作用(p<0.05),降低肝脏遭受氧化损伤。且姜黄素+胡椒碱PVP包合物组对过氧化酶活性降低的改善作用更为显著(p<0.05)。
3 讨论
肝脏疾病是威胁人们身体健康的重大疾病之一,肝脏疾病形成的原因有很多。近年来随着社会的发展,人们遭受越来越多的来自生活和工作的压力,这些压力会扰乱人们生理稳态,诱发了大量的心理和生理障碍[10]。之前的研究表明,拘束应激增加外源性物质的入侵,抑制脂质和糖代谢,从而引发肝脏损伤[11-12]。拘束应激所诱导的氧化应激是一种被广泛使用的氧化应激模型[13]。拘束应激导致肝脏疾病的主要机理是过量的活性氧(reactive oxygen species,ROS)致使肝脏中稳定的氧化还原过程被破坏,ROS的生成和消除失去平衡,肝脏中堆积大量的ROS,从而引发脂质过氧化,破坏肝脏细胞的结构与完整性,导致肝脏损伤[14]。以往研究表明,姜黄素具有很好的体外抗氧化活性,但其具有不溶于水、在体内不易被吸收利用、生物利用度低等缺点。研究表明胡椒碱可以从吸收、代谢等多种途径来提高一些吸收差、生物利用度低的药物的药效。A Sehgal等[15]发现,姜黄素胡椒碱复配可以改善苯并芘诱导的DNA损伤,这是由于胡椒碱可以很好的抑制肝脏和肠道的芳基碳氢化合物羟基化和葡萄苷酸化,提高治疗姜黄素的生物利用度以及药理活性。Suresh等[16]发现,每天给予大鼠姜黄素胡椒碱复配物(质量比25∶1)500mg/kg,可以将姜黄素吸收率由60%~66%上升至78%。韩刚等[17]发现,以PVP为载体,制备姜黄素固体分散体可以有效的提高姜黄素在大鼠体内的生物利用度。本试验结果显示,对小鼠进行18 h的拘束负荷,导致小鼠血浆ALT、AST活性水平和MDA含量的显著增加,肝脏组织发生病理损伤。同时肝脏内存在由GSH-PX、SOD、CAT 3种抗氧化酶组成的抗氧化防御系统,可以及时清理不断生成的自由基,阻断自由基的链式放大反应,保护肝脏免受氧化损伤[18]。拘束应激导致GSH-PX、SOD、CAT的活性降低,降低了肝脏细胞防御体系的抗氧化能力,致使肝脏遭受氧化损伤。在给予口服姜黄素胡椒碱复配PVP包合物、姜黄素PVP包合物、姜黄素后,其血浆ALT、AST活性和肝脏MDA含量均有不同程度的降低,肝脏中的GSH-PX、SOD、CAT 3种抗氧化酶活性也得到了不同程度的缓解,其中姜黄素胡椒碱复配PVP包合物组对肝脏氧化损伤的保护作用最强,姜黄素PVP包合物组效果其次,姜黄素组的效果最差。PVP分子中既含有极性较大的内酰胺基,又含有非极性的亚甲基,这使得PVP对难溶于水的姜黄素增溶作用较强。以PVP为载体,制成固体分散体,提高了姜黄素在小鼠体内的生物利用度。研究显示,胡椒碱也具有一定的抗氧化活性,同时也能通过抑制药物代谢酶活性来提高姜黄素的生物利用度。所以姜黄素胡椒碱复配PVP包合物对拘束应激小鼠肝损伤缓解作用最强。
总之,本试验研究发现姜黄素胡椒碱复配固体制剂能明显提高姜黄素对拘束应激肝损伤的缓解作用,可能是因为与胡椒碱复配可以提高肠道对姜黄素的吸收,与PVP的包合可以增加姜黄素的水溶性,增加机体对姜黄素的吸收。由此,通过与胡椒碱的复配和PVP的包合可以增加姜黄素的药理效果,这为开发新型高效的保肝护肝药物、保健品提供了新思路。
[1]Rosenberger C,Elsenbruch S,Scholle A,et al.Effects of psychological stress on the cerebral processing of visceral stimuli in healthy women[J].Neurogastroen Motil,2009,21(7):740-745
[2]Moore C J,Cunningham S A.Social position,psychological stress,and obesity:a systematic review[J].Acad Nutr Diet,2012,112(4):518-526
[3]Raschzok N,Sallmon H,Pratschke J,et al.MicroRNAs in liver tissue engineering-New promises for failing organs[J].Advanced drug delivery reviews,2015,88:67-77
[4]杨长军,马云,李铁柱,等.姜黄保健功效研究及市场前景分析[J].食品研究与开发,2016,37(6):218-220
[5]Metzler M,Pfeiffer E,Schulz S I,et al.Curcumin uptake and metabolism[J].Biofactors,2013,39(1):14-20
[6]王秀梅,彭文兴.胡椒碱可提高药物生物利用度的作用机制研究进展[J].中国临床药理学杂志,2010,26(6):471-474
[7]Singh S,Jamwal S,Kumar P.Piperine enhances the protective effect of curcumin against 3-NP induced neurotoxicity:possible neurotransmitters modulation mechanism[J].Neurochemical research,2015,40(8):1758-1766
[8]Yamaoka Y,Kawakita T,Nomoto K.Protective effect of a traditional Japanese medicine,Bu-zhong-yi-qi-tang(Japanese name:Hochuekki-to),on the restraint stress-induced susceptibility against Listeria monocytogenes[J].Immunopharmacology,2000,48(1):35-42
[9]Nanji A A,Jokelainen K,Fotouhinia M,et al.Increased severity of alcoholic liver injury in female rats:role of oxidative stress,endotoxin,and chemokines[J].Am.J Physiol,2001,281(6):1348-1356
[10]Stojanovich L,Marisavljevich D.Stress as a trigger of autoimmune disease[J].Autoimmun Rev,2008,7(3):209-213
[11]He R R,Yao X S,Li H Y,et al.The anti-stress effects of Sarcandra glabra extract on restraint-evoked immunocompromise[J].Biological and Pharmaceutical Bulletin,2009,32(2):247-252
[12]Bao L,Abe K,Tsang P,et al.Bilberry extract protect restraint stress-induced liver damage through attenuating mitochondrial dysfunction[J].Fitoterapia,2010,81(8):1094-1101
[13]何蓉蓉,姚新生,栗原博.拘束应激动物模型的研究现状与应用[J].中国实验方剂学杂志,2008,14(11):80-83
[14]Yu B P.Cellular defenses against damage from reactive oxygen species[J].Physiological reviews,1994,74(1):139-162
[15]Sehgal A,Kumar M,Jain M,et al.Combined effects of curcumin and piperine in ameliorating benzo(a)pyrene induced DNA damage[J].Food and chemical toxicology,2011,49(11):3002-3006
[16]Suresh D,Srinivasan K.Tissue distribution&elimination of capsaicin,piperine&curcumin following oral intake in rats[J].2010,131(5):682-691
[17]韩刚,翟丽,赵琳琳,等.姜黄素固体分散体在大鼠体内的药动学研究[J].中国药学杂志,2009,44(9):698-700
[18]Stewart S,Jones D,Day C P.Alcoholic liver disease:new insights into mechanisms and preventative strategies[J].Trends in molecular medicine,2001,7(9):408-413
Curcumin Combined Piperine Attenuates Restraint Stress Provoked Liver Injury
BAI Li-xia,ZHANG Kun,ZHAO Min-cong,WEN Zhe,ZHAO Jun-feng,DU Zhi-yun*
(Institute of Medicine and Green Chemistry,Guangdong University of Technology,Guangzhou 510006,Guangdong,China)
Within polyvinylpyrnolidone (PVP)as the carrier,using curcumin combined piperine distribution(5 ∶1)solid preparation of PVP,in curcumin solid dispersion and curcumin as the reference preparation,to research curcumin combined piperine with solid preparation attenuates restraint stress provoked liver injury in mice.The research results showed that curcumin+piperine PVP inclusion compound group,PVP inclusion compound curcumin and curcumin group could reduce plasma ALT,AST activities and the content of liver MDA,caused by restraint stress.and increase of the activities of GSH-PX,SOD and CAT in liver.The group of curcumin and piperine PVP inclusion compound was most significant.Thus,curcumin combined piperine with solid preparation could significantly inhibited restraint stress provoked liver injury in mice,this was because the piperine could increase the bioavailability of curcumin,the preparation of PVP solid preparation could increase the ratio of curcumin piperine after the solubility in water.
curcumin;piperine;solid preparation;liver injury
10.3969/j.issn.1005-6521.2017.17.043
2016-12-16
柏利霞(1992—),女(汉),硕士研究生在读,从事天然产物与绿色化学研究。
*通信作者
