苦瓜多糖对运动力竭小鼠疲劳的干预研究
2017-09-04于志江
于志江
(河南科技学院,河南新乡453003)
苦瓜多糖对运动力竭小鼠疲劳的干预研究
于志江
(河南科技学院,河南新乡453003)
研究苦瓜多糖对一次性力竭运动后小鼠疲劳缓解及氧化损伤影响。以醇沉水提法制备的苦瓜多糖灌胃小鼠21 d后,采用力竭游泳试验,测定小鼠力竭游泳时间,血清乳酸,乳酸脱氢酶及尿素氮,肝肌糖原及组织(心肌、肝脏)中谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)与超氧化物歧化酶(superoxide dismutase,SOD)活力、丙二醛(malondialdehyde,MDA)含量。同力竭对照小鼠比较,苦瓜多糖能延长小鼠负重游泳时间,提高肝脏及肌肉糖原水平,减少运动后血乳酸,尿素氮的堆积,提高乳酸脱氢酶活性。此外,还可提高心脏及肝脏中SOD及GPX活性,降低MDA水平。结果表明苦瓜多糖具有显著的抗疲劳功效,可减轻大强度运动后自由基造成的氧化损伤,促进机体功能恢复。
苦瓜;粗多糖;抗疲劳;氧化应激;力竭
疲劳是在一定工作或环境条件下,机体的机能不能维持某一特定水平和(或)不能维持预定的运动强度而引起的工作能力显著降低的一种病理现象[1]。运动医学理论证明,高强度运动后机体处于缺氧状态,不仅消耗大量能源物质,堆积致疲劳物质,还会产生大量的自由基,引起机体细胞功能障碍,导致运动能力降低,产生疲劳感,进而危害人体的健康[2]。因此,清除自由基,增强机体抗氧化能力能有效延缓和预防高强度运动诱发的疲劳[3]。植物多糖存在于植物细胞壁中,国内外已较多研究表明多种植物多糖具有抗氧化及抗疲劳作用[4-5]。苦瓜是葫芦科苦瓜属植物(Momordica charantia L.)果实,是传统的药食两用植物,具有多种药理活性。苦瓜多糖(bitter gourd polysaccharide,BGPs)是从苦瓜果实中提取的一类杂多糖,是苦瓜的主要有效成分,具有降血糖、抗病毒、抗肿瘤、提高免疫力等功效[6]。但到目前为止,鲜有关于苦瓜多糖抗高强度诱导的疲劳及氧化应激方面的报道。研究苦瓜多糖对一次力竭运动小鼠抗疲劳及抗氧化的活性,旨在阐明苦瓜多糖提高运动能力的作用及机理,并为苦瓜在运动保健食品方面的开发利用提供理论依据。
1 材料与方法
1.1 材料
1.1 主要材料及试剂
新鲜苦瓜:市售;乳酸(lactic acid,LD)、乳酸脱氢酶(lactate dehydrogenase,LDH)及血尿素氮(blood urea nitrogen,BUN)试剂盒:中生北控生物有限公司;糖原、SOD及GPX酶活试剂盒、丙二醛(MDA)试剂盒:南京建成生物工程研究所;考马斯亮蓝G250:天津明川试剂公司;其它试剂均为国产分析纯。
1.2 仪器
Glamour3000全自动生化分析仪:美国魅力公司;722N可见分光光度计:上海菁华科技仪器有限公司;EX224电子分析天秤:奥尔斯仪器有限公司;FW100高速粉碎机:天津市李斯特仪器有限公司。
1.2 方法
1.2.1 苦瓜多糖制备
采用水提醇沉法提取苦瓜多糖[7]:鲜苦瓜洗净,去瓤、干燥、粉碎过60目筛得苦瓜粉,80%的乙醇回流,滤渣经60℃烘干后以蒸馏水热提苦瓜多糖,提取条件为:1∶30(g/mL)的料液比,90℃提取 0.5 h。取提取液上清,60℃旋转蒸发浓缩至原滤液体积20%,加85%乙醇置冰箱过夜醇沉,6 000 r/min离心 10 min取沉淀,冷冻干燥后得苦瓜糖。
1.2.2 实验动物条件和分组
SPF级雄性昆明小鼠,购于军事医学科学院实验动物中心,体重18 g~22 g。实验小鼠饲养条件为:温度18℃~22℃、相对湿度45%~55%,自然光照,自由采食和饮水。适应性饲养1周,按照文献[8]方法测定小鼠游泳时间,挑选游泳时间相同或相似的小鼠40只,随机分成4组,分别是正常对照组(CN)、力竭运动组(E)、苦瓜多糖低(BGPs-L)、高剂量组(BGPs-H)。CN组及E组蒸馏水灌胃,BGPs-L及BGPs-H组灌胃100、500 mg/(kg·d)剂量的BGPs,每天1次,连续给药21 d。各组给予基础饲料和自由饮水。
1.2.3 负重力竭游泳实验
各组于灌胃第15天开始进行适应性游泳训练,游泳时间由10 min/d开始,每日递增5 min至第21天。力竭游泳实验[8]:除了正常对照组外,其余3组末次给药30 min后,给予小鼠尾部负重相当于自重5%的铅丝,将各组小鼠分别放入恒温水池箱,水深(20±5)cm、水温(25±1)℃。放入后立即计时,不断用玻棒拨动小鼠游泳,直到力竭为止,记录小鼠游泳力竭时间。小鼠游泳力竭标准为:小鼠沉于水面下8 s后不能浮出水面。
1.3 测试样品的制备和检测
1.3.1 血清指标检测
力竭游泳实验后,摘眼球取血后脱臼处死,血经3 000 r/min离心15 min,收集血清,-4℃贮藏备用。用全自动生化分析仪严格按照试剂盒方法检测血清中LD、LDH、BUN等指标。
1.3.2 肝糖原和肌糖原含量的测定
分别称取0.1 g肝脏和0.5 g肌肉置于15 mL玻璃匀浆管内,按1∶9(g/mL)比例加入5%三氯醋酸进行快速匀浆(冰浴),经3 500 r/min离心10 min,取上清液,既得10%组织匀浆,测定时再用生理盐水稀释。严格按照糖原试剂盒(蒽酮法)测定肝脏及肌肉糖原含量。
1.3.3 肝脏和心肌氧化应激检测
心肌和肝脏组织均按照1∶9(g/mL)比例加入预冷生理盐水充分研磨,4℃,4 000 r/min离心10 min,取上清,得10%组织匀浆。采用考马斯亮蓝试剂盒测定上清液中的蛋白浓度,严格参照试剂盒的操作步骤测定SOD、GPX活性和MDA浓度。
1.4 数据分析
数据经整理后输入SPSS 18软件,结果均以均数±标准误(n=10)表示,并进行ANOVA分析,多重比较采用 Dunnet’s法,P<0.05 为差异显著性。
2 结果与分析
2.1 BGPs对小鼠力竭游泳时间的影响
BGPs对小鼠力竭游泳时间的影响见表1。
表1 BGPs对小鼠力竭游泳时间的影响(,n=10)Table 1 Effect of BGPs on the exhausting swimming time in mice(,n=10)

表1 BGPs对小鼠力竭游泳时间的影响(,n=10)Table 1 Effect of BGPs on the exhausting swimming time in mice(,n=10)
注:同列肩注不同字母表示P<0.05,-表示无。
组别BGPs剂量/(mg/kg B.W.)力竭游泳时间/min CN 0 -E 0 91.39±12.56aBGPs-L 100 116.25±20.8bBGPs-H 500 125.87±13.67b
运动耐力的增强是抗疲劳能力提高最有力的综合表现,负重游泳持续时间可以反应小鼠运动疲劳的状况[9]。如表 1所示,与力竭组(E)比较,BGPs-L及BGPs-H组的力竭游泳时间均显著增加(P<0.05)。
2.2 BGPs对小鼠力竭游泳血清相关生理指标的影响
BGPs对小鼠力竭游泳血清指标的影响见表2。
表2 BGPs对小鼠力竭游泳血清指标的影响(,n=10)Table 2 Effect of BGPs on the serum indexes in mice(,n=10)
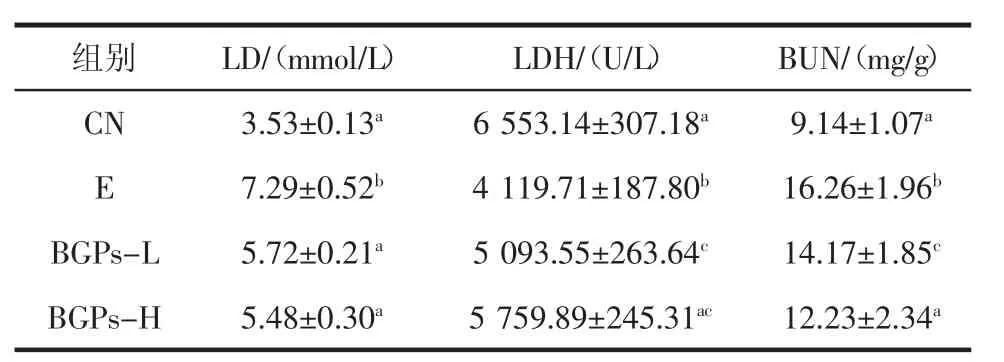
表2 BGPs对小鼠力竭游泳血清指标的影响(,n=10)Table 2 Effect of BGPs on the serum indexes in mice(,n=10)
注:同行肩注不同字母表示P<0.05。
组别LD/(mmol/L)LDH/(U/L)BUN/(mg/g)CN 3.53±0.13a 6 553.14±307.18a 9.14±1.07aE 7.29±0.52b 4 119.71±187.80b 16.26±1.96bBGPs-L 5.72±0.21a 5 093.55±263.64c 14.17±1.85cBGPs-H 5.48±0.30a 5 759.89±245.31ac 12.23±2.34a
机体运动疲劳状态下,动用蛋白质供能较多,蛋白质代谢产物BUN增高,因此,血BUN是反映机体疲劳程度的常用指标[10]。本研究发现,力竭运动组血BUN显著高于CN组,而BGPs-H显著降低了力竭运动所致的高浓度尿素氮(P<0.05)。进一步说明了一定量的BGPs能缓解高强度运动的疲劳。乳酸(LD)是机体运动过程中诱发疲劳感重要的代谢物之一,而LDH可以代谢乳酸,降低疲劳感。本研究发现,力竭运动导致小鼠血LD水平增高,LDH活性降低(P<0.05),而与E组比较,BGPs处理组的LD降低,LDH活性增加(P<0.05)。表明BGPs能通过清除力竭运动所致的乳酸堆积缓解疲劳,其机制可能与乳酸脱氢酶的变化有关。
2.3 BGPs对肝脏、骨骼肌糖原的影响
BGPs对糖原(肝脏、肌肉)的影响见图1。
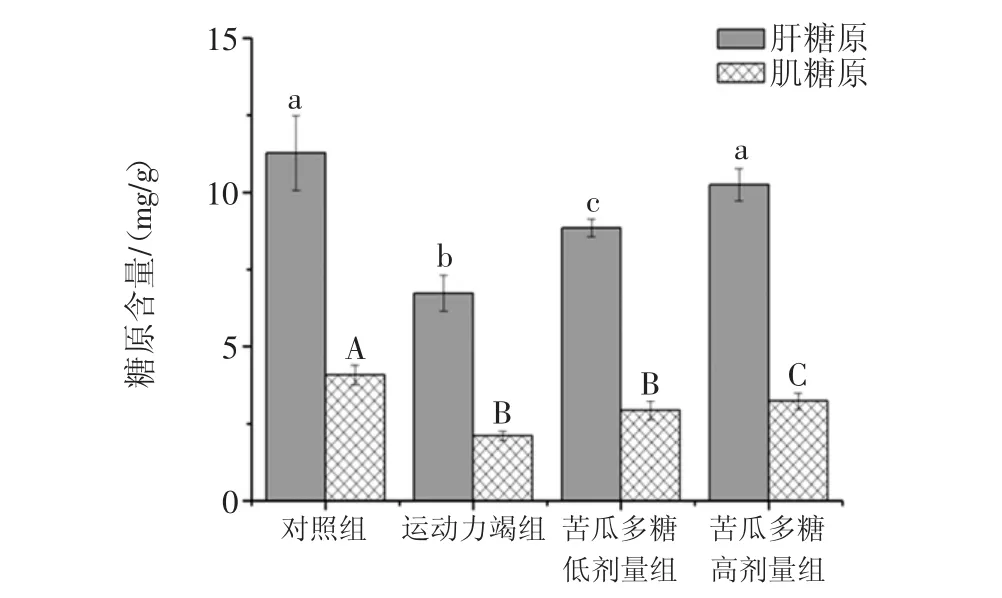
图1 BGPs对糖原(肝脏、肌肉)的影响(,n=10)Fig.1 Effects of BGPs on glycogen(muscle and liver)in mice(,n=10)
肝糖和肌糖是机体内贮存糖原的主要方式,在运动过程,肌肉对肌糖原的需求增加,肝糖原快速分解,释放葡萄糖快速入血,维持机体血糖以满足运动肌肉对糖的需求,而肌糖原和肝糖原对维持机体运动的耐力较重要[11]。如图1所示,与CN组比较,力竭组肝糖原与肌糖原均显著降低(P<0.05);而BGPs-L组肝糖原显著高于力竭组(P<0.05);BGPs-H组肌糖原和肝糖原均高于力竭组(P<0.05);,从而改善力竭运动所致疲劳。
2.4 BGPs对氧化应激(心肌、肝脏)的影响
BGPs对氧化应激(心肌、肝脏)的影响见表3。
表3 BGPs对氧化应激(心肌、肝脏)的影响(,n=10)Table 3 Effects of BGPs on oxidative stress in mice(,n=10)说明苦瓜多糖能改善肝脏与骨骼肌糖原的代谢
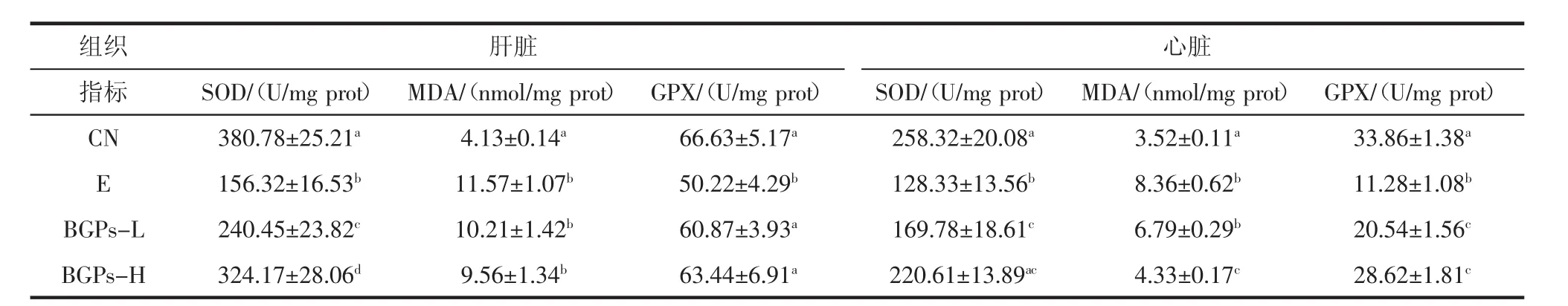
表3 BGPs对氧化应激(心肌、肝脏)的影响(,n=10)Table 3 Effects of BGPs on oxidative stress in mice(,n=10)说明苦瓜多糖能改善肝脏与骨骼肌糖原的代谢
注:同列肩注不同字母表示P<0.05。
组织 肝脏 心脏指标SOD/(U/mg prot)MDA/(nmol/mg prot)GPX/(U/mg prot)SOD/(U/mg prot)MDA/(nmol/mg prot)GPX/(U/mg prot)CN 380.78±25.21a 4.13±0.14a 66.63±5.17a 258.32±20.08a 3.52±0.11a 33.86±1.38aE 156.32±16.53b 11.57±1.07b 50.22±4.29b 128.33±13.56b 8.36±0.62b 11.28±1.08bBGPs-L 240.45±23.82c 10.21±1.42b 60.87±3.93a 169.78±18.61c 6.79±0.29b 20.54±1.56cBGPs-H 324.17±28.06d 9.56±1.34b 63.44±6.91a 220.61±13.89ac 4.33±0.17c 28.62±1.81c
SOD和GPX是机体主要的抗氧化酶,负责清除体内的氧自由基,缓解氧化应激。而MDA则是脂质过氧化代谢产物之一,是反映组织氧化应激损伤的重要指标。如表3所示,与对照组比较,力竭运动组的肝脏及心脏氧化抗氧化酶(SOD,GPX)活性均显著降低,而MDA均显著增高(P<0.05)。说明负重力竭游泳可导致机体心脏及肝脏的抗氧化能力下降,诱发氧化应激。这与以往研究结果一致[12]。而与力竭组比较,BGPs-L组肝脏与心肌中SOD与GPX均显著增高(P<0.05),MDA均无显著变化(P>0.05);BGPs-H组SOD及GPX活性显著增高,而MDA显著降低(P<0.05)。表明一定量的苦瓜多糖能提高力竭运动小鼠的抗氧化酶活性,缓解氧化损伤。
3 结论
本研究采用一次力竭游泳动物实验对苦瓜多糖缓解力竭运动所致的疲劳及氧化损伤的活性进行考察。研究发现,苦瓜多糖提取物能显著增加动物力竭游泳时间,并能增加力竭游泳后小鼠肝肌糖原水平及LDH活性,同时降低LD及BUN。表明苦瓜多糖提取物能显著增强小鼠抗疲劳能力,延缓了运动疲劳的发生,进而提高了运动能力,其作用机制可能与苦瓜多糖改善糖原代谢及清除疲劳物质有关。过度运动所产生大量自由基,超出机体的防御水平时,会破坏组织细胞内生物大分子结构,进而影响其功能[13]。苦瓜多糖能显著提高力竭运动后组织(肝脏,心脏)SOD及GPX活性增高,而降低MDA水平。表明力竭运动过程中,苦瓜多糖能缓解组织细胞氧化应激损伤。
[1]李爱臣,房磊.败酱草多糖对运动疲劳大鼠的肝组织保护作用[J].食品研究与开发,2016,37(12):174-177
[2]杨晓杰,付学鹏,刘泽东.蒲公英多糖抗疲劳作用研究[J].时珍国医国药,2008,19(11):2686-2687
[3]王玉勤,于晓婷,吴晓岚,等.黄精多糖对力竭小鼠脑组织自由基代谢影响[J].中国公共卫生,2014,34(2):1165-1167
[4]池爱平,陈锦屏,熊正英.木枣多糖抗疲劳组分对力竭游泳小鼠糖代谢的影响[J].中国运动医学杂志,2007,4(6):411-415
[5]郑飞.蓝莓多糖对衰老小鼠运动耐力及抗疲劳效果研究[J].食品科学,2014,35(21):249-252
[6]钟雨,闫明珠,张泽生,等.黄秋葵水提物抗运动疲劳作用研究[J].食品科技,2015,40(7):221-225
[7]李士杰,肖连冬.水提醇沉法提取苦瓜多糖条件研究[J].中国酿造,2016,35(5):166-170
[8]Matsumoto K,Ishihara K,Tanaka K,et al.An adjustable-current swimming pool for the evaluation of endurance capacity of mice[J].Journal of applied physiology,1996,81(4):1843-1849
[9]周庆峰,姜书纳,马亢,等.铁棍山药多糖抗疲劳及耐缺氧作用研究[J].时珍国医国药,2014,25(2):284-285
[10]杨雪,张海悦,张鑫,等.猴头菇多糖对小鼠抗疲劳作用研究[J].食品工业科技,2015,36(13):369-370,375
[11]江海涛,任源浩,吴雨龙,等.蛹虫草多糖对小鼠抗疲劳作用的研究[J].食用菌学报,2014,21(3):55-59
[12]史亚丽,刘运祥,韩立明,等.灵芝多糖对力竭小鼠抗脂质过氧化作用研究[J].现代预防医学,2006,33(6):889-890
[13]SACHDEV S,DAVIES KJ.Production,detection and adaptive responsetofreeradicalsinexercise[J].Freeradicalbiologyandmedicine,2008,44(2):215-223
Effects of Polysaccharides from Momordica charantia L.on Fatigue in Mice with Exhaustive Exercise
YU Zhi-jiang
(Henan University of Science and Technology,Xinxiang 453003,Henan,China)
The aim of this study was to investigate the effects of Momordica charantia L.polysaccharide(BGPs)on fatigue and oxidative damage in exercise-exhaustive mice.The animals were treated with BGPs prepared by alcohol submerged extraction method for 21 days by gavage.The exhaustive swimming time,lactate,lactate dehydrogenase and urea nitrogen in serum,glycogen in liver and muscle,the activities of glutathione peroxidase(GPX)and superoxide dismutase(SOD)as well as the content of malondialdehyde(MDA)in liver and heart were measured.Compared with the exercise-exhaustive mice,BGPs prolonged the weight-bearing swimming time,increased the glycogen levels of liver and muscle,reduced the accumulation of blood lactic acid and urea nitrogen,and improved the activity of lactate dehydrogenase.In addition,the improved activities of antioxidases(SOD and GPX)and the reduced MDA levels in heart and liver of BGPs treated mice were observed.The results showed that BGPs had significant protective effects against exercise-fatigue,relieved oxidative damage caused by free radicals after high intensity exercise,and promoted the recovery of body function.
Momordica charantia L.;polysaccharides;anti-fatigue;oxidative stress;exhaustion
10.3969/j.issn.1005-6521.2017.17.042
2016-12-09
于志江(1984—),男(汉),讲师,硕士,研究方向:民族传统体育保健。
