胭脂萝卜花青素的酶法提取及抑菌活性研究
2017-09-04梁姗徐波刘欢曹颜蒋子川
梁姗,徐波,刘欢,曹颜,蒋子川
(长江师范学院生命科学与技术学院,重庆408100)
胭脂萝卜花青素的酶法提取及抑菌活性研究
梁姗,徐波,刘欢,曹颜,蒋子川
(长江师范学院生命科学与技术学院,重庆408100)
为研究酶法提取胭脂萝卜花青素的工艺条件,考察了纤维素酶-果胶酶比例、酶用量、酶解时间、酶解温度、pH值5个单因素对花青素提取率的影响。采用中心组合设计及响应面分析得出酶法提取胭脂萝卜花青素最佳工艺为:果胶酶与纤维素酶比例1∶2(质量比)、添加量0.03 mg/g,在50℃下,pH 4.0,酶解95 min。在此条件下,花青素的最高提取量为4.25 mg/g。采用分光光度法和牛津杯进行抑菌试验,结果表明,胭脂萝卜花青素对枯草芽孢杆菌、大肠杆菌、白色念珠菌均有抑制作用,最低抑菌浓度分别为0.8%、1.6%、1.6%。
胭脂萝卜;花青素;酶法提取;抑菌活性
花青素(anthocyanin)是存在于植物中的水溶性天然色素,在自然状态下往往与各种糖苷形成花色苷[1-3]。近年研究表明其具有较强的抑菌活性,邓红梅等[4]发现野生葡萄皮渣花青素对金黄色葡萄球菌有较好的抑制作用。张俊等[5]发现紫萝卜花青素能抑制大肠杆菌和金黄色葡萄球菌,褚盼盼等[6]发现黑豆皮花青素对大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌的抑制效果较好,郝文博和古荣鑫等[7-8]发现蓝莓及紫甘薯花青素对大肠杆菌均有较强抑制作用。胭脂萝卜(carmine radish)是重庆市涪陵特有的蔬菜品种,富含花青素类天竺葵素。本研究探讨了酶法提取胭脂萝卜花青素的最佳工艺及其抑菌活性,以期为胭脂萝卜花青素的进一步开发利用提供依据。
1 材料与方法
1.1 材料与试剂
胭脂萝卜品种为胭脂红1号,由长江师范学院生命科学与技术学院保存;大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、白色念珠菌、黑曲霉来自于长江师范学院微生物实验室;AB-8大孔树脂:东鸿化工有限公司。无水乙醇、氢氧化钠、硫酸镁、硫酸亚铁、硫酸锌、硫酸铝、盐酸、氯化钠(均为国产分析纯):重庆川东化工有限公司;纤维素酶,果胶酶:北京奥博星生物技术有限公司。
1.2 仪器与设备
超净工作台(ZHJH-C1112CZ):上海智城分析仪器制造有限公司;高速冷冻离心机(TGL-16M):湖南湘仪仪器制造有限公司;电热恒温培养箱(DHP-9082):上海一恒科学仪器有限公司;旋转蒸发仪(RE-52A):上海亚荣仪器有限公司。
1.3 方法
1.3.1 酶法提取花青素
新鲜胭脂萝卜洗干净,均匀切成2 mm薄片,60℃烘干到恒重,粉碎并过40目筛,避光常温保存。称取胭脂萝卜粉1.0 g,以100 mL的去离子水(pH 7.0)溶解,加入复合酶(纤维素酶-果胶酶)进行酶解,调节酶解pH值与时间,过滤去除滤渣,以3 000 r/min,离心10 min,取上清,用旋转蒸发仪去除液体,以去离子水溶解花青素并定容1至100 mL测定胭脂萝卜花青素含量。
1.3.2 花青素含量测定
采用宋德群等报道的pH示差法计算花青素含量[9]。计算公式为:
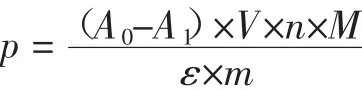
式中:p为花青素含量,mg/g;A0和 A1分别 pH 1.0、pH 4.5时花青素在520 nm处的吸光度;V为提取液总体积,mL;n为稀释倍数;M为天竺葵素-3-槐二糖苷相对分子量(648.5);ε为消光系数(30 200);m 为样品质量,g。
1.3.3 单因素试验设计
分别探究果胶酶∶纤维素酶(质量比)为 3∶1、2∶1、1∶1、2∶1、3∶1;复合酶用量(mg/g):0.01、0.02、0.03、0.04、0.05;酶解 pH:3.0、3.5、4.0、4.5、5.0;酶解时间(min):30、60、90、120、150;酶解温度(℃):35、40、45、50、55 对胭脂萝卜花青素提取量的影响。
1.3.4 响应面法试验设计
根据单因素试验结果,以复合酶用量(A)、酶解时间(B)、酶解pH(C)这3个因素为自变量,以胭脂萝卜花青素提取量为响应值,利用Box-Behnken组合设计试验方法[12],进行对提取胭脂萝卜花青素条件的优化,因素水平见表1。
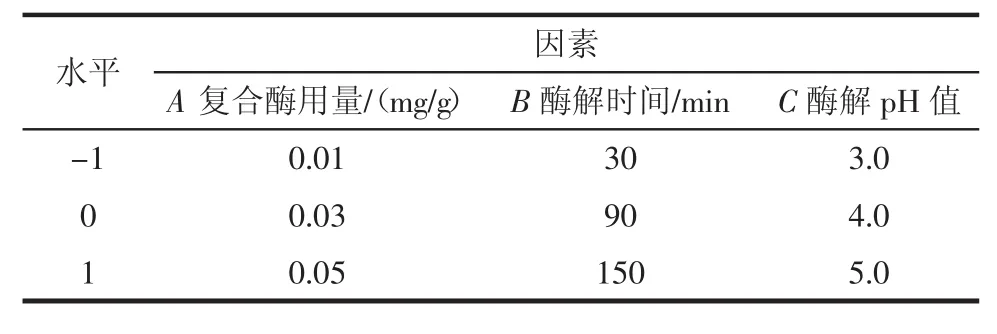
表1 因素与水平Table 1 Factors and levels
1.3.5 胭脂萝卜花青素的树脂纯化
在层析柱中加入预处理好的AB-8大孔树脂,加入花青素提取液,吸附达饱和(流出的液体和流进的花青素吸光度值相同),用蒸馏水反复冲洗树脂,直到流出的液体无白色或褐色浑浊为止。以1%盐酸乙醇进行解析,收集滤液,用旋转蒸发仪在40℃回收乙醇,得到花青素纯化液。
1.3.6 胭脂萝卜花青素抑菌活性
大肠杆菌、枯草芽孢杆菌、鼠沙门氏菌、金黄色葡萄球菌采用牛肉膏蛋白胨培养基培养,黑曲霉、白色念珠菌用PDA培养基培养。取纯化后的花青素溶液稀释至5 mg/mL,6种供试菌种的菌液中分别加入10 mL花青素和10 mL无菌水(对照)进行培养,细菌37℃培养24 h,霉菌28℃培养2 d。用可见分光光度计在520 nm处分别测定处理组和对照组各菌悬液的吸光值。利用牛津杯法测量抑菌圈的大小[10]。根据菌悬液的吸光值和抑菌圈的大小综合得出胭脂萝卜花青素对供试菌的抑菌效果[11-12]。
1.3.7 胭脂萝卜花青素的最小抑菌浓度(MIC)
将胭脂萝卜花青素和各菌悬液按比例加入试管中,使试管中的抑菌剂质量浓度为0.4%、0.8%、1.2%、1.6%、2.0%、2.4%。细菌于37℃培养箱内培养24 h,霉菌于28℃培养箱内培养2 d,培养基中没有细菌生长的最低浓度即为最小抑菌浓度[13-14]。
2 结果与分析
2.1 单因素试验结果
2.1.1 复合酶比例对花青素提取量的影响
复合酶比例对花青素提取量的影响见图1。
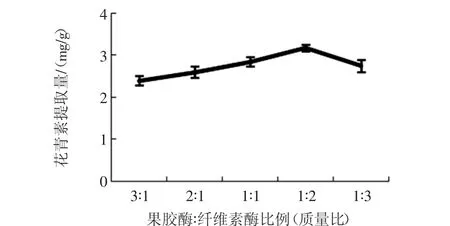
图1 复合酶比例对花青素提取量的影响Fig.1 Effect of the ratio of compound enzyme on anthocyanin content
当果胶酶∶纤维素酶为3∶1(质量比)时,花青素提取量最低,果胶酶∶纤维素酶为1∶2(质量比)时,花青素的提取量达到最高,说明纤维素酶在胭脂萝卜酶解过程中更为重要,可能与萝卜中纤维素含量较高有关。
2.1.2 复合酶用量对花青素提取量的影响
复合酶用量对花青素提取量的影响见图2。
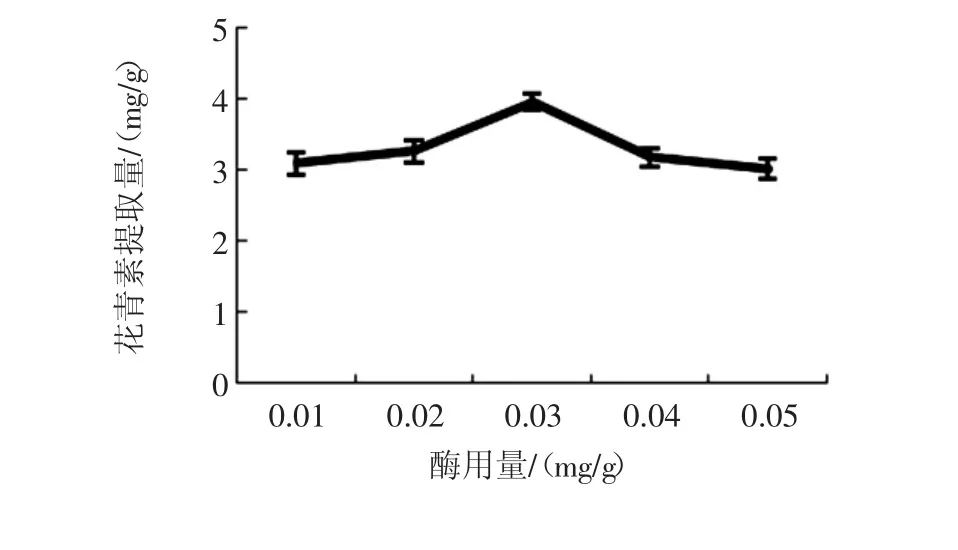
图2 复合酶用量对花青素提取量的影响Fig.2 Effect of the enzyme dosage on the anthocyanin content
随着酶用量从0.01 mg/g增加至0.03 mg/g,花青素的提取量也增加,当酶用量超过0.03 mg/g后,花青素提取量并未增加,反而有降低的趋势,可能是0.03 mg/g酶用量已使细胞壁的降解达到最大化,因此最佳的复合酶用量为0.03 mg/g。
2.1.3 酶解pH值对花青素提取量的影响
酶解pH值对花青素提取量的影响见图3。
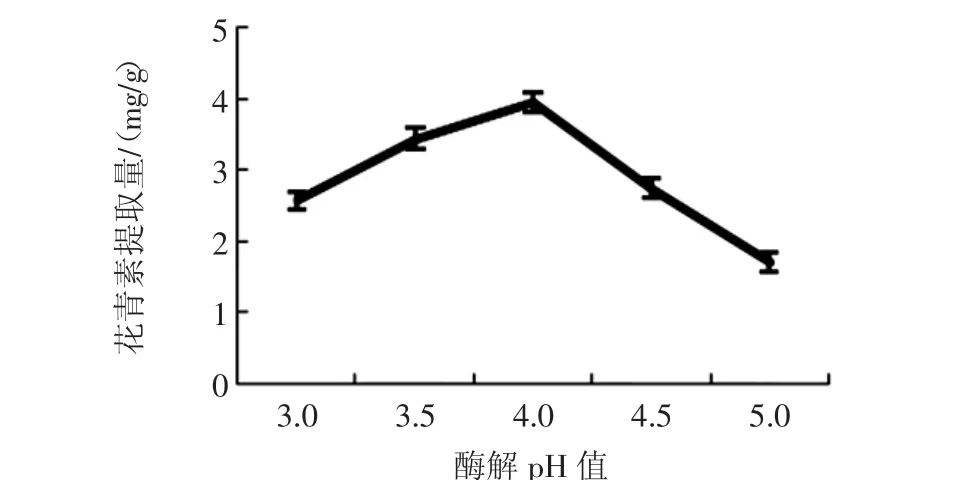
图3 酶解pH值对花青素提取量的影响Fig.3 Effect of enzymolysis pH on anthocyanin content
随着复合酶pH值从3.0到4.0,花青素提取量达到最高,超过pH 4.0,花青素的提取量降低,可能是由于高pH值影响了酶的活性,从而影响了花青素的提取量。果胶酶的最适pH值为3.0左右,纤维素酶最适pH值为5.0左右,因此,复合酶采用pH 4.0也是较适宜的。
2.1.4 酶解时间对花青素提取量的影响
酶解时间对花青素提取量的影响见图4。
90 min以内,随着酶解时间的增加花青素的提取量也增加,90 min~150 min时,花青素的提取量随酶解时间的增加反而减少,说明90 min已足够使花青素完全溶出。
2.1.5 酶解温度对花青素提取量的影响
酶解温度对花青素提取量的影响见图5。
花青素提取量随着酶解温度的上升而提高,在50℃时达到最高,随后酶解温度的升高反而引起花青素提取量降低。可能是由于过高的温度使酶活性降低,同时导致花青素部分降解。果胶酶与纤维素酶的最适温度均为50℃左右,因此复合酶采用50℃也是较适宜的。
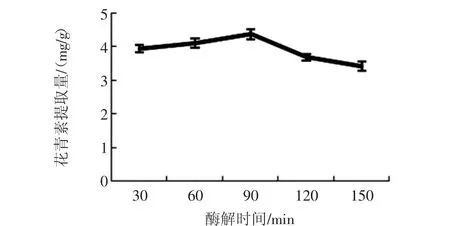
图4 酶解时间对花青素提取量的影响Fig.4 Effect of enzymolysis time on anthocyanin content
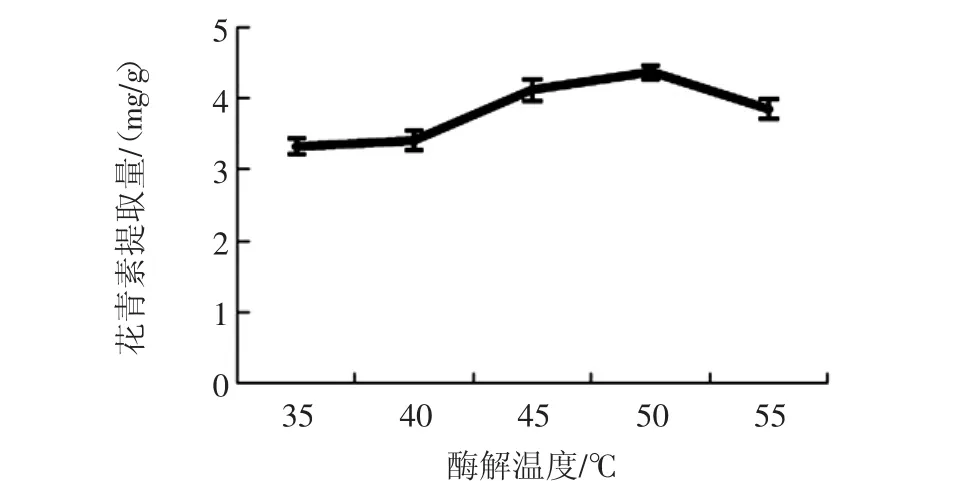
图5 酶解温度对花青素提取量的影响Fig.5 Effect of enzymolysis temperature on anthocyanin content
2.2 响应曲面法优化试验结果
基于单因素试验结果,选取复合酶用量(A)、酶解时间(B)、酶解pH值(C)进行响应面分析,结果见表2。
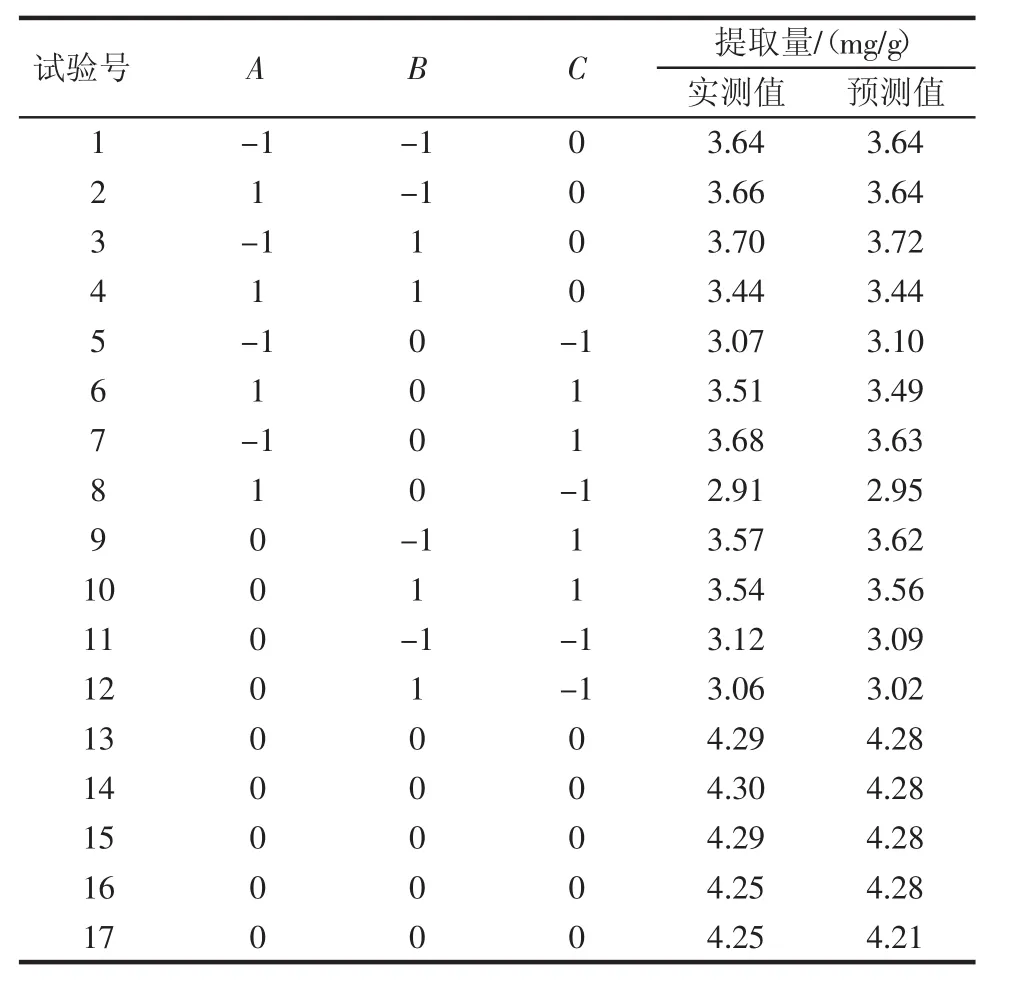
表2 响应面分析方案及实验结果Table 2 Response surface analysis and results
以花青素提取量(mg/g)为响应值(Y),使用软件Design Expert 8.0进行多元回归拟合,获得二次回归方程:Y=4.28-0.071A-0.031B+0.27C-0.070AB-0.002 5AC+0.007 5BC-0.35A2-0.32B2-0.64C2。
2.3 模型显著性检验
模型显著性检验见表3。
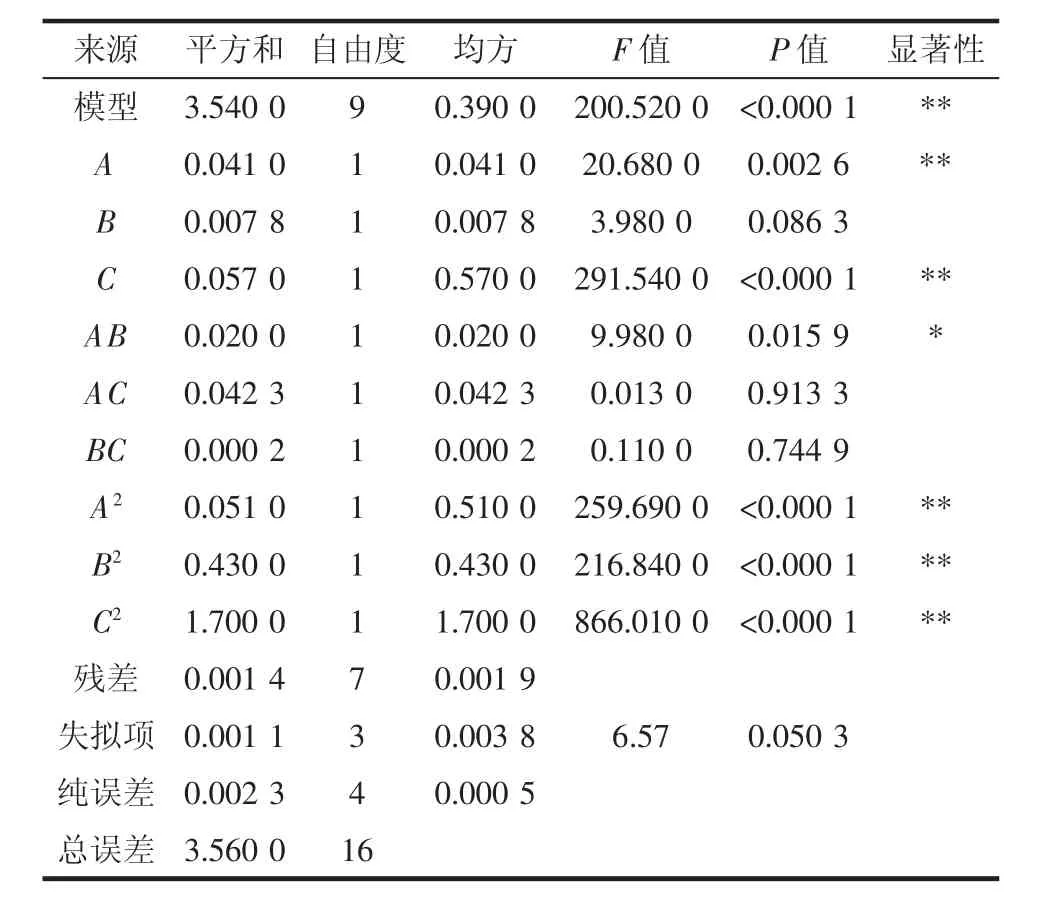
表3 回归模型的方差分析Table 3 Variance analysis of regression model
从表3的模型方差分析中可以看出,本试验的二次多项模型极显著性(P<0.01),失拟项不显著(P=0.050 3>0.01),说明该模型对胭脂萝卜花青素提取量进行分析与预测是可靠的。模型的一次项A、C的影响极显著,B的影响不显著,单因素对胭脂萝卜提取量影响的顺序为C>A>B,即酶解pH值>复合酶用量>酶解时间。二次项中酶解pH值、复合酶用量、酶解时间的影响均极显著。交互项中酶解时间和复合酶用量的影响显著、复合酶用量和酶解pH值的影响不显著,酶解pH值和酶解时间影响不显著。进一步缩减模型,得到Y=4.28-0.071A+0.27C-0.070AB-0.35A2-0.32B2-0.64C2。
复合酶用量、酶解时间和酶解pH值之间的交互作用对花青素提取量的影响见图6。通过Design-Expert软件进行分析胭脂萝卜花青素最佳提取工艺,得到回归方程的最大值点是:果胶酶∶纤维素酶(质量比)1∶2、酶解温度 50℃、酶解 pH4.21、复合酶用量 0.03mg/g、酶解时间95.73 min,考虑到实际操作性将工艺参数修正为:果胶酶∶纤维素酶(质量比)1∶2、酶解温度50℃、酶解pH 4.0、复合酶用量0.03 mg/g、酶解时间95 min,花青素提取量的预测值最高为4.31mg/g。在此条件下进行5次试验,花青素提取量为4.25mg/g,相差0.06mg/g,说明该优化工艺所得试验结果稳定;与预测值的相对误差为1.39%,说明采用响应面优化法获得的提取条件是可靠的。
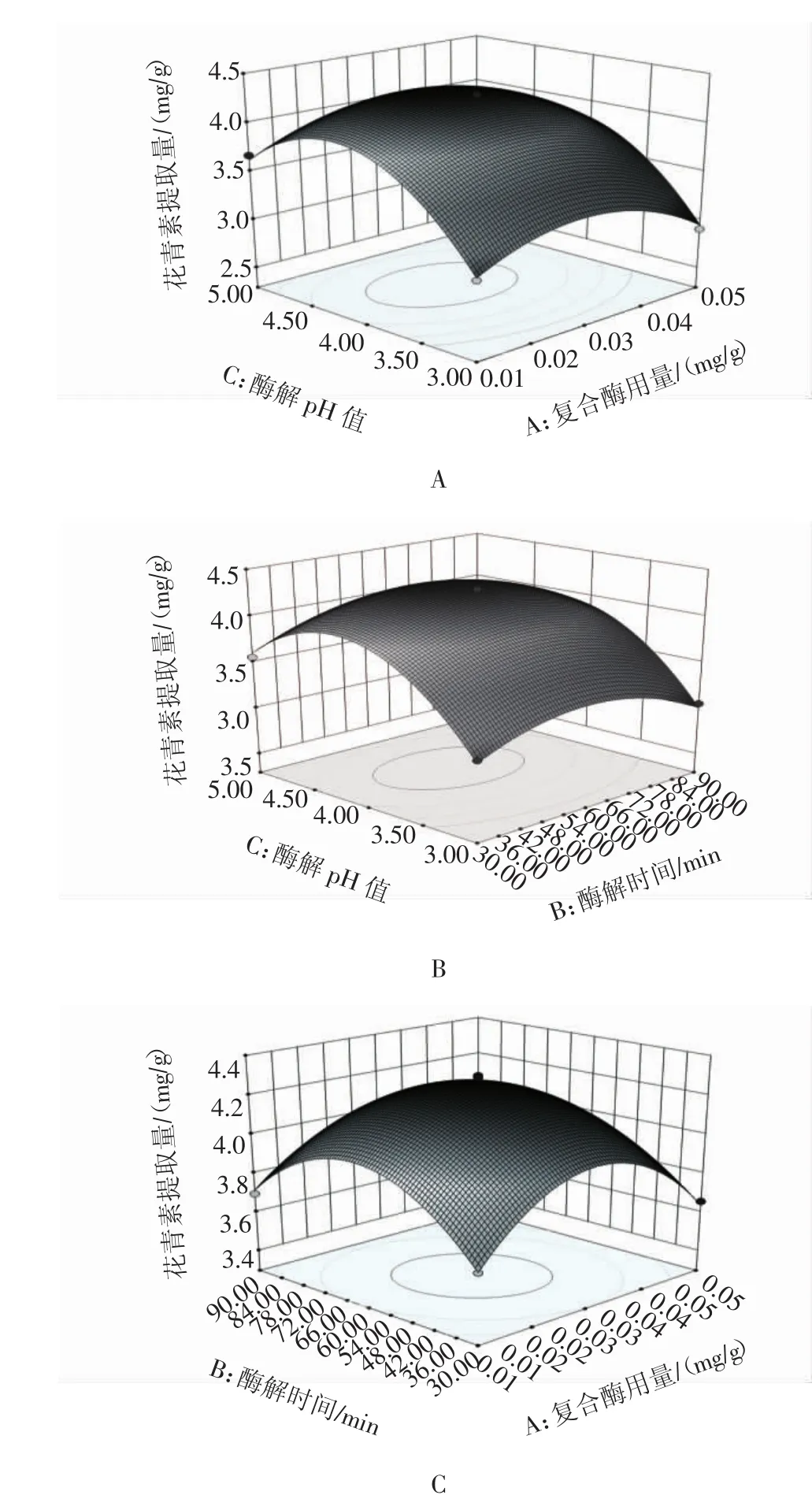
图6 响应面分析Fig.6 Response surface analysis
2.4 胭脂萝卜花青素抑菌性
2.4.1 胭脂萝卜花青素对供试菌的抑制率
胭脂萝卜花青素对供试菌的抑制率见图7。
由图7可知,胭脂萝卜花青素对枯草芽孢杆菌的抑菌率最高,为92.09%;对大肠杆菌和白色念珠菌的抑制率分别为77.22%和75.16%;对金黄色葡萄球菌和沙门氏菌的抑制率分别为71.32%和67.58%;对黑曲霉的抑菌率最低,为39.61%。可以初步判断胭脂萝卜花青素对菌种的抑菌效果为:枯草芽孢杆菌>大肠杆菌>白色念珠菌>金黄色葡萄球菌>鼠伤寒沙门氏菌>黑曲霉。
抑菌圈试验结果见表4。
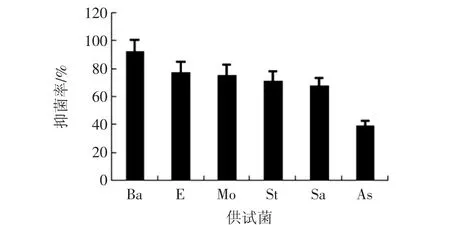
图7 胭脂萝卜花青素的抑菌率Fig.7 Bacteriostasis rate of carmine radish anthocyanins
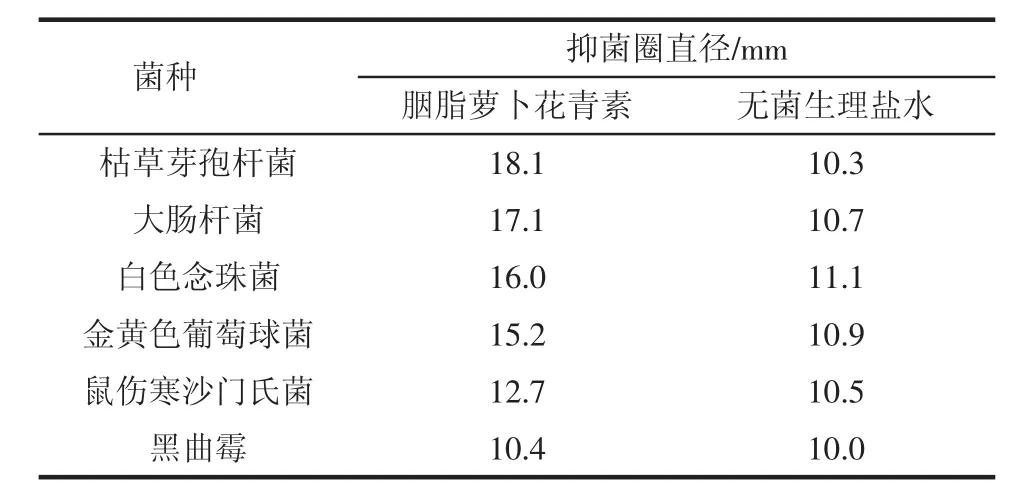
表4 抑菌圈的测定Table 4 Bacteriostatic ring determination
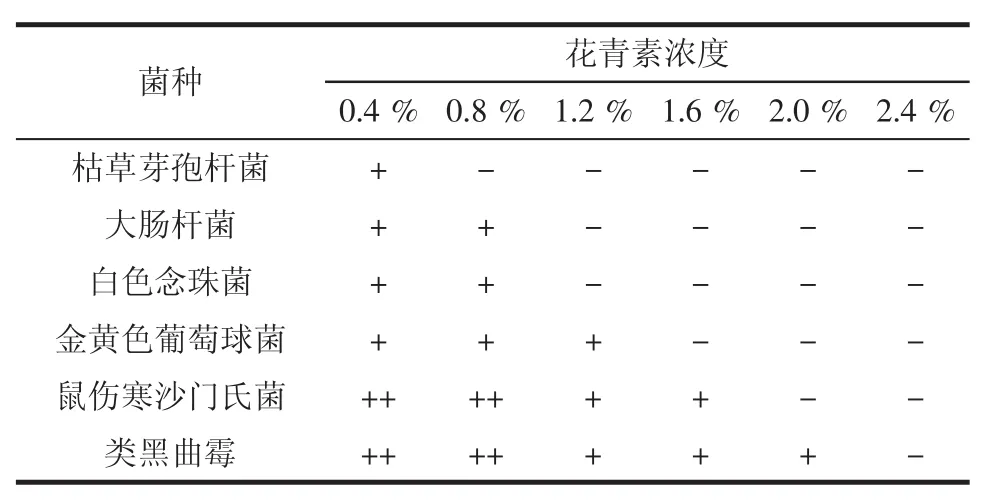
表5 胭脂萝卜花青素的最小抑菌浓度Table 5 Minimum inhibitory concentration of carmine radish anthocyanin
在相同浓度下,胭脂萝卜花青素对供试菌有不同的抑菌活性。其中,胭脂萝卜花青素对枯草芽孢杆菌的抑制效果最好,抑菌圈达到18.1 mm;对大肠杆菌和白色念珠菌的抑菌圈分别为17.1 mm和16.0 mm;对金黄色葡萄球菌和鼠伤寒沙门氏菌的抑菌圈分别为15.2 mm和12.7 mm;对黑曲霉没有显著抑菌效果。抑菌圈与抑菌率的结果一致。由此可得出胭脂萝卜花青素对供试菌的抑制效果为:枯草芽孢杆菌>大肠杆菌>白色念珠菌>金黄色葡萄球菌>鼠伤寒沙门氏菌>黑曲霉。
2.4.2 胭脂萝卜花青素的最小抑菌浓度(MIC)
胭脂萝卜花青素的最小抑菌浓度见表5。
由表5可见,随着胭脂萝卜花青素的浓度增加,抑菌效果增强。其对枯草芽孢杆菌抑菌性最高,最低抑菌浓度为0.8%;对大肠杆菌、白色念珠菌的的抑菌效果较强,最低抑菌浓度为1.2%;对金黄色葡萄球菌的抑菌性较弱,其最低抑菌浓度为1.6%;对鼠伤寒沙门氏菌和黑曲霉的最低抑菌浓度分别为2.0%、2.4%。
3 结论
本研究采用Box.Behnken的中心组合设计及响应面分析,建立了酶法提取胭脂萝卜花青素提取的二次多项式数学模型。经检验证明该模型是合理可靠的,能够优化胭脂萝卜花青素的提取量的工艺。酶法提取胭脂萝卜花青素最佳工艺参数为果胶酶:纤维素酶(质量比)1:2、酶解温度 50℃、酶解 pH 4.0、复合酶用量0.03 mg/g、酶解时间95 min,花青素的最大提取量为4.25 mg/g。
进一步研究胭脂萝卜花青素的抑菌活性发现,胭脂萝卜花青素对枯草芽孢杆菌、大肠杆菌、白色念珠菌抑制效果较好,对金黄色葡萄球菌有一定抑制效果,对鼠伤寒沙门氏菌和黑曲霉无抑制。张俊等[15-16]对紫胡萝卜花青素的抗菌活性进行了研究,发现随着花青素浓度的增加,对大肠杆菌、金黄色葡萄球菌的抑菌效果随之增加,并且对大肠杆菌、金黄色葡萄球菌的抑菌效果较大,对粪链球菌的抑菌效果较差。当花青素粗提取液浓度达到5 mg/mL时,紫甘薯花青素对大肠杆菌的抑菌率为100%,对革兰氏阴性细菌的抑菌性大于霉菌[8,17]。而在本次试验中,胭脂萝卜花青素浓度为5 mg/mL时,对枯草芽孢杆菌的抑菌率最高达到92.09%,对大肠杆菌的抑菌率为77.22%,与其它报道结果基本相符。
[1]戴妙妙.紫娟茶中花青素提取物的抗氧化性研究[J].食品研究与开发,2016,37(9):42-46
[2]贾秀娟,魏晓瑶,赵艳敏,等.黑果花楸果实中花青素含量分布及抗氧化活性[J].食品研究与开发,2017,38(8):33-37
[3]韦艳双,田密霞,张美娇,等.蓝莓花青素对糖尿病小鼠器官抗氧化能力的研究[J].食品与机械,2016(6):156-159
[4]邓红梅,周天.野生葡萄皮渣中花青素的含量及其抗氧化性和抑菌性研究[J].中国食品添加剂,2016(9):90-94
[5]张俊,程卫东,史学伟,等.紫胡萝卜花青素提取工艺及其体外抗菌活性研究[J].中国调味品,2016,41(11):140-144
[6]褚盼盼,靳泽荣,乔元彪.黑豆皮花青素的不同提取方法及其体外抗菌活性比较研究[J].大豆科学,2015,34(4):132-136
[7]郝文博,姜广明,车文实.蓝莓花青素的抗氧化作用和抑菌性研究[J].黑河学院学报,2014(3):123-125
[8]古荣鑫,胡花丽,刘雨辰,等.紫甘薯花青素提取工艺及抑菌活性的研究[J].山东农业科学,2012,44(4):107-113
[9]宋德群,孟宪军,王晨阳,等.蓝莓花色苷的pH示差法测定[J].沈阳农业大学学报,2013,44(2):231-233
[10]佘之蕴,黄宝莹,刘海卿,等.牛津杯法测定食品添加剂对五种益生菌的抑菌活力[J].食品工业,2016(1):171-174
[11]盛建国,黄东余.银杏叶提取工艺及其抑菌性能探讨[J].食品工业科技,2005,26(1):65-67
[12]纪丽莲.荷叶中抑菌成分的提取及其抑菌活性的研究[J].食品科学,1999,20(8):64-66
[13]董波,刁天娇,李益玲,等.葡萄籽原花青素对白色念珠菌抑菌作用的体外研究[J].中国微生态学杂志,2015,27(1):49-51
[14]艾启俊,于庆华,张红星,等.鹿蹄草素对金黄色葡萄球菌的抑制作用及其机理研究[J].中国食品学报,2007,7(2):33-37
[15]张俊,程卫东,史学伟,等.紫胡萝卜花青素提取工艺及其体外抗菌活性研究[J].中国调味品,2016,41(11):140-144
[16]王关林,岳静,李洪艳,等.甘薯花青素的提取及其抑菌效果分析[J].中国农业科学,2005,38(11):2321-2326
[17]陈婵,丁玲,黄琼,等.紫色甘薯原花青素抑菌效果的研究[J].食品研究与开发,2014,35(12):12-14
Enzymatic Extraction and Antibacterial Activity of Anthocyanin from Carmine Radish
LIANG Shan,XU Bo,LIU Huan,CAO Yan,JIANG Zi-chuan
(Life Science&Technology College,Yangtze Normal University,Chongqing 408100,China)
To explore the technology of extraction anthocyanin from carmine radish,five single factors were studied including cellulase-pectinase ratio,enzyme dosage,enzymolysis time,enzymolysis temperature and pH.The optimum extraction technology was determined based on center combination design and response surface analyze.The cellulase-pectinase ratio was 1∶2(quality ratio),enzyme dosage was 0.03 mg/g for 95 min at 50℃with pH4.0.Under this condition,anthocyanin extraction content was 4.25 mg/g.In addition,spectrophotometric and oxford cup method were used to conduct bacteriostasis experiment.The results indicated,the anthocyanin from carmine radish had antibacterial activity against bacteria,the minimal inhibitory concentration for Bacillus subtilis,Escherichia coli,Candida albicans were 0.8%,1.6%and 1.6%.
carmine radish;anthocyanin;enzymatic extraction;antibacterial activity
10.3969/j.issn.1005-6521.2017.17.011
2017-04-26
重庆市教委科研基金(KJ1601207);长江师范学院校级项目(2015XJXM04)
梁姗(1982—),女(汉),讲师,博士研究生,研究方向:天然产物活性。
