硒蛋白和过氧化氢酶清除羟自由基作用的研究
2017-09-04铁梅刘丽庄晓虹姚懿孙继凤吴钰滢李华为
铁梅,刘丽,庄晓虹,姚懿,孙继凤,吴钰滢,李华为,*
(1.辽宁大学环境学院,辽宁沈阳110036;2.沈阳师范大学化学与生命科学学院,辽宁沈阳110034)
硒蛋白和过氧化氢酶清除羟自由基作用的研究
铁梅1,刘丽1,庄晓虹1,姚懿1,孙继凤1,吴钰滢2,李华为2,*
(1.辽宁大学环境学院,辽宁沈阳110036;2.沈阳师范大学化学与生命科学学院,辽宁沈阳110034)
在甲基紫-Fe2+-H2O2体系中,试验得到最佳测定条件:缓冲溶液用量为1.0 mL、甲基紫用量为3.5 mL、Fe2+用量为3.0 mL和H2O2加样量为2.5 mL。采用紫外可见分光光度法研究富硒食用菌中硒蛋白和过氧化氢酶对羟自由基的清除作用。结果表明:硒蛋白清除羟自由基的能力明显高于相同浓度的无机硒和蛋白质,且清除率随着各自加入量的增加而相应增加;硒蛋白和过氧化氢酶对清除羟自由基具有一定的协同作用,为富硒食品的合理开发和利用提供了一定的参考依据。
硒蛋白;过氧化氢酶;羟自由基
活性氧自由基具有活泼的化学性质,是人体生命活动中多种生化反应的中间代谢产物,在需氧生物体内保持自由基稳橫性动态的特征[1-2]。当体内清除氧自由基的酶减少或机体受到外界刺激生成过量自由基打破其平衡时,对人体内生物大分子如核酸、蛋白质等造成损伤,导致细胞结构和功能的破坏。活性氧自由基主要包括超氧阴离子和羟自由基等。羟自由基(·OH)是目前为止被认为毒性最强,最活跃的活性分子,几乎可以与所有的生物分子发生化学反应,比如羟自由基可以引发不饱和脂肪酸发生脂质过氧化反应,具有损伤细胞膜结构功能和多种生物分子的能力,引发肿瘤、心血管、肺气肿等疾病[3-5]。使用抗氧化剂能够有效清除自由基,并且对于自由基引起的疾病有预防和治疗的作用。而内源性抗氧化剂难以抵抗自由基引起的病变,所以外源性抗氧化剂和具有抗氧化功能的食品便成为近年来的研究热点[6-8]。
硒是人体必需的微量元素,食品中硒可分为无机硒和有机硒,无机硒毒性大,而硒与蛋白、多糖和核酸结合,形成的硒蛋白、硒多糖等有机硒生物大分子化合物,其无毒、安全、生物利用率高[9-10]。硒蛋白具有一定的抗氧化作用,具有清除体内自由基及抗衰老作用,对人体健康有着极为重要的意义[11-12]。过氧化氢酶存在于红细胞及某些组织内的过氧化体中,是生物防御体系的关键酶之一[13],它的主要作用就是催化H2O2分解为H2O与O2,使得H2O2不会与O2在铁螯合物作用下反应生成非常有害的·OH。目前对于富硒食用菌硒蛋白和过氧化氢酶体系的抗氧化性研究较少,本文提取富硒金针菇和蛹虫草中的硒蛋白,利用甲基紫-Fe2+-H2O2体系研究其对羟自由基的清除作用,进一步探讨硒蛋白与过氧化氢酶清除羟自由基的作用,对开发天然有机硒补剂、研发抗氧化药物、预防疾病具有重要意义。
1 材料与方法
1.1 仪器与试剂
7500c型ICP-MS:美国Agilent公司;Cary 50紫外-可见分光光度计:美国VARIAN公司;冷冻离心机:美国科峻电器公司;HZQ-Q全温震荡器:哈尔滨东联电子技术开发有限公司。
考马斯亮蓝G250(分析纯):国药集团化学试剂有限公司;硫酸铵(分析纯):沈阳力诚试剂厂;甲基紫(分析纯):沈阳市试剂三厂;双氧水(分析纯):沈阳力诚试剂厂;硫酸亚铁(分析纯):沈阳新兴试剂厂;盐酸(优级纯):北京化工厂;过氧化氢酶(10000U/mg):美国Sigma公司。
1.2 试验方法
1.2.1 富硒食用菌硒蛋白的制备
称取富硒食用菌干样1.0 g,加20 mL,pH值为3.5的Tris-HCl溶液,全温震荡器内浸提2.0 h,抽滤。重复一次,合并滤液,并向其中加入硫酸铵至饱和度为95%,透析后,分别以考马斯亮蓝染色法[14]和ICP-MS法[15]测定蛋白浓度C蛋白和硒的含量C硒,剩余置-20℃下储藏备用。
1.2.2 羟自由基的测定
H2O2和Fe2+发生Fenton产生·OH。甲基紫在pH≥3的酸性溶液中呈紫色,·OH容易进攻高电子云密度点,会与甲基紫中具有高电子云密的—C=C—基团发生亲电加成反应,从而使甲基紫褪色。通过测定甲基紫吸光度值的变化可测定出·OH的生成量。
在10 mL比色管中依次加入2×10-4mol/L甲基紫溶液 1.5、2.5、3.5、4.5 mL,0.1 mol/L pH=3.5 的 Tris-HCl溶液 0.5、0.75、1、1.25 mL,1×10-3mol/L 的 Fe2+溶液 2、2.5、3、3.5 mL,0.12% 的 H2O2溶液 1.5、2、2.5、3 mL 分别做单因素试验,定容10.0mL,摇匀,放置30 min,在波长578 nm处测定吸光度A对照;将Fe2+溶液和H2O2以H2O代替做空白A空白,则△A0=A对照-A空白,根据朗伯比尔定律可以求得羟自由基的生成量。
1.2.3 富硒食用菌硒蛋白清除羟自由基的研究
在1.2.2体系中,分别加入1.0、3.0、5.0 mL富硒食用菌中提取的硒蛋白清除羟自由基,摇匀后加入H2O2,30 min后在波长578 nm处测定吸光度A样品,计算其与空白的△A1=A样品-A空白,则硒蛋白对自由基的清除率S按以下公式计算:

1.2.4 富硒食用菌硒蛋白与过氧化氢酶的协同作用研究
在1.2.2体系中,加入3 mL硒蛋白和3 mL不同浓度的过氧化氢酶,摇匀后再加H2O2,30 min后测定吸光度。按上式计算清除率。
2 结果与讨论
2.1 生成羟自由基的试验条件的优化
2.1.1 吸收光谱
分别测定了甲基紫溶液(MV)、MV-Fe2+溶液、MV-H2O2溶液和MV-Fe2+-H2O2溶液的吸收光谱,结果见图1。

图1 吸收光谱Fig.1 Absorption spectra
发现前三者的最大吸收波长均在582 nm附近且吸光度值几乎不变,而MV-Fe2+-H2O2溶液的最大吸收波长值移到578 nm,并且吸光度明显降低,说明体系吸光度值的下降是Fenton试剂产生的羟自由基使酸性溶液中甲基紫褪色造成的,并确定紫外-可见分光光度计的测定波长为578 nm。
2.1.2 缓冲液对△A的影响
分别考察了缓冲液pH值和用量对△A0的影响,见图2和图3。
由图2可知,随着pH值的增加,体系中的△A0先增大后减小,所以选取pH=3.5,此时羟自由基含量最大。图3中△A0随着缓冲液用量的增加在降低,但在0.75 mL和1.50 mL之间变化非常缓慢。故本试验选用缓冲溶液体积为1.0 mL。
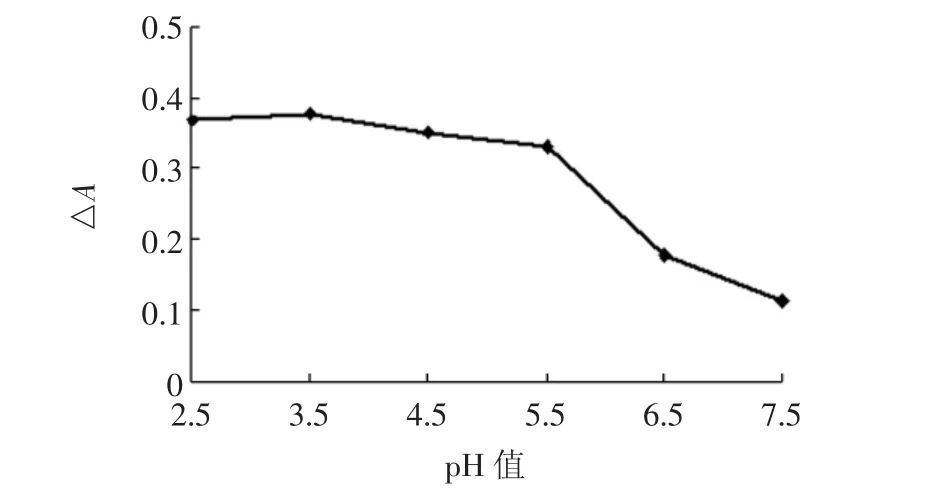
图2 缓冲溶液pH值对△A的影响Fig.2 Effect of pH on the absorption

图3 缓冲溶液用量对△A的影响Fig.3 Effect of dosage of buffer solution on the absorption
2.1.3 甲基紫用量的影响
缓冲溶液pH值为3.5,用量为1.0 mL,加入不同体积的甲基紫溶液,甲基紫用量对△A的影响见图4。

图4 甲基紫用量对△A的影响Fig.4 Effect of dosage of methyl violet on the absorption
从图4中发现随着甲基紫用量的增加,△A0也在增加。当甲基紫溶液体积为3.5 mL时,△A0趋于稳定。所以本试验甲基紫用量为3.5 mL。
2.1.4 Fe2+用量和H2O2用量的影响
在缓冲溶液pH值为3.5,用量为1.0 mL,甲基紫用量为3.5 mL的条件下,考查Fe2+和H2O2用量对△A0的影响,见图5和图6。
由图5可见随着Fe2+溶液的增加而增加,当Fe2+用量为3.0 mL时,△A0趋于稳定,故本试验Fe2+用量为3.0 mL。而在图6中可以看出随着H2O2用量的增加,在2.5 mL时△A0出现最大值,所以H2O2的加样量为2.5 mL。

图5 Fe2+用量对△A的影响Fig.5 Effect of dosage of Fe2+on the absorption

图6 H2O2用量对△A的影响Fig.6 Effect of dosage of H2O2on the absorption
2.1.5 反应时间的影响
在缓冲溶液pH=3.5,用量为1.0 mL,甲基紫、Fe2+和H2O2的用量分别为3.5、3.0和2.5 mL时,每5分钟取样测定一次吸光度。反应时间对△A的影响见图7。

图7 反应时间对△A的影响Fig.7 Effect of reaction time on the absorption
从图7中可以看出随反应时间的增加,△A0逐渐升高,反应进行到30 min时,△A0趋于稳定。所以反应时间定为30 min。
2.2 富硒食用菌硒蛋白清除羟自由基的作用
2.2.1 硒蛋白清除羟自由基作用
经ICP-MS法和考马斯亮蓝法测定,虫草硒蛋白C硒为 19.352 3 μg/L、C蛋白为 126.17 μg/mL ,金针菇硒蛋白中硒的浓度为19.574 8 μg/L、蛋白质浓度为95.83 μg/mL。按照产生羟自由基工作原理设计的反应体系,分别加入硒蛋白、蛋白质和亚硒酸钠溶液,使得蛋白质的浓度和硒的浓度分别与硒蛋白中的蛋白质和硒浓度在同一水平,在体系中依次加入1、3、5 mL的硒蛋白,从而分为由低到高3种不同的浓度组,在波长578 nm处测定吸光度,根据公式计算清除率见图8和图9。
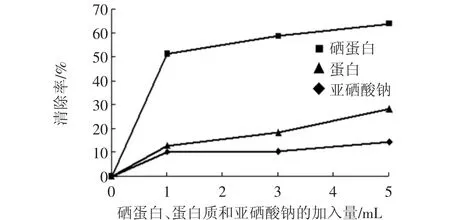
图8 富硒虫草硒蛋白对羟自由基的清除率Fig.8 The scavenging effect of selenoprotein of Se-enriched Cordyceps militaris to hydroxyl free radical

图9 富硒金针菇硒蛋白对羟自由基的清除率Fig.9 The scavenging effect of selenoprotein of Se-enriched Flammulina velutipes to hydroxly free radical
从图8、9可以看出:不同浓度的亚硒酸钠,蛋白质和硒蛋白对羟自由基均有清除作用,且清除率随着各自加入量的增加而增加。无论是低浓度组还是高浓度组,富硒食用菌蛋白对羟自由基的清除率均显著地高于普通蛋白质以及亚硒酸钠,因为富硒食用菌蛋白和其对应的蛋白质浓度相同,富硒食用菌中所含的硒又与亚硒酸钠溶液中硒的浓度相同,因此这一结果说明,硒增强了食用菌蛋白清除羟自由基的能力,富硒食用菌中硒蛋白具有更高的抗氧化作用。在各浓度组中,蛋白质和亚硒酸钠对·OH的清除率之和小于富硒食用菌蛋白对·OH的清除率,且存在极显著差异,说明硒与食用菌蛋白质之间在清除自由基方面存在协同作用。
2.2.2 富硒食用菌硒蛋白与过氧化氢酶(CAT)的协同清除羟自由基作用
硒蛋白与过氧化氢酶分别对·OH具有清除作用,而本研究在此基础上向体系中共同添加两种物质,即按照产生羟自由基工作原理设计的反应体系,在加入H2O2之前,加入3 mL硒蛋白后,加入不同浓度的过氧化氢酶经过紫外可见光谱测定,根据公式计算清除率见图10。
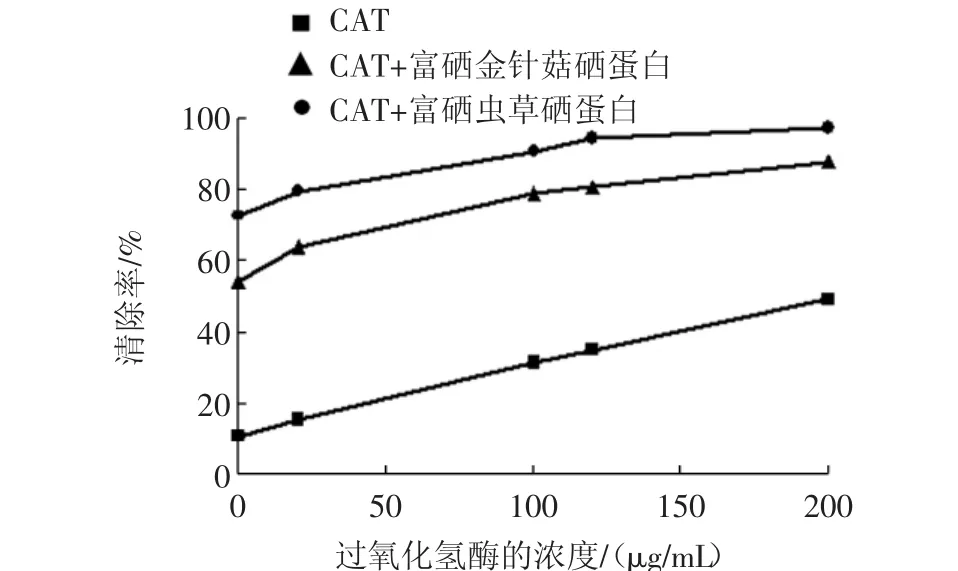
图10 CAT与硒蛋白对羟自由基的清除率Fig.10 The scavenging effect of CAT and selenoprotein to hydroxly radical
从图10可知,过氧化氢酶对羟自由基的清除率在0~200 μg/mL范围内呈现一定的线性关系,S=0.193 4C+11.47,R2=0.997 8。与单独过氧化氢酶相比,加入富硒食用菌蛋白后,对羟自由基的清除率显著增强,并且在相同过氧化氢酶浓度下,·OH清除率要大于单一的过氧化氢酶和硒蛋白的清除率之和,说明富硒食用菌蛋白和过氧化氢酶在清除羟自由基方面存在着协同作用。
3 结论
鉴于羟自由基的毒害性,使得人们对抗氧化剂的研究越来越多。以食用菌为载体进行富硒培养得到富硒食用菌,不仅具有食用菌的效果,还增加了新的功效。研究结果表明:1)生成羟自由基的最佳试验条件:在甲基紫-Fe2+-H2O2体系中,缓冲溶液用量为1.0 mL、甲基紫用量为3.5 mL、Fe2+用量为3.0 mL和H2O2的加样量为2.5 mL。2)硒蛋白对羟自由基的清除率高于同质量浓度的蛋白质和亚硒酸钠,表明硒增强食用菌蛋白消除羟自由基的能力,且随着加入量的增加,硒蛋白、蛋白质和亚硒酸钠对羟自由基的清除率均增强。3)硒蛋白的加入促进过氧化氢酶对羟自由基的清除作用,两者在清除羟自由基方面存在着协同作用。因此,富硒食用菌中的硒蛋白作为一种天然无毒高效的自由基清除剂,能够拮抗或抑制体内过量的自由基,增强体内抗自由基酶系统的活力,从而预防相关疾病的发生,维护人体健康。
参考文献:
[1]王福海,黄成华.活性氧自由基的研究进展 [J].广州化工,2013,41(16):10-12
[2]李旭.茶多酚的抗自由基作用[J].科技视界,2014(25):352-353
[3]李云.综述自由基对人体健康的影响及目前的预防措施[J].内蒙古石油化工,2011,37(1):87-89
[4]张丽,陈冠华,方柔,等.毛细管电泳法测定过氧化氢酶与天然抗氧化剂协同清除羟自由基作用[J].分析化学,2013,41(10):1571-1576
[5]吕明生,王淑军,房耀维,等.超声波提取雪莲薯多糖工艺优化及其对羟自由基的清除[J].食品科学,2011,32(2):24-27
[6]Gutteridge J M,Halliwell B.Antioxidants:molecules,medicines,and myths[J].Biochem Biophys Res Commun.,2010,393:561-564
[7]Yang J H,Lin H C,Mau J L.An tioxidant properties of several commercial mushrooms[J].Food Chemistry,2002,77:229-235
[8]E Niki.Assessment of Antioxidant Capacity in vitro and in vivo[J].Free Radic Biol Med,2010,49:503-515
[9]铁梅,李宝瑞,邢志强,等.富硒大豆中蛋白提取工艺优化及HPLC-MS联用测定硒代蛋氨酸[J].食品科学,2015,36(8):6-11
[10]Abdulah R,Miyazaki K,Nakazawa M,et al.Chemical forms of selenium for cancer prevention [J].Journal of Trace Elements in Medicine and biology,2005,19(2):141-150
[11]黄开勋,刘琼,徐辉碧.硒蛋白的抗氧化性研究与第21个氨基酸的发现[J].无机化学学报,2008,24(8):1214-1216
[12]胡振瀛,史卿,熊华,等.富硒及普通菜籽粕蛋白的抗氧化作用比较[J].南昌大学学报(工科版),2014,36(1):7-10
[13]朱鸿,李想韵,邓玉,等.芦荟过氧化氢酶的分离纯化和性质研究[J].食品科学,2010,31(5):206-210
[14]陈钧辉,陶力,李俊,等.生物化学实验[M].北京:科学出版社,2003:63-64
[15]铁梅,臧树良,张崴,等.ICP-MS测定食用菌中硒的方法研究[J].光谱学与光谱分析,2006,3(26):551-553
Studies on Scavenging Hydroxyl Free Radical by Selenoprotein and Catalase
TIE Mei1,LIU Li1,ZHUANG Xiao-hong1,YAO Yi1,SUN Ji-feng1,WU Yu-ying2,LI Hua-wei2,*
(1.College of Environmental Sciences,Liaoning University,Shenyang 110036,Liaoning,China;2.College of Chemistry and Life Sciences,Shenyang Normal University,Shenyang 110034,Liaoning,China)
The experimental conditions of Fenton system of MV-Fe2+-H2O2has been studied and the optimal determination conditions were found out with buffer solution 1.0 mL,MV 3.5 mL,Fe2+3.0 mL,H2O22.5mL,respectively.In the best condition of Fenton system,the effect of scavenging hydroxyl free radical of selenoprotein and catalase were studied by ultraviolet spectrophotometer.The result indicated that selenoprotein on hydroxyl free radical removal rate were higher than those of commom protein and inorganic selenium at the same concentration,and removal rate increased with addition amount;selenoprotein and catalase in scavenging hydroxyl free radical had synergistic effect.A basis was provided for reasonable exploitation and utilization of selenium enriched food.
selenoprotein;catalase;hydroxyl free radical
10.3969/j.issn.1005-6521.2017.17.002
2016-11-08
国家自然科学基金面上项目(31371085);辽宁省科技厅计划项目(2011205001)
铁梅(1964—),女(汉),教授,博士,研究方向:农产品、食品中微量元素的检测方法、形态分析、生物活性及迁移转化规律等。
*通信作者:李华为(1962—),男,教授,硕士,研究方向:分析化学。
