以三苯甲烷染料酸性品红作探针检测罐头肉中的痕量Hg
2017-09-03江虹庞向东秦艾谢秋霞
江虹,庞向东,秦艾,谢秋霞
(长江师范学院化学化工学院,重庆市无机特种功能材料重点实验室,长江师范学院武陵山片区绿色发展协同创新中心,重庆, 408100)
以三苯甲烷染料酸性品红作探针检测罐头肉中的痕量Hg
江虹*,庞向东,秦艾,谢秋霞
(长江师范学院化学化工学院,重庆市无机特种功能材料重点实验室,长江师范学院武陵山片区绿色发展协同创新中心,重庆, 408100)
建立了检测肉罐头中有毒重金属元素Hg 的酸性品红共振光散射法,研究了共振光散射的光谱特征、适宜反应条件、共存物质的影响及反应机理。在pH 6.56 的Tris-盐酸缓冲介质中,溴代十六烷基吡啶增敏酸性品红并与Hg(Ⅱ)结合生成三元复合物,使体系的共振光散射(RLS)显著增强并产生新的RLS光谱,在最大共振散射峰附近,Hg(Ⅱ) 的质量浓度在0.005~0.40 mg/L与体系的共振光散射增强强度的绝对值│ΔIRLS│呈线性关系,定量限为0.032 mg/kg。方法简便、灵敏,加标回收率为98.5%~102%,相对标准偏差RSD(n=5)为2.0%~2.5%。适于罐头类肉食中Hg 的测定。
酸性品红;Hg;肉罐头;溴代十六烷基吡啶;共振光散射
Hg 是一种剧毒物质,可通过食物链在人体内蓄积,到达一定浓度时,人体就会出现中毒现象,甚至危及生命。罐头中的 Hg 可因制造、加工、运输等过程中受到一定污染或由于其他环境因素等受到某些污染而存在。
目前,测定 Hg 的方法主要有原子吸收法[1-2],紫外-可见分光光度法[3-5],荧光法[6-9],电化学法[10-11]及电感耦合等离子体质谱法[12-16]等。原子吸收法灵敏度高、分析范围广、抗干扰能力强、但所用仪器价格较贵,不易普及。紫外-可见分光光度法所用仪器价廉,是早期测 Hg 的常用方法,但由于操作繁琐、灵敏度较低,抗干扰能力较差,现已逐渐被更为灵敏的仪器分析法所替代。荧光法影响因素多,线性范围窄,条件要求较苛刻。电化学法因需特殊的富集材料,受基质影响较大,实际应用较少。电感耦合等离子体质谱法准确度高、选择性好,但仪器贵,运行成本高。共振光散射(RLS)法是20世纪90 年代新发展起来的一种具有极高灵敏度的分析方法,在环境分析领域已有所应用[17-18],但基本未见用于食品中Hg 的分析。本试验以酸性三苯甲烷染料酸性品红作探针,采用共振光散射技术研究罐头肉中痕量Hg 的检测方法。本法所用仪器只需普通的荧光分光光度计,仪器价廉,操作简便,可用于肉罐头中痕量Hg 的测定。
1 材料与方法
1.1材料与试剂
试剂:酸性品红(acid fuschin,简写为 AFU)溶液:称取适量AFU于小烧杯中,用水溶解后配成1.0×10-4mol/L。Hg(Ⅱ) 标准溶液:准确称取适量的Hg(NO3)2于小烧杯中,加 0.6 mol/L HNO3溶解后转移至500mL 容量瓶中,用水稀至刻度,摇匀,即得20.06 mg/L 贮备液,操作液浓度为2.006 mg/L。Tris(三羟甲基氨基甲烷)-盐酸缓冲溶液:0.10 mol/L盐酸与0.20 mol/L Tris溶液混合,用酸度计测定,配成pH 3.0~9.5的系列缓冲溶液。溴代十六烷基吡啶(简写为TPB):称取适量TPB,用少量无水乙醇溶解后加水配成400 mg/L。HNO3、H2SO4(重庆川东化工(集团)有限公司化学试剂厂)。KMnO4(成都化夏化学试剂有限公司) 溶液:5.0×104mg/L。盐酸羟胺(成都化夏化学试剂有限公司)溶液:2.0×105mg/L。试剂均为分析纯,实验用水为超纯水。
样品:午餐肉罐头(1#)(上海梅林食品有限公司),午餐肉罐头(2#)(漳州市港昌工贸有限公司),午餐肉罐头(3#)(青岛北海远航食品有限公司)。
1.2仪器与设备
F-2500型荧光分光光度计,日本日立公司;pHS-3C 精密酸度计,上海虹益仪器仪表有限公司。
1.3样品处理
准确称取捣碎混匀的罐头样品1#21.566 2 g,2#21.496 8 g,3#21.457 3 g,分别置于消化装置锥形瓶中,各加玻粒珠数粒,HNO340 mL(试剂空白不加)、H2SO410 mL,摇匀后,装上冷凝管,在电炉上低温加热,待开始发泡时即停止加热,发泡停止后,在135℃ 下加热回流2 h(若加热过程中溶液变为棕色,则立即补加HNO3,至消化液呈透明浅黄色为止)。回流放冷后,用适量水洗涤冷凝管,洗液并入消化液中,取下锥形瓶,再在电炉上加热煮沸10 min 以上以浓缩溶液并除去NO2,放至室温。于样品消化液及试剂空白液中分别加入5.0×104mg/L KMnO4溶液至呈紫红色,再滴加2.0×105mg/L 盐酸羟胺溶液(边加边摇)至紫红色刚褪去,20 min后,定量转移至50 mL 容量瓶中,用水定容,即得待测样液及试剂空白液。
1.4RLS的测定
准确加入0.5 mL pH 6.56 的Tris-盐酸缓冲溶液于10 mL 具塞比色管中,再依次加入3.0 mL 1.0×10-4mol/L AFU 溶液、0.30 mL 400 mg/L 的TPB 溶液和适量的 2.006 mg/L 的Hg(Ⅱ)标准溶液或样液,用水定容,摇匀,40 min 后,在荧光光度计上(λex=λem=220 nm,测定狭缝5.0 nm)同步扫描RLS 光谱,记录381 nm波长处体系的共振光散射强度IRLS及试剂空白的共振光散射强度I0,计算ΔIRLS=IRLS-I0。
2 结果与讨论
2.1AFU-TPB-Hg(Ⅱ)的光谱特征
图1为体系各溶液的 RLS 光谱。
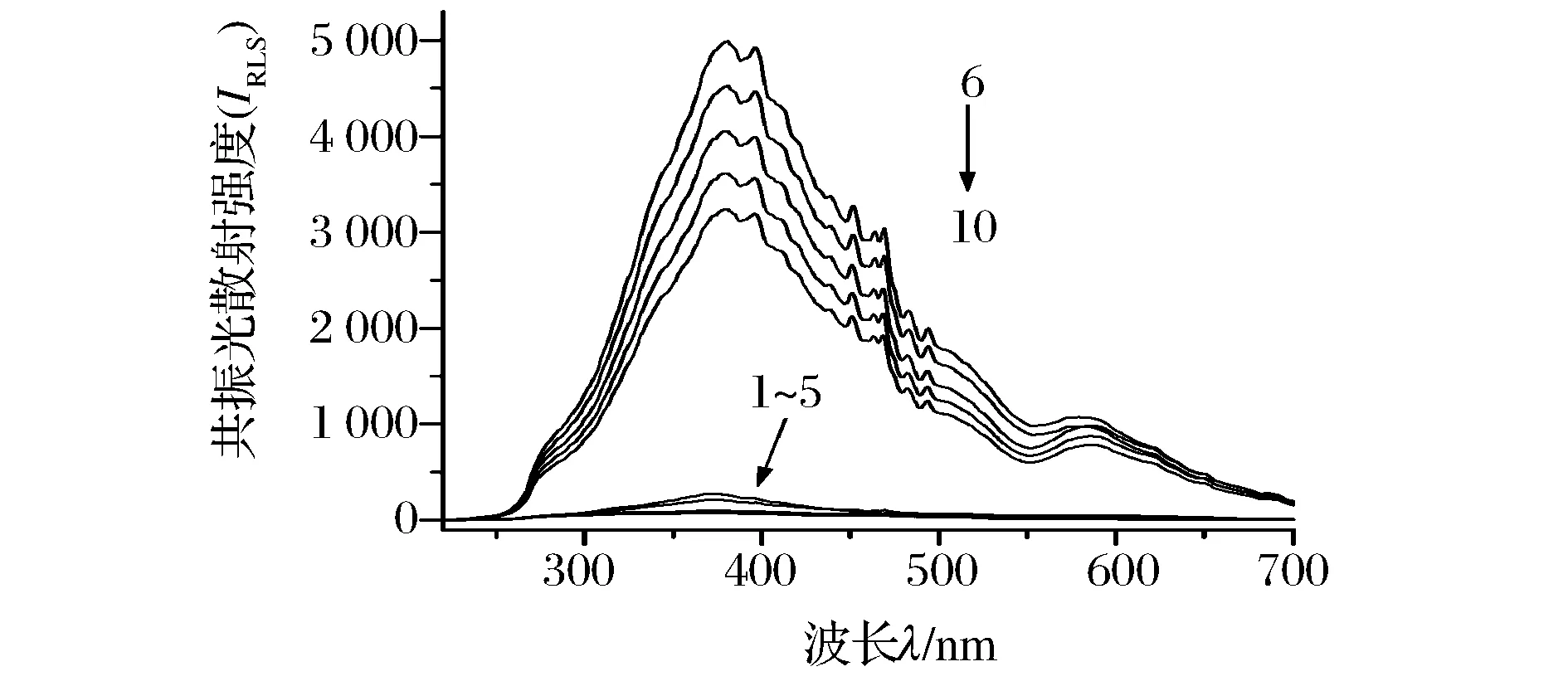
1-0.201 mg/L Hg(Ⅱ); 2-3.0×10-5 mol/L AFU; 3-12.0 mg/L TPB; 4-3.0×10-5 mol/L AFU, pH 6.56; 5-12.0 mg/L TPB,pH 6.56; 6~10-(0.0、0.100、0.201、0.301、0.401 mg/L) Hg(Ⅱ) - 3.0×10-5 mol/L AFU - 12.0 mg/L TPB, pH 6.56 图1 RLS光谱 Fig.1 RLS spectra
由图1可见,单独的Hg(Ⅱ)、AFU、TPB及AFU、TPB 相应的弱酸性溶液的RLS均很微弱(曲线1~5)。当在AFU 的酸性溶液中加入TPB 后,其RLS 显著增强(曲线6),最大RLS 峰位于 381 nm,在其附近,还有一个强度略小一点的散射峰。在最大共振散射波长处,随着溶液中Hg(Ⅱ) 浓度的逐渐增大,体系的共振光散射强度逐渐减小(曲线6~10),但Hg(Ⅱ)在一定浓度范围内,其质量浓度与体系的共振光散射增强强度的绝对值(│ΔIRLS│)呈线性关系,故可用于Hg(Ⅱ)的定量测定。
可能的反应机理:AFU 是一种三苯甲烷类的酸性染料,其分子上含有3个磺酸根离子,而TPB 是一种阳离子表面活性剂,其分子上的Br-离解后变成带1个单位正电荷的阳离子活性基团。于是带正负电荷的阴、阳离子靠静电引力结合生成离子缔合物,使RLS 增强,由此说明TPB 对AFU 具有增敏作用。当有Hg(Ⅱ)参与时,AFU 除可与TPB 反应外,还可与Hg(Ⅱ) 反应,即存在竞争反应。由于Hg(Ⅱ) 有空轨道,酸性品红结构上除有3个磺酸根离子外,还有3个氨基,而氨基氮上有孤对电子,可与Hg(Ⅱ) 形成配位化合物,因此,Hg(Ⅱ) 与AFU 反应可生成带负电荷的络阴离子或缔合颗粒,进而与TPB 结合生成三元复合物;或AFU 先与TPB 结合,再与Hg(Ⅱ) 结合生成粒径更大的物质。无论以哪种方式结合,均使体系的摩尔质量和体积显著增大,从而导致RLS 显著增强。
2.2反应条件的选择
2.2.1 pH 值
室温下,考察了 BR、NaAc-HAc及Tris-盐酸等缓冲溶液对三元体系│ΔIRLS│的影响。结果表明,Tris-盐酸作反应介质,体系的│ΔIRLS│相对最大。继而考察了不同pH 值的Tris-盐酸缓冲溶液对体系│ΔIRLS│的影响(图2)。

图2 pH值对│Δ IRLS│的影响Fig.2 Effect of buffer pH on │ΔIRLS│
结果表明,pH值为5.7~6.8时,体系的│ΔIRLS│相对较大,灵敏度较高。故实验在此pH 范围内选用pH 6.56 的Tris-HCl 缓冲溶液。继而又考察了不同用量的pH 6.56 的缓冲溶液对体系│ΔIRLS│的影响,结果表明,适宜用量为0.5 mL。
2.2.2 AFU 溶液的浓度
室温下,考察了不同浓度的AFU 溶液对三元体系│ΔIRLS│的影响(图3)。

图3 AFU溶液浓度对│Δ IRLS│的影响Fig.3 Effect of AFU concentration on │ΔIRLS│
结果表明,AFU 溶液的浓度在2.5×10-5~ 3.3×10-5mol/L 范围内,│ΔIRLS│较大,灵敏度较高。当溶液中AFU 浓度小于2.5×10-5mol/L时,由于反应不完全而导致│ΔIRLS│减弱;当AFU 浓度大于3.3×10-5mol/L 时,由于AFU 自身的聚集作用也使体系的│ΔIRLS│减弱。故实验选用1.0×10-4mol/L FUA 溶液3.0 mL。
2.2.3 表面活性剂
室温下,考察了十二烷基磺酸钠、十二烷基硫酸钠、溴化十六烷基三甲基铵、溴代十六烷基吡啶,OP乳化剂、Triton X-100、Tween-20 等表面活性剂对三元体系│ΔIRLS│的影响。结果表明,只有溴代十六烷基吡啶和溴化十六烷基三甲基铵对体系有增敏作用,其中溴代十六烷基吡啶增敏效果最佳。故实验选用400 mg/L TPB 溶液作为增敏剂,适宜用量0.30 mL。
2.2.4 试剂加入顺序
室温下,考察了体系中各物质在不同加入顺序时对体系│ΔIRLS│的影响。结果表明,按1.4 中的加入顺序为最佳,此时体系的│ΔIRLS│最大,灵敏度最高,故实验按此最佳顺序进行。
2.2.5 反应时间及稳定性
室温下,考察了不同反应时间对体系│ΔIRLS│的影响(图4)。
图4结果表明,反应开始至40 min 前,随着时间的增加,│ΔIRLS│逐渐增大,曲线表现为一条斜线,表明在此段时间内,物质间的反应并未完全;当40 min 后,随着时间的增加,│ΔIRLS│不再增大,曲线基本处于一个平台上,这表明反应在40 min 内即可进行完全,其后稳定时间至少1 h。故实验选在40 min 后测定。
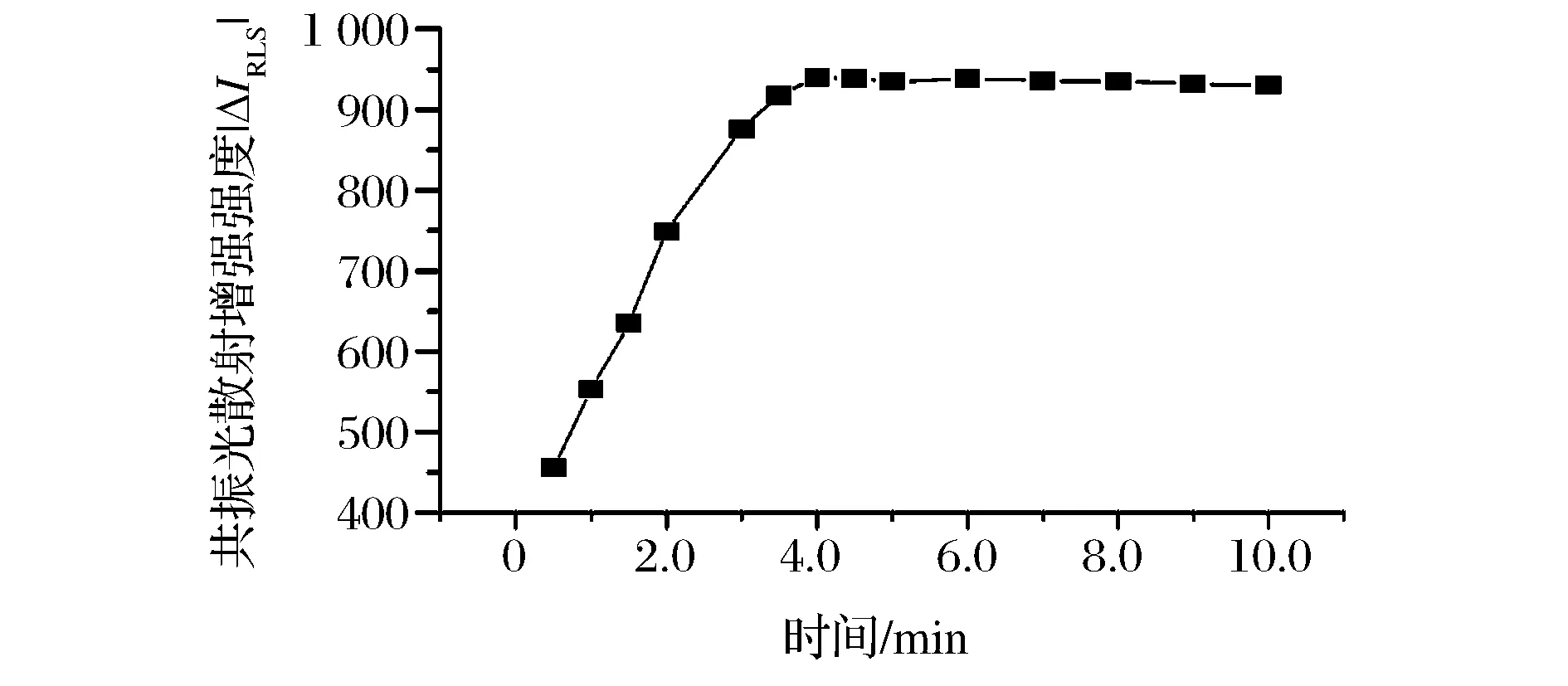
图4 时间对│Δ IRLS│的影响 Fig.4 Effect of time on│ΔIRLS│
2.3标准曲线
按最佳反应条件配制Hg(Ⅱ) 的标准系列溶液并按1.4 节方法同步扫描RLS 光谱。作│ΔIRLS│-ρ 标准曲线(图5)。该方法的一元线性回归方程为ΔIRLS=-16.80-4 429ρ(ρ: mg/L),相关系数为r=-0.999 3,线性范围为0.005~0.40 mg/L,定量限为0.032 mg/kg。

图5 Hg(Ⅱ)的标准曲线Fig.5 Standard curve of Hg(Ⅱ)
2.4共存物质的影响
室温下,考察了某些常见物质对测定0.201 mg/L Hg(Ⅱ) 的影响。结果表明,相对误差≤ ±5% 时,以下物质不干扰测定:500倍的K+、Na+、NH4+、Sr2+、NO3-、 Cl-、S2O32-、SO42-;100 倍的Fe2+、Mn2+、Ba2+、Ca2+、Mg2+、Cu2+;20 倍的Fe3+、SO32-、C2O42-、CO32-;8倍的Al3+。可见,常见阴、阳离子不干扰测定。故方法有良好的选择性。
2.5样品分析
取1.3 节中的各待测样液4.0 mL,按实验方法配制溶液并扫描RLS 光谱。各样品的处理及各待测样液的测定均各平行进行5份,同时做加标回收试验(n=5)及空白试验,最后求出各样液中Hg(Ⅱ) 的含量,并推至原始样品中总Hg的含量。同时与国标法(冷原子吸收法,AAS)比较,结果见表1。

表1 样品分析结果及回收试验(n=5)
注:ND 为未检出;样品含量<检出限的按检出限的1/2 计算回收率。
3 结论
本法操作简便,有高的灵敏度和良好的选择性,准确度和精密度能满足痕量分析要求。与AAS法相比,本法成本更低,所用仪器只需普通的荧光分光光度计,仪器、试剂价廉易得,且不需配备专门的元素灯。方法适于罐头午餐肉中Hg 的测定。
[1] 周巧丽,郭鹏然,潘佳钏,等.活性炭富集-电热塞曼原子吸收光谱法测定水中痕量的汞[J].分析化学,2016,44(8):1 270-1 276.
[2] ASHKENANI H, DADFARNIA S, HAJISHABANI A M, et al. Preconcentration, speciation and determination of ultra trace amounts of mercury by modified octadecyl silica membrane disk/electronbeam irradiation and cold vapor atomic absorptionspectrometry [J]. Journal of Hazardous Materials,2009,161(1):276-280.
[3] 范彩玲,张海燕,周秋华,等.巯基棉富集-表面活性剂增溶光度法测定茶叶中的汞[J].食品与发酵工业,2014,40(12):177-180.
[4] 江瑜,俞善辉,戴聪聪.meso-四(4-羟基-3-甲氧基苯基)卟啉光度法测定汞(Ⅱ)[J].冶金分析,2015,35(2):45-48.
[5] GARIMA P P, AJAYA K S, SURENDRA P, et al. Kinetic determination of trace amount of mercury(II) in environmental samples [J]. Microchemical Journal,2016,128:55-61.
[6] 万锐,刘付英.微波消解-氢化物原子荧光光谱法测定糙米中的汞[J].粮食与饲料工业,2014(5):61-62,65.
[7] 蒋丽容,郎春燕,杨海波.微波消解-双通道原子荧光光谱法同时测定家禽内脏中的硒和汞[J].分析试验室,2013,32(6):108-111.
[8] 叶惠煊,谭舟,刘向前,等.湿法消解-原子荧光光谱法测定湘葛一号中的砷、汞、铅[J].食品科学,2014,35(4):151-154.
[9] LI Dan, LI Chun-yan, LI Yong-fei, et al. Rhodamine-based chemodosimeter for fluorescent determination of Hg2+in 100% aqueous solution and in living cells [J]. Analytica Chimica Acta, 2016,934:218-225.
[10] 刘波,付丁强,牛明明,等.1-(2-吡啶偶氮)-2-萘酚修饰玻碳电极阳极溶出伏安法测定痕量汞[J].湖北民族学院学报(自然科学版),2014,32(1):57-59.
[11] BHUSHAN G, PIA D, EVGENIA D, et al. Exploring amide linkage in a polyviologen derivative towards simultaneous voltammetric determination of Pb(II), Cu(II) and Hg(II) ions [J]. Electrochimica Acta,2016,192:482-488.
[12] 叶发明,张祥.等离子体质谱法与原子荧光光谱法测食品中砷、汞、硒、锑的方法比对[J].粮油食品科技,2016,24(1):77-80.
[13] TAI C Y, JIANG S J, SAHAYAM A C. Determination of As,Hg and Pb in herbs using slurry sampling flow injection chemical vapor generation inductively coupled plasma mass spectrometry[J]. Food Chemistry,2016,192:274-279.
[14] IRENA W, EMILIA V. Determination of cadmium, copper, mercury,lead and zinc mass fractions in marine sediment by isotope dilution inductively coupled plasma mass spectrometry applied as a reference method [J]. Microchemical Journal,2016,128:198-207.
[15] JIN Peng-fei, LIANG Xiao-li, XIA Lu-feng, et al. Determination of 20 trace elements and arsenic species for a realgar-containing traditional chinese medicine niuhuang jiedu tablets by direct inductively coupled plasma-mass spectrometry and high performance liquid chromatography-inductively coupled plasma-mass spectrometry[J]. Journal of Trace Elements in Medicine and Biology,2016,33:73-80.
[16] FANG Yong,PAN Yu-shi,LI Peng,et al. Simultaneous determination of arsenic and mercury species in rice by ion-pairing reversed phase chromatography with inductively coupled plasma mass spectrometry [J]. Food Chemistry,2016,213:609-615.
[17] 杨胜园,徐小娜,于军晖,等.孔雀石绿-碘化钾体系共振光散射法测定水中痕量汞[J].应用化工,2015,44(1):172-174,177.
[18] 王莹莹,李华春,谭克俊.硫代乙酰胺共振光散射法检测环境水样中痕量汞[J].应用化学,2012,29(2):233-237.
Detectionoftracemercuryincannedmeatusingacidtriphenylmethanedyefuchsinacidastheprobe
JIANG Hong*,PANG Xiang-dong,QIN Ai,XIE Qiu-xia
(College of Chemistry and Chemical Engineering, Collaborative Innovation Center for Green Development in Wuling Mountain Areas, Yangtze Normal University, Chongqing 408100,China)
A new acid fuschin resonance light scattering method for the determination of toxic heavy metal element mercury in canned meat was established. The spectrum characteristics of resonance light scattering and optimum reaction conditions and the effects of coexistent substances and reaction mechanism of ternary complex were discussed. In the Tris-Hydrochloric acid buffer medium of pH 6.56, cetylpyridine bromide sensitization acid fuschin were combined with mercury(Ⅱ) to form ternary complexes, which distinctly enhanced the resonance light scattering (RLS) of the system and created a new resonance light scattering spectrum. In the vicinity of the maximum resonance light scattering peak, the absolute value of resonance light scattering enhance intensity (│ΔIRLS│) was directly proportion to the mass concentration of mercury(Ⅱ) in the range of 0.005 to 0.40 mg/L with quantitative limitation of 0.032 mg/kg. The method was simple and sensitive, the standard addition recovery and RSD% (n=5) were in the ranges of 98.5%-102% and 2.0%-2.5% respectively. The method is suitable for the determination of mercury in canned meat.
acid fuschin; mercury; canned meat; cetylpyridine bromide; resonance light scattering
10.13995/j.cnki.11-1802/ts.013612
学士,教授(本文通讯作者,E-mail: jianghongch@163.com)
重庆市教委科技基金资助项目(KJ1401226);长江师范学院科技基金资助项目(2015CXX079)
2016-12-13,改回日期:2017-01-04
