3种酒类酒球菌发酵性能研究及其对樱桃酒品质的影响
2017-09-03车长远董雪张沁芳王舒胡潇李杰董庆苓孙舒扬赵玉平
车长远,董雪,张沁芳,王舒,胡潇,李杰,董庆苓,孙舒扬*,赵玉平
1(鲁东大学 食品工程学院,山东 烟台,264025)2(烟台大学 生命科学学院,山东 烟台,264025)
生产与科研经验
3种酒类酒球菌发酵性能研究及其对樱桃酒品质的影响
车长远1,董雪1,张沁芳2,王舒1,胡潇1,李杰1,董庆苓1,孙舒扬1*,赵玉平2
1(鲁东大学 食品工程学院,山东 烟台,264025)2(烟台大学 生命科学学院,山东 烟台,264025)
在樱桃酒的生产过程中,苹果酸-乳酸发酵(malolactic fermentation, MLF)是降低酒体酸度、改善口感、提升生物稳定性、提高风味复杂性的重要过程,因此,选择合适的乳酸菌株触发MLF对于保障樱桃酒的品质和安全性十分重要。以市售的3种酒类酒球菌(Enoferm ALPHA、VTT.D、Lalvin VP41)为研究对象,比较它们在苹果酸-乳酸发酵过程中的增殖情况,以及它们对樱桃酒基本理化指标、挥发性组分以及生物胺含量的影响,并据此选择适宜的发酵乳酸菌株。研究结果表明,3株酒类酒球菌均可在20天内完成降酸过程,生物胺含量均在可控范围,对酒体成分的影响也不存在显著性差异。Lalvin VP41能够增加樱桃酒多种挥发性物质的合成量,如苯乙醇、丁酸乙酯、乙酸异戊酯和α-松油醇等,从而增强了樱桃酒的果香和花香特征,因此,其更适宜作为樱桃酒发酵的降酸菌株。
酒类酒球菌;樱桃酒;挥发性组分;生物胺
樱桃酒富含矿物质、维生素和多酚等保健成分,具有促进血液循环和机体代谢、改善心脑血管功能等功效[1-2]。樱桃酒的酿造是一个复杂的微生物学过程,包括酒精发酵和苹果酸-乳酸发酵(malolactic fermentation,MLF)2个主要的发酵阶段。酒精发酵是利用酵母菌将果实内的大部分糖转为乙醇和CO2,同时生成甘油、高级醇、酯类等代谢产物。酒精发酵结束后,樱桃酒还面临着降解有机酸的问题。适量的有机酸可以赋予樱桃酒醇厚感和清爽感,抑制杂菌的活动,但是当有机酸含量较高时,会给人以酸涩、粗糙的感觉[3-4]。酒精发酵刚结束时,樱桃酒中含有大量的苹果酸和柠檬酸,这些有机酸带有强烈的刺激味,严重影响樱桃酒的口感。MLF过程是在乳酸菌的作用下,将L-苹果酸转化为L-乳酸,具有降低樱桃酒酸度和涩度、改善口感、增强微生物稳定性、增加香气复杂度的作用[5-6]。
MLF可以自然发生,也可以通过人为接种乳酸菌来启动。自发的MLF在发酵时间上具有不确定性,而且不利于樱桃酒的品质控制和安全控制,因此通过人为添加乳酸菌启动MLF是目前樱桃酒生产中的重要工序。MLF由多种降酸乳酸菌完成,这些乳酸菌主要分属于4个属,即酒球菌(Oenococcus)、乳杆菌(Lactobacillus)、片球菌(Pediocooccus)和明串珠菌(Leuconostoc)。其中酒类酒球菌(Oenococcusoeni)是公认的最优良的苹果酸-乳酸发酵菌株[7-8]。在整个MLF过程中具有生长速率快、耐SO2、发酵平稳且完全、最终代谢产物能赋予樱桃酒特有的风味等优点,且能保证樱桃酒的安全性。本实验对3种商业化酒类酒球菌(Enoferm ALPHA、VTT.D、Lalvin VP41)进行测试,通过比较它们的发酵进程,对樱桃酒基本理化指标、生物胺含量以及挥发性组分的影响,确定适宜的苹果酸-乳酸发酵菌株。
1 材料与方法
1.1材料
实验用樱桃品种为拉宾斯,采自烟台,2016年6月成熟并收集。其基本化学成分如下:总糖 159 g/L,可溶性固形物16.6%,滴定酸5.8 g/L,pH 3.78。
1.2酿造菌种
酿酒酵母Lalvin BM 4×4,酒类酒球菌Enoferm ALPHA、VTT.D、Lalvin VP41,加拿大Lallemand公司。
1.3试剂
2-辛醇、丹磺酰氯、甲醇、香气标准品、生物胺标准品:色谱纯,美国Sigma 公司;L-苹果酸检测试剂盒,德国Biopharm公司;氯化钠、酒石酸钾钠、亚铁氰化钾:分析纯,国药集团;其他试剂均为国产分析纯。
1.4仪器
气相色谱质谱联用仪(Agilent 6890N -MS 5975),美国Agilent公司;LC-20A高效液相色谱仪(配紫外检测器),日本Shimadzu公司;50/30 μm DVB/CAR/PDMS 固相微萃取头,美国 Supelco公司;FE20K pH计,瑞士梅特勒-托利多公司;DC-12型氮吹仪,上海安谱科学仪器有限公司;Cary60紫外可见分光光度计,美国Agilent公司。
1.5实验方法
1.5.1 樱桃酒发酵工艺
樱桃果实采摘后清洗、破碎,输入发酵罐中,102 ℃灭菌10 min,并加入50 mg/L SO2抑制果浆氧化,再加入果胶酶(30 mg/L)反应6 h。添加适量蔗糖使还原糖达到210 g/L,然后接种酿酒酵母Lalvin BM 4×4(300 mg/L),并于25 ℃持续发酵7~8 d。酒精发酵过程中,监测果浆中糖度、温度变化,定期搅拌循环。当樱桃酒总糖小于4 g/L时,离心分离出酿酒酵母,终止酒精发酵。而后分别接种3株酒类酒球菌(10 mg/L)进行苹果酸-乳酸发酵。MLF在20 ℃下进行,监测樱桃酒中酒酒球菌和苹果酸的变化。待苹果酸浓度低于0.5 g/L,离心去除酒酒球菌终止苹果酸乳酸发酵,而后测定樱桃酒的基本理化指标、挥发性香气组分以及生物胺含量。
1.5.2 分析方法
还原糖、总酸、酒精度、挥发酸的测定方法参照《葡萄酒、果酒通用分析方法》(GB/T 15038—2006)执行。其中:还原糖采用斐林试剂法测定,以葡萄糖计;酒精度采用密度瓶法;pH 通过pH计测定;挥发酸和总酸均通过氢氧化钠滴定法测定,分别以乙酸和苹果酸计。L-苹果酸采用L-苹果酸检测试剂盒测定。
酵母活细胞数采用梯度稀释法检测。在酒精发酵过程中,间隔12 h取样,用无菌水梯度稀释后(稀释倍数为101~108),涂布于酵母膏胨葡萄糖琼脂培养基(YPD),于25 ℃好氧条件下培养2 d后计数[7]。菌体量的表示方法为CFU/mL。
乳酸菌活细胞计数也采用梯度稀释法测定。在苹果酸-乳酸发酵过程中,定时取样。将样品樱桃酒用无菌生理盐水梯度稀释,稀释倍数为101~108,然后涂布于含有200 μg/mL制霉菌素的MRS培养基上。培养皿置于30 ℃厌氧条件下培养3 d后计数。菌体量的表示方法为CFU/mL。
生物胺测定方法参照国标《食品中生物胺含量的测定》(GB/T 5009.208—2008)执行。
1.5.3 挥发性香气物质的萃取和分析方法
15 mL的顶空瓶中加入5 mL樱桃酒酒样和1.5 g NaCl、5 μL 2-辛醇(内标)之后加盖密封,再将顶空瓶放入30 ℃的水浴中预平衡10 min,将老化好的50/30 μm DVB/CAR/PDMS萃取头插在样品瓶上,吸附30 min后拔出,再将萃取头插入气相色谱仪进样口,在220 ℃解吸附5 min,进行GC/MS检测。色谱柱为DB-Wax(60 m×0.25 mm,0.25 m i.d.),不分流进样。采用程序升温法,初始温度为40 ℃保持2 min,以6 ℃/min的速度升至230 ℃,并持续15 min。载气为氦气,体积流量为2 mL/min。质谱仪在70 eV的电子冲击模式(EI)下操作,扫描范围为34~348 m/Z,离子源温度为230 ℃。挥发性化合物定性分析通过比较来自NIST数据库(安捷伦)的质谱光谱数据和已经被文献报道的保留指数(RI)来确定。
挥发性组分的定量分析采用标准曲线法。标准曲线的做法是:用标准样品配制成一系列不同浓度的溶液,在与待测组分相同的色谱条件下,等体积准确进样,测量各峰的峰面积或峰高,用峰面积或峰高对样品浓度绘制标准曲线。
1.6数据处理
使用 SPSS v13.0(SPSS 公司,美国)对所有数据进行方差分析。利用方差分析和邓肯的多重比较测试实验来确定酒样指标之间的差异。所有的变量都经标准化(1/Sdev)处理。
2 结果与分析
2.1酒精发酵和苹果酸-乳酸发酵进程
在发酵初期,酿酒酵母Lalvin BM 4×4需要12 h左右的时间适应发酵醪液,而后开始迅速增殖,即进入对数生长期。该酿酒酵母在发酵60 h时进入稳定期,活细胞数达到最高值(5.57 × 107CFU/mL),并维持了近30 h。在发酵后期,由于樱桃浆液中的糖分和营养素已被大量消耗,剩余营养素不足,导致酵母开始衰老死亡,数量逐渐减少。
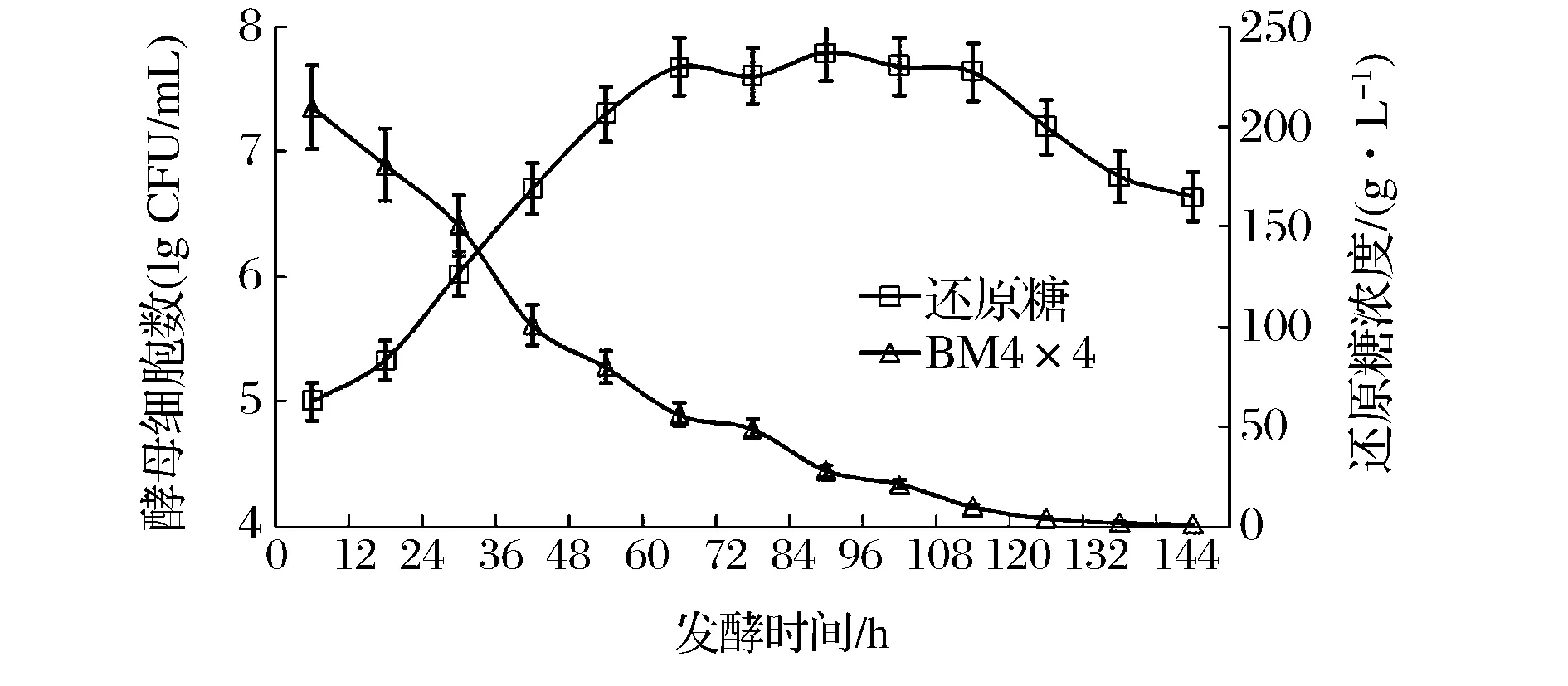
图1 酿酒酵母增殖和还原糖代谢过程Fig.1 The evolution of BM 4 × 4 and consumption of reducing sugars during alcoholic fermentation
在酒精发酵结束后,分别接入3种商业化酒类酒球菌(Enoferm ALPHA、VTT.D、Lalvin VP41)启动MLF,进行生物降酸实验(图2、图3)。3株乳酸菌也表现出良好的适应性,能够较快地触发MLF。Enoferm ALPHA、Lalvin VP41的延滞期均为2天,VTT.D的延滞期只有1天,而后3种酒类酒球菌都进入对数生长期,开始了快速增殖。在苹果酸-乳酸发酵第11天,Enoferm ALPHA和VTT.D的活细胞数均达到了最高,分别为5.06 × 107CFU/mL和3.98 × 107CFU/mL,Lalvin VP41则在发酵第13天达到最大生物量,为6.33 × 107CFU/mL。随后,3种酒酒球菌进入衰亡期,活细胞数出现大幅下降。

图3 苹果酸乳酸发酵中苹果酸的代谢过程Fig.3 The consumption of malic acid during malolactic fermentation
就苹果酸的代谢过程而言,在发酵初期,接种3株酒类酒球菌的樱桃酒中的苹果酸的浓度几乎都未变化,出现了短暂的延滞。待Enoferm ALPHA、VTT.D、Lalvin VP41适应酒体环境后,苹果酸的含量开始下降。接种VTT.D的樱桃酒最早开始进行降酸;接种Enoferm ALPHA和Lalvin VP41的樱桃酒虽然前期降酸速度较慢,但是后期速度加快。MLF持续时间与所选用的酒酒球菌有关,VTT.D耗时最短,整个MLF持续17天,而Lalvin VP41和Enoferm ALPHA则需要19天使苹果酸降至预定浓度之下。
2.2酒类酒球菌对樱桃酒基本成分的影响
苹果酸-乳酸发酵结束后,去除发酵残渣,获得澄清樱桃酒,而后检测酒体的各种基本理化指标,包括酒精度、还原糖、pH、滴定酸、挥发酸和苹果酸含量,具体结果列于表1中。

表1 接种不同酒类酒球菌的樱桃酒的基本酒体成分
注:同行字母(a-c)代表显著性差异(P< 0.05)。
无论接种哪株酒类酒球菌,最终获得的樱桃酒的还原糖含量都低于4 g/L,说明樱桃酒已发酵完全,成为干型红樱桃酒。测试酒样的酒精度在10.2%~10.5%vol,pH值在pH 3.96~3.99,滴定酸含量在4.65~4.72 g/L,仅存在微小差异。根据葡萄酒国家标准(GB15037—2006),挥发酸的质量浓度必须低于1.2 g/L,本研究中3种樱桃酒的挥发酸含量均低于0.45 g/L,符合国标规定,但是接种Enoferm ALPHA的樱桃酒的该指标浓度显著高于其他2种酒样。苹果酸含量在MLF后已降低至0.39~0.43 g/L,说明3株酒类酒球菌分解苹果酸的能力相当,不存在显著性差异。
2.3酒类酒球菌对生物胺含量的影响
生物胺是一类含氮的、低分子量的碱性化合物,广泛存在于富含蛋白质的食品和含酒精的发酵饮料中[10-11]。它主要通过微生物对氨基酸脱羧作用或氨基酸转氨酶对醛类物质转氨作用生成。果酒中的生物胺主要有组胺、酪胺、苯乙胺、精胺等,当这些生物胺过量摄入时,可致使人体出现头痛、呼吸紊乱、心悸、血压变化等应激反应[12-14],严重情况下,可引起大脑出血,甚至死亡。生物胺中以组胺对人体健康的危害最大,其次是酪胺;腐胺和尸胺毒性也较大,并且可以增强组胺的毒性。目前,部分国家已制定了严格的食品(葡萄酒)中的组胺限量标准,如法国不得高于8 mg/L,比利时不得高于5~6 mg/L,德国不得高于2 mg/L[12]。
生物胺属于果酒酿造过程中不良代谢物,其含量与水果品种、果实卫生状况、酿造工艺、储存条件等诸多因素相关[13]。在果酒的生产过程中,诸多环节都有可能导致生物胺的形成或积累,其中苹果酸-乳酸发酵是果酒生物胺形成的最主要的阶段[14-15]。果酒中的乳酸菌不仅能够分解苹果酸,而且还会对酒中的氨基酸进行脱羧反应,产生生物胺。
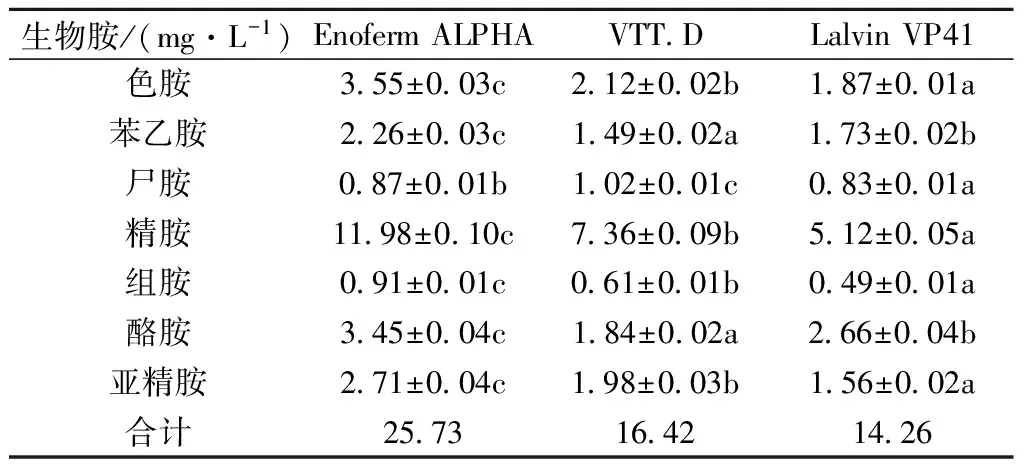
表2 接种不同酒类酒球菌的樱桃酒的生物胺含量
注:同行字母(a-c)代表显著性差异(P<0.05)。
笔者检测和比对了接种3株酒类酒球菌的樱桃酒中的生物胺的种类和含量,结果列于表2中。3种樱桃酒中均检出7种生物胺,分别是色胺、苯乙胺、尸胺、精胺、组胺、酪胺和亚精胺。精胺是樱桃酒中含量最高的生物胺,在接种Enoferm ALPHA的樱桃酒中达到了11.98 mg/L,在使用VTT.D和Lalvin VP41的樱桃酒中也分别达到了7.36 mg/L和5.12 mg/L。酪胺是樱桃酒中含量仅次于精胺的生物胺,在接种Enoferm ALPHA、VTT.D和Lalvin VP41的酒样中含量分别达到了3.45、1.84、2.66 mg/L。其他生物胺的含量均较低,不超过2 mg/L。组胺在3种樱桃酒中的含量介于0.49~0.91 mg/L之间,低于欧美等国对组胺限量标准。以上结果说明三株酒类酒球菌均为低产生物胺的安全菌株,可以在樱桃酒应用。但是就三者之间相互比较,我们发现Lalvin VP41合成的生物胺总量最低,因此安全性最高。
2.4酒类酒球菌对挥发性组分的影响
樱桃酒的香气是由挥发性醇类、酸类、酯类、醛酮类和萜烯类等多种物质的香气复合组成[16-20],主要来自樱桃果实本身、发酵过程和陈酿过程。本研究对樱桃酒的主要的挥发性香气组分也进行了定性和定量测定,以明确不同的酒类酒球菌对樱桃酒芳香品质的影响。采用HS-SPME和GC-MS技术对3种樱桃酒的挥发性组分进行萃取和检测,结果如表3所示。

表3 接种不同酒类酒球菌的樱桃酒的挥发性香气组分含量 单位:mg/L
注:同行字母(a-c)代表显著性差异(p< 0.05)。
3种酒类酒球菌发酵得到的樱桃酒的挥发性组分大致相同,主要分属于挥发性醇类、酯类、酸类、醛酮类和萜烯类化合物,但是含量差异较大。据此可以推断,不同的酒类酒球菌可能会对樱桃酒的芳香品质产生重要影响,使其风味特征有所改变。
Lalvin VP41促进了多种挥发性醇类、酯类和萜烯类化合物的合成,特别是苯乙醇、丁酸乙酯、乙酸异戊酯和α-松油醇。这些芳香化合物具有花香或果香类香气特征,如丁酸乙酯有类似草莓的香气,乙酸异戊酯能散发出类似香蕉的香气,α-松油醇具有丁香气味[21-22]。由于这些芳香化合物的存在,会赋予Lalvin VP41樱桃酒更浓郁的花香和果香香气。某些挥发性酸类化合物,如乙酸、己酸等,其含量在接种VTT.D的樱桃酒中较高。乙酸具有酸味,己酸具有油脂味,浓度较低时能够丰富樱桃酒的风味特征,但是浓度过高则有可能带来负面影响[23-24],导致樱桃酒出现酸败或油腻的异味。VTT.D樱桃酒中这2种物质含量虽然较高,但其浓度低于阈值或仅少量超过,因而不会对酒体产生负面影响。Enoferm ALPHA 也促进了很多芳香化合物的形成,如苯乙醇、丁酸乙酯、乙酸异戊酯、己酸乙酯等,但其增加幅度不及Lalvin VP41。总之,Lalvin VP41促进了挥发性酯类和萜烯类化合物的释放,香气总量高于其他2种酒类酒球菌的樱桃酒,因而赋予酒样更浓郁的花香和果香,提高了樱桃酒的芳香特性和风味特性,具有在樱桃酒中应用的价值。
3 结论
本研究选取了3种市售的酒类酒球菌(Enoferm ALPHA、VTT.D、Lalvin VP41)启动苹果酸-乳酸发酵,并观察它们在MLF过程中的变化及苹果酸的代谢过程。结果显示,3种酒类酒球菌均能较好的适应樱桃酒的酒体环境,快速触发MLF,在3周内可将苹果酸浓度降低至0.5 g/L以下。MLF发酵结束后,离心去除酒类酒球菌,获得澄清酒体,而后检测樱桃酒的基本理化指标、挥发性组分及生物胺含量。研究结果表明,接种3种酒类酒球菌的樱桃酒的酒体组成非常相近,仅有微小差异。生物胺中毒性最高的组胺在3种樱桃酒中的含量均不超过2 mg/L,说明本研究获得的樱桃酒均具有较高的安全性。接种Enoferm ALPHA 的樱桃酒的生物胺总量高于其他2种樱桃酒。对挥发性香气组分的检测结果表明,Lalvin VP41能够大幅增加苯乙醇、丁酸乙酯、乙酸异戊酯和α-松油醇等挥发性组分的产量,进而赋予樱桃酒更浓郁的果香和花香,提高樱桃酒的芳香特性。基于以上发现,Lalvin VP41更适宜作为樱桃酒发酵的降酸菌株。
[1] SUN Sun-yang,GONG Han-sheng,LIU Wen-li,et al.Application and validation of autochthonousLactobacillusplantarumstarter cultures for controlled malolactic fermentation and its influence on the aromatic profile of cherry wines[J].Food Microbiology,2016,55:16-24.
[2] SUN Sun-yang,GONG Han-sheng,ZHAO Yu-ping,et al.Sequential culture withTorulasporadelbrueckiiandSaccharomycescerevisiaeand management of fermentation temperature to improve cherry wine quality[J].Journal of the Science of Food and Agriculture,2016,96(6):1880-1887.
[3] SUMBY K M,GRBIN P R,JIRANEK V.Implications of new research and technologies for malolactic fermentation in wine [J].Applied Microbiology and Biotechnology,2014,98(19):8111-8132.
[4] BARTOWSKY E J,COSTELLO P J,CHAMBERS P J.Emerging trends in the application of malolactic fermentation [J].Australian Journal of Grape and Wine Research,2015,21(S1):663-669.
[5] IZQUIERDO-CAAS P M,MENA-MORALES A,GARCA-ROMERO E.Malolactic fermentation before or during wine aging in barrels [J].LWT - Food Science and Technology,2016,66:468-474.
[6] BETTERIDGE A,GRBIN P,JIRANEK V.ImprovingOenococcusoenito overcome challenges of wine malolactic fermentation [J].Trends in Biotechnology,2015,33:(9)547-553.
[7] SUN Shu-yang,Han-sheng,JIANG Xiao-man,et al. Selected non-Saccharomyceswine yeasts in controlled multistarter fermentations withSaccharomycescerevisiaeon alcoholic fermentation behaviour and wine aroma of cherry wines[J].Food Microbiology,2014,44:15-23.
[8] 李志军,栾同青,钟其顶,等.发酵型饮料酒中生物胺研究进展[J].食品研究与开发,2013,34(12):111-115.
[9] HERNANDEZ O P,LAPENA A C,GALLEGO A P,et al.Biogenic amine determination in wine fermented in oak barrels:factors affecting formation[J].Food Research International,2008,41(7):697-706.
[10] 李志军,钟其顶,邢江涛,等.国内消费市场葡萄酒与啤酒中生物胺污染水平的分析[J].中国食品学报,2013,13(06):191-197.
[11] MOHAMMED G I,BASHAMMAKH A S,ALSIBAAI A A,et al.ChemInform abstract: a critical overview on the chemistry, clean-up and recent advances in analysis of biogenic amines in foodstuffs[J].Trac Trends in Analytical Chemistry,2016,78(40):84-94.
[12] 张剑,钟其顶,熊正河,等.葡萄酒中生物胺的研究进展[J].酿酒科技,2010(7):80-85.
[13] 于英,李记明,姜文广,等.酿酒工艺对葡萄酒中生物胺的影响[J].食品与发酵工业,2011,37(11):66-70.
[14] GUO Yan-yun,YANG Yan-ping,PENG Qian,et al.Biogenic amines in wine: a review[J].International Journal of Food Science & Technology,2015,50(7):1523-1532.
[15] ALVAREZ M A,MORENO-ARRIBAS M V.The problem of biogenic amines in fermented foods and the use of potential biogenic amine-degrading microorganisms as a solution[J].Trends in Food Science & Technology,2014,39(2):146-155.
[16] SABLAYROLLES J M.Control of alcoholic fermentation in winemaking: Current situation and prospect[J].Food Research International,2009,42(4):418-424.
[17] NIU Y,Zhang X,Xiao Z,et al.Characterization of odor-active compounds of various cherry wines by gas chromatography-mass spectrometry, gas chromatography-olfactometry and their correlation with sensory attributes[J].Journal of Chromatography B,2011,879(23):2287-2293.
[18] XIAO Z,LIU S,GU Y,et al.Discrimination of cherry wines based on their sensory properties and aromatic fingerprinting using HS-SPME-GC-MS and multivariate analysis[J].Journal of Food Science,2014,79(3):284-294.
[19] XIAO Z,Zhou X,Niu Y,et al.Optimization and application of headspace-solid-phase micro-extraction coupled with gas chromatography-mass spectrometry for the determination of volatile compounds in cherry wines[J].Journal of Chromatography B,2015,978:122-130.
[20] 牛云蔚.樱桃酒的特征风味及品质调控研究[D].无锡:江南大学,2012.
[22] FERREIRA V,ORTIN N,ESCUDERo A,et al.Chemical characterization of the aroma of Grenache Rose wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J].Journal of Agriculture and Food Chemistry,2002,50(14):4048-4054.
[23] RODRIGUEZ S B,AMBERG E, THORNTON R J,et al.Malolactic fermentation in Chardonnay: growth and sensory effects of commercial strains ofLeuconostocoenos[J]. Journal of Applied Bacteriology,1990,68(2):139-144.
[24] GIL M,CABELLOS J M,ARROYO T,et al.Characterization of the volatile fraction of young wines from the Denomination of origin "Vinos de Madrid" (Spain)[J].Analytica Chimica Acta,2006,563(1-2):145-153.
ComparisonoffermentativeperformancesofthreeOenococcusoenistrainsandtheirinfluencesonthequalityofcherrywines
CHE Chang-yuan1,DONG Xue1,ZHANG Qin-fang2,WANG Shu1, HU Xiao1,LI Jie1,DONG Qing-ling1,SUN Shu-yang1*,ZHAO Yu-ping2
1(School of Food Engineering, Ludong University, Yantai 264025, China) 2(College of Life Sciences, Yantai University, Yantai 264025, China)
Malolactic fermentation (MLF) is vital for cherry wine production, since it can reduce the wine’s acidity, improve the mouth feel, enhance the biological stability and improve the wine’s flavor complexity. In the present study, three commercialOenococcusoenistrains were used as candidates to compare their evolutions during MLF and their influences on the compositional profile, volatile profile and biogenic amine contents of cherry wines. Obtained results demonstrated that all the MLF processes involving the threeO.oenistrains were finished within 20 days, and no significant differences or only slight differences were observed in the basic composition and biogenic amine levels among these cherry wines. Moreover,Lalvin VP41 was found to significantly boost the production of several volatile compounds in cherry wines derived from this strain, such as 2-phenylethanol, ethyl butyrate, 3-methylbutyl acetate and α-terpineol, and therefore reinforced the wine’s fruity and floral characters. Based on above findings, LalvinVP41 was selected as the most suitableO.oenistrain for the production of cherry wines.
Oenococcusoeni; cherry wine; volatile compounds; biogenic amine
10.13995/j.cnki.11-1802/ts.013802
硕士,讲师(孙舒扬副教授为通讯作者,E-mail:sysun81@aliyun.com)。
国家自然科学基金(31501577)
2017-01-10,改回日期:2017-03-07
