腹腔镜胃癌根治术中应用加速康复外科对术后近期营养指标的影响
2017-09-03王贵和程康文
王贵和 程康文
·论 著·(胃癌专题)
腹腔镜胃癌根治术中应用加速康复外科对术后近期营养指标的影响
王贵和 程康文
目的 观察加速康复外科(enhanced recovery after surgery,ERAS)对腹腔镜胃癌根治术病人术后近期营养指标的影响。方法 将以2016年1~7月期间收治的胃癌病人为研究对象,按腹腔镜胃癌手术操作指南进行腹腔镜辅助下D2根治术的65例胃癌病人随机分为2组,常规组(n=32)应用传统围手术期处理行腹腔镜手术,观察组(n=33)在ERAS理念指导下行腹腔镜手术。2组病人分别于术前、术后第1天、术后第3天、术后第7天抽取外周血测定白蛋白(ALB)、前白蛋白(PRE)、转铁蛋白(TRF)、视黄醇结合蛋白(RbP)、血红蛋白(Hb),监测术后第1天、术后第7天和术后第30天的体重与术前体重的比值(WR),并进行对比分析。结果 术前各项指标2组间差异均无统计学意义。术后第1天,各组指标均较术前降低,2组之间差异无统计学意义(P>0.05);术后2组病人ALB、PRE、TRF水平逐渐上升,与常规组相比,术后第7天时观察组ALB水平为(38.6±2.0) g/L、PRE水平为(192.2±16.1) mg/L,升高更明显,差异有统计学意义(P<0.05)。常规组术后第1天、术后第3天RbP水平均低于术前(P<0.05),而观察组术后RbP水平与术前无明显差异。2组病人术后Hb水平均低于术前(P<0.05),术后第7天2组均恢复至术前水平,2组之间Hb水平分别为(109.4±7.11) g/L和(108.7±8.11) g/L,差异无统计学意义。2组病人术后WR逐渐下降,术后第7天时常规组为0.93±0.053,低于观察组的0.96±0.028,差异有统计学意义(P<0.05)。结论 腹腔镜胃癌根治术中应用ERAS理念,可维持病人术后营养状态。
胃癌根治术; 加速康复外科; 腹腔镜检查; 营养指标
加速康复外科(enhanced recovery after surgery, ERAS)的核心理念是减少机体的应激反应,保持内环境的稳定,从而促进术后的康复[1-2]。目前关于ERAS促进肠功能恢复、减少术后并发症、减轻炎症反应及保护机体的免疫功能已有报道[3-6],但是关于ERAS对于机体营养状况的影响研究甚少。胃癌病人营养不良的问题普遍存在,而营养不良又与胃癌预后直接相关。ERAS理念的实施就包括了临床营养支持。因此,目前认为围手术期营养宜与ERAS融合在一起[7],ERAS从营养的角度来讲,其主要目标是优化营养支持和代谢调控,以尽可能避免分解代谢。本文从营养学角度进一步分析ERAS对机体营养状况的影响,为胃癌病人实施ERAS提供循证医学依据。
资料与方法
一、临床资料
本研究以2016年1~7月期间我院胃肠外科收治的胃癌病人为研究对象,按腹腔镜胃癌手术操作指南(2007版)[8]进行腹腔镜辅助下D2根治术。本研究获病人知情同意及医院伦理委员会批准。入选标准:①胃镜病理确诊为胃腺癌病人;②年龄≥18岁,且≤65岁;③术前TNM分期为Ⅰb~Ⅲc期;④美国麻醉医师协会(ASA)评分≤3分。排除标准:①有腹腔镜手术禁忌证的病人;②术前接受放、化疗或免疫治疗的病人;③合并其他恶性肿瘤以及既往有其他恶性肿瘤的病人;④合并自身免疫性疾病的病人;⑤存在延长住院时间的因素(心肺脑并发症、需抗凝治疗等)。本研究最终入选62例,将其随机分为2组,即采用常规围术期管理的对照组(常规组)32例和ERAS模式围术期管理的观察组(观察组)33例。2组病人性别、年龄、体质量指数(BMI)、手术方式、吻合方式、TNM分期及术中出血量差异均无统计学意义,见表1。
二、处理方法
1.常规组 常规宣教,术前晚应用口服泻剂或机械灌肠;术前12 h禁食,8 h禁水;常规放置胃管,3~5 d后拔除;使用全身麻醉+静脉复合麻醉;术后平均8 d左右拔除空肠营养管,下床活动后拔除(48~72 h后)尿管;术中及术后不限制补液,静脉给予非阿片类止痛药(如氟比洛芬脂),间断给予阿片类药物止痛(曲马多、哌替啶等);24~48 h后动员病人下床活动,未陪护其术后活动情况;常规静脉营养4~7 d至肛门排气后拔除胃管,给予饮水,逐步过渡至流食、半流食后逐渐停止静脉营养输液。
2.观察组 强化沟通交流;无需常规行清洁灌肠及口服泻药;术前6 h禁食,术前3 h口服10%葡萄糖溶液250 ml;不常规放置胃管,放置24 h后尽早拔除;使用全身麻醉+胸段硬膜外麻醉;控制输液温度、温水腹腔冲洗(37 ℃);术后平均4 d左右拔除空肠营养管;不常规放置腹腔引流管,术后少于100 ml时尽早拔除;术后第1天早晨拔除尿管(24 h内);术中限制补液(6~8 ml·kg-1·h-1);术后尽快停止静脉输液(平均5 d左右);尽量首选非甾体类止痛药物,减少阿片类药物的使用,术前开始口服氨酚羟考酮片,术后静脉注射环氧合酶-2受体抑制剂帕瑞昔布纳(40 mg,q8 h),缝皮前切口注射罗哌卡因浸润(75 mg:20 ml),手术当天及术后第1天静脉注射甲泼尼龙40 mg;术后麻醉清醒即开始协助其床上活动,12 h后鼓励下床活动,24 h内陪护其下床活动;术后8 h经口少量饮水,术后12~24 h鼻饲肠内营养液,之后开始口服流质饮食,逐渐增量,并逐渐减少经空肠营养管给予的肠内营养液量,第4天开始试行停止肠外营养及输液,开始经口逐渐过渡至半流食。2组病人术后第1天和第2天常规给予人血白蛋白10 g。

表1 两组病人一般资料比较
3.观察指标 2组病人分别于术前、术后第3天、术后第7天清晨抽取空腹静脉血,用全自动生化分析仪检测白蛋白(ALB)、前白蛋白(PRE)、转铁蛋白(TRF)、视黄醇结合蛋白(RbP)含量、血红蛋白(Hb)含量。记录术前体重、术后第1天和术后第7天的体重,并比较2组病人术后第1天和术后第7天的体重与术前体重的比值(术后体重/术前体重=WR)。
4.出院标准 出院标准包括:①无明显疼痛症状或口服止痛药控制良好;②体力活动无明显受限,可以进行日常自理生活;③完全经口流质或半流质饮食,无需静脉输液;④病人同意出院;⑤出院后可接受电话随访,同意定期来我院门诊复查,并如有不适及时入院。
三、统计学方法
结 果
一、营养指标的变化
2组病人术前指标相比差异无统计学意义(P>0.05);术后第1天,除观察组RbP水平不变,各组指标均较术前降低(P<0.05),与观察组相比,常规组降低差异无明显统计学意义(P>0.05);至术后第7天除常规组PRE外,2组ALB、PRE水平均大于术前水平。术后第3天2组病人TRF水平仍低于术前,2组之间差异无统计学意义,至术后第7天观察组TRF逐渐恢复至术前水平,而常规组仍低于术前。常规组术后第1天RbP水平低于术前,之后逐渐上升,至术后第7天恢复至术前水平,观察组术后RbP水平与术前差异有统计学意义,但两组之间RbP水平差异无统计学意义。2组病人术后第1天和第3天Hb水平均低于术前(P<0.05),术后第7天2组均恢复至术前水平,2组之间Hb水平差异无统计学意义。结果见表2。
二、术后体重比值变化
2组病人术后体重逐渐下降,至术后第30天时最低,其中在术后第1天、第3天和第30天时2组之间WR比值差异无统计学意义,仅在术后第7天时可见观察组体重高于对照组(P<0.05),差异有统计学意义。(表3)
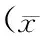
表2 两组病人手术前后营养指标变化±s)
注:a.术后第1天与术前第1天比较统计值;b.术后第3天与术前第1天比较统计值;c.术后第7天与术前第1天比较统计值

表3 2组病人术后体重比值(WR)变化±s)
讨 论
围手术期的各种干预操作、手术创伤、疼痛刺激等均导致下丘脑-垂体-肾上腺皮质轴和交感-肾上腺髓质轴激活,导致内分泌代谢通路的改变,表现为胰高血糖素、儿茶酚胺、糖皮质激素升高,导致机体炎性活动、高分解代谢,使得体内细胞群减少及器官功能下降,表现为负氮平衡[9-10]。有研究表明代谢正常的择期腹部手术病人,丢失氮40~80 g,相当于1.2~1.4 kg湿重骨骼肌[11],从而延迟切口愈合、损伤免疫功能、降低肌肉强度。ERAS能缩短住院时间,改善器官功能,提高营养状况,改善生活质量,且并不提高并发症发生率[12]。而ERAS正是基于无痛、无应激、无风险的理念去保护机体内环境稳态,从而减少术后并发症促进术后早期康复,这点我们早期的研究已证实[13],但是关于ERAS对术后营养学影响的研究较少,因此,我们研究ERAS对胃癌病人的营养指标影响。
目前通常用内脏蛋白反映机体营养状况,其水平主要与机体的代谢水平及营养状况有关,我们选取ALB、PRE、TRF、RbP、Hb含量来反映胃癌病人的营养状况。我们研究发现,术后第1天2组病人ALB水平均较术前降低(P<0.05),但是2组之间ALB水平无明显差异;到术后第3天2组ALB水平恢复至术前水平;术后第7天2组ALB水平均高于术前水平,而应用ERAS理念的观察组与常规组相比,其升高幅度大。而PRE的变化趋势与ALB基本相符,只是术后第7天应用ERAS理念的观察组较术前升高明显,但常规组仍处于术前水平。以上均体现出ERAS对改善营养起到了积极作用。Liu等[6]研究结果也支持我们的结论。
TRF是血浆中主要的含铁蛋白质,负责运载体内的铁。我们发现2组病人术后TRF水平均降低,之后逐渐上升,术后第7天时观察组TRF水平恢复至术前,表明ERAS可以促进术后TRF水平的恢复。RbP为血液中视黄醇(维生素A)的转运蛋白,主要由肝细胞合成,血清RbP能够及时、准确地反映危重病人营养支持的效果,同时可以动态评估病情变化[14]。我们研究发现2组病人RbP水平在术前及术后无明显差距,但是可见常规组术后第1天和第3天RbP水平低于术前,术后第7天恢复至术前水平,而观察组相比术前无明显变化,上述结果一定程度表明ERAS可以稳定术后RbP水平。2组之间Hb差异无统计学意义,表明ERAS对Hb水平的改变无明显影响,不排除病例数少导致选择偏倚可能。
ERAS改善胃癌术后营养状况可能的原因有:①术前不行机械灌肠、术前口服碳水化合物,可避免术前机体脱水,并避免焦虑、口渴及饥饿状态,防止术后发生胰岛素抵抗的现象[15],保持术中处于合成代谢状态,能减少术后机体蛋白质的分解,从而保持体重和维持肌肉力量[16]。②术中使用腹腔镜微创技术,并应用保温措施,可降低手术创伤应激反应,降低了全身炎症反应,从而减少机体的分解代谢。③术中采用胸段硬膜外阻滞联合全身麻醉,有效阻断了交感神经对应激的反应,使得下丘脑-垂体-肾上腺皮质轴和交感-肾上腺髓质轴激活受阻,从而改变内分泌代谢通路[17]。④术后早期进食,强调维持营养滋养保护肠道黏膜,可以预防肠道菌群移位及毒素吸收,减少感染性并发症,之后待肠功能逐渐恢复后,营养支持的目的就是提供营养物质[18];同时肠内营养感染相关技术并发症少,因此可间接减少营养消耗[19]。⑤术后多联模式充分镇痛,可阻滞交感神经通路的疼痛刺激信号传入机制,减少各类炎性细胞因子及炎症介质的释放,从而保证了术后早期活动,促进了肠功能恢复,有利于早期进食。
营养不良与外科病人预后直接相关,术前血清ALB水平是胃肠手术后手术部位感染(SSI)的独立危险因素[20]。我们认为应用ERAS提高术后ALB、PRE水平也可一定程度减少术后感染,这点在ERAS可减少术后包括感染在内的并发症中可证明。ERAS对术后营养状态的影响与术后康复是紧密相关的。加速康复外科从营养的角度来讲,其主要目标是优化营养支持和避免饥饿,以尽可能减少负氮平衡[21]。我们研究发现术后1周时,ERAS组体重减轻较常规组低,而术后1个月时无明显差距,表明ERAS可降低术后短期的负氮平衡的发生。
总之,本研究将ERAS理念应用于腹腔镜胃癌根治术病人中,探讨其对机体营养状况的影响。结果表明,在ERAS的措施中,减少手术引起的代谢应激反应,能明显改善病人的营养状况,因而值得在胃癌腹腔镜根治术中广泛推广,但仍需随机双盲的多中心前瞻性研究证实。
1 Kehlet H. Multimodal approach to control postoperative pathophysiology and rehabilitation.Br J Anaesth,1997,78: 606-617.
2 江志伟,黎介寿.我国加速康复外科的研究现状.中华胃肠外科杂志,2016,19:246-249.DOI:10.3760/ cma.j.issn.1671-0274.2016.03.002.
3 Abdikarim I,Cao XY,Li SZ,et al.Enhanced recovery after surgery with laparoscopic radical gastrectomy for stomach carcinomas.World J Gastroenterol,2015,21: 13339-13344.DOI:10.3748/wjg.v21.i47.13339.
4 Liu XX,Pan HF,Jiang ZW,et al."Fast-track" and "Minimally invasive" surgery for gastric cancer.Chin Med J,2016,129:2294-2300.DOI:10.4103/ 0366-6999.190659.
5 Liu G,Jian F,Wang X,et al.Fast-track surgery protocol in elderly patients undergoing laparoscopic radical gastrectomy for gastric cancer:a randomized controlled trial.Onco Targets Ther,2016,9:3345-3351.DOI:10.2147/ OTT.S107443.
6 程康文,王贵和.加速康复外科对腹腔镜胃癌根治术病人炎症因子与免疫功能的影响.腹腔镜外科杂志,2017,22:30-35.DOI:10.13499/j.Cnki.Fqjwkzz.2017.01.030.
7 Bozzetti F,Mariani L.Perioperative nutritional support of patients undergoing pancreatic surgery in the age of ERAS.Nutrition,2014,30:1267-1271.DOI:10.1016/j.nut.2014.03.002.
8 余佩武,王自强.腹腔镜胃癌手术操作指南(2007版).中华消化外科杂志,2007,6:476-480.DOI:10.3760/cma.j.issn.1673-9752.2007.06.029.
9 Scott MJ,Baldini G,Fearon KC,et al.Enhanced recovery after surgery (ERAS) for gastrointestinal surgery, part 1:pathophysiological considerations.Acta Anaesthesiol Scand,2015,59:1212-1231.DOI:10.1111/aas.12601.
10Carli F.Physiologic considerations of enhanced recovery after surgery(ERAS) programs: implications of the stress response.Can J Anesth/J Can Anesth,2015,62:110-119.DOI:10.1007/s12630-014-0264-0.
11Schricker T,Lattermann R.Strategies to attenuate the catabolic response to surgery and improve perioperative outcomes.Can J Anaesth,2007,54:414-419.DOI:10.1007/ BF03022026.
12邱远,杨桦.加速康复外科在结肠直肠癌病人围手术期营养支持中的应用.外科理论与实践,2016,21:32-36.DOI:10.16139/j.1007-9610.2016.01.009.
13程康文,王贵和,束宽山,等.腹腔镜胃癌根治术中应用快速康复外科理念的研究.腹腔镜外科杂志,2016, 21:292-296.DOI:10.13499/j.Cnki.Fqjwkzz.2016.04.292.
14韩涛,阙军,曹权.血清视黄醇结合蛋白在危重病人营养支持效果评价中的意义.南京医科大学学报(自然科学版),2016,36:750-752/768.DOI:10.7655/NYDXBNS20160622.15McClave SA,Kozar R,Martindale RG.Summary points and consensus recommendations from the North American Surgical NutritionSummit.JPEN,2013,37:99S-105S.DOI:10.1177/0148607113495892.
16Svanfeldt M,Thorell A,Hausel J,et al.Randomized clinical trial of the effect of preoperative oral carbohydrate treatment on postoperative whole-body protein and glucose kinetics.Br J Surg,2007,94:1342-1350.DOI:10.1002/bjs.5919.
17李茂新,张建立,孙振青,等.加速康复外科指导下腹腔镜结直肠癌根治术后营养指标的变化分析.腹腔镜外科杂志,2012,17:899-902.DOI:10.13499/j.Cnki.fqjwkzz.2012.12.022.
Effect of enhanced recovery after surgery on the postoperative short-term nutrition indicators after laparoscopic gastrectomy for gastric cancer
Wang Guihe,Cheng Kangwen.
Department of Gastroenterological Surgery, Tongling People’s Hospital, Tongling 244000, China
Wang Guihe, Email:yiyuanckw @163.com
Objective To investigate the influence of enhanced recovery after surgery (ERAS) on the postoperative short-term nutrition indicators after laparoscopic gastrectomy for gastric cancer.Methods Sixty-five patients were randomized to receive traditional protocol and laparoscopic surgery (routine group,n=32), and ERAS concept-guided laparoscopic surgery (observation group,n=33). ALB, PRE, TRF, RbP and Hb were tested before and 1, 3 and 7 days after operation. The ratio of body weight 1, 3, 7 and 30 days after operation to the body weight before the operation (WR) was monitored, and comparative analyses were performed.Results There was no significant difference in preoperative indexes. On the first day after operation, the indexes in the two groups were lower than those before operation, but there was no significant difference between the two groups (P>0.05). The levels of ALB, PRE and TRF increased gradually in the two groups after operation. As compared with the conventional group, the levels of ALB (38.6±2.0 g/L) and PRE (192.2±16.1 mg/L) in the observation group were significantly increased on the postoperative day 7 (P<0.05). On the postoperative day 1 and 3, the level of RbP was lower than that before operation (P<0.05), but there was no significant difference in the level of RbP in the observation group before and after the operation. The postoperative Hb levels were lower than those preoperation (P<0.05) in two groups. On the postoperative day 7, Hb levels in the two groups were restored to the preoperative levels and the level of Hb between the two groups (109.4±7.11 g/Lvs. 108.7±8.11 g/L) showed no statistically significant difference. In the two groups, the postoperative WR was decreased gradually, and WR in the routine group (0.93±0.053) was lower than that in the observation group (0.96±0.028) on the postoperative day 7 (P<0.05).Conclusions The application of ERAS concept in laparoscopic radical gastrectomy can maintain postoperative nutritional status.
Radical gastrectomy for cancer; Enhanced recovery after surgery; Laparoscopy; Nutrition indicators
安徽省铜陵市卫生科研项目{卫科研[2015]12号}
244000 安徽省铜陵市人民医院胃肠外科
王贵和,Email:yiyuanckw@163.com
R735.2
A [DOI] 10.3969/j.issn.1003-5591.2017.04.011
�介寿.营养支持治疗与加速康复外科.肠外与肠内营养,2015,22:32:65-67.
10.16151/j.1007-810x.2015.02.001.
2017-01-22)
19Gramlich L,Kichian K,Pinilla J,et al.Does enteral nutrition compared to parenteral nutrition result in better outcomes in critically ill adult patients?A systematic review of the literature.Nutrition,2004,20:843-848.DOI:10.1016/j.nut.2004.06.003.
20Hennessey DB,Burke JP,Ni-Dhonochu T,et al.Preoperative hypoalbuminemia is an independent risk factor for the development of surgical site infection following gastrointestinal surgery:a multi-institutional study.Ann Surg,2010,252:325-329.DOI:10.1097/SLA.0b013e3181e9819a.
21李宁.重视外科病人营养问题.中国实用外科杂志,2012,32:101-103.
