脑胶质瘤中RAD18的表达与放射治疗抵抗相关性分析
2017-09-03徐延斌麻旭东任付宾
徐延斌 麻旭东 谢 晨 詹 奇 任付宾
·基础研究·
脑胶质瘤中RAD18的表达与放射治疗抵抗相关性分析
徐延斌 麻旭东 谢 晨 詹 奇 任付宾
目的 探讨RAD18与多形性胶质母细胞瘤(Glioblastoma multiforme,GBM)放射抵抗的相关性,以期为改善脑胶质瘤放射抵抗提供新的治疗靶点。方法 将人脑胶质瘤细胞系A172分别转染空白和装有RAD18的质粒载体,应用克隆实验检测经相同剂量射线照射后两组细胞增殖情况,最后采用qRT-PCR方法检测原发性及放射性粒子近距离治疗后复发性GBM样本中RAD18 mRNA的表达情况,进行统计学分析。结果 经转染RAD18质粒过表达的GBM细胞经放射治疗后增殖情况高于转染空白质粒的GBM细胞(P<0.001);经近距离放射性粒子治疗后复发性GBM中RAD18 mRNA的表达水平高于原发性GBM(P<0.01)。结论 复发性GBM放射治疗的抵抗性可能与RAD18的蛋白过表达有关。
多形性胶质母细胞瘤;RAD18;放射性粒子
放射治疗是多形性胶质母细胞瘤(Glioblastoma multiforme,GBM)的主要治疗手段之一,也是术后治疗的首选方式[1]。近年来,随着新技术的出现,放射性粒子近距离植入使得放射治疗更加精准[2]。经过悉心治疗,也有很大一部分患者会出现复发,对放射治疗出现抵抗[3]。复发的原因与肿瘤细胞对放射治疗产生抵抗性有关。放射治疗的靶标是肿瘤细胞的DNA分子,DNA损伤后的修复能力与肿瘤细胞对放射治疗的有效性密切相关[4-5]。泛素系统在DNA损伤后修复过程中起着不可或缺的作用,RAD18是一种单链DNA结合蛋白,具有泛素连接酶E3特有的典型RING结构[6]。RAD18在直肠癌、黑色素瘤、脑胶质瘤等多个恶性肿瘤中表达增加[7-9]。本研究通过基础实验及临床资料的分析,探究RAD18和GBM放射性粒子近距离治疗抵抗的相关性,以期为改善脑胶质瘤放射抵抗提供新的治疗靶点。
1 材料与方法
1.1 一般材料
A172(人脑胶质瘤细胞系)购自美国典型培养物保藏中心;NHAs(正常人星形胶质细胞)购自美国Lonza公司;DMEM细胞培养液购自美国Amresco公司;胎牛血清(FBS)、0.25%胰蛋白酶-EDTA消化液、Lipofectamine 2000转染试剂盒、RNA提取试剂盒购自美国Invitrogen公司;磷酸盐(PBS)粉、青链霉素混合液购自北京Solarbio生物科技有限公司;pcDNA3.1质粒购自美国Addgene公司;氨基糖甙类新霉素衍生物Geneticin(G418)、氯仿、EDTA购自美国Sigma公司;RIPA裂解液购自美国Cell Signaling公司;聚偏二氟乙烯膜(PVDF膜)购自美国Thermo Scientific公司;Bradford试剂盒、羊抗鼠IgG购自美国Bio-Rad公司;抗RAD18购自美国Sigma-Aldrich公司;β-actin购自美国Bethyl Laboratories公司。
1.2 临床资料
10例人脑多形性胶质母细胞瘤组织纳入本研究,组织标本均来源于哈尔滨医科大学附属第四医院2007—2015年间手术患者,其中5例为经过手术及放射性粒子近距离治疗后复发性GBM,5例为原发性GBM。胶质瘤标本由两名经验丰富的临床病理医师按照世界卫生组织病理学标准独立确诊。其中男性患者6例,女性患者4例;患者年龄31~76岁,平均年龄48.5岁;肿瘤位置:额叶5例,颞叶1例,顶枕叶4例。收取的所有标本于手术切除后即放置于-80℃超低温冰箱中保存。本实验研究获得哈尔滨医科大学伦理委员会的批准,所有参与者知情并同意。
1.3 实验方法
1.3.1 人脑胶质瘤细胞及正常人星形胶质细胞的培养 A172细胞置于含10%胎牛血清、1%青链霉素的DMEM细胞培养液中,置于37℃、5%CO2细胞培养箱中孵育。NHAs置于含重组人表皮生长因子、胰岛素、氨基酸、GA-1000、左旋谷氨酰胺及5%胎牛血清的培养基中孵育。
1.3.2 Western blot检测A172及NHAs中RAD18蛋白质的表达 分别收集正常人星形胶质细胞及胶质瘤细胞,冰PBS漂洗2次,加入RIPA裂解液,冰上静置5 min。吸入预冷的1.5 mL EP管中,应用超声破碎细胞,1~2 s/次,间隔5~10 s重复一次,总共10~20次。超声破碎细胞后将其置入离心机,最大转速离心30 min。应用Bradford试剂盒检测RAD18蛋白浓度。取等浓度蛋白样品置于12% SDS-PAGE凝胶中电泳,积层胶部分50~60 V,分离胶部分90~100 V,跑胶1.5 h。然后将胶转至PVDF膜上。膜上加入1∶250稀释的鼠抗人RAD18一抗,室温下孵育2 h。洗膜3次,15 min/次。然后加入1∶1 000稀释的羊抗鼠IgG二抗,室温下孵育1 h,洗膜3次。应用增强化学发光免疫分析技术观察信号。同样方法检测β-actin内参蛋白,通过RAD18与内参之间条带灰度的比值,分析RAD18蛋白的相对含量。
1.3.3 A172细胞系转染及细胞克隆实验
1.3.3.1 将A172细胞系转染装有RAD18的质粒载体及空白质粒载体A172细胞用EDTA消化成细胞悬液,以1×105/2.5 mL/孔,接种于6孔培养板中,置于5% CO2培养箱中孵育,当细胞生长至80%融合时,加入4 μg预装RAD18的pcDNA3.1质粒转染胶质瘤细胞,阴性对照组加入空白pcDNA3.1质粒。操作过程参照Lipofectamine 2 000转染试剂盒说明书。孵育48 h后,更换培养液,加入含600 μg/mL的新霉素衍生物Geneticin(G418)的DMEM细胞培养液。在筛选培养基中孵育4周后,应用G418筛选有抗性的细胞。用Western blot方法检测两组RAD18表达变化。转染RAD18质粒及空白质粒的细胞在含300 μg/mL G418的DMEM培养液中继续孵育。
1.3.3.2 克隆形成实验 将已转染装有RAD18质粒载体及空白质粒载体的A172细胞,以1×103/孔的密度接种于6孔培养板中,细胞分两组,每组设3个复孔。分别接受2 Gy γ射线照射。在含300 μg/mL G418的DMEM细胞培养液中孵育10~14 d,每3 d更换一次条件培养基。当细胞形成肉眼可见克隆的时候,终止孵育。以细胞数目超过50个的孤立细胞群作为判断克隆的标准,计算克隆形成数量。移去细胞培养液,应用冷甲醇固定克隆细胞约15 min。弃除固定液,滴入结晶紫染色。
1.3.4 qRT-PCR对比原发及复发GBM标本中RAD18 mRNA的表达情况 采用试剂盒提取组织标本中的总RNA,操作步骤严格按照试剂盒说明书进行。总RNA应用随机引物经逆转录酶催化成cDNA。PCR扩增条件:95℃温度下预变性3 min,然后于95℃变性10 s,55℃退火45 s,72℃延伸30 s,一共进行40个循环。RAD18引物序列:上游引物5′-TTCACAAAAGGAAGCCGCTG-3′;下游引物5′-TTACTGAGGTCATATTATCTTC-3′。内参GAPDH的引物序列:上游引物5′-GAAGGT-GAAGGTCGGAGTC-3′;下游引物5′-GAAGATGGTGATGGGATTTC-3′。利用2-△△CT的方法计算分析,基因的表达水平以GAPDH的表达量为内参,统计分析基因的表达水平变化。
1.4 统计学处理
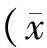
2 结果
2.1 RAD18在人脑胶质瘤细胞及星形胶质细胞中的表达
应用Western blot方法检测RAD18蛋白显示,A172细胞系中RAD18蛋白表达(0.18±0.01)与NHAs(0.19±0.01)相近,两者都是低表达或不表达,差异不具有统计学意义(P>0.05)(图1)。
2.2 超表达RAD18的A172胶质瘤细胞对γ射线抵抗性增加
经转染装有RAD18质粒的A172细胞的RAD18蛋白表达(0.90±0.11)高于转染空白质粒载体组的RAD18蛋白表达(0.21±0.01),具有统计学差异(P<0.001)(图2)。细胞克隆形成实验显示两组的细胞量都在减少,到14天时,以超过50个孤立的细胞群作为判断标准,转染RAD18质粒的A172细胞经过同等剂量γ射线照射后细胞克隆形成数量(158.70±14.36)高于空白质粒A172细胞(53.33±11.50),具有统计学差异(P<0.001)(图3)。
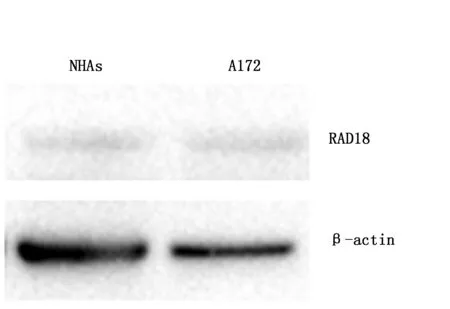
图1 Western blot方法检测RAD18在正常人类星形胶质细胞中和胶质瘤细胞系的蛋白表达Figure 1 Expression of RAD18 protein in NHAs and glioma cell lines was detected by Western blot
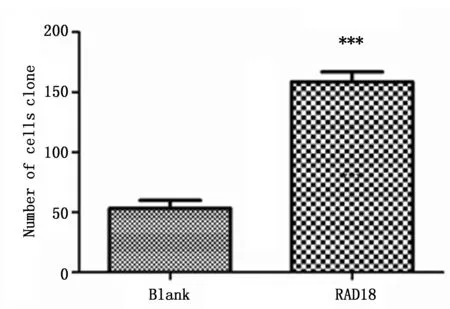
图3 转染RAD18质粒和空白质粒载体的A172细胞系接受2 Gyγ射线照射后细胞克隆形成数Figure 3 The number of clones in A172 cells transfected with RAD18 and blank plasmid after IR treatment(2 Gy)Note:***P<0.001,compared to the blank plasmid group.

图2 Western blot方法检测转染RAD18质粒或空白对照质粒载体的A172细胞系中RAD18蛋白的表达Figure 2 The expression of RAD18 protein was analyzed in A172 cells transfected with RAD18 and blank plasmids by Western blot.Note:***P<0.001,compared to the blank plasmid group.
2.3 qRT-PCR检测原发性及复发性GBM标本中RAD18 mRNA的表达
经放射性粒子近距离治疗后复发性GBM标本中RAD18 mRNA表达(14.13±2.67)高于原发性GBM标本(7.12±2.60),具有统计学差异(P<0.01)(图4)。
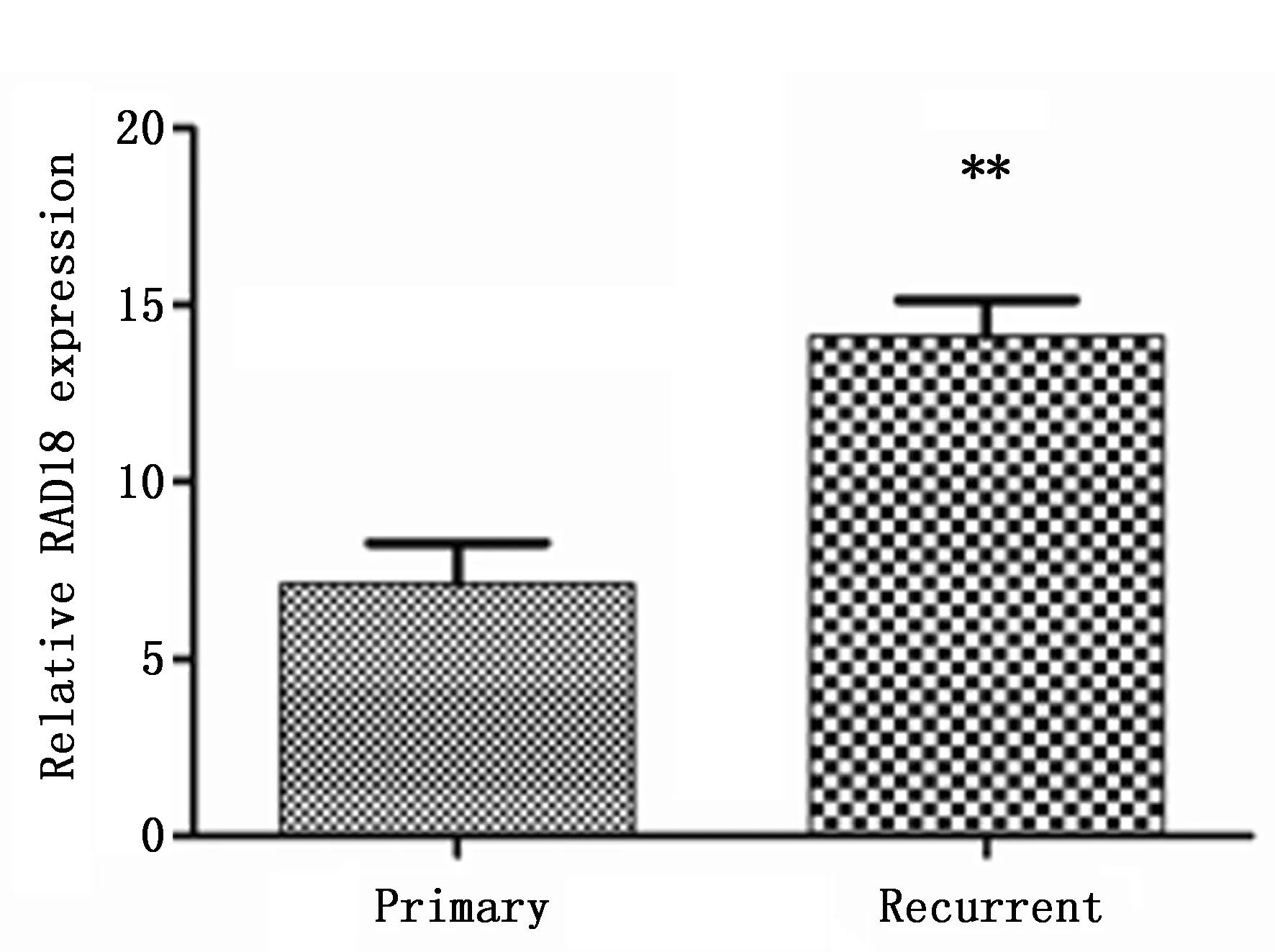
图4 RAD18在原发性及复发性胶质瘤样本中表达情况Figure 4 The mRNA expression of RAD18 in primary and recurrent glioblastoma multiforme(GBM)samplesNote:**P<0.01,compared to the primary GBM.
3 讨论
RAD18是泛素蛋白酶体系统的重要成分之一,参与多种蛋白酶的表达,对维护细胞正常活性及遗传物质稳定性起重要作用。因此,RAD18成为近年来肿瘤学及遗传学研究的热点。有研究表明RAD18也在恶性胶质瘤中特异性表达[9]。本研究选取的细胞系A172为RAD18低表达的细胞系,与正常人星型胶质细胞表达量相近。通过转染使低表达的A172细胞系RAD18表达水平增高,其接受同等剂量照射后,细胞增殖能力明显高于普通的A172细胞。证明体外实验中,RAD18的表达水平可以影响脑胶质瘤对放射治疗的抵抗性。具体作用机制可能与RAD18抑制凋亡、增加DNA双链断裂修复能力有关[8]。放射治疗不可避免的引起DNA损伤,当DNA损伤发生后,RAD18可被招募至DNA损伤位点,与泛素结合酶RAD6结合形成二聚体,促使增殖细胞核抗原发生单泛素化[10]。经过泛素化的增殖细胞核抗原向下游的效应器发出信号,通过招募DNA聚合酶到损伤部位对受损DNA进行修复[11-13]。有研究显示,RAD18不仅对跨损伤DNA合成有调节作用,也参与氧化损伤修复[4,14]。RAD18作为泛素-蛋白酶体系统的关键环节,对放射治疗引起的肿瘤细胞DNA损伤可能有修复作用。
放射性粒子近距离治疗是将放射性核素粒子种植到肿瘤内部或周围,通过持续释放的射线达到杀伤肿瘤的目的。它较传统的放疗相比,一定程度提高了放射治疗的有效性,但是不可避免的还是会出现放射抵抗这一现象[2]。本研究通过收集外科手术获得了5例经放射性粒子近距离治疗后复发性GBM标本,并与原发性患者标本相比,发现复发性GBM的RAD18 mRNA表达量明显高于原发性,结合前期实验,在活体上从一定程度上证实了GBM对放射治疗的抵抗性与RAD18的表达量相关。结合体外实验分析原因,可能是因为放射治疗引起DNA损伤后,RAD18对DNA修复起到了重要调节作用,提高了受损DNA的修复能力,减少了肿瘤细胞凋亡的发生,由此导致GBM患者产生放射抵抗。因此,若以RAD18为靶点,应用RNA干扰技术特异性抑制RAD18表达,或许能够缓解GBM患者产生放射抵抗,为放射治疗提高疗效。但是由于本研究的样本量比较少,得出的结论仍需更大样本量、活体内进一步验证。另外,除了DNA损伤修复以外,肿瘤对放疗抵抗的机制还有:肿瘤干细胞、肿瘤乏氧、基因突变、自噬增强、MicroRNAs调节异常及血管生长因子过表达等因素[15]。希望通过对RAD18的深入研究,联合其他机制,找到更有效的方法,来解决胶质瘤对放射治疗抵抗的难题。
1 Opyrchal M,Allen C,Iankov I,et al.Effective radiovirotherapy for malignant gliomas by using oncolytic measles virus strains encoding the sodium iodide symporter(MV-NIS)[J].Hum Gene Ther,2012,23(4):419-427.
2 徐延斌,李建华.放射性粒子治疗与基因治疗神经胶质瘤的概况[J].实用肿瘤学杂志,2015,29(2):153-156.
3 Wang W,Long L,Wang L,et al.Knockdown of Cathepsin L promotes radiosensitivity of glioma stem cells both in vivo and in vitro[J].Cancer Lett,2016,371(2):274-284.
4 Yang Y,Durando M,Smith-Roe SL,et al.Cell cycle stage-specific roles of Rad18 in tolerance and repair of oxidative DNA damage[J].Nucleic Acids Res,2013,41(4):2296-2312.
5 Franceschi S,Tomei S,Mazzanti CM,et al.Association between RAD51 rs1801320 and susceptibility to glioblastoma[J].J Neurooncol,2016,126(2):265-270.
6 Masuda Y,Suzuki M,Kawai H,et al.Asymmetric nature of two subunits of rad18,a ring-type ubiquitin ligase E3,in the human rad6a-rad18 ternary complex[J].Nucleic Acids Res,2012,40(3):1065-1076.
7 Liu RL,Dong Y,Deng YZ,et al.Tumor suppressor miR-145 reverses drug resistance by directly targeting DNA damage-related gene RAD18 in colorectal cancer[J].Tumour Biol,2015,36(7):5011-5019.
8 Wong RP,Aguissa-Toure AH,Wani AA,et al.Elevated expression of rad18 regulates melanoma cell proliferation[J].Pigment Cell Melanoma Res,2012,25(2):213-218.
9 Xie C,Wang H,Cheng H,et al.RAD18 mediates resistance to ionizing radiation in human glioma cells[J].Biochem Biophys Res Commun,2014,445(1):263-268.
10 Durando M,Tateishi S,Vaziri C.A non-catalytic role of DNA polymerase eta in recruiting Rad18 and promoting PCNA monoubiquitination at stalled replication forks[J].Nucleic Acids Res,2013,41(5):3079-3093.
11 Hibbert RG,Huang A,Boelens R,et al.E3 ligase rad18 promotes monoubiquitination rather than ubiquitin chain formation by E2 enzyme rad6[J].Proc Natl Acad Sci U S A,2011,108(14):5590-5595.
12 Huttner D,Ulrich HD.Cooperation of replication protein A with the ubiquitin ligase Rad18 in DNA damage bypass[J].Cell Cycle,2008,7(23):3629-3633.
13 Bachl J,Ertongur I,Jungnickel B.Involvement of Rad18 in somatic hypermutation[J].Proc Natl Acad Sci U S A,2006,103(32):12081-12086.
14 Palle K,Vaziri C.Rad18 E3 ubiquitin ligase activity mediates fanconi anemia pathway activation and cell survival following DNA topoisomerase 1 inhibition[J].Cell Cycle,2011,10(10):1625-1638.
15 顾昕.自噬在人肺腺癌细胞放疗抵抗形成中的作用及机制研究[D].上海:第二军医大学,2015:1-69.
(收稿:2016-12-06)
Correlation between RAD18 expression and radiotherapy resistance in glioblastoma multiforme
XUYanbin,MAXudong,XIEChen,ZHANQi,RENFubin
Department of Micro-Neurosurgery,The Fourth Hospital Affiliated of Harbin Medical University,Harbin 150001,China
Objective The objective of this study was to investigate the relationship between the expression of RAD18 and radiation resistance in glioblastoma multiforme(GBM)and to provide a new therapeutic target for improving the radiation resistance of GBM.Methods Human glioma A172 cells were transfected into blank and RAD18-containing plasmid vector.The cell proliferation of two groups after the same dose radiation was detected by cloning assay.The mRNA expression of RAD18 in primary and recurrent GBM samples after close proximity treatment were detected by qRT-PCR.All data were analyzed statistically.Results The proliferation of GBM cells transfected with RAD18 plasmid was higher than that of cells transfected with blank plasmid after radiation therapy(P<0.001).The expression level of RAD18 mRNA in recurrent GBM was higher than that in the untreated radioactive granules primary GBM(P<0.01).Conclusion The resistance of recurrent GBM to radiotherapy may be associated with the overexpression of RAD18 protein.
Glioblastoma multiforme;RAD18;Radioactive particles
黑龙江省科技攻关一般项目(GC12C303-3);黑龙江省卫生厅科研课题(2013102)
哈尔滨医科大学附属第四医院微创神经外科(哈尔滨 150001)
徐延斌,男,(1961-),硕士,副主任医师,从事胶质瘤诊断与治疗的研究。
谢晨,E-mail:xcldj@126.com
R739.41
A
10.11904/j.issn.1002-3070.2017.04.001
