钼酸铵净化研究现状
2017-09-03李来平蒋丽娟李延超
刘 燕,李来平,蒋丽娟,杨 健,李延超
(西北有色金属研究院,陕西 西安 710016)
钼酸铵净化研究现状
刘 燕,李来平,蒋丽娟,杨 健,李延超
(西北有色金属研究院,陕西 西安 710016)
本文简要介绍了钼酸铵的净化方法,如制备原料的净化处理,钼酸铵生产过程中除杂,还介绍了高纯钼酸铵的制备技术,最后探讨了钼酸铵溶液净化的研究发展方向。
钼酸铵;高纯;净化
0 引 言
钼酸铵是重要的钼酸盐之一[1],它是生产金属钼的原料,用作生产石油加氢脱硫,丙烷氧化生产丙烯腈和褐煤液化的催化剂,还用作生产硫代钼酸铵,硫代钼酸铵是生产三核钼和纳米级二硫化钼的原料。
在现代工业领域钼酸铵的应用日趋重要,我国是世界上生产钼酸铵的主要国家之一,其产能约占世界总产量的一半,不过由于多种原因,生产钼酸铵的原料——工业三氧化钼含杂质较高,特别是含Cu、Fe、Ca、Pb、P、W和K等较高,如我国最大钼酸铵生产厂生产的工业氧化钼含有云母、钾长石,从而导致工业氧化钼中含K较高,另一大型钼矿床生产的钼精矿含白钨矿较高,工业氧化钼中含W量为0.5%~1.0%,还有两家钼酸铵厂生产的产品中含K和W均高,K的含量在0.02%,后者W的含量有时高达0.1%~0.2%。世界上其他生产钼酸铵国家如美国、加拿大、智利和伊朗等也遇到类似钼酸铵除杂问题。
随着现代科技的飞速发展,对钼及钼产品的性能提出了更新、更高的要求,因此,对钼酸铵的纯度要求也愈来愈严格,就钼酸铵生产来说,使产品中各种杂质含量尽可能降低以达到用户要求显得更为重要。
在制备钼酸铵工序中对产品纯度起决定性作用的是净化,净化后钼酸铵溶液中的杂质含量直接决定钼酸铵的质量等级。净化的方式有许多种,其中硫盐法在我国钼酸铵净化中占据着主导地位,离子交换法只有半工业试验[2]。本文将详细介绍钼酸铵的各种除杂净化方法。
1 制备原料净化
1.1 采用氧化剂+浸出剂对制备原料进行净化
通过钼精矿氧化焙烧制得的工业三氧化钼中含有较高的Cu、Fe、Mg、Ca等离子,一般采用化学法净化处理,即用氧化剂氧化工业氧化钼中的MoO2为MoO3,与此同时用浸出剂除去工业氧化钼中的Cu、Fe、Ca、Mg、Pb、Ba和部分K等杂质。可选用的氧化剂有H2O2、KMnO4和KS2O8等,可选择的浸出剂有HNO3、H2SO4与HNO3混合酸、HCl和卡罗酸等[3]。浸出时间一般为2 h,个别为1.5 h,温度为70 ℃。硝酸可将MoO2氧化为MoO3,反应如下:MoO2+2H++2(NO3)-→MoO3+2NO2+H2O。低浓度硝酸很容易将Cu和Fe浸出,1.5 N硝酸溶液可将Ca、Mg、Pb、Ba和Sr等浸出。4 N的H2SO4加上0.5 N的HNO3可将工业氧化钼中的MoO2降至0.2%以下。工业氧化钼中K的含量一般为0.1%,浸出时溶解在溶液中的钼用弱碱性阴离子交换树脂吸附,而后用1~2.5 M的稀氢氧化钾解吸,解吸的钼酸钠返回浸出作业。用过的浸出液经处理后再循环使用。
Judy L Scheftic等人[4]提出了一种净化钼的方法,将含有钾的三氧化钼溶液在硝酸和氨的混合液中进行除杂,其中硝酸的浓度为3.5~400 mol/L,氨的浓度为0.5~1.0 mol/L,混合液的温度为50 ℃,并进行两次浸出。将第二次浸出的三氧化钼进行水洗,在温度50 ℃、pH值9.0条件下用氨水溶解水洗后的三氧化钼,使其形成钼酸铵溶液,然后通过结晶形成二钼酸铵。
1.2 采用酸+盐的混合液对制备原料进行净化处理
酸+盐预处理工艺是国内普遍采用的钼酸铵生产工艺[5],以工业氧化钼为原料,用HCl和NH4Cl溶液浸出,在两者浓度比适当、温度适宜的条件下,可将工业氧化钼中的Cu、Fe、Ca、Zn、Pb和P等杂质大部分除去,而且工业氧化钼不被溶解,大于99%的钼保留在固相中。
Timothy A Brunelli[6]等公开了一种从三氧化钼中除去钾并形成高纯钼化合物的方法。首先将含杂质的三氧化钼进行酸浸,酸浸溶液由矿物酸和矿物酸的铵盐两部分组成,它们的质量比为3∶1。将三氧化钼在充足的温度和时间下酸浸,然后进行固液分离,将分离出的三氧化钼用水洗涤,洗涤后用氨水处理形成钼酸铵溶液,最后结晶出高纯钼的化合物。
Lim Kyoung Mee等人[7]报道了一种用酸和盐除去氧化钼中杂质的方法,该方法采用3种不同试剂进行三级浸出,首先用氯化铵、氯化钠和盐酸混合液进行除杂,然后用氯化铵、氯化钙和盐酸混合液进行除杂,最后采用氯化铵、氯化钠、氯化钙和盐酸的混合液除杂。该工艺不但除杂效果好,而且可以有效回收溶解在浸出液中的钼,在该浸出液体系中,由于存在同离子效应,钼酸铵溶解量非常少,只有1%,绝大部分钼都以固体的形式存在。另外,除杂过程中氯化铵的用量减少,因此可有效减少氮的总量,该工艺可提高废水的质量。
1.3 氧压氧化法制备高质量工业氧化钼产品
德国的Kummer[8]推出了一种改进的POX-MoSX法,从低品位钼精矿生产二钼酸铵。将低品位钼精矿(Mo含量为25.5%~29.3%)置入带有衬钛不锈钢的反应釜中,加水调浆至固体浓度为20%~30%,在温度为210~220 ℃,氧分压为0.6~0.7 MPa条件下进行压煮2 h左右。将釜内反应产物冷却后放出,然后过滤,滤液为可溶性钼化合物和硫酸铜、硫酸铁等。向滤液中添加铁屑,在室温条件下沉铜,经过滤、洗涤后继续加铁屑沉淀钼,固体钼返回至压煮再进行氧化,滤饼用水重新调浆,加碳酸钠水溶液浸出钼为可溶性钼酸钠。产出的钼酸钠溶液用溶剂萃取钼,萃取剂的组成为10%的双十三胺、5%癸醇和85%Escaid110溶剂。负载钼的有机相用弱酸洗涤,pH值为4~4.5,目的是有效减少砷、磷、硒和硫酸盐转入有机相。用浓氨水解吸有机相上的钼,解吸溶液的pH控制在7。为了进一步减少钼酸铵溶液中的痕量杂质,向钼酸铵解吸溶液加入少量钼酸铁和硫化铵。然后过滤,蒸发结晶得二钼酸铵。结晶过程的蒸气经冷却回收氨,返回溶剂萃取系统。与传统的氧化焙烧钼精矿转化工业氧化钼方法比较,操作环境友好,钼资源利用率高,工业氧化钼产品质量好,为炼制高强度低合金钢和不锈钢等提供了优质前躯体。
2 钼酸铵生产过程除杂
2.1 去除钼酸铵中铜、铁、铅的方法
去除钼酸铵中的铜、铁、铅,使主金属离子钼和其他非主金属离子分离,一般采用硫化沉淀法,通常选择硫化钠或硫化铵对钼酸铵浸出液进行沉淀。硫化沉淀原理是利用某些杂质的硫化物在碱性溶液中的溶度积很小的特点,向浸出液中加入硫化铵或硫化钠,使之成为硫化物沉淀,以达到与钼分离的目的。将浸出的钼酸铵溶液放入净化槽,加热并用氨水调pH值,同时不断搅拌,慢慢地分多次加入硫化铵溶液,反应完毕后,停止搅拌,待溶液静置澄清后,吸出上清液过滤或直接过滤。
俞娟等人[9]开展了钼酸铵溶液的净化研究,采用分析纯Na2S·9H2O作为除去铜、铅、锌的沉淀剂。称取一定量的氨浸后的钼酸铵,置入于35~40 ℃条件下恒温并搅拌1 h,然后滴入硫化钠溶液,直至上清液呈无色透明,停止搅拌和加热并进行过滤,试验结果表明,铜、铁、铅的沉淀率分别达到99.60%、99.24%、100.00%。
2.2 除钼酸铵中微量元素磷、砷和硅等杂质
李万龙[10]等人公开了一种从钼酸铵溶液中除去微量磷、砷、硅杂质的方法,采用“晶种”原理,首先将含杂质的溶液升温至50 ℃左右,然后加入钼酸铵除磷、砷和硅杂质产生的渣作为“晶种”进行除杂。该方法解决了钼酸铵溶液中微量磷、砷和硅杂质去除难的问题,既节省了生产成本又提高了产品质量,同时,避免了因增大工业氯化镁用量易带入其他杂质使钼酸铵溶液二次“污染”的风险。具体方法是:取2 m3待除杂的钼酸铵溶液,升温至48 ℃,加入氨水调节pH值为8.5,加入10 kg前期生产钼酸铵除磷、砷和硅杂质产生的渣,搅拌10 min,加入35 L工业氯化镁溶液搅拌25 min,降温至42 ℃,加入活性碳2 kg搅拌15 min后过滤,滤液50 ℃按酸沉化学理论计量的1.05倍加入工业浓硝酸结晶钼酸铵,产品结果见表1。
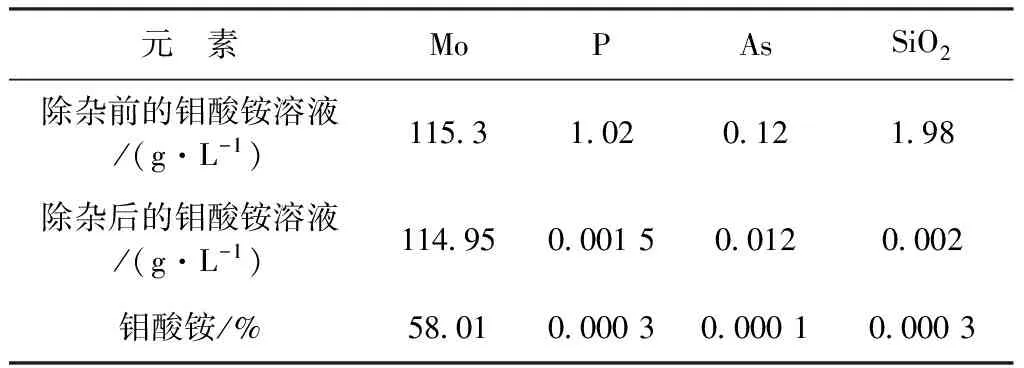
表1 钼酸铵产品结果表
从表1可以看出,除杂效果非常明显,除杂过程中钼的回收率≥99.5%,产出的钼酸铵质量符合国家标准(GB/T3460-2007)一级品。
杨亮[11]等人进行了钼酸铵溶液中去除砷的研究,采用氯化镁使砷形成砷酸铵镁沉淀而除去。在氯化镁用量为理论量的1.2倍,反应温度为24 ℃,反应时间为30 min条件下,溶液中砷的量由原来的8.75 g/L降低到46.7 mg/L,钼的入渣率为0.34%。然后将除砷得到的钼酸铵溶液调节pH为9.2,流速为1 mL/min,交换后液体积为724弱酸性阳离子树脂17倍时,交换后液中镁浓度由原来的520 mg/L降低至72 mg/L。
2.3 去除钼酸铵中钨的方法
冷明峰[12]采用吸附共沉淀法分离钼酸铵中的钨,以九水硝酸铁为原料,新生态的氢氧化铁为载体,在pH值为8左右,陈化时间为使氢氧化铁由沉淀之初的无定形胶体形态转换为晶型沉淀时刻,此时载体对钨的吸附达到最大值,可有效去除钼酸铵中的钨。
2.4 离子交换树脂进行净化处理
离子交换法是液相离子和固相离子间所进行的一种可逆性化学反应,当液相中的某些离子较为离子交换固体所亲和时,便会被离子交换固体吸附,为维持水溶液的电中性,离子交换固体必须释出等价离子回溶液中。
袁茂强和肖新志[13]提供一种钼酸铵溶液深度净化除杂工艺。工艺包括两个步骤:第一步将钼酸铵溶液中加入氯化镁,然后进行过滤使固液分离;第二步用D850、D750、D851或D751树脂对滤液进行吸附,树脂流速为10 ~12 cm3/min,至络黑T或者酸性络蓝K指示不变色,得到的钼酸铵溶液纯度有效提高。
美国AMAX公司采用离子交换树脂进行净化。首先将含杂质的工业氧化钼用热水浸出,配制浆料浓度为20%~50%,在温度为80 ℃左右的热水中水浸约1 h。中和滤液,再用阴离子树脂IRA-93进行离子交换,用氨水解吸树脂上的钼获得钼酸铵溶液。然后用氨水浸滤饼,固液分离后将滤液与解吸获得钼酸铵溶液一起进行真空蒸馏,该工艺的一个优点是蒸馏时不需要调节pH值,蒸出的氨和水经冷凝器冷却至缓冲瓶中,返回到氨浸工序。蒸发后的钼酸铵溶液在20 ℃或稍低的温度下冷却结晶,然后过滤、真空干燥得高纯七钼酸铵。
2.5 萃取法进行净化处理
溶剂萃取的原理是利用化合物在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同,使化合物从一种溶剂内转移到另外一种溶剂中。经多次萃取,将绝大部分的化合物提取出来。
Viktor Stoller等人[14]于2010年发明了一种制备七钼酸铵的方法。该方法中采用萃取法进行净化除杂。首先用氢氧化钠溶解工业氧化钼得钼酸钠溶液,然后过滤,将滤液pH调为2.5,用含双十三胺有机相进行萃取得到负载钼有机相,将其中一部分引入用于反萃的搅拌器中,同时往该搅拌器中加入氨溶液和冷却结晶得到的母液,调节氨钼比为1.20∶1,获得钼含量为19.24%的反萃液(反萃率为94.5%)。将反萃液在15~20 ℃下冷却结晶制取七钼酸铵。另一部分含钼有机相引入搅拌器中,同时将第一次反萃有机相也通入该搅拌器中,另外,再加入适量的氨溶液和冷却结晶后的母液,进行反萃,将反萃液进行真空蒸馏获得二钼酸铵,把反萃有机相进行两次水洗使其再生。该工艺的优势是在制备高纯七钼酸铵过程中避免了能耗高的缺点,同时也避免了产品中氨含量过高的缺点,直收率高,资源得到合理利用。
3 高纯钼酸铵的制备
许多学者研究了高纯钼酸铵的制备,申友元[15]等人提供了一种高纯仲钼酸铵的制备方法。采用国家标准二级(MSA-2)的多钼酸铵为原料,按多钼酸铵(kg)∶纯水(L)∶氨水(L)=1∶(0.20~0.25)∶0.6的比例,在60 ℃以上进行搅拌使钼酸铵溶解,而后在蒸汽压为0.1~0.15 MPa的条件下进行蒸发结晶,在蒸发结晶时每1 000 kg多钼酸铵加入异二胺四乙酸40~150 g,结晶母液浓缩后进行固液分离,然后干燥至水分≤1.0 g/cm3。该方法降低了多钼酸铵溶解时的液固比,可缩短结晶时间, 即可缩短在不锈钢槽的搅拌时间,从而减少杂质的带入量,提高仲钼酸铵的纯度。加入乙二胺四乙酸可使铁、铜、硅等杂质元素进入溶液与仲钼酸铵分离,进而使钼酸铵纯度大幅度提高。本发明的制备方法操作简单,产品稳定,结晶率达94.5%以上。
Richard A.Ronzio等人[16]研发了一种制备高纯七钼酸铵或二钼酸铵的方法。首先将工业氧化钼用热水浸并过滤,将滤液进行中和,然后采用阴离子树脂处理,用氨水解吸获得钼酸铵溶液。将滤饼进行氨浸,氨浸液与离子交换得到的钼酸铵溶液一起进行真空蒸馏,该工艺蒸馏时不需要调节pH值,蒸发出的氨和水经过冷凝器冷却到缓冲瓶中,返回至氨浸作业。蒸发得到的钼酸铵溶液在20 ℃或稍低的温度下冷却结晶,然后过滤、真空干燥得高纯七钼酸铵产品。
宫崎英男[17]等制备高纯钼酸铵的方法如下,在纯氨水中,以NH3-/Mo摩尔比等于1的条件下,加入230 g/L纯三氧化钼,搅拌微热使三氧化钼充分溶解,过滤,加入二次蒸馏得硝酸,硝酸浓度为6 N,溶液浓度为100 g/L,再在90 ℃下加热1 h得到钼酸铵结晶体。
制备高纯钼酸铵时,二次蒸馏硝酸含Na<0.5 μg/kg,氨水含Na<10 μg/g,水使用超纯水,其含Na<0.5 μg/kg,制备用容器要使用透明石英制品。这种高纯钼酸铵含杂如表2所示。

表2 高纯钼酸铵产品分析结果 mg/kg
该产品制备的钼材用作半导体装置的电极和配线等。
4 展 望
近年来,我国钼酸铵产业的发展非常迅速,但制备的钼酸铵中钙、铁、铜、钾、钠等杂质含量较高,与国外还存在一定差距。从整体发展趋势来看,我国的钼冶炼行业,正朝着品质高端化、品种多样化、工艺合理化、控制自动化、节能环保化、管理现代化、规模集团化方向发展,相信不久的将来会迎来新的发展高潮。
[1] 张文钲.钼酸铵的研发进展[J].中国钼业, 2005, 29(2):29-32.
[2] 袁茂强, 曾 雪.钼酸铵溶液深度净化工艺探索[J].中国钼业, 2003, 27(3):19-21.
[3] 向铁根.钼冶金[M].长沙:中南大学出版社, 2009.
[4] Judy L Scheftic, James N Christini.Continuous process for purifying molybdenum:US4933152[P].1990-06-12.
[5] 李 辉, 唐丽霞.钼酸铵生产工艺与技术进展状况分析[J].中国钼业, 2009, 36(6):41-43.
[6] Timothy A Brunelli, Michael J Cheresnowsky.Purification of molybdenum.US4612172[P].1987-10-27.
[7] Lim Kyoung Mee, Song Jin Kon, HUR Chun Hoi.Method for leaching impurties contained in molybdenum oxide concentrates.WO 2011052993[P].2010-08-12.
[8] Balliett Robert W, Kummer Wolfgang, Litz John E, et al.Production of pure molybdenum oxide from low grade molybdenite concentrates.WO 02089944[P].2004-05-04.
[9] 俞 娟, 杨红英, 方 钊,等.钼酸铵溶液的净化研究[J].中南大学学报, 2014, 45(9):2959-2965.
[10] 李万龙, 赖 坚, 汤志强,等.从钼酸铵溶液中除去微量P、As、Si杂质的方法. CN 102219259[P].2011-10-19.
[11] 杨 亮, 赵中伟, 陈爱良,等.从钼酸铵溶液中除去砷的研究[J].中南大学学报, 2011, 42 (8):2193-2197.
[12] 冷明峰.吸附共沉淀法分离钼酸铵中的钨[J].中国钼业, 2011,35(2):36-38.
[13] 袁茂强,曾 雪.钨酸铵或钼酸铵溶液深度净化除杂工艺[P].2003,27(3):19-21.
[14] Viktor Stoller, Michael Erb, Juliane Meese-Marktscheffel, et al.Method for producing ammonium heptamolybdate.US 20100008846[P].2010-01-14.
[15] 申友元, 吴国根, 陈和平,等.高纯仲钼酸铵的制备方法.CN 03124673.7[P].2004-07-22.
[16] Richard A.Ronzio, Philip K.Davis, Robert C.Zigler.Process for producing ammonium heptamolybdate and/or ammonium dimolybdate.US 4079116[P].1978-03-14.
[17] 宫崎英男, 三宅敏夫, 加藤義春.高纯钼酸铵结晶的制造方法.JPH01172225[P].1989-07-07.
RESEARCH STATUS OF AMMONIUM MOLYBDATE PURIFICATION
LIU Yan, LI Lai-ping, JIANG Li-juan, YANG Jian,LI Yan-chao
(Northwest Institute for Nonferrous Metal Research,Xi'an 710016, Shaanxi, China)
The purification methods of ammonium molybdate were briefly described, such as the purifying method of crude material, removing impurities from ammonium molybdate during production process. The preparation technique of high-purity ammonium molybdate was also reviewed. Finally, the prospective research direction of ammonium molybdate solution purification was forecasted.
ammonium molybdate; high purity; purification
2017-04-28;
2017-06-02
刘 燕(1984—),女,硕士,工程师。主要从事有色金属冶金和化工方面的研究。E-mail:373924243@qq.com
10.13384/j.cnki.cmi.1006-2602.2017.04.001
TF125.2+41
A
1006-2602(2017)04-0001-04
