渐尖毛蕨二氢黄酮苷对糖尿病肾病大鼠肾上皮-间质转化的影响Δ
2017-09-03熊佳俊陈镜楼宋红萍湖北中医药大学药学院武汉430065华中科技大学同济医学院附属普爱医院药学部武汉430033
熊佳俊,陈镜楼,宋红萍(1.湖北中医药大学药学院,武汉 430065;.华中科技大学同济医学院附属普爱医院药学部,武汉 430033)
渐尖毛蕨二氢黄酮苷对糖尿病肾病大鼠肾上皮-间质转化的影响Δ
熊佳俊1*,陈镜楼2#,宋红萍2(1.湖北中医药大学药学院,武汉 430065;2.华中科技大学同济医学院附属普爱医院药学部,武汉 430033)
目的:考察渐尖毛蕨二氢黄酮苷(CAF)对糖尿病肾病(DKD)大鼠肾上皮-间质转化(EMT)的影响。方法:将大鼠随机分为正常组(生理盐水)、模型组(生理盐水)、阳性组[罗格列酮,0.4 mg/(kg·d)]和CAF高、低剂量组[12.5、25 mg/(kg·d)],每组10只。除正常组的其余大鼠均采用ip链脲霉素(60 mg/kg)+高脂饮食诱导DKD的发生,并于实验第13~16周同时ig相应药物。实验结束后,检测大鼠空腹血糖值和血肌酐(Scr)、尿素氮(BUN)含量,观察肾组织胶原沉积及基底膜增厚情况,免疫组化法检测肾组织中α-平滑肌肌动蛋白(α-SMA)、纤维连接蛋白(fibronectin)和上皮细胞钙黏蛋白(E-cadherin)表达,Western blot法检测肾组织中糖原合成酶激酶3β(GSK-3β)、磷酸化GSK-3β(p-GSK-3β)和β-链蛋白(β-catenin)的表达。结果:与正常组比较,模型组大鼠空腹血糖值和Scr、BUN含量均显著升高(P<0.01);肾组织有明显胶原沉积、基底膜增厚;肾组织中α-SMA、fibronectin、β-catenin表达水平和GSK-3β磷酸化程度均显著升高(P<0.01),E-cadherin表达水平显著降低(P<0.01)。与模型组比较,各给药组大鼠空腹血糖值和Scr、BUN含量均显著降低(P<0.05或P<0.01);肾组织胶原沉积和基底膜增厚情况显著改善;肾组织中α-SMA、fibronectin、β-catenin表达水平和GSK-3β磷酸化程度均显著降低(P<0.05或P<0.01),阳性组和CAF高剂量组大鼠肾组织中E-cadherin表达水平显著升高(P<0.01)。结论:CAF能抑制DKD大鼠的肾EMT,其作用的分子机制可能与下调肾组织中β-catenin表达和抑制GSK-3β磷酸化失活有关。
渐尖毛蕨;二氢黄酮苷;糖尿病肾病;上皮-间质转化;上皮细胞钙黏蛋白;糖原合成酶激酶3β;大鼠
糖尿病是严重威胁人类健康的公共卫生问题,而糖尿病肾病(Diabetic kidney disease,DKD)是糖尿病患者的主要致死原因之一[1-2]。DKD已经成为西方首位和我国第2位的终末期肾病原因[3]。DKD以基底膜增厚、系膜区扩张、细胞外基质(Extracellular matrix,ECM)重塑和沉积等为主要病理特征,本质上是肾纤维化的过程[4-5]。而上皮-间质转化(Epithelial-mesenchymal transition,EMT)是DKD过程中导致肾纤维化的重要机制[6]。其中上皮标记物上皮细胞钙黏蛋白(E-cadherin)以及间质标记物α-平滑肌肌动蛋白(α-SMA)和纤维连接蛋白
(fibronectin)的表达程度是评价EMT水平的重要指标。渐尖毛蕨[Cyslosorus acuminatus(Houtt.)Nakai]是金星蕨科毛蕨属植物,富含多种新颖的二氢黄酮类化合物。笔者前期研究发现渐尖毛蕨总黄酮能调控3T3-L1
前脂肪细胞的增殖、分化并抑制胰岛素抵抗[7]、降低糖尿病模型小鼠的血糖含量并减轻肾损伤程度[8],随后预实验结果提示渐尖毛蕨二氢黄酮苷(Cyclosorus acuminatus flavanone glycoside,CAF)很可能为渐尖毛蕨生物活性的物质基础。在本研究中笔者拟探讨CAF对DKD大鼠肾EMT的影响和可能的作用机制,为其进一步开发利用提供实验参考。
1 材料
1.1 仪器
DMi8显微镜(德国Leica公司);JS-1075荧光化学发光凝胶成像系统(上海培清科技有限公司)。
1.2 药品与试剂
罗格列酮片(成都恒瑞制药有限公司,批号:150101,规格:4 mg/片);血糖(批号:20151016)、血肌酐(Scr,批号:20151016)、尿素氮(BUN,批号:20151014)含量测定试剂盒(南京建成生物工程研究所);链脲霉素(美国Sigma-Aldrich公司);兔源糖原合成酶激酶3β(GSK-3β)多克隆一抗和酶标山羊抗兔二抗(武汉三鹰生物技术有限公司);兔源β-链蛋白(β-catenin)和磷酸化GSK-3β(p-GSK-3β)多克隆一抗(美国CST公司);其余试剂均为分析纯。
1.3 药材与CAF
渐尖毛蕨药材采收于江西省九江市,由九江市林业科学研究所高级工程师谭策铭教授鉴定为金星蕨科毛蕨属渐尖毛蕨[Cyclosorus acuminatus(Houtt)Nakai],标本(No.JX0507)保存于华中科技大学同济医学院药学院;CAF按照前期研究的方法制备和检测[8],经高效液相色谱法测定其纯度>98%,其结构式见图1。
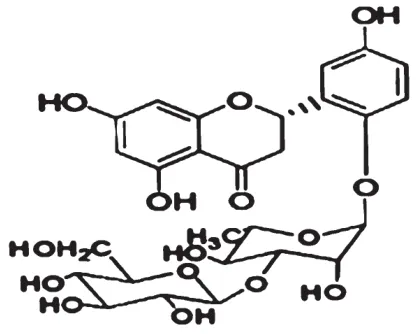
图1 CAF的化学结构式Fig 1 Chemical structure of CAF
1.4 动物
Wistar大鼠50只,♂,6周龄,体质量(200±20)g,购于湖北省疾病预防控制中心,合格证号:SCXK(鄂)2015-0018。大鼠于温度为(22±3)℃、湿度为(50±10)%、昼夜节律为12 h光照∶12 h黑暗的环境下饲养,自由饮食。
2 方法
2.1 造模、分组与给药
大鼠适应环境1周后随机分为5组,分别为正常组、模型组、阳性组和CAF高、低剂量组。除正常组外的其余大鼠饲予高脂饮食(即普通饲料470 g/kg、蔗糖100 g/kg、蛋黄200 g/kg、猪油200 g/kg、胆固醇20 g/kg和脱氧胆酸钠10 g/kg),并在第4周末一次性ip 60 mg/kg的链脲霉素[9]。注射72 h后检测空腹血糖值,将血糖值大于16.7 mmol/L者纳入实验[2],继续给予高脂饮食至实验第13周。从第13周开始,CAF高、低剂量组大鼠在给予高脂饮食的同时分别ig 25、12.5 mg/(kg·d)的CAF水溶液(该给药剂量是基于笔者前期研究发现300 mg/kg的渐尖毛蕨总黄酮具有改善糖尿病小鼠肾损伤的潜力[8],自总黄酮中分离得到CAF产率为5.36%,计算出小鼠ig剂量为16.08 mg/kg,同时根据体表面积换算得到大鼠ig剂量为12.5 mg/kg),至第16周末实验结束;阳性组大鼠ig 0.4 mg/(kg·d)罗格列酮(参照说明书中人用剂量,根据体表面积换算得到大鼠的等效剂量),至第16周末实验结束;正常组和模型组大鼠ig等体积的生理盐水,至第16周末实验结束。
2.2 空腹血糖值和生化指标检测
16周实验周期结束后收集大鼠血样,用于检测空腹血糖值和Scr、BUN含量,具体操作按照相应试剂盒说明书进行。
2.3 肾胶原沉积和基底膜增厚情况检测
将大鼠处死后分离肾组织。其中一部份进行4%多聚甲醛固定、石蜡包埋和组织切片后,用于Masson染色和天狼星红染色观察组织胶原沉积情况,以及过碘酸雪夫氏染色(PAS染色)观察肾基底膜增厚情况。
2.4 肾组织中α-SMA、fibronectin和E-cadherin表达
采用免疫组化法。脱蜡切片于2%双氧水中浸泡10 min,然后用5%山羊血清封闭10 min;随后用相应一抗于37℃温育1 h,以磷酸盐缓冲液(PBS)清洗后用酶标山羊抗兔二抗于37℃温育10 min;用二氨基联苯胺浸泡3 min后,苏木精染色,乙醇脱水。通过平行操作但不加一抗孵育切片作为阴性对照,并以此判断阳性表达。各切片样本于400倍光学显微镜下观察并拍照,然后通过Image J软件进行半定量分析积分光密度(IOD)值。
2.5 肾组织中p-GSK-3β、GSK-3β和β-catenin表达
采用Western blot法。取另一部份肾组织,液氮研磨后抽提总蛋白,检测蛋白浓度;按照待测样本-上样缓冲液(4∶1,V/V)混匀后在100℃加热3 min使蛋白质变性;取样20 μL进行10%聚丙烯酰胺凝胶电泳;转膜,置于5%脱脂奶粉溶液中37℃封闭1 h,分别加入p-GSK-3β、GSK-3β和β-catenin一抗(1∶1 000),4℃孵育过夜;清洗后加入酶标山羊抗兔二抗,室温下孵育1 h,化学发光并以凝胶成像系统成像。通过Bio-Rad Quantity One软件测定条带光密度值,以目的蛋白条带光密度值与内参βactin条带光密度值的比值计算目的蛋白的相对表达量,以p-GSK-3β/GSK-3β比值表示GSK-3β的磷酸化程度。
2.6 统计学方法
3 结果
3.1 大鼠空腹血糖值和Scr、BUN含量测定结果
与正常组比较,模型组大鼠空腹血糖值和Scr、BUN含量均显著升高(P<0.01);与模型组比较,阳性组和CAF高、低剂量组大鼠空腹血糖值和Scr、BUN含量均显著降低(P<0.05或P<0.01),结果见表1。
表1 各组大鼠空腹血糖值和Scr、BUN含量检测结果(±s,n=8)Tab 1 Detection results of fasting glucose level and BUN,Scr contents of rats in each group(±s,n=8)
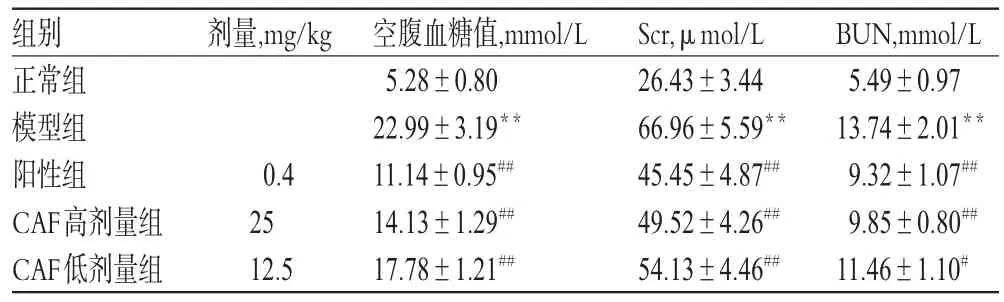
表1 各组大鼠空腹血糖值和Scr、BUN含量检测结果(±s,n=8)Tab 1 Detection results of fasting glucose level and BUN,Scr contents of rats in each group(±s,n=8)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,#P<0.05,##P<0.01
组别正常组模型组阳性组CAF高剂量组CAF低剂量组BUN,mmol/L 5.49±0.97 13.74±2.01**9.32±1.07##9.85±0.80##11.46±1.10#剂量,mg/kg 0.4 25 12.5空腹血糖值,mmol/L 5.28±0.80 22.99±3.19**11.14±0.95##14.13±1.29##17.78±1.21##Scr,μmol/L 26.43±3.44 66.96±5.59**45.45±4.87##49.52±4.26##54.13±4.46##
3.2 大鼠肾胶原沉积和基底膜增厚情况观察结果
与正常组比较,模型组大鼠肾胶原明显沉积、基底膜显著增厚;给药后,各给药组大鼠肾组织胶原沉积和肾小球基底膜增厚状况明显改善,结果见图2。
3.3 大鼠肾组织中α-SMA、fibronectin和E-cadherin表达测定结果
与正常组比较,模型组大鼠肾组织中α-SMA、fibronectin表达水平显著升高(P<0.01),E-cadherin表达水平显著降低(P<0.01),提示DKD大鼠肾组织EMT处于活跃状态。与模型组比较,除CAF低剂量组大鼠肾组织中E-cadherin表达水平升高不显著外,其余各给药组大鼠上述指标均显著改善(P<0.01),提示CAF能抑制DKD大鼠肾的EMT。免疫组化结果见图3,测定结果见表2。
3.4 大鼠肾组织中GSK-3β磷酸化程度和β-catenin表达的测定结果
与正常组比较,模型组大鼠肾组织中GSK-3β磷酸化程度及β-catenin表达水平显著升高(P<0.01);与模型组比较,各给药组大鼠肾组织中GSK-3β磷酸化程度及β-catenin表达水平均显著降低(P<0.05或P<0.01)。蛋白质印迹电泳图见图4,测定结果见表3。
4 讨论
DKD是糖尿病患者最常见的微血管并发症之一,可呈进行性发展,最终将诱导肾小球硬化和间质纤维化[4-5]。罗格列酮是临床治疗DKD的常见药物,但是由于存在疗效不稳定和肝毒性问题,罗格列酮并不能真正逆转DKD[10]。肾纤维化以ECM过度合成、重塑和沉积为特征,其核心环节涉及EMT过程,将造成肾上皮细胞结构的破坏和功能的丧失[11]。一方面,现已知高度分化和结构完整的肾小球上皮细胞是维持肾小球滤过屏障正常功能的核心关键,也是控制DKD的重要因素[12]。另一方面,大量成纤维细胞通过EMT过程形成于肾小管,分泌ECM,促发DKD后期肾脏纤维化的形成[6]。由此可见,干预EMT过程是调控DKD肾纤维化的重要手段。
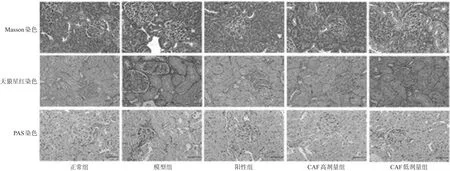
图2 各组大鼠肾组织切片Masson、天狼星红和PAS染色图(×400)Fig 2 Masson,sirius red and PAS staining of kidney tissue sections of rats in each group(×400)

图3 各组大鼠肾组织中α-SMA、fibronectin和E-cadherin表达的免疫组化图(×400)Fig 3 Immunohistochemistry plot for α-SMA,fibronectin and E-cadherin in kidney tissue of rats in each group(× 400)
表2 各组大鼠肾组织中α-SMA、fibronectin和E-cadherin表达测定结果(±s,n=6)Tab 2 Determination results of α-SMA,fibronectin phosphorylation degree and β-catenin expression in kidney tissue of rats in each group(±s,n=6)

表2 各组大鼠肾组织中α-SMA、fibronectin和E-cadherin表达测定结果(±s,n=6)Tab 2 Determination results of α-SMA,fibronectin phosphorylation degree and β-catenin expression in kidney tissue of rats in each group(±s,n=6)
注:与正常组比较,**P<0.01;与模型组比较,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,##P<0.01
组别正常组模型组阳性组CAF高剂量组CAF低剂量组E-cadherin 1.00±0.07 0.79±0.06**0.97±0.08##0.91±0.07##0.86±0.08剂量,mg/kg 0.4 25 12.5 α-SMA 1.00±0.13 1.48±0.12**1.09±0.11##1.12±0.11##1.28±0.13##fibronectin 1.00±0.08 1.33±0.11**1.02±0.10##1.09±0.10##1.15±0.13##
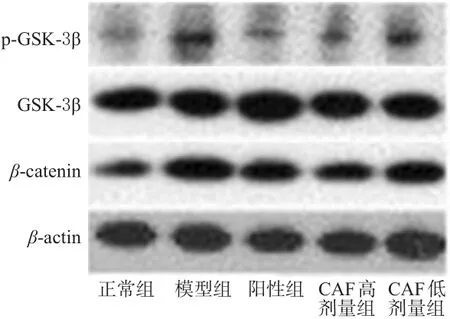
图4 各组大鼠肾组织中p-GSK-3β、GSK-3β和β-catenin表达的电泳图Fig 4 Electrophoresis of p-GSK-3β,GSK-3β and βcatenin protein expression in kidney tissue of rats in each group
EMT程序通常由锌指结合转录因子、碱性螺旋-环-螺旋因子和淋巴细胞增强因子等细胞核内转录因子直接激活,以上皮标记物E-cadherin等表达缺失和间质标记物α-SMA和fibronectin等过表达为特征[13]。外界刺激通过多种细胞信号通路的传导到达核内并启动相应的转录因子,从而完成外界刺激激活EMT的过程。其中Wnt/β-catenin等信号通路是参与EMT调控的主流信号通路之一,其在慢性肾疾病中的功能也得到越来越多的关注[14]。Wnt/β-catenin通路在没有刺激信号时,β-catenin蛋白通过与GSK-3β和轴抑制蛋白(Axin)结合形成复合物而处于沉默状态;当Wnt配体与其膜受体Frizzled结合后激活通路,促进复合物解离失活,使β-catenin蛋白大量游离于细胞质中,进而导致位移进入细胞核内的β-catenin蛋白大幅增多,从而与EMT转录因子结合,促进EMT[12,14]。
表3 各组大鼠肾组织中GSK-3β磷酸化程度及β-catenin表达测定结果(±s,n=6)Tab 3 Determination results of GSK-3β phosphorylation degree and β-catenin expression in kidney tissue of rats in each group(±s,n=6)

表3 各组大鼠肾组织中GSK-3β磷酸化程度及β-catenin表达测定结果(±s,n=6)Tab 3 Determination results of GSK-3β phosphorylation degree and β-catenin expression in kidney tissue of rats in each group(±s,n=6)
注:与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01Note:vs.normal group,**P<0.01;vs.model group,#P<0.05,##P<0.01
组别正常组模型组阳性组CAF高剂量组CAF低剂量组β-catenin/β-actin 1.00±0.19 2.37±0.27**1.77±0.21##1.68±0.15##1.95±0.19#剂量,mg/kg 0.4 25 12.5 p-GSK-3β/GSK-3β 1.00±0.11 2.83±0.33**1.21±0.19##1.36±0.14##2.15±0.22##
二氢黄酮是黄酮类化合物的一员,流行病学研究证实其具有改善高血压、调节血脂紊乱、减轻胰岛素抵抗、抑制体内氧化应激和炎症反应等生理功能[15]。蕨类植物作为过渡植物,具有种类丰富的黄酮类次生代谢产物,且含量高、易于分离纯化,其中二氢黄酮主要分布于金星蕨科等植物中[16]。渐尖毛蕨是金星蕨科毛蕨属植物,在江浙等地区用于治疗热淋、小儿疳积、消化不良、咽喉肿痛和风湿痹痛等有悠久历史[6]。笔者前期研究发现渐尖毛蕨总黄酮部位具有减轻胰岛素抵抗和改善长期高血糖诱导的小鼠肾损伤的功能,而CAF成分很可能为其药效物质基础。本研究发现,CAF能有效改善DKD模型大鼠的肾胶原沉积和基底膜增厚,且具有抑制肾EMT过程的作用。其可能的分子机制与降低肾组织中β-catenin表达和抑制GSK-3β磷酸化失活有关。
本研究为传统民间药物渐尖毛蕨在DKD中的应用奠定了理论基础,更深入的药理作用机制和完善的CAF剂量-时间-药效学关系研究将在本课题组下一步的工作中继续完善。
[1] Zhang L,Zhang J,Liu X,et al.Tribbles 3 regulates the fibrosis cytokine TGF-β1 through ERK1/2-MAPK signaling pathway in diabetic nephropathy[J].J Immunol Res,2014,doi:10.1155/2014/240396.
[2] 杨文超,顾正位,路其康,等.复方葛根片对糖尿病肾病模型大鼠肾组织的保护作用[J].中国药房,2015,26(34):4807-4809.
[3] Tian Y,Lv G,Yang Y,et al.Effects of vitamin D on renal fibrosis in diabetic nephropathy model rats[J].Int J Clin Exp Pathol,2014,7(6):3028-3037.
[4] Lv M,Chen Z,Hu G,et al.Therapeutic strategies of diabetic nephropathy:recent progress and future perspectives [J].Drug Discov Today,2015,20(3):332-346.
[5]Ma J,Wu H,Zhao CY,et al.Requirement for TLR2 in the development of albuminuria,inflammation and fibrosis in experimental diabetic nephropathy[J].Int J Clin Exp Pathol,2014,7(2):481-495.
[6] 刘林卉,董成龙,苏东明.二甲双胍对糖尿病肾病小鼠肾脏保护作用[J].江苏医药,2016,42(5):504-506.
[7] 雷湘,杨娴,陈镜楼,等.渐尖毛蕨黄酮对3T3-L1前脂肪细胞增殖与分化的影响[J].中国医院药学杂志,2013,33(10):775-778.
[8] Chen JL,Lei YF,Liu YJ,et al.Extract of cyclosorus acuminatus attenuates diabetic nephropathy in mice via modifying peroxisome proliferators activated receptor signaling pathway[J].Food Chem,2011,128(3):659-666.
[9] Zhang S,Yang J,Li H,et al.Skimmin,a coumarin,suppresses the streptozotocin-induced diabetic nephropathy in wistar rats[J].Eur J Pharmacol,2012,692(1/2/3):78-83.
[10] Ahad A,Mujeeb M,Ahsan H,et al.Prophylactic effect of baicalein against renal dysfunction in type 2 diabetic rats [J].Biochimie,2014,doi:10.1016/j.biochi.2014.08.006.
[11] Kothari AN,Mi Z,Zapf M,et al.Novel clinical therapeutics targeting the epithelial to mesenchymal transition[J]. Clin Transl Med,2014,doi:10.1186/s40169-014-0035-0.
[12] Peixoto EB,Papadimitriou A,Teixeira DA,et al.Reduced LRP6 expression and increase in the interaction of GSK3β with p53 contribute to podocyte apoptosis in diabetes mellitus and are prevented by green tea[J].J Nutr Biochem,2015,26(4):416-430.
[13] Gonzalez DM,Medici D.Signaling mechanisms of the epithelial-mesenchymal transtition[J].Sci Signal,2015,doi:10.1126/scisignal.2005189.
[14] 常保超,陈卫东,张燕,等.白芍总苷对2型糖尿病大鼠肾组织Wnt/β-catenin信号通路表达的影响[J].中国中药杂志,2014,39(19):3829-3835.
[15] Chanet A,Milenkovic D,Manach C,et al.Citrus flavanones:what is their role in cardiovascular protection?[J]. J Agric Food Chem,2012,60(36):8809-8822.
[16] 沈伟,宋磊,李赫宇.蕨类植物黄酮类化学成分及生物活性研究进展[J].食品研究与开发,2015,36(17):186-188.
Effect of Cyslosorus acuminatus Flavonone Glycoside on Kidney Epithelial-mesenchymal Transition in Rats with Diabetic Kidney Disease
XIONG Jiajun1,CHEN Jinglou2,SONG Hongping2(1.College of Pharmacy,Hubei University of Chinese Medicine,Wuhan 430065,China;2.Dept.of Pharmacy,Pu’ai Hospital Affiliated to Tongji Medical College,Huazhong University of Science and Technology,Wuhan 430033,China)
OBJECTIVE:To investigate the effect of Cyslosorus acuminatus flavonone glycoside(CAF)on kidney epithelial-mesenchymal transition(EMT)in rats with diabetic kidney disease(DKD).METHODS:Rats were randomly divided into nor-mal group(normal saline),model group(normal saline),positive group[rosiglitazone,0.4 mg/(kg·d)],CAF high-dose and lowdose groups[12.5,25 mg/(kg·d)],10 in each group.Except for normal group,other groups were intraperitoneally injected streptozotocin(60 mg/kg)+high fat diet to induce DKD,and intragastrically administrated related medicines in 13-16 weeks.After the experimental period,fasting blood glucose level and serum creatinine(Scr),blood urea nitrogen(BUN)contents of rats were detected,collagen deposition and basement membrane thickening in kidney tissue were observed.Immunohistochemistry was used to detect α-smooth muscle actin(α-SMA),fibronectin,epithelial cadherin(E-cadherin)expressions in kidney tissue,and Western blot was used to determine the glycogen synthase kinase 3β(GSK-3β),phosphorylated GSK-3β(p-GSK-3β),β-catenin expressions in kidney tissue.RESULTS:Compared with normal group,fasting blood glucose level,Scr and BUN contents in model group were significantly increased(P<0.01);kidney tissue showed obvious collagen deposition and basement membrane thickening;the α-SMA,fibronectin,β-catenin expression levels and GSK-3β phosphorylation degree in kidney tissue were significantly increased(P<0.01),while E-cadherin expression levels was significantly decreased(P<0.01).Compared with model group,fasting blood glucose level,Scr and BUN contents in each administration group were significantly reduced(P<0.05 or P<0.01);collagen deposition and basement membrane thickening in kidney tissue were significantly improved;the α-SMA,fibronectin,and β-catenin expression levels and GSK-3β phosphorylation degree in kidney tissue were significantly decreased(P<0.05 or P<0.01),while E-cadherin expression levels in positive group and CAF high-dose group were significantly increased(P<0.01).CONCLUSIONS:CAF can inhibit the kidney EMT of rats with DKD,the molecular mechanism may be associated with downregulating β-catenin expression and inhibiting GSK-3β phosphorylation inactivation.
Cyslosorus acuminatus;Flavonone glycoside;Diabetic kidney disease;Epithelial-mesenchymal transition;Epithelial cadherin;Glycogen synthase kinase 3β;Rats
R285
A
1001-0408(2017)22-3052-05
2017-01-16
2017-04-11)
(编辑:林 静)
湖北省卫生计生科研基金(No.WJ2017M189);武汉市科学技术计划项目(No.2015071704011629)
*硕士研究生。研究方向:药物新剂型、生物药剂学。电话:027-68831991。E-mail:shanghuchuan@126.com
#通信作者:主管药师,博士。研究方向:泌尿生殖系统药学研究。电话:027-68831991。E-mail:jinglouchen@126.com
DOI10.6039/j.issn.1001-0408.2017.22.08
