茯苓皮水提物对四氯化碳诱导大鼠肝纤维化的改善作用Δ
2017-09-03蒋征奎王学方郑州大学附属肿瘤医院药学部郑州450000河南省植物天然产物开发工程技术研究中心郑州45000
蒋征奎,王学方(1.郑州大学附属肿瘤医院药学部,郑州 450000;.河南省植物天然产物开发工程技术研究中心,郑州 45000)
茯苓皮水提物对四氯化碳诱导大鼠肝纤维化的改善作用Δ
蒋征奎1*,王学方2(1.郑州大学附属肿瘤医院药学部,郑州 450000;2.河南省植物天然产物开发工程技术研究中心,郑州 450002)
目的:研究茯苓皮水提物(PWE)对四氯化碳(CCl4)诱导大鼠肝纤维化的改善作用。方法:将84只大鼠随机分为空白对照组、溶剂对照组、模型对照组、阳性对照组(复方鳖甲软肝片,0.75 g/kg)和PWE低、中、高剂量组(0.9、1.8、3.6 g/kg,以生药计),每组12只。除空白对照组与溶剂对照组(ip植物油)外,其余各组大鼠均ip CCl4-植物油溶液复制肝纤维化模型。造模成功后,各给药组大鼠ig相应药物,其余3组大鼠ig等体积生理盐水,每天1次,连续4周。给药结束后,采用酶联免疫吸附法检测大鼠血清中天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)、层黏连蛋白(LN)、透明质酸(HA)、羟脯氨酸(Hyp)和肝组织中还原性谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、丙二醛(MDA)的含量,苏木精-伊红染色和Masson染色观察大鼠肝组织病理变化。结果:与空白对照组比较,溶剂对照组大鼠各指标均无明显变化(P>0.05);模型对照组大鼠血清中AST、ALT、LN、HA、Hyp含量和肝组织中MDA含量显著升高(P<0.05),肝组织中GSH、SOD含量显著降低(P<0.05),且肝组织发生明显纤维化病变。与模型对照组比较,PWE中、高剂量组大鼠血清中AST、ALT、LN、HA、Hyp含量和肝组织中MDA含量显著降低(P<0.05),肝组织中GSH、SOD含量显著升高(P<0.05),肝组织纤维化程度明显减轻。结论:PWE对CCl4诱导的大鼠肝纤维化具有良好的改善作用,其机制可能与抑制机体脂质过氧化有关。
茯苓皮;水提物;肝纤维化;脂质过氧化;大鼠
茯苓皮为多孔菌科真菌茯苓[Poria cocos(Schw.) Wolf]菌核的外皮,味甘、淡,性平,具有利水消肿的功效,用于治疗水肿、小便不利等[1]。茯苓皮总三萜和多糖为茯苓皮中主要的化学成分[2]。现代药理研究表明,茯苓皮三萜类成分和多糖成分具有较好的抗氧化活性[3],茯苓皮总三萜对高脂血症小鼠具有明显的降血脂作用[4],茯苓皮乙醇提取物具有显著的利尿作用[5]。然而,茯苓皮在我国作为加工“茯苓片”“茯苓块”时削下的外皮临床上用量很少,在日本加工白茯苓时一般作为下脚料废弃。有文献报道,茯苓皮中的三萜类成分含量远高于茯苓菌核[6]。张先淑等[7]研究表明,茯苓三萜对四氯化碳(CCl4)致小鼠肝损伤有明显的治疗作用,但未见茯苓皮提取物对肝纤维化作用的实验研究。
肝纤维化是多种慢性肝病向肝硬化发展的中间病理阶段,是威胁人类健康的常见疾病,也是原发性肝癌发病的危险因素之一。迄今为止,虽然治疗肝纤维化的药物繁多,但治疗效果并不理想,因而中药治疗成为研究和临床治疗的热点[8-9]。本研究用CCl4诱导大鼠发生肝纤维化,观察茯苓皮水提物对大鼠肝纤维化的改善用,为其临床应用提供实验基础,也为茯苓资源的综合开发利用提供科学依据。
1 材料
1.1 仪器
Thermo 3001 Varioskan Flash全自动多功能酶标仪(美国Thermo公司);AU-2700全自动生化分析仪、BX-50显微镜(日本Olympus公司);UV-2409紫外分光光度计(北京市永光明医疗仪器厂)。
1.2 药品与试剂
复方鳖甲软肝片(内蒙古福瑞医疗科技有限公司,批号:20150112,规格:0.5 g/片);丙氨酸转氨酶(ALT,批号:20140303)、天冬氨酸转氨酶(AST,批号:20140303)、还原型谷胱甘肽(GSH,批号:20140512)、丙二醛(MDA,批号:201400722)、超氧化物歧化酶(SOD,批号:201400722)、羟脯氨酸(Hyp,批号:20140724)酶联免疫吸附(ELISA)试剂盒均购自南京建成生物工程研究所;透明质酸(HA,批号:14070303)、层黏连蛋白(LN,批号:14070304)ELISA试剂盒均购自上海拜沃生物科技有限公司;CCl4(分析纯,天津市光复科技发展有限公司)。
1.3 动物
SPF级健康Wistar大鼠84只,♂,体质量180~220 g,购自郑州大学实验动物中心,许可证号:SCXK(豫)-2010-0002,动物合格证号:41003100001553。
1.4 药材
茯苓皮药材购自河南瑞龙制药股份有限公司,由河南大学药学院张保国教授鉴定为多孔菌科真菌茯苓[Poria cocos(Schw.)Wolf]菌核的外皮。
2 方法
2.1 药物的制备
取茯苓皮药材1 500 g,粉碎,加10倍量水,煎煮3次,每次1 h,合并3次煎液,过滤,滤液减压浓缩至干,得茯苓皮水提物(PWE)。采用比色法测得PWE中多糖的含量为32.9%,临用前用生理盐水配成含药混悬液使用。
2.2 分组、造模与给药
将84只大鼠随机分成7组,分别为空白对照组、溶剂对照组、模型对照组、阳性对照组(复方鳖甲软肝片,0.75 g/kg)和PWE低、中、高剂量组(0.9、1.8、3.6 g/kg,以生药计)。其中,空白对照组大鼠以常规鼠饲料喂养,自由饮水;溶剂对照组大鼠ip植物油溶液(1 mL/kg),每周2次(周一上午和周四晚上),连续4周;其余5组大鼠均ip 40%CCl4-植物油溶液(1 mL/kg)造模,每周2次(周一上午和周四晚上),连续4周,各组大鼠均在相同条件下饲养。造模4周后,各给药组大鼠每天空腹ig相应药物1次(10 mL/kg),空白对照组、溶剂对照组和模型对照组大鼠ig等体积生理盐水,连续4周,并于给药同时继续上述造模处理。
2.3 指标检测
各组大鼠于末次给药后禁食不禁水1 d,然后于眼静脉丛取血,并将其断颈处死,分离血清在-20℃条件下保存。按照ELISA试剂盒说明书操作检测血清中AST、ALT、LN、HA和Hyp的含量;用10%的甲醛溶液将肝右叶固定,用于病理切片苏木精-伊红(HE)染色与Masson染色分析;将剩余肝组织置于液氮中保存,匀浆后按照ELISA试剂盒说明书操作,检测肝组织中GSH、SOD和MDA的含量。
2.4 统计学方法
3 结果
3.1 PWE对肝纤维化大鼠血清中AST、ALT的影响
与空白对照组比较,溶剂对照组大鼠血清中AST、ALT含量差异无统计学意义(P>0.05);模型对照组大鼠血清中AST、ALT含量显著升高(P<0.05)。与模型对照组比较,PWE低剂量组大鼠血清中AST、ALT含量略有降低,但差异无统计学意义(P>0.05);PWE中、高剂量组大鼠血清中AST、ALT含量显著降低(P<0.05),结果详见表1。
表1 各组大鼠血清中AST、ALT含量测定结果(±s,n=12)Tab 1 Determination results of ALT,AST contents inserum of rats in each group(±s,n=12)

表1 各组大鼠血清中AST、ALT含量测定结果(±s,n=12)Tab 1 Determination results of ALT,AST contents inserum of rats in each group(±s,n=12)
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.model control group,#P<0.05
组别空白对照组溶剂对照组模型对照组阳性对照组PWE低剂量组PWE中剂量组PWE高剂量组ALT,U/L 51.23±20.38 52.24±16.58 258.47±36.72*92.49±30.73#220.32±50.77 147.62±25.30#96.45±13.64#剂量,g/kg 0.75 0.9 1.8 3.6 AST,U/L 55.39±19.64 55.54±9.98 249.65±16.16*89.33±19.51#207.56±10.74 158.12±6.72#94.28±6.67#
3.2PWE对肝纤维化大鼠血清中LN、HA、Hyp含量的影响
与空白对照组比较,溶剂对照组大鼠血清中LN、HA、Hyp含量差异无统计学意义(P>0.05);模型对照组大鼠血清中LN、HA、Hyp含量显著升高(P<0.05)。与模型对照组比较,阳性对照组和PWE中、高剂量组大鼠血清中LN、HA、Hyp含量显著降低(P<0.05),结果见表2。
表2 各组大鼠血清中LN、HA、Hyp含量测定结果(±s,n=12,μg/L)Tab 2 Determination results of LN,HA,Hyp contents in serum of rats in each group(±s,n=12,μg/L)

表2 各组大鼠血清中LN、HA、Hyp含量测定结果(±s,n=12,μg/L)Tab 2 Determination results of LN,HA,Hyp contents in serum of rats in each group(±s,n=12,μg/L)
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05Note:vs.blank control group,*P<0.05;vs.model control group,#P<0.05
组别空白对照组溶剂对照组模型对照组阳性对照组PWE低剂量组PWE中剂量组PWE高剂量组Hyp 14.71±0.27 15.10±0.43 20.82±0.52*16.96±0.81#19.93±0.14 17.98±0.34#16.61±0.87#剂量,g/kg 0.75 0.9 1.8 3.6 LN 76.85±3.58 76.99±3.59 115.13±16.34*80.78±8.60#112.79±17.32 91.29±14.62#84.03±11.10#HA 134.51±19.45 136.12±34.03 331.84±34.58*263.24±30.11#308.47±47.46 242.39±31.89#179.78±28.40#
3.3 PWE对肝纤维化大鼠肝组织中GSH、SOD、MDA含量的影响
与空白对照组比较,溶剂对照组大鼠肝组织中GSH、SOD、MDA含量差异无统计学意义(P>0.05);模型对照组大鼠肝组织中GSH、SOD含量显著降低(P<0.05),MDA含量显著升高(P<0.05)。与模型对照组比较,阳性对照组和PWE中、高剂量组大鼠肝组织中GSH、SOD含量显著升高(P<0.05),MDA含量显著降低(P<0.05),结果见表3。
表3 各组大鼠肝组织中GSH、SOD、MDA含量测定结果(±s,n=12)Tab 3 Determination results of GSH,SOD,MDA content in liver tissue of rats in each group(±s,n=12)

表3 各组大鼠肝组织中GSH、SOD、MDA含量测定结果(±s,n=12)Tab 3 Determination results of GSH,SOD,MDA content in liver tissue of rats in each group(±s,n=12)
注:与空白对照组比较,*P<0.05;与模型对照组比较,#P<0.05 Note:vs.blank control group,*P<0.05;vs.model control group,#P<0.05
组别空白对照组溶剂对照组模型对照组阳性对照组PWE低剂量组PWE中剂量组PWE高剂量组MDA,nmol/g prot 1.29±0.29 1.19±0.32 2.70±0.41*2.13±0.47#2.46±0.39 1.92±0.25#1.52±0.63#剂量,g/kg 0.75 0.9 1.8 3.6 GSH,mg/g prot 2.71±0.22 2.62±0.41 1.68±0.23*2.39±0.42#1.76±0.51 1.93±0.21#2.27±0.38#SOD,U/g prot 250.69±25.56 244.87±17.76 149.18±11.39*141.89±15.70 153.77±22.83 190.18±35.46#217.09±34.56#
3.4 PWE对肝纤维化大鼠肝组织病变的影响
3.4.1 HE染色 空白对照组与溶剂对照组大鼠肝细胞结构正常,无炎症细胞浸润,肝索排列整齐,肝小叶结构完整。模型对照组大鼠肝组织发生明显炎症变化,可见大量脂肪变性与炎症细胞浸润,另有水样变性甚至气球样变化,可见散在的不同程度的坏死肝细胞,肝的正常结构遭到破坏。阳性对照组和PWE各剂量组大鼠肝组织病理损伤程度均有不同程度减轻的趋势,且以PWE高剂量组效果最好,细胞炎症明显减轻、脂肪变性空泡明显减少,结果见图1。
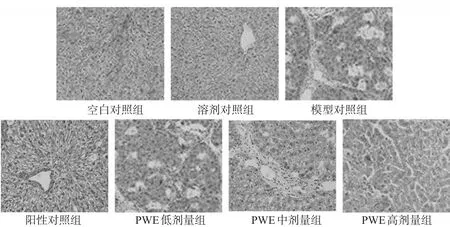
图1 各组大鼠肝组织HE染色结果(×200)Fig 1 Results of HE staining in liver tissue of rats in each group(×200)
3.4.2 Masson染色 空白对照组大鼠肝组织未见纤维增生,仅在中央静脉及肝窦内有轻微的蓝色胶原纤维。溶剂对照组大鼠肝组织未见纤维增生。模型对照组大鼠汇管区和小叶间有大量粗大增生的胶原纤维,切片中有大量假小叶形成,胶原纤维呈宽带状,互相连接,细胞变性坏死明显,偏光显微镜下区分可见红、黄色成分居多。阳性对照组和PWE各剂量组大鼠肝组织胶原纤维均有不同程度减轻,肝小叶结构也有所恢复,结缔组织增生也有不同程度减少,且以PWE高剂量组效果最好,结果见图2。
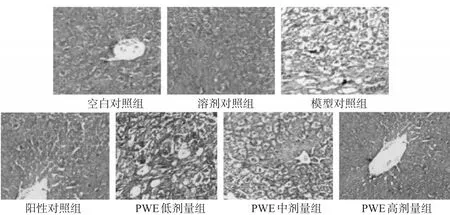
图2 各组大鼠肝组织Masson染色结果(×200)Fig 2 Results of Masson staining in liver tissue of rats in each group(×200)
4 讨论
肝纤维化是继发于多种物理、化学因素引起的肝炎症或损伤后组织修复过程中的代偿反应,属于可逆病变[10]。CCl4诱发的化学性肝纤维化动物模型是常用的经典模型,被广泛应用于防治肝纤维化药物筛选及其作用机制的研究。本研究选用的阳性药复方鳖甲软肝片为治疗慢性乙型肝炎纤维化以及早期肝硬化属“瘀血阻络、气血亏虚兼热毒未尽”的有效中成药,已被纳入我国肝纤维化中西医结合诊疗指南[11]。
在本研究造模期间,模型对照组大鼠的行为习惯均异于空白对照组,表现出行动迟缓、毛发散乱、厌食少动等行为,而用药组大鼠则表现得相对正常。
肝功能的改变可反映肝的炎症和肝细胞变性、坏死的程度。当肝受到损害时,肝细胞的变性、坏死会导致细胞内容物的溢出,通过检测血清或者血浆中相关酶含量或活性变化可对肝细胞的受损程度进行评价,目前常用的检测指标有AST、ALT等[12]。肝纤维化的实质是由于胶原和细胞外基质(ECM)的合成与降解失衡,导致ECM在肝内过量沉积。而参与肝纤维化形成的ECM成分包括胶原蛋白、非胶原性糖蛋白和蛋白多糖三大类。其中,Hyp为胶原蛋白所特有的氨基酸成分,其含量可反映胶原代谢的变化情况,与肝纤维化程度相平行;HA是构成ECM中蛋白多糖的主要成分;LN是一种重要的结构糖蛋白,HA和LN对慢性肝损伤和肝纤维化的诊断价值已得到普遍认可[13]。本研究结果显示,模型对照组大鼠血清中AST、ALT、LN、HA、Hyp含量均明显增加,肝组织损伤较重,提示CCl4诱发的大鼠肝纤维化模型复制成功。而给予PWE后,可显著降低由CCl4所致的大鼠血清中AST、ALT、LN、HA、Hyp含量的增加,提示PWE具有抑制肝损伤的作用;且病理切片也显示PWE可抑制肝胶原纤维的合成和沉积,对CCl4诱导的大鼠肝纤维化具有良好的防治作用。
有研究表明,CCl4诱导的肝纤维化模型大鼠存在明确的脂质过氧化损伤反应[14]。SOD是一种超氧离子清除剂,可抑制自由基启动的脂质过氧化反应;MDA是脂质过氧化的最终产物,其含量高低反映了组织过氧化损伤的程度;GSH是重要的抗氧化剂和自由基清除剂,在拮抗氧化性毒物中发挥着重要作用,其不仅可防止肝细胞损伤,还可增强肝细胞膜对氧自由基的耐受性,从而提高机体的抗氧化能力。本研究结果显示,模型对照组大鼠肝组织中GSH、SOD含量显著减少,MDA含量显著增加;给予PWE后,肝纤维化模型大鼠肝组织中GSH、SOD含量显著增加,MDA含量显著减少,提示PWE具有抗氧化作用。
综上所述,PWE对CCl4诱导的大鼠肝纤维化具有良好的改善作用,其机制可能与抑制机体的脂质过氧化有关。
[1] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:240-241.
[2] 张怡莎.茯苓皮化学成分的研究[J].中外医学研究,2013,11(26):144.
[3] 陈红梅.茯苓皮多糖和三萜类物质提取及其抗氧化活性研究[J].生物学杂志,2015,32(2):48-52.
[4] 毛跟年,张诗韵,付超,等.茯苓皮总三萜的降血脂活性研究[J].陕西科技大学学报,2015,33(3):130-134.
[5] 田婷,陈华,殷璐,等.茯苓和茯苓皮水和乙醇提取物的利尿作用及其活性成分的分离鉴定[J].中国药理学与毒理学杂志,2014,28(1):57-62.
[6] 冯亚龙,赵英永,丁凡,等.茯苓皮的化学成分及药理研究进展:Ⅰ[J].中国中药杂志,2013,38(7):1098-1102.
[7] 张先淑,饶志刚,胡先明,等.茯苓总三萜对小鼠肝损伤的预防作用[J].食品科学,2012,33(15):270-273.
[8] 李荣华,王航宇,林友胜,等.锁阳提取物对肝纤维化模型大鼠的改善作用及其机制研究[J].中国药房,2016,27(28):3903-3906.
[9] 许珂玉,肖建英.五味子粗多糖提取物对大鼠肝纤维化的防治作用研究[J].中国药房,2011,22(19):1743-1745.
[10] Demiroren K,Dogan Y,Kocamaz H,et al.Protective effects of L-carnitine,N-acetylcysteine and genistein in an experimental model of liver fibrosis[J].Clin Res Hepatol Gastroenterol,2014,38(1):63-72.
[11] 夏晖,张宁,周双男,等.复方鳖甲软肝片抗纤维化研究进展[J].医药导报,2013,32(4):500-503.
[12] 王蓉,王媛媛,王彧杰.丹酚酸A对四氯化碳诱导的大鼠肝纤维化的防治作用及机制研究[J].中南药学,2014,12(11):1083-1087.
[13] 黄艳,黄成,李俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖、凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[14] 吴芙蓉,姜玲,何晓丽,等.橙皮苷对化学性肝纤维化大鼠的保护作用[J].中药材,2015,38(11):2390-2393.
Improvement Effect of Poria cocos Peels Water Extract on Liver Fibrosis in Rats Induced by Carbon Tetrachloride
JIANG Zhengkui1,WANG Xuefang2(1.Dept.of Pharmacy,Affiliated Cancer Hospital of Zhengzhou University,Zhengzhou 450000,China;2.Henan Plant Natural Products Development Engineering Technology Center,Zhengzhou 450002,China)
OBJECTIVE:To study the improvement effect of Poria cocos peels water extract(PWE)on liver fibrosis in rats induced by carbon tetrachloride(CCl4).METHODS:84 rats were randomly divided into blank control group,solvent control group,model control group,positive control group(Compound biejia ruangan tablet,0.75 g/kg),PWE low-dose,medium-dose,high-dose groups(0.9,1.8,3.6 g/kg,calculated by crude drugs),12 in each group.Except for blank control group and solvent control group(ip vegetable oil),other groups
CCl4-vegetable oil solution to reduce liver fibrosis model,ip.After modeling,each administration group received related medicines,ig,other 3 groups received equal volume of normal saline,once a day,for 4 weeks.After administration,enzyme-linked immunosorbent assay was used to detect the aspartate aminotransferase(AST),alanine aminotransferase(ALT),laminin(LN),hyaluronic acid(HA),hydroxyproline(Hyp)contents in serum and reduced glutathione(GSH),superoxide dismutase(SOD),malondialdehyde(MDA)contents in liver tissue of rats;HE staining and Masson staining were adopted to observe the pathological changes of liver tissue.RESULTS:Compared with blank control group,indexes of rats in solvent control group had no obvious changes(P>0.05).AST,ALT,LN,HA,Hyp contents in serum and MDA content in liver tissue in model control group were significantly increased(P<0.05);GSH,SOD contents in liver tissue were significantly reduced(P<0.05);and liver tissue showed obvious fibrosis lesions.Compared with model control group,AST,ALT,LN,HA,Hyp contents in serum and MDA content in liver tissue in PWE medium-dose,high-dose groups were significantly reduced(P<0.05);GSH,SOD contents in liver tissue were significantly increased(P<0.05);fibrosis degree of liver tissue was obviously relieved.CONCLUSIONS:PWE shows good improvement effect on liver fibrosis of rats induced by CCl4,which may be related to inhibiting the lipid peroxidation.
Poria cocos peels;Water extract;Liver fibrosis;Lipid peroxidation;Rats
R285.5
A
1001-0408(2017)22-3065-04
2017-02-07
2017-04-11)
(编辑:林 静)
河南省科技攻关项目(No.152102110115)
*主管药师,硕士。研究方向:中药质量标准与新药开发。电话:0371-65587172。E-mail:kui3456@163.com
DOI10.6039/j.issn.1001-0408.2017.22.11
