液态发酵法合成雪峰虫草活性成分的初步研究Δ
2017-09-03张小娟鲁耀邦唐映红崔培梧湖南中医药大学药学院长沙410208湖南中医药大学中药药性与药效实验室长沙410208湖南中医药大学中药民族药物创新与发展实验室长沙410208
刘 莎,张小娟,王 炜,陈 林,廖 彦,鲁耀邦,唐映红,崔培梧#(1.湖南中医药大学药学院,长沙 410208;2.湖南中医药大学中药药性与药效实验室,长沙 410208;3.湖南中医药大学中药民族药物创新与发展实验室,长沙 410208)
液态发酵法合成雪峰虫草活性成分的初步研究Δ
刘 莎1,2*,张小娟1,2,王 炜1,3,陈 林1,2,廖 彦1,2,鲁耀邦1,2,唐映红1,2,崔培梧1,2#(1.湖南中医药大学药学院,长沙 410208;2.湖南中医药大学中药药性与药效实验室,长沙 410208;3.湖南中医药大学中药民族药物创新与发展实验室,长沙 410208)
目的:探索液态发酵法合成雪峰虫草活性物质的基础工艺,为雪峰虫草资源的综合开发提供必要技术支持。方法:利用液态发酵技术对雪峰虫草菌丝体进行培养,并通过培养基组成和培养条件控制来实现活性物质的高效合成。以雪峰虫草菌为出发菌株,分别考察不同碳源(蔗糖、葡萄糖和可溶性淀粉)、不同氮源(蛋白胨、酵母浸粉、酵母浸膏、硝酸钠、硝酸钾和尿素)、不同维生素B(维生素B1和复合维生素B)和不同初始pH(pH为4、5、6、7、8、9)对雪峰虫草菌丝生长和胞外多糖、胞内多糖、虫草酸、胞内三萜合成的影响,进而筛选最佳培养基成分。结果:最佳碳源为蔗糖,最佳氮源为酵母浸粉,最佳维生素B为维生素B1,最佳初始pH为8。在碳源为蔗糖、氮源为酵母浸粉、添加0.1 g/L维生素B1和初始pH为8时可得到较高的生物量和代谢产物积累水平。结论:雪峰虫草可在液态发酵体系高效积累代谢产物;可通过发酵过程优化控制,实现该菌株细胞生长和活性代谢产物合成的优化。
雪峰虫草;活性成分;液态发酵;生物合成
冬虫夏草[Cordyceps sinensis(Berk.)Sacc.]为我国传统名贵滋补中药,已有500余年的应用历史,具有调节免疫、抗炎、抗氧化、抗肿瘤等活性[1-3]。但由于连年掠夺式采挖和生态环境的退化,我国虫草资源日趋匮乏。因此,发掘冬虫夏草替代品成为解决现有虫草资源危机的主要手段。雪峰虫草(Ophiocordyceps xuefengensis sp. nov)是线虫草菌科线虫草菌属的一个新种,也是目前全球报道个体最大的虫草,因产于雪峰山脉,故名“雪峰虫草”[4]。雪峰虫草作为瑶药在唐朝就有记载,具有补肺益肾、止咳化痰之功效,配伍后对高血压、病毒性肝炎、类风湿性关节炎、痛风等症亦有良好疗效[5-6]。真菌分类学和分子生物学鉴定结果显示,雪峰虫草与冬虫夏草亲缘关系最近,且含有与冬虫夏草相同的腺苷、虫草素、虫草酸、多糖、甾醇等活性成分[6-8],这意味着雪峰虫草具有开发成冬虫夏草替代品的独特潜质。
药用菌物的传统人工栽培手段存在生长周期长、易受自然环境影响、产品质量稳定性差等不足,而药用菌物的发酵培养技术却可明显改善上述不足,并已被广泛应用于冬虫夏草[9]、蛹虫草[10]、灵芝[11]、茯苓[12]等名贵菌物活性成分的高效合成。因此,探索液态发酵体系雪峰虫草活性物质的合成规律,对于其目标代谢产物的定向合成、促进雪峰虫草的高效综合开发具有重要意义。
1 材料
1.1 仪器
LB-85A双层恒温振荡培养箱(金坛市博朗仪器制造有限公司);MJX-250BX霉菌培养箱、DGF-4AB立式电热鼓风干燥箱(天津市泰斯特仪器有限公司);SW-CJ-2FD超净工作台(苏州净化设备有限公司);YXQ-LS-50SII立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂);UV-5100B紫外可见分光光度计(上海元析仪器有限公司);PH1MV pH计(上海理达仪器厂);GL-21M立式高速冷冻离心机(长沙平凡仪器仪表有限公司);JY92-IIDN超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.2 菌株
Ophiocordyceps xuefengensis CCTCC M 2015777,由湖南师范大学生命科学学院真菌研究室陈作红教授分离、鉴定为雪峰虫草菌株,并保藏于中国典型培养物保藏中心。
1.3 药品与试剂
熊果酸对照品(中国食品药品检定研究院,批号:110742-201220,纯度:≥99%);维生素B1片(华中药业股份有限公司,批号:20150814,规格:10 mg/片);复合维生素B片(威海南波湾生物技术有限公司,批号:20120419,规格:500 mg/片);甘露醇对照品(上海源叶生物科技有限公司,批号:J14D6R7494,纯度:≥99%);葡萄糖、蔗糖、乙酸铵及其他试剂均为国产分析纯。
2 方法
2.1 菌种活化
取保藏的雪峰虫草菌种,转接至马铃薯葡萄糖琼脂平板上,在28℃下培养10 d,然后转接至不含琼脂的马铃薯葡萄糖培养基中,装液量为100 mL/250 mL,于28℃、180 r/min振荡培养6 d,作为二级菌种。
2.2 培养基的单因素筛选
2.2.1 碳源筛选 以10 g/L蛋白胨、0.5 g/L磷酸二氢钾、0.5 g/L七水硫酸镁为基础培养基,分别加入30 g/L的葡萄糖、蔗糖、淀粉,装液量为100 mL/250 mL,灭菌后接种5%种子培养液,于28℃、180 r/min振荡培养6 d,分析菌丝生长和代谢产物的合成情况。
2.2.2 氮源筛选 以30 g/L葡萄糖、0.5 g/L磷酸二氢钾、0.5 g/L七水硫酸镁为基础培养基,分别加入10 g/L的酵母浸粉、酵母浸膏、蛋白胨、硝酸钠、硝酸钾、尿素,其他操作方法同“2.2.1”项下碳源筛选部分。
2.2.3 生长因子筛选 以30 g/L葡萄糖、10 g/L蛋白胨、0.5 g/L磷酸二氢钾、0.5 g/L七水硫酸镁为基础培养基,分别加入0.1 g/L的维生素B1、复合维生素B,并以不加维生素为空白对照组,其他操作方法同“2.2.1”项下碳源筛选部分。
2.2.4 培养基初始pH的筛选 以30 g/L葡萄糖、10 g/L蛋白胨、0.5 g/L磷酸二氢钾、0.5 g/L七水硫酸镁为基础培养基,用1 mol/L氯化氢或1 mol/L氢氧化钠将其初始pH值调为4、5、6、7、8、9,其他操作方法同“2.2.1”项下碳源筛选部分。
2.3 相关分析方法
2.3.1 生物量的测定 培养结束后取发酵液50 mL,过滤后用蒸馏水洗涤3次,然后于60℃烘箱烘至恒质量,分析天平称质量后并将单位换算为g/L。
2.3.2 胞外多糖的测定 收集除去菌体的发酵液,经30%(V/V)乙醇沉淀以去除杂蛋白,向上清液继续添加乙醇至70%(V/V),剧烈搅拌后在4℃冰箱静置过夜,于4 500×g离心10 min。收集沉淀,并向沉淀中加4倍量95%乙醇洗涤3次,于60℃烘干,即得胞外粗多糖。采用Sevage法对粗多糖进行纯化,然后采用苯酚-硫酸法[12-13]测定其含量。
2.3.3 胞内多糖的测定 收集50 mL发酵液的菌丝体,并在60℃烘箱烘至恒质量,然后于研钵中充分研磨成精细粉末,加入100 mL蒸馏水后于沸水浴中回流提取3次,每次提取1 h。趁热用布氏漏斗过滤并合并滤液,用旋转蒸发仪减压蒸馏浓缩至约10 mL,继续添加乙醇至70%(V/V),剧烈搅拌后在4℃冰箱静置过夜,于 4 500×g离心10 min。收集沉淀,并向沉淀中加4倍量95%乙醇洗涤3次,于60℃烘干,即得胞内粗多糖。采用Sevage法对粗多糖进行纯化,然后采用苯酚-硫酸法[12-13]测定其含量。
2.3.4 虫草酸的测定 采用高碘酸钠比色法测定[14]。将干燥后雪峰虫草菌丝体于研钵中充分研磨成精细粉末,加入一定体积蒸馏水后于超声波细胞粉碎机中粉碎20 min(冰浴,功率500 W,工作10 s,停留10 s),然后于4 500×g离心10 min。收集上清液,并作适量稀释后取1 mL稀释液,加入1 mL高碘酸钠试液后,室温放置10 min。加2 mL 0.1%鼠李糖,再加4 mL新配制的纳什试剂,53℃水浴15 min,用分光光度计在420 nm波长处测吸光度,按回归方程计算虫草酸含量。
2.3.5 胞内三萜的测定 采用香草醛-高氯酸显色法[15]测定。精密称取雪峰虫草干菌体粉末0.03 g,加入5 mL甲醇,水浴80℃提取2 h,4 500×g离心10 min。精密吸取上清液1 mL,水浴加热挥干,分别加入5%香草醛-冰乙酸溶液0.4 mL和高氯酸1.0 mL,于60℃水浴加热15 min后移入冰水浴中,再加入冰乙酸5.0 mL,摇匀后用分光光度计在548 nm波长处测吸光度,按回归方程计算胞内三萜含量。
2.4 统计学方法
3 结果
3.1 不同碳源对雪峰虫草菌丝生长和代谢产物合成的影响
碳源是细胞生长和代谢产物合成所需碳元素骨架的主要来源,菌丝体在代谢过程中往往会依据碳源的类型作出相应的调整,并有不同的代谢产物合成规律[16]。为寻找最优碳源,本研究考察了蔗糖、葡萄糖和可溶性淀粉分别作为碳源时雪峰虫草的代谢特征,结果见图1。
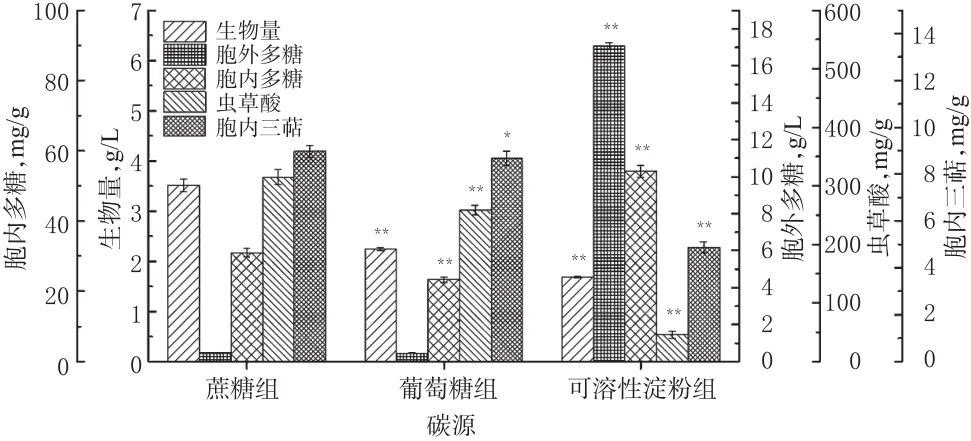
图1 不同碳源对雪峰虫草菌丝生长和代谢产物合成的影响(±s,n=3)Fig 1 Effects of different carbon sources on the mycelial growth and metabolites synthesis of O.xuefengensis(±s,n=3)
由图1可知,以蔗糖为碳源时,雪峰虫草的生物量最高,含量为(3.51±0.12)g/L,且同时可获得最高含量的虫草酸和胞内三萜,分别为(314.96±13.31)mg/g和(8.97±0.24)mg/g,这些指标与葡萄糖组和可溶性淀粉组比较差异均有统计学意义(P<0.05或P<0.01);当以可溶性淀粉为碳源时,唯有胞外多糖和胞内多糖含量比蔗糖组高,而生物量、虫草酸和胞内三萜含量显著下降,推测为未完全消耗的淀粉对多糖分析结果产生了影响。因此,蔗糖为最佳碳源。
3.2 不同氮源对雪峰虫草菌丝生长和代谢产物合成的影响
氮源为细胞生长和产物合成的另一重要因素,按照其化学组成可分为无机氮源和有机氮源。本实验选择了蛋白胨、酵母浸粉和酵母浸膏为有机氮源,硝酸钠、硝酸钾和尿素为无机氮源,分别考察了其对雪峰虫草代谢的影响,结果见图2。
由图2可知,与蛋白胨组比较,无机氮源组除胞外多糖含量比蛋白胨组高外,其他指标均显著降低,故在后续实验过程中舍弃无机氮源。在有机氮源中,酵母浸粉组可收获最高含量的胞外多糖、胞内多糖和胞内三萜,分别为(2.20±0.03)g/L、(76.29±2.81)mg/g、(8.76± 0.40)mg/g;而酵母浸膏组可收获最高含量的生物量和虫草酸,分别为(10.83±0.47)g/L、(149.59±6.30)mg/g,均略高于酵母浸粉组的(10.25±0.32)g/L、(132.83± 5.88)mg/g,但胞外多糖、胞内多糖和胞内三萜却显著低于酵母浸粉组。因此,最佳氮源为酵母浸粉。
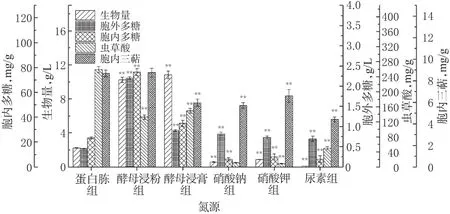
图2 不同氮源对雪峰虫草菌丝生长和代谢产物合成的影响(±s,n=3)Fig 2 Effects of different nitrogen sources on the mycelial growth and metabolites synthesis of O. xuefengensis(±s,n=3)
3.3 不同维生素B对雪峰虫草菌丝生长和代谢产物合成的影响
维生素B参与了众多次级代谢的调节,在药用菌物的发酵培养基中常用作重要的生长因子[17]。本实验考察了维生素B1和复合维生素B对雪峰虫草液态发酵过程中代谢的影响,结果见图3。
由图3可知,与空白对照组比较,维生素B1组表现出显著的菌丝生长促进和代谢产物合成促进效应;而与维生素B1组比较,复合维生素B组仅在胞内三萜方面有优势。因此,培养基中加入维生素B1可显著促进雪峰虫草代谢产物的积累。
3.4 初始pH对雪峰虫草菌丝生长和代谢产物合成的影响
培养基初始pH对细胞的酶反应速率和代谢途径调控起着关键作用。本实验分别考察了培养基初始pH为4、5、6、7、8、9时的雷峰虫草代谢特征,结果见图4。
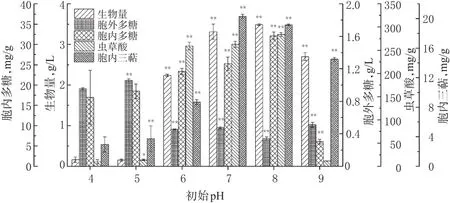
图4 不同初始pH对雪峰虫草菌丝生长和代谢产物合成的影响(±s,n=3)Fig 4 Effects of different initial pH on the mycelial growth and metabolites synthesis of O.xuefengensis(±s,n=3)
由图4可知,在pH为8时可收获最高含量的生物量、胞内多糖、虫草酸,分别为(3.49±0.02)g/L、(32.10± 0.96)mg/g、(283.85±4.12)mg/g;而pH为7时可收获最高含量的胞内三萜(20.32±0.25)mg/g,略高于pH为8时的(19.16±0.12)mg/g;pH为5时胞外多糖含量最高为(1.06±0.02)g/L,但其他指标严重降低。因此,选择pH为8时可获得最高的发酵效率。
4 讨论
药用菌物发酵技术的快速发展为实现其活性成分的生物合成提供了较好的思路,也是中医药现代化发展过程中对菌物药充分发掘的有效手段[9-11]。雪峰虫草为湖湘特色民族药物,已有500余年的应用历史,但随着地方特色民族药物资源的快速开发,雪峰虫草的野生资源被快速消耗。因此,尝试以液态发酵技术对其菌丝体进行培养,并通过培养基组成和培养条件控制来实现活性物质的高效合成,将为雪峰虫草资源的综合开发提供必要的技术支持。
本研究以雪峰虫草菌为出发菌株,从碳源、氮源、维生素B、培养基初始pH方面对其菌丝生长和胞外多糖、胞内多糖、虫草酸、胞内三萜的积累水平进行了综合分析,结果显示在碳源为蔗糖、氮源为酵母浸粉、添加0.1 g/L维生素B1和初始pH为8时可得到较高的生物量和代谢产物积累水平,说明可通过发酵过程优化控制,实现该菌株细胞生长和活性代谢产物合成的优化。从实验数据还可看出,不同代谢产物对不同的营养因子或发酵条件有不同的响应,且菌株细胞生长和产物合成往往对营养因子和培养条件也有不同的需求。因此,若以开发雪峰虫草野生资源的替代品为目标,须重视多种活性成分合成的协同调控。今后本课题组将围绕培养基及培养条件多因子的综合调控及其过程放大进行深入研究。
[1] Xie C,Xu N,Shao Y,et al.Using FT-NIR spectroscopy technique to determine arginine content in fermented Cordyceps sinensis mycelium[J].Spectrochim Acta A Mol Biomol Spectrosc,2015,doi:10.1016/j.saa.2015.05.028.
[2] Zhang X,Cui P,Li B,et al.A review on the constituents and related bioactivities of the mysterious caterpillar fungus Ophiocordyceps sinensis[J].Digital Chinese Medicine,2015,1(1):81-88.
[3] 张文娟,康帅,魏锋,等.基于ITS序列分析鉴别冬虫夏草与古尼虫草[J].药物分析杂志,2015,35(9):1551-1555.
[4] Wen T,Zhu R,Kang J,et al.Ophiocordyceps xuefengensis sp.nov.from larvae of Phassus nodus(Hepialidae)in Hunan Province,southern China[J].Phytotaxa,2013,123(1):41-50.
[5] 刘浩,镇兰萍,朱如彩,等.雪峰虫草性状和显微特征研究[J].中国中药杂志,2015,40(14):2820-2824.
[6] 郑兵,谢芳一,蔡国辉,等.雪峰虫草对DC-CIK增殖及HepG2细胞杀伤作用的实验研究[J].中国免疫学杂志,2015,31(2):189-192.
[7] 秦优,陈林,梁雪娟,等.雪峰虫草高效液相色谱指纹图谱研究[J].湖南中医药大学学报,2016,36(2):47-50.
[8] 张水寒,蔡萍,陈林,等.高效液相色谱-四级杆-飞行时间串联质谱分析雪峰虫草化学成分[J].中草药,2015,46(6):817-821.
[9] Yan J,Wang W,Wu J.Recent advances in Cordyceps sinensis polysaccharides:mycelial fermentation,isolation,structure,and bioactivities:a review[J].J Funct Foods,2014,doi:10.1016/j.jff.2013.11.024.
[10] Zhu Z,Liu X,Dong F,et al.Influence of fermentation conditions on polysaccharide production and the activities of enzymes involved in the polysaccharide synthesis of Cordyceps militaris[J].Appl Microbiol Biotechnol,2016,doi:10.1007/s00253-015-7235-4.
[11] Wei Z,Liu L,Guo X,et al.Sucrose fed-batch strategy enhanced biomass,polysaccharide,and ganoderic acids production in fermentation of Ganoderma lucidum 5.26[J]. Bioprocess Biosyst Eng,2015,doi:10.1007/s00449-015-1480-x.
[12] 崔培梧,胡亚强,钟瑜萍,等.氧载体对茯苓菌液态深层发酵的影响[J].中药材,2015,38(6):1157-1160.
[13] 冀建伟,周宇雪,刘蕾,等.厚朴花低聚糖、多糖的分离纯化及其体外抗氧化活性研究[J].中国药房,2016,27(34):4848-4851.
[14] 温鲁,尹起范,唐玉玲,等.蚕虫草与有关虫草活性成分检测比较[J].食品科学,2004,25(8):155-157.
[15] Shu S,Chen B,Zhou M,et al.De novo sequencing and transcriptome analysis of Wolfiporia cocos to reveal genes related to biosynthesis of triterpenoids[J].PLOS One,2013,8(8):e71350.
[16] Croese E,Jeremiasse AW,Marshall IP,et al.Influence of setup and carbon source on the bacterial community of biocathodes in microbial electrolysis cells[J].Enzyme Microb Technol,2014,doi:10.1016/j.enzmictec.2014.04.019.
[17] 胡朝暾,唐霞,肖震,等.茯苓发酵液中蛋白质的电泳分离与质谱分析[J].中草药,2016,47(13):2269-2276.
Primary Study on the Synthesis of Active Ingredients of Ophiocordyceps xuefengensis by Submerged Fermentation Method
LIU Sha1,2,ZHANG Xiaojuan1,2,WANG Wei1,3,CHEN Lin1,2,LIAO Yan1,2,LU Yaobang1,2,TANG Yinghong1,2,CUI Peiwu1,2(1.College of Pharmacy,Hunan University of Chinese Medicine,Changsha 410208,China;2.TCM Potency&Efficacy Laboratory,Hunan University of Chinese Medicine,Changsha 410208,China;3.TCM and Ethnomedicine Innovation&Development Laboratory,Hunan University of Chinese Medicine,Changsha 410208,China)
OBJECTIVE:To explore basic technology for synthesis of active ingredients of Ophiocordyceps xuefengensis,and provide necessary technical support for comprehensive development of O.xuefengensis sourse.METHODS:Submerged fermentation method was used to cultivate the mycelium,achieving efficient synthesis of active ingredients by controlling medium composition and cultivation conditions.Using the bacteria as starting strain,the effects of different carbon sources(sucrose,glucose and soluble starch),different nitrogen sources(peptone,yeast extract powder,yeast extract,sodium nitrate,potassium nitrate and urea),different vitamin B(vitamin B1and vitamin B complex)and different initial pH(pH was set at 4,5,6,7,8 and 9,respectively)on mycelial growth,extracellular and intracellular polysaccharide synthesis,cordycepin synthesis and intracellular triterpenoid synthesis were investigated to screen the optimal medium composition.RESULTS:The optimal carbon source,nitrogen source,vitamin B and initial pH were sucrose,yeast extract powder,vitamin B1and 8,respectively.High biomass and metabolite accumulation levels can be obtained when carbon source was sucrose,nitrogen source was yeast extract powder,adding 0.1 g/L vitamin B1with initial pH of 8.CONCLUSIONS:O.xuefengensis can efficiently accumulate metabolites,and achieve the optimization of strain cell growth and synthesis of active metabolite by optimizing and controlling the fermentation process.
Ophiocordyceps xuefengensis;Active ingredient;Submerged fermentation;Biosynthesis
R965.2
A
1001-0408(2017)22-3079-05
2016-11-07
2017-02-08)
(编辑:余庆华)
湖南省科技重大专项子项目(No.2014FJ1007);湖南中医药大学“十二五”校级重点学科项目(No.校行科字〔2012〕2号)
*硕士研究生。研究方向:药用菌物活性成分挖掘及其生物合成研究。电话:0731-88458225。E-mail:1099570752@qq.com
#通信作者:讲师,博士研究生。研究方向:药用菌物活性物质基础及其代谢工程研究。电话:0731-88458225。E-mail:cuipeiwu@126. com
DOI10.6039/j.issn.1001-0408.2017.22.15
