扎考必利对哇巴因诱发的成年大鼠心律失常的抑制作用*
2017-09-03王晓露杨明珠薛晓艳张堉琪陈依春封启龙吴博威
王晓露, 杨明珠, 薛晓艳, 张堉琪, 陈依春, 封启龙△, 吴博威
(1山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,山西 太原 030001; 2西藏民族大学机能教研室,陕西 咸阳 712000)
扎考必利对哇巴因诱发的成年大鼠心律失常的抑制作用*
王晓露1, 杨明珠1, 薛晓艳1, 张堉琪1, 陈依春2, 封启龙1△, 吴博威1
(1山西医科大学生理学系,细胞生理学省部共建教育部重点实验室,山西 太原 030001;2西藏民族大学机能教研室,陕西 咸阳 712000)
目的: 观察内向整流钾通道激动剂扎考必利(zacopride)对哇巴因(ouabain)诱发的成年大鼠心律失常的影响,并探讨其电生理机制。方法: 利用ouabain建立成年大鼠离体和在体心律失常模型,观察zacopride对各类心律失常的作用。应用全细胞膜片钳技术,观察zacopride对大鼠单个心室肌细胞内向整流钾电流(IK1)、静息膜电位(RMP)及延迟后除极(DADs)的影响。结果: 浓度为1 μmol/L的zacopride使ouabain诱发的离体心脏期前收缩个数、室速和室颤持续时间及发生率均显著降低(P<0.05)。在麻醉大鼠,15 μg/kg的zacopride使ouabain诱发的期前收缩个数、室速和室颤持续时间及发生率均显著降低(P<0.05)。Ouabain使IK1明显减小(P<0.05),而0.1~10 μmol/L zacopride可部分恢复甚至完全逆转ouabain对IK1的抑制作用,其中1 μmol/L 为最大效应浓度。Ouabain使RMP减小(P<0.05),应用zacopride(0.1~10 μmol/L)后,RMP呈不同程度地增大,zacopride在1 μmol/L时达最大效应浓度,使RMP增大至接近正常水平。1 μmol/L的zacopride可有效抑制ouabain诱发的成年大鼠心室肌细胞DADs,使其发生率由91.67%下降至12.50%(P<0.05);在灌流液中加入1 μmol/L BaCl2后,DADs再次出现。结论: 内向整流钾通道激动剂zacopride对ouabain诱发的成年大鼠室性心律失常具有明显抑制作用,其机制与zacopride适度增强IK1、使RMP负值增大并抑制DADs有关。
心律失常; 内向整流钾通道; 静息膜电位; 延迟后除极; 全细胞膜片钳
心律失常是由于心脏电活动节律起源和(或)传导异常导致心脏搏动的频率和(或)节律异常,主要表现为心动节律或心率改变,如心动过速、过缓或心律不齐等。近年来,心血管病发病率和死亡率呈上升趋势,其中仅心律失常即占心血管病的26.8%[1],尤其是恶性心律失常,往往导致心源性猝死和心力衰竭,严重威胁着人类健康,已成为重大的公共卫生问题。
目前临床上抗心律失常药物虽然种类繁多,但大多是Na+、K+或Ca2+通道阻滞剂,它们通过改变心肌细胞电生理特性,使心肌细胞的兴奋性和传导性发生改变以达到抗心律失常的作用,但阻断或抑制某些离子电流本身又可能成为致心律失常的原因,因此几乎所有抗心律失常药物在一定条件下均可发生新的心律失常或者使原有心律失常加重[2-3]。
心肌内向整流钾通道(inward rectifier potassium channel,IK1)是由7个亚家族(Kir1~Kir7)组成的超家族,广泛分布于各种组织[4],是形成和影响心肌细胞静息电位最重要的离子通道,同时还参与动作电位的形成,故对该通道的干预,必然会影响心肌的兴奋性以及心律失常的发生[5-7]。本实验室近年来研究发现,促胃肠动力药扎考必利(zacopride)对心室肌细胞IK1具有选择性激动作用[8],并进一步证实激动IK1对心肌缺血/再灌注、乌头碱等诱发的心律失常具有显著的抑制作用[9-10],但其对临床较为常见的洋地黄类药物中毒性心律失常是否有效,尚未见文献报道。
本研究选用哇巴因(ouabain)建立大鼠离体和在体心律失常模型,以模拟临床洋地黄中毒性心律失常。在此基础上,观察内向整流钾通道激动剂zacopride的抗心律失常作用,并对其电生理机制进行进一步研究。
材 料 和 方 法
1 实验动物
健康SPF级成年Sprague-Dawley(SD)大鼠(220 g~240 g),雌雄不限,由中国人民解放军军事医学科学院实验动物中心提供,许可证号为SCXK(京)2014-0013;自由进食、饮水;室温控制在(25±2)℃。
2 药品与试剂
哇巴因购自Sigma;扎考必利购自Tocris;盐酸利多卡因注射液购自上海朝晖药业有限公司;胶原酶P(collagenase P)购自Bochringer Mannhein;三磷酸腺苷镁盐(Mg-ATP)、5′-三磷酸腺苷二钾(K2-ATP)、4-氨基吡啶(4-aminopyridine,4-AP)、牛磺酸(taurine)、磷酸肌酸二钠盐、氯化钡(BaCl2)、L-谷氨酸、EGTA和HEPES均购自Sigma; NaH2PO4、MgSO4、NaCl、KCl、CaCl2和MgCl2均购自Sangon Biotech;其余试剂均为国产分析纯。
3 主要溶液配制
(1)台氏液(mmol/L):NaH2PO40.3、glucose 10.0、HEPES 5.0、NaCl 140.0、KCl 5.4、MgCl21.0和CaCl21.8,使用NaOH调节pH至7.38。(2)无钙台氏液:不含CaCl2的台氏液。(3)KB液(mmol/L):KCl 40.0、L-谷氨酸 50.0、glucose 10.0、MgSO43.0、HEPES 10.0、taurine 20.0、KH2PO425.0和EGTA 1.0,使用KOH调节pH至7.38。(4)酶液:无钙台氏液中加入taurine 20.0 mmol/L和collagenase P 0.07~0.10 g/L,使用NaOH调节pH至7.38。(5)IK1电极内液(mmol/L):K2-ATP 3.0、Mg-ATP 1.0、KCl 150.0、EGTA 5.0、MgCl21.0、4-AP 5.0和HEPES 5.0,使用KOH调节pH至7.30;细胞外液为台氏液中加入0.5 mmol/L CdCl2阻断L-型钙通道。(6)动作电位内液(mmol/L)[11]:磷酸肌酸二钠盐 5.0、KCl 140.0、HEPES 10.0、Mg-ATP 5.0和MgCl22.0,使用KOH调节pH至7.20;动作电位外液(mmol/L):KCl 2.7、glucose 10.0、CaCl21.8、HEPES 10.0、NaCl 134.0和MgCl21.0,使用NaOH调节pH至7.40。
4 主要仪器
BL-420F生物机能实验系统购自成都泰盟软件有限公司;膜片钳放大器和数模转换器购自Axon Instruments;电动式微操纵器购自Sutter Instruments;倒置显微镜购自Olympus;微电极拉制仪购自Nari-shige;Langendorff心脏灌流系统购自AD Instruments。
5 方法
5.1 离体心律失常模型的建立 将健康SD大鼠(220 g~240 g)用50 mg/kg戊巴比妥钠腹腔注射麻醉后,开胸游离心脏并且悬挂于Langendorff装置上,使用低钾台氏液进行主动脉逆行灌流,流速8 mL/min,观察至少30 min待心电图波形稳定后使用给药泵给药。实验分组如下:(1)control组:低钾台氏液灌流;(2)zacopride组:含1 μmol/L zacopride低钾台氏液灌流;(3)ouabain组:含10 μmol/L ouabain低钾台氏液灌流;(4)ouabain+zacopride组:预先用含1 μmol/L zacopride低钾台氏液灌流30 min后改用含10 μmol/L ouabain和1 μmol/L zacopride低钾台氏液灌流;(5)ouabain+zacopride+BaCl2组:预先用含1 μmol/L zacopride低钾台氏液灌流30 min后改用含10 μmol/L ouabain、1 μmol/L zacopride和1 μmol/L BaCl2低钾台氏液灌流。观察各组大鼠心电图变化,记录药物干预后30 min内室性期前收缩个数、室速和室颤持续时间及发生率。
5.2 在体心律失常模型的建立 将35只健康SD大鼠(220 g~240 g)随机分为5组,使用30 mg/kg水合氯醛腹腔注射麻醉后仰卧位置于鼠板上,连接固定肢体导联。采用BL-420F生物机能实验系统记录大鼠Ⅱ导联心电图,连续观察30 min心电图无异常后尾静脉给药。实验分组如下:(1)control组:0.9% NaCl尾静脉注射;(2)zacopride组:15 μg/kg zacopride尾静脉注射;(3)ouabain组:1 mg/kg oua-bain尾静脉注射;(4)ouabain+zacopride组:15 μg/kg zacopride尾静脉注射3 min后给予1 mg/kg ouabain尾静脉注射;(5)ouabain+lidocaine组:7.5 mg/kg lidocaine尾静脉注射3 min后给予1 mg/kg ouabain尾静脉注射。持续观察各组大鼠的体表心电图变化,记录药物干预后1 h内室性期前收缩的个数、室速和室颤持续时间及发生率。
5.3 单个心室肌细胞的分离 将健康SD大鼠(220 g~240 g)用50 mg/kg戊巴比妥钠腹腔注射麻醉后,颈动脉放血并且迅速开胸取心脏,置于预先以100%氧气冲灌的4 ℃无钙台氏液中进行修剪,然后将心脏悬挂于Langendorff心脏灌流装置上经主动脉逆行灌流。首先用无钙台氏液灌流8~10 min后,再改用胶原酶液循环灌流15~20 min。在整个灌流过程中始终保持37 ℃恒温,恒压80 cmH2O,并持续以100%氧气通气。待心室肌组织变大变软后选择左心室部分剪下,置于KB液中剪碎,轻轻吹打3~5 min后经150 μm孔径的滤网过滤得到单个心室肌细胞,保存于KB液中,室温放置3~4 h稳定后进行实验。
5.4 全细胞膜片钳记录 吸取预先存放于KB液中的细胞悬液1~2滴,滴入倒置显微镜的细胞槽(约1 mL)中,静置8~10 min,待细胞充分贴壁后,用含钙台氏液灌流复钙,流速2 mL/min。玻璃电极内充灌电极内液,电阻约为2~5 MΩ。镜下选取长杆状、横纹清晰、无自主收缩的心室肌细胞作为实验对象,将玻璃电极缓慢移至细胞表面,施加负压从而在细胞膜和电极尖端之间形成高阻封接(即电阻达到GΩ),负压破膜后采用膜电容补偿和串联电阻补偿后进行全细胞记录。相关离子电流经Axopatch 200B膜片钳放大器、Digidate 1440A数模转换器及pCLAMP 8.0采集、贮存及分析,最终保存于电脑硬盘备用。
5.5 单个心室肌细胞IK1的记录 完整且纹理较好的大鼠单个心室肌细胞经含0.5 mmol/L CdCl2的IK1细胞外液灌流后,形成全细胞模式。在电压钳模式下,钳制电位-40 mV,给予细胞0.5 Hz、500 ms、跃阶10 mV从-120 mV~+20 mV的去极化脉冲刺激激活IK1。膜电流大小使用电流密度(pA/pF)表示。实验分组如下:(1)control组:IK1细胞外液灌流;(2)ouabain组:含10 μmol/L ouabain的IK1细胞外液灌流;(3)ouabain+zacopride组:含10 μmol/L ouabain和0.1~10 μmol/L zacopride 的IK1细胞外液灌流;(4)ouabain+zacopride+BaCl2组:含10 μmol/L ouabain、1 μmol/L zacopride和1 μmol/L BaCl2的IK1细胞外液灌流。观察不同药物组IK1的变化。
5.6 单个心室肌细胞静息膜电位(resting membrane potential,RNP)和延迟后除极(delayed afterdelarizations,DADs)的记录 形成全细胞模式后,在电流钳模式下首先观察并记录细胞RMP,随后用记录动作电位的细胞外液进行灌流,并且采用连续5次刺激(15 ms,3 Hz)作为条件刺激诱发动作电位,之后给予药物诱发DADs。实验分组同单个心室肌细胞IK1记录,灌流液改为含各种药物的动作电位细胞外液。
6 统计学处理
用SPSS 17.0统计软件进行分析,数据均采用均数±标准误(mean±SEM)表示。多个样本间比较使用单因素方差分析,组间两两比较采用SNK-q法,两样本率的比较使用χ2检验,以P<0.05为差异有统计学意义。
结 果
1 Zacopride对ouabain诱发的离体大鼠心律失常具有显著的抑制作用
心电图结果表明,1 μmol/L zacopride可显著抑制10 μmol/L ouabain灌流诱发的离体大鼠室性心律失常。在对照组和单独给予zacopride组,均未观察到室性心律失常的发生。在给予ouabain 30 min后,100%大鼠发生室速,持续时间(218.40±29.61)s;87.5%大鼠出现室颤,持续时间(10.71±2.90)s;期前收缩个数为751±24(P<0.05)。在使用zacopride和ouabain联合灌流30 min后,完全消除了室颤的发生,室速的发生率降至25%,持续时间缩短至(18.85±12.40)s,期前收缩个数减少至125±14(P<0.05)。Zacopride对心律失常的抑制作用可被BaCl2阻断,在zacopride和ouabain混合灌流液中加入1 μmol/L BaCl2后,室颤再次出现,期前收缩个数、室速持续时间及发生率增加(P<0.05),与ouabain组相比无统计学差异,见图1、表1。
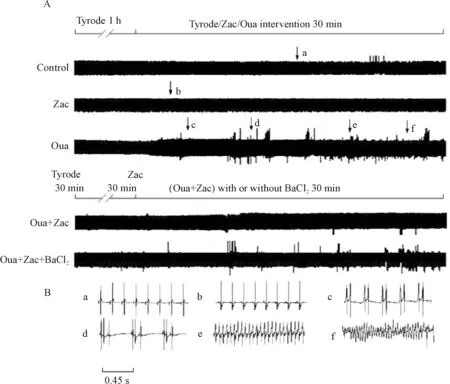
Figure 1.Representative electrocardiogram (ECG) traces (recorded from Ⅱ limb leads) showing inhibitory effect of zacopride (Zac) on ouabain (Oua)-induced arrhythmias in theinvitrorat hearts. A: traces from rats in all groups; B: examples of arrhythmias. a: normal ECG; b: ECG after zacopride (1 μmol/L) administration; c: premature ventricular contraction bigeminies; d: premature ventricular contraction trigeminies; e: ventricular tachycardia; f: ventricular fibrillation.
图1 Zacopride抑制ouabain诱发的离体大鼠心脏心律失常的典型心电图
表1 Zacopride对ouabain诱发离体大鼠心脏心律失常的抑制作用
Table 1.Inhibitory effect of zacopride (Zac; 1 μmol/L) on ouabain (Oua; 10 μmol/L)-induced arrhythmias in theinvitrorat hearts (Mean±SEM.n=8)

GroupTotalofPVBDurationofVT(s)IncidenceofVT(%)DurationofVF(s)IncidenceofVF(%)Control16±20000Zac12±20000Oua751±24∗218.40±29.61∗100∗10.71±2.90∗ 87.5∗Oua+Zac125±14#18.85±12.40#25#0#0#Oua+Zac+BaCl2703±28△207.91±21.84△100△9.65±2.87△75△
PVB: premature ventricular beats; VT: ventricular tachycardia; VF: ventricular fibrillation.*P<0.05vscontrol;#P<0.05vsOua;△P<0.05vsOua+Zac.
2 Zacopride对ouabain诱发麻醉大鼠心律失常具有显著的抑制作用
肢体Ⅱ导联心电图结果表明,15 μg/kg zacopride可显著抑制ouabain所致麻醉大鼠心律失常的发生。在对照组和单独给予zacopride组,均未观察到室性心律失常的发生。给予ouabain后,1 h内100%大鼠发生室速,持续时间(1 250±59)s;71.4%大鼠出现室颤,持续时间(19.14±6.49)s;期前收缩个数为2 281±115。但在ouabain中加入zacopride后则可完全消除室颤的发生,给药后1 h内仅28.6%大鼠发生室速,持续时间缩短至(15.57±10.10)s;期前收缩个数减少至171±25。Zacopride对心律失常的抑制作用与利多卡因(7.5 mg/kg)相似,其对期前收缩的抑制作用甚至优于利多卡因(P<0.05),见图2、表2。
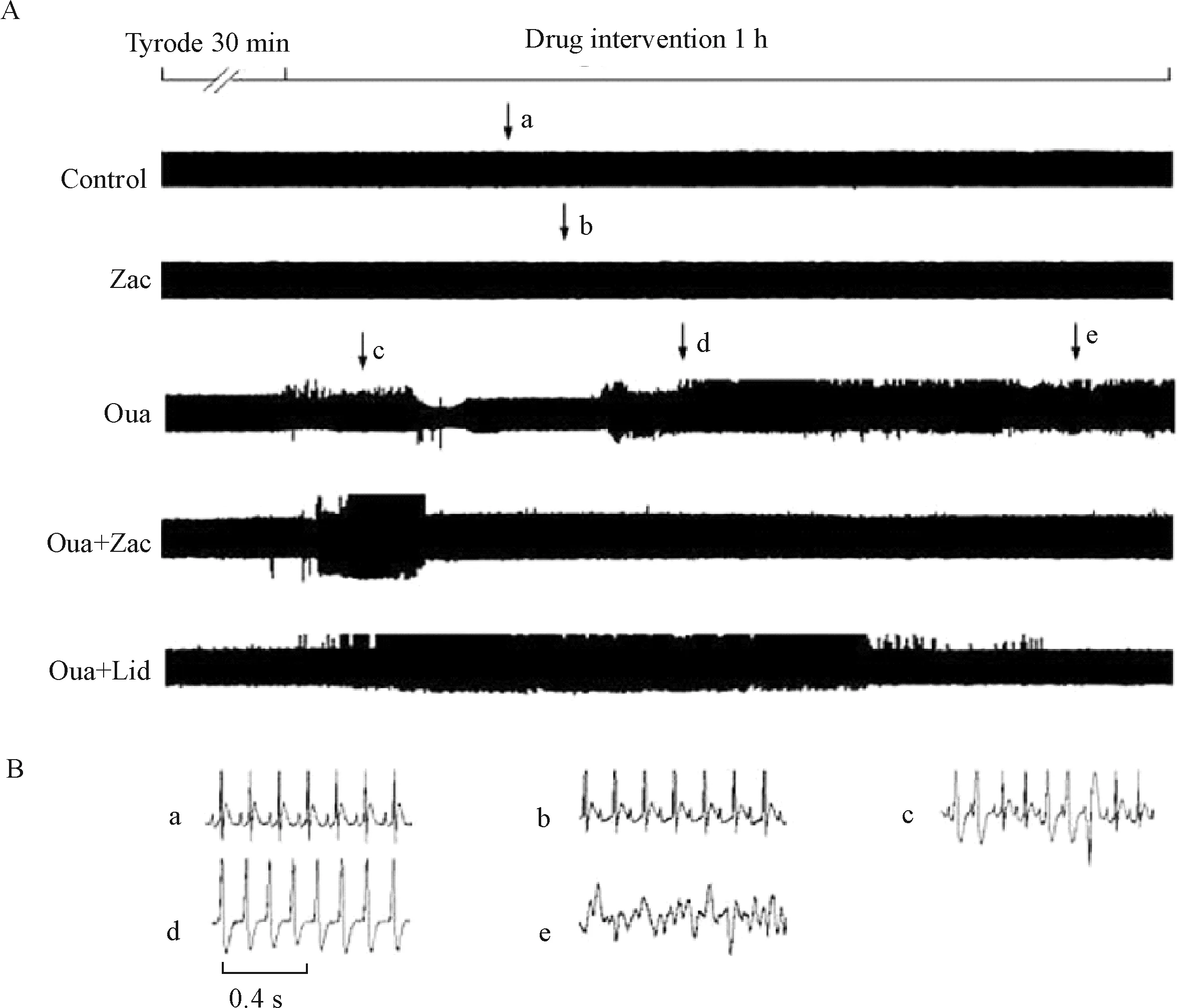
Figure 2.Representative electrocardiogram (ECG) traces (recorded from Ⅱ limb leads) showing inhibitory effect of zacopride (Zac; 15 μg/kg) on ouabain (Oua; 1 mg/kg)-induced arrhythmias in the anesthetized rats. A: traces from rats in all group; B: examples of arrhythmias. Lid: lidocaine (7.5 mg/kg). a: normal ECG; b: ECG after zacopride (15 μg/kg) administration; c: premature ventricular beats; d: ventricular tachycardia; e: ventricular fibrillation.
图2 Zacopride抑制ouabain诱发的麻醉大鼠心律失常的典型心电图
表2 Zacopride对ouabain诱发麻醉大鼠心律失常具有显著的抑制作用
Table 2.Inhibitory effect of zacopride (Zac; 15 μg/kg) on ouabain (Oua; 1 mg/kg)-induced arrhythmias in anesthetized rats (Mean±SEM.n=7)
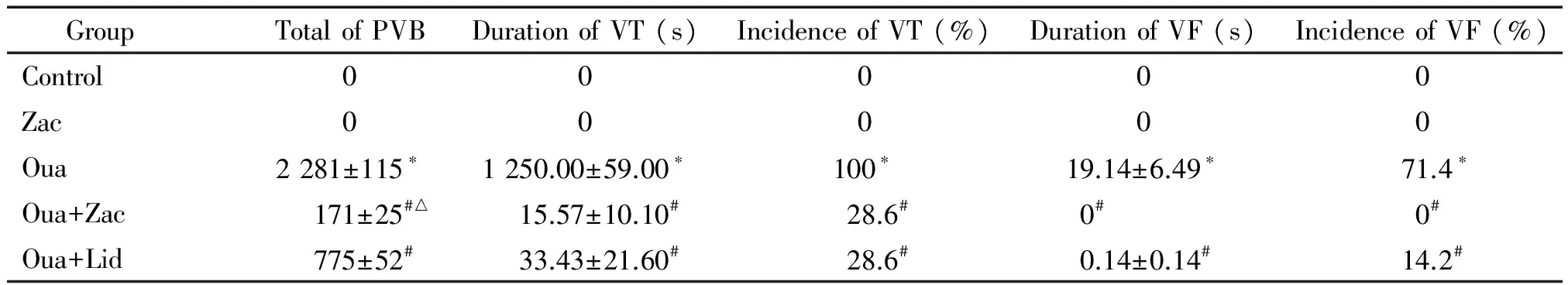
GroupTotalofPVBDurationofVT(s)IncidenceofVT(%)DurationofVF(s)IncidenceofVF(%)Control00000Zac00000Oua2281±115∗1250.00±59.00∗100∗19.14±6.49∗ 71.4∗Oua+Zac171±25#△15.57±10.10# 28.6#0#0#Oua+Lid775±52#33.43±21.60#28.6#0.14±0.14#14.2#
Lid: lidocaine (7.5 mg/kg).*P<0.05vscontrol;#P<0.05vsOua;△P<0.05vsOua+Lid.
3 Zacopride可以逆转ouabain对大鼠心室肌细胞IK1的抑制效应
为探讨zacopride抗心律失常的电生理机制,运用全细胞膜片钳技术记录大鼠心室肌细胞IK1。结果显示,10 μmol/L ouabain可使大鼠心室肌细胞IK1明显降低,内向电流(-100 mV)和外向电流(-60 mV)分别从(-10.67±0.68)pA/pF和(2.96±0.84)pA/pF降至(-6.58±0.39)pA/pF和(1.98±0.88)pA/pF(P<0.05)。在灌流液中加入1~10 μmol/L zacopride后,IK1呈不同程度地恢复。1 μmol/L为zacopride的最大效应浓度,可使IK1内向电流(-100 mV)和外向电流(-60 mV)分别增大到(-11.08±1.50)pA/pF和(3.04±0.49)pA/pF(P<0.05),接近于对照组水平;在加入1 μmol/L BaCl2混合灌流后该作用被阻断,心室肌细胞的内向电流和外向电流均减小(P<0.05),见图3、表3。
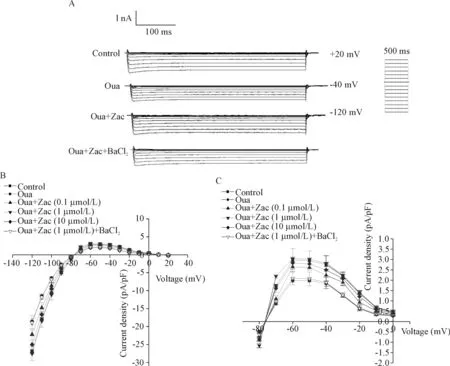
Figure 3.Antagonistic effect of zacopride (Zac) on ouabain (Oua; 10 μmol/L)-inducedIK1suppression in normal rat ventricular myocytes. A:IK1traces recorded using 500 ms step voltage from holding potential of -40 mV to voltage ranging from -120 to 20 mV; B: current-voltage relationships forIK1before and after addition of drugs; C: expanded plots for the outward components ofIK1from B. Mean±SEM.n=8.
图3 Zacopride可逆转ouabain对大鼠心室肌细胞IK1的抑制作用
表3 Zacopride和ouabain对大鼠单个心室肌细胞IK1和RMP的影响
Table 3.The effects of zacopride (Zac) and ouabain (Oua; 10 μmol/L) on inward rectifier potassium current (IK1) and resting membrane potential (RMP) in isolated rat ventricular myocytes (Mean±SEM.n=8)
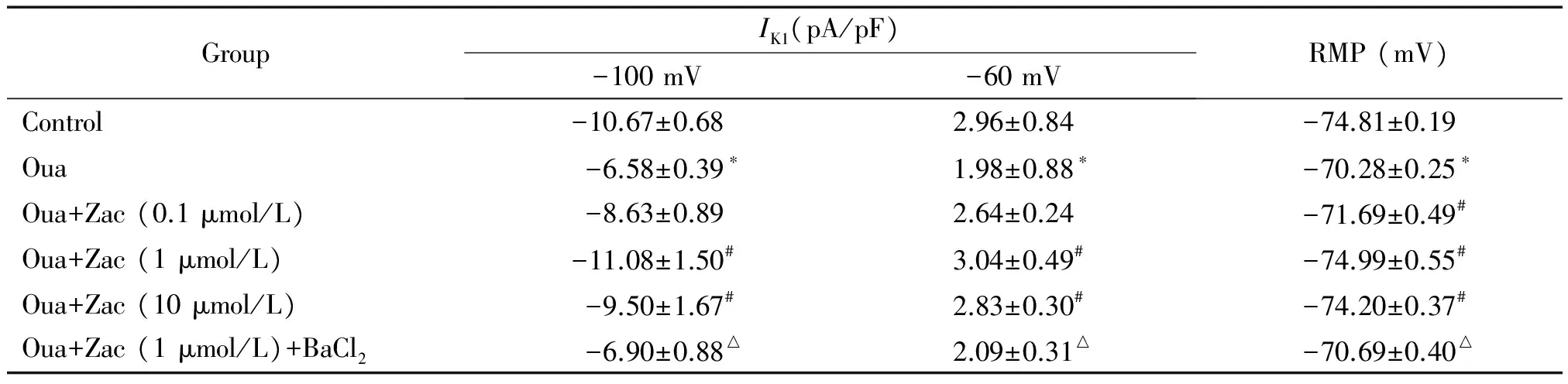
GroupIK1(pA/pF)-100mV-60mVRMP(mV)Control-10.67±0.682.96±0.84-74.81±0.19Oua-6.58±0.39∗1.98±0.88∗-70.28±0.25∗Oua+Zac(0.1μmol/L)-8.63±0.892.64±0.24-71.69±0.49#Oua+Zac(1μmol/L)-11.08±1.50#3.04±0.49#-74.99±0.55#Oua+Zac(10μmol/L)-9.50±1.67#2.83±0.30#-74.20±0.37#Oua+Zac(1μmol/L)+BaCl2-6.90±0.88△2.09±0.31△-70.69±0.40△
*P<0.05vscontrol;#P<0.05vsOua;△P<0.05vsOua+Zac (1 μmol/L).
4 Zacopride可以逆转ouabain减小大鼠心室肌细胞RMP的作用
运用全细胞膜片钳技术,在电流钳模式下记录大鼠心室肌细胞RMP。结果显示,10 μmol/L ouabain灌流可使正常大鼠心室肌细胞RMP从(-74.81±0.19)mV减小至(-70.28±0.25)mV(P<0.05);给予0.1~10 μmol/L zacopride灌流后,减小的RMP呈不同程度恢复,这一效应在1 μmol/L时达最大。在ouabain持续灌流的情况下,1 μmol/L zacopride可使心肌细胞RMP从(-70.28±0.25)mV增加至(-74.99±0.55)mV(P<0.05),后者与对照组RMP水平相接近。Zacopride增大RMP的效应可被1 μmol/L BaCl2阻断,在给予BaCl2后心室肌细胞RMP减小至(-70.69±0.40)mV(P<0.05),接近于ouabain组,见表3。
5 Zacopride对ouabain诱发心室肌细胞DADs的抑制作用
用含10 μmol/L ouabain的台氏液持续灌流,在电流钳模式下给予连续5次刺激(15 ms,3 Hz)作为条件刺激诱发DADs。结果表明,1 μmol/L zacopride可显著抑制心室肌细胞DADs发生,使其发生率由91.67%下降至12.50%(P<0.05);在灌流液中加入1 μmol/L BaCl2后,DADs再次出现,表明zacopride抑制DADs与其增大IK1有关,见图4。

Figure 4.Inhibitory effect of zacopride (Zac; 1 μmol/L) on ouabain (Oua; 10 μmol/L)-induced DADs in rat ventricular myocytes.
图4 Zacopride对ouabain诱发的大鼠单个心室肌细胞DADs的抑制作用
讨 论
本研究首次观察了内向整流钾通道激动剂zacopride对ouabain诱发成年大鼠心律失常的影响,结果表明,zacopride对ouabain诱发大鼠离体和在体心律失常具有明显的抑制作用,并可逆转ouabain对IK1及RMP的抑制或减小作用,对ouabain诱发DADs也具有显著的抑制效应。我们推测,zacopride的抗心律失常作用是通过增强IK1、增大RMP和抑制DADs而实现的。
本实验选用ouabain建立大鼠心律失常模型。Ouabain又名毒毛花苷G,是由洋地黄植物中提取的强心苷类药物,可以增加心肌收缩力,但因其毒性较大,一般不作为临床用药,主要限于动物心律失常造模使用[12]。研究表明,ouabain主要作用于心肌细胞膜上Na+,K+-ATP酶并抑制其活动。Na+,K+-ATP酶每分解一分子ATP可将3个Na+移出胞外,同时将2个K+移入胞内,结果使胞内负电荷增加,因而具有生电性。当Na+,K+-ATP酶受抑制时,心肌细胞的静息电位负值减小,膜稳定性下降,很容易发生后除极和触发活动并最终引发快速型心律失常[13-14]。此时,最有效的干预应该是增大RMP,理论上要达到这一目标可通过增大IK1实现,但以往一直没有一种IK1特异性激动剂可供使用。近年来本实验室研究发现,zacopride可以通过选择性激动IK1抑制乌头碱、心肌缺血/再灌注损伤等多种因素所致的心律失常[9-10],并且zacopride在抗心律失常的同时还具有一定的心脏保护作用[15]。已有最新研究显示zacopride对人心室肌细胞异丙肾上腺素/咖啡因诱发的触发性心律失常有明确的抑制作用[16]。
尽管洋地黄类药物作为经典的正性肌力药物使用已有几百年的历史,但其最大的特点是有效治疗量、中毒量和致死量3者非常接近,加上不同个体对药物的耐受性差异也较大,故容易发生中毒,其中80%~90%表现为心律失常。本研究通过建立ouabain诱发的大鼠心律失常模型以模拟临床常见的洋地黄中毒性心律失常,其意义在于证实了zacopride具有显著的抗心律失常效应,为临床洋地黄中毒性心律失常的药物治疗提供了新的实验依据。
现有的抗心律失常药多为Na+、K+、Ca2+等通道的阻断剂,这些药物在治疗心律失常的同时往往又多具有致心律失常的风险。Zacopride属苯甲酰胺衍生物,为5-羟色胺3(5-HT3)受体阻断剂和5-羟色胺4(5-HT4)受体激动剂[17-18]。研究发现,与其它同类药物(cisapride、RS67506等)抑制大鼠心室肌IK1所不同的是,zacopride通过PKA介导的信号通路增强IK1[19-20],在0.1~10 μmol/L对大鼠心室肌IK1表现出显著的激动作用(内向和外向电流均增大),1 μmol/L为最大效应浓度,并且对INa、ICa-L、Ito、Isus、IK(豚鼠)、IKATP、INa/Ca和Ipump等影响动作电位的离子电流均无显著作用;在电流钳模式下则使正常心肌细胞静息电位负值增大[8]。本研究证实,zacopride可以逆转ouabain对IK1和RMP的抑制作用,使原来减小的膜电位得以恢复,通过提高膜稳定性、抑制DADs而产生抗心律失常效应。本研究的实验结果也进一步支持,激动心肌IK1有望成为今后抗心律失常治疗的新策略和新途径。
[1] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2014》概要[J]. 中国循环杂志, 2015, 31(7):617-622.
[2] Sanguinetti MC, Bennett PB. Antiarrhythmic drug target choices and screening[J]. Circ Res, 2003, 93(6):491-499.
[3] Lafuente-Lafuente C, Mouly S, Longás-Tejero MA, et al. Antiarrhythmic drugs for maintaining sinus rhythm after cardioversion of atrial fibrillation: a systematic review of randomized controlled trials[J]. Arch Intern Med, 2006, 166(7):719-728.
[4] Kuang Q, Purhonen P, Hebert H. Structure of potassium channels[J]. Cell Mol Life Sci, 2015, 72(19):3677-3693.
[5] Hibino H, Inanobe A, Furutani K, et al. Inwardly recti-fying potassium channels: their structure, function, and physiological roles[J]. Physiol Rev, 2010, 90(1):291-366.
[6] Anumonwo JM, Lopatin AN. Cardiac strong inward recti-fier potassium channels[J]. J Mol Cell Cardiol, 2010, 48 (1):45-54.
[7] Lopatin AN, Anumonwo JM. Structural and molecular bases of cardiac inward rectifier potassium channel function[M]// Zipes DP, Jalife J. Cardiac electrophysiology: from cell to bedside. 6th ed. Phildelphia:Saunders, 2014:33-41.
[8] Liu QH, Li XL, Xu YW, et al. A novel discovery ofIK1channel agonist: zacopride selectively enhancesIK1current and suppresses triggered arrhythmias in the rat[J]. J Cardiovasc Pharmacol, 2012, 59(1):37-48.
[9] 李 瑜, 杨 迎, 郭云飞, 等. Zacopride缺血后适应抑制大鼠缺血/再灌注性心律失常[J]. 中国病理生理杂志, 2016, 32(11):1921-1927.
[10]刘清华, 吴博威, 张 杨, 等. Zacopride增强心肌内向整流钾电流(IK1)发挥抗心律失常效应[J]. 中国病理生理杂志, 2010, 26(6):1041-1046.
[11]Mészáros J, Khananshvili D, Hart G. Mechanisms underlying delayed afterdepolarizations in hypertrophied left ventricular myocytes of rats[J]. Am J Physiol, 2001, 281(2):H903-H914.
[12]Almotrefi AA, Basco C, Moorji A, et al. Class I antiarrhythmic drug effects on ouabain binding to guinea pig cardiac Na+-K+ATPase[J]. Can J Physiol Pharmacol, 1999, 77(11):866-870.
[13]Laredo J, Hamilton BP, Hamlyn JM. Ouabain is secreted by bovine adrenocortical cells[J]. Endocrinology, 1994, 135(2):794-797.
[14]杨宝峰. 药理学[M]. 第7版. 北京: 人民卫生出版社, 2008:256-259.
[15]Wu BW, Cao JM. On the risk concerns of zacopride, a moderateIK1channel agonist with cardiac protective action[J]. J Cardiovasc Pharmacol, 2014, 64(4):357-359.
[16]Elnakish MT, Canan BD, Kilic A, et al. Effects of zacopride, a moderateIK1channel agonist, on triggered arrhythmia and contractility in human ventricular myocar-dium[J]. Pharmacol Res, 2016, 115:309-318.
[17]Silvestre JS, Fernández AG, Palacios JM. Effects of 5-HT4receptor antagonists on rat behaviour in the elevated plus-maze test[J]. Eur J Pharmacol, 1996, 309(3):219-222.
[18]Yamakuni H, Nakayama H, Matsui S, et al. Inhibitory effect of zacopride on Cisplatin-induced delayed emesis in ferrets[J]. J Pharmacol Sci, 2006, 101(1):99-102.
[19]刘清华, 许言午, 吴博威. Zacopride增强心肌内向整流钾电流(IK1)效应的受体和信号转导通路[J]. 中国病理生理杂志, 2012, 28(1):6-10.
[20]Zhang L, Liu QH, Liu CF, et al. Zacopride selectively activates the Kir2.1 channel via a PKA signaling pathway in rat cardiomyocytes[J]. Sci China Life Sci, 2013, 56(9):788-796.
(责任编辑: 林白霜, 罗 森)
Inhibitory effect of zacopride on ouabain-induced arrhythmias in adult rats
WANG Xiao-lu1, YANG Ming-zhu1, XUE Xiao-yan1, ZHANG Yu-qi1, CHEN Yi-chun2, FENG Qi-long1, WU Bo-wei1
(1DepartmentofPhysiology,KeyLaboratoryofCellularPhysiologyCo-establishedbyMinistryofEducationofChinaandShanxiProvince,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofFunction,XizangMinzuUniversity,Xianyang712000,China.E-mail:fengqilong@163.com)
AIM: To investigate the effect of zacopride, an inward rectifier potassium channel agonist, on ouabain-induced arrhythmias in adult rats, and to explore the underlying electrophysiological mechanism.METHODS: Using ouabain to establishinvitroandinvivoarrhythmic rat models, the effects of zacopride on ouabain-induced arrhythmias were observed. The technique of whole-cell patch clamp was used to observe the effects of zacopride on inward rectifier potassium current (IK1), resting membrane potential (RMP) and delayed afterdepolarizations (DADs) in single rat ventricular myocyte. RESULTS: Zacopride at 1 μmol/L significantly reduced total number of premature ventricular beats, and the duration and incidence of ventricular tachycardia and ventricular fibrillation induced by ouabain in rat heartsinvitro(P<0.05). In anesthetized rats, zacopride at 15 μg/kg significantly reduced total number of premature ventricular beats, and the duration and incidence of ventricular tachycardia and ventricular fibrillation induced by ouabain (P<0.05).IK1was significantly inhibited by ouabain (P<0.05), which was partially and even completely reversed by zacopride at 0.1~10 μmol/L. RMP value was significantly reduced by ouabain (P<0.05), and then increased to different levels after treatment with zacopride (0.1~10 μmol/L). Zacopride at 1 μmol/L showed its maximal effect and RMP was restored to normal level. Moreover, zacopride at 1 μmol/L markedly suppressed ouabain-induced DADs in single rat ventricular myocyte. The incidence of DADs decreased from 91.67% to 12.50% after zacopride was applied (P<0.05), and this effect was abolished by 1 μmol/L BaCl2. CONCLUSION: Inward rectifier potassium channel agonist zacopride significantly inhibits ouabain-induced ventricular arrhythmias in adult rats. The mechanism is related to increased RMP level and inhibition of DADs by activation ofIK1channel.
Arrhythmia; Inward rectifier potassium channel; Resting membrane potential; Delayed afterdepolarization; Whole-cell patch clamp
1000- 4718(2017)08- 1371- 08
2017- 01- 18
2017- 04- 11
高校“131”领军人才工程优秀中青年拔尖创新人才; 山西省重点实验室建设项目(No. 2015012003-08); 山西省高等学校优秀青年学术带头人支持项目
R541.7; R363; R331.3+8
A
10.3969/j.issn.1000- 4718.2017.08.005
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0351-4135768; E-mail: fengqilong@163.com
