厄洛替尼减轻STZ诱导的糖尿病肾病模型大鼠的肾损伤
2017-09-03黄恬,蔡稀,钟玲
黄 恬, 蔡 稀, 钟 玲
(重庆医科大学附属第二医院肾内科, 重庆 400010)
厄洛替尼减轻STZ诱导的糖尿病肾病模型大鼠的肾损伤
黄 恬, 蔡 稀, 钟 玲△
(重庆医科大学附属第二医院肾内科, 重庆 400010)
目的: 研究表皮生长因子受体(EGFR)抑制剂厄洛替尼(erlotinib)对糖尿病肾病大鼠肾脏的保护作用及机制。方法: 采用大剂量(55 mg/kg)链脲佐菌素(STZ)腹腔注射诱导大鼠糖尿病肾病模型,以1周后血糖值>16.7 mmol/L的大鼠为造模成功的标准。将糖尿病大鼠随机分为2组[STZ组和STZ+erlotinib(100 mg·kg-1·d-1)组],并以正常大鼠为对照组 (control 组)。Erlotinib处理4周后,检测大鼠空腹血糖、血清肌酐和24 h尿蛋白含量的变化;HE染色和Masson染色观察肾脏组织病理学改变;Western blot检测各组肾脏组织中EGFR、p-EGFR、转化生长因子β1(TGFβ1)、Smad2/3、p-Smad2/3、Ⅳ型胶原蛋白(ColⅣ)和纤连蛋白(fibronectin)的蛋白水平;活性氧簇(ROS)和丙二醛(MDA)试剂盒分别检测各组肾脏组织中ROS和MDA水平。结果: 与control组相比,STZ组血糖、24 h尿蛋白和血清肌酐水平均显著升高(P<0.01),肾组织形态学出现异常变化;与STZ组相比,STZ+erlotinib组的血糖、24 h尿蛋白水平和血清肌酐水平显著降低(P<0.05),肾小球结构恢复正常,肾小球系膜细胞增生程度明显减弱。厄洛替尼明显抑制了STZ大鼠肾组织中p-EGFR、TGFβ1、p-Smad2/3、ColⅣ和fibronectin蛋白水平,也明显抑制了STZ大鼠肾组织中ROS和MDA水平。结论: 厄洛替尼可能通过抑制EGFR/TGFβ1-Smad2/3信号通路的激活来抑制糖尿病肾病肾组织的纤维化和氧化应激反应,从而减轻肾损伤。
糖尿病肾病; 厄洛替尼; 表皮生长因子受体; 转化生长因子β1
糖尿病肾病(diabetic nephropathy, DN)是Ⅰ型或Ⅱ型糖尿病的主要并发症,继发于糖尿病并呈进行性加重,是糖尿病患者的主要死因[1],也是导致肾脏相关疾病发病率及死亡率升高的主要原因[2]。糖尿病肾病的主要病理特征表现为肾小管及肾小球基底膜增厚、肾小管肾小球肥大、系膜区细胞外基质进行性聚集和肾小管间质纤维化等[2]。临床上DN初期表现为肾小球滤过率减小,后期出现蛋白尿、动脉血压升高、体液潴留等,最终导致肾功能衰竭[3]。目前,我国糖尿病发病率快速增长,随之而来的社会问题也日趋严重。因此,探索糖尿病肾病的发病机制,寻求防治措施,显得尤为迫切。
表皮生长因子受体(epidermal growth factor receptor, EGFR)属于受体酪氨酸激酶ErB家族成员之一,包含一个细胞外的配体结合区、一个跨膜区、一个细胞质蛋白酪氨酸激酶区以及一个具有多个磷酸化结合位点的C末端。EGFR广泛表达于哺乳动物肾脏组织中,包括肾小球、肾小管、肾皮质及肾髓质集合管等[4]。越来越多的研究表明EGFR是细胞增殖、分化、迁移及死亡等细胞生理病理变化的重要调节因子[5-6]。也有研究证实EGFR活化与转化生长因子β(transforming growth factor,TGFβ)信号通路相互作用是肾组织纤维化的关键环节,TGFβ信号通路的激活能促进胶原蛋白、纤连蛋白和层黏连蛋白的形成,并且能抑制由基质金属蛋白酶介导的细胞外基质的降解,导致细胞外基质的积累增加,从而促进了糖尿病肾病的进展[4,7-9]。此外,TGFβ信号通路的激活可促进氧化应激反应,而氧化应激是糖尿病肾损伤的重要原因之一[10]。因此,在糖尿病肾病进展过程中调控EGFR的活性具有重要的意义。厄洛替尼(erlotinib)是一种新型的表皮生长因子受体酪氨酸激酶抑制剂,通过竞争性结合酪氨酸激酶催化区结合位点来阻断表皮生长因子受体酪氨酸激酶的信号转导途径。有文献报道在糖尿病肾病模型中EGFR处于活化状态,EGFR抑制剂厄洛替尼能够激活AMPK、抑制mTOR信号通路,而mTOR信号通路的抑制则增加了自噬反应,减弱了内质网应激,最终减慢了糖尿病肾病的发展[11]。然而该报道未阐明厄洛替尼对与EGFR活化密切相关的TGFβ信号通路及氧化应激反应的影响。
本研究通过对糖尿病肾病模型大鼠进行厄洛替尼干预,从生化指标、肾脏病理水平来证实其对糖尿病肾病模型大鼠肾脏的保护作用,并通过阐明厄洛替尼对TGFβ信号通路的影响解析其发挥保护作用的分子机制,以初步探讨厄洛替尼治疗糖尿病肾病的临床应用价值。
材 料 和 方 法
1 实验动物、试剂和仪器
46只健康成年SD大鼠,体重200~220 g,购自第三军医大学,合格证号为0020392。
链脲佐菌素(streptozotocin,STZ)购于Sigma;厄洛替尼购自Selleck;尿蛋白定量测试盒、血清肌酐(serum creatinine,Scr)测定试剂盒、活性氧簇(reactive oxygen species,ROS) 检测试剂盒和丙二醛(malondialdehyde,MDA)检测试剂盒购于南京建成生物工程研究所;抗EGFR抗体、抗p-EGFR抗体、抗TGFβ1抗体、抗Ⅳ型胶原蛋白(collagen Ⅳ,ColⅣ)抗体、抗纤连蛋白(fibronectin)抗体和抗β-actin抗体均购于Bioworld;抗Smad2/3和抗p-Smad2/3抗体购于Cell Signaling Technology;抗兔Ⅱ抗购于中衫金桥公司。
激光扫描共聚焦显微镜(Leica);照相系统(OLYMPUS);分光光度计(Thermo);TC2323型恒温箱(SHEL LAB);高速台式离心机(Beckman);血糖仪及配套试纸(爱乐芬)。
2 主要方法
2.1 动物模型的建立及分组 46只健康SD大鼠给予普通饲料适应性喂养2周后,尾静脉取血测定血糖未见异常(第0周)。选取40只大鼠禁食后,给予大剂量(55 mg/kg)STZ腹腔注射,1周后(第1周末),禁食3 h,血糖值>16.7 mmol/L的大鼠视为糖尿病模型建模成功。选择18只造模成功的大鼠,随机分为6组,灌胃给予厄洛替尼,每组剂量分别为0、25、50、75、100和125 mg·kg-1·d-1,连续灌胃3周(第2~4周)后检测空腹血糖(fasting blood glucose,FBG)水平,以空腹血糖水平下降最明显时的厄洛替尼剂量(100 mg·kg-1·d-1)为实验处理剂量。另选取6只糖尿病大鼠设为厄洛替尼组(STZ+erlotinib组),通过灌胃给予厄洛替尼(100 mg·kg-1·d-1),连续给药4周(第5~8周);同时,分别选取6只健康大鼠设为对照组(control组)和6只糖尿病大鼠设为STZ组,灌胃给予等体积生理盐水。
2.2 生化指标检测 采用爱乐芬血糖仪及配套试纸测定大鼠FBG水平,记录各组大鼠的血糖变化。第0周、第4周、第6周、第8周末,将大鼠放入代谢笼中,收集24 h尿标本,离心取上清,测定尿蛋白含量;同时于相同时点收集大鼠血液测定各组大鼠血肌酐的含量。
2.3 收集肾组织标本 采用颈椎脱臼法处死各组大鼠,解剖、分离出双侧肾脏,去除包膜,用生理盐水冲洗后,液氮保存,备用。
2.4 HE染色 取实验大鼠肾脏组织,置于冰台用 PBS 冲洗干净,除去包膜,滤纸吸干,取左肾沿冠状面剖开,置于4%多聚甲醛溶液固定,石蜡包埋,切片,常规HE染色,中性树胶封固。光学显微镜400倍下观察大鼠肾组织肾小球、肾小管、间质等的形态结构变化,并进行图像采集。
2.5 Masson染色观察肾脏纤维化 肾脏组织切片经苏木精染色1 min,冲洗液冲洗30 s;丽春红酸性品红液染色30~60 s,冲洗液清洗30 s;磷钼酸分色6~8 min,弃分色液;亮绿蓝染色5 min,用无水乙醇清洗;无水乙醇基本挥发完后加入中性树脂封片,光学显微镜400倍下观察,对肾脏胶原纤维的分布和纤维化程度进行分析。
2.6 Western blot检测蛋白水平 取米粒大小的肾脏组织于流式管中,加入1 mL 含蛋白酶抑制剂的RIPA裂解缓冲液,用组织匀浆机破碎组织,后将流式管置于冰中15 min,转移样本至EP管中,16 000 ×g离心5 min,吸取上清,用BCA法测定蛋白浓度。取30 μg蛋白上样,SDS-PAGE分离蛋白后,转移蛋白至NC膜,5%脱脂牛奶封闭1 h,稀释 I 抗(抗EGFR抗体1∶1 000、抗p-EGFR抗体1∶800、抗TGFβ1抗体 1∶1 000、抗Smad2/3、p-Smad2/3抗体 1∶2 000、抗ColⅣ抗体1∶500、抗fibronectin抗体1∶500、抗β-actin抗体1∶2 000),4 ℃摇床中孵育过夜,Ⅱ抗室温下摇床孵育2 h,ECL显影。以β-actin为内参照。
2.7 活性氧簇(reactive oxygen species,ROS)水平的检测 准确称取大鼠肾脏组织,按重量(g)∶体积(mL)=1∶20的比例加入匀浆介质(100 mmol/L PBS缓冲液),用组织匀浆机破碎组织, 1 000×g离心10 min,取上清待测,另取部分上清用BCA法测定蛋白浓度。配制1 mmol/L DCFH-DA工作液,在10 μL样本中加入190 μL DCFH-DA工作液作为测定孔,在10 μL PBS中加入190 μL DCFH-DA工作液作为对照孔,混匀后,37 ℃孵育30 min,于荧光显微镜下(激发波长500 nm,发射波长535 nm)观察测量荧光强度,计算每毫克蛋白荧光强度和荧光强度的百分比。
2.8 丙二醛(malondialdehyde,MDA)含量的检测 按2.7所述方法获得肾脏组织匀浆,BCA法测定蛋白浓度,按照试剂盒说明书加入待测样本、标准品及试剂,混匀后95 ℃沸水浴40 min, 4 000 r/min离心10 min,取上清于532 nm处读取各标本吸光度,根据说明书上MDA含量计算公式计算每毫克蛋白中MDA的含量。
3 统计学处理
使用SPSS 19.0统计软件对实验结果进行统计学分析,所得数据采用均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,组间两两比较采用Bonferroni校正的t检验, 以P<0.05为差异有统计学意义。
结 果
1 不同剂量厄洛替尼作用效果检测
不同剂量的厄洛替尼均能降低STZ大鼠的空腹血糖水平,其中100 mg·kg-1·d-1和125 mg·kg-1·d-1灌胃剂量的作用效果最明显,见图1。因此后续我们选择100 mg·kg-1·d-1作为厄洛替尼的实验剂量。
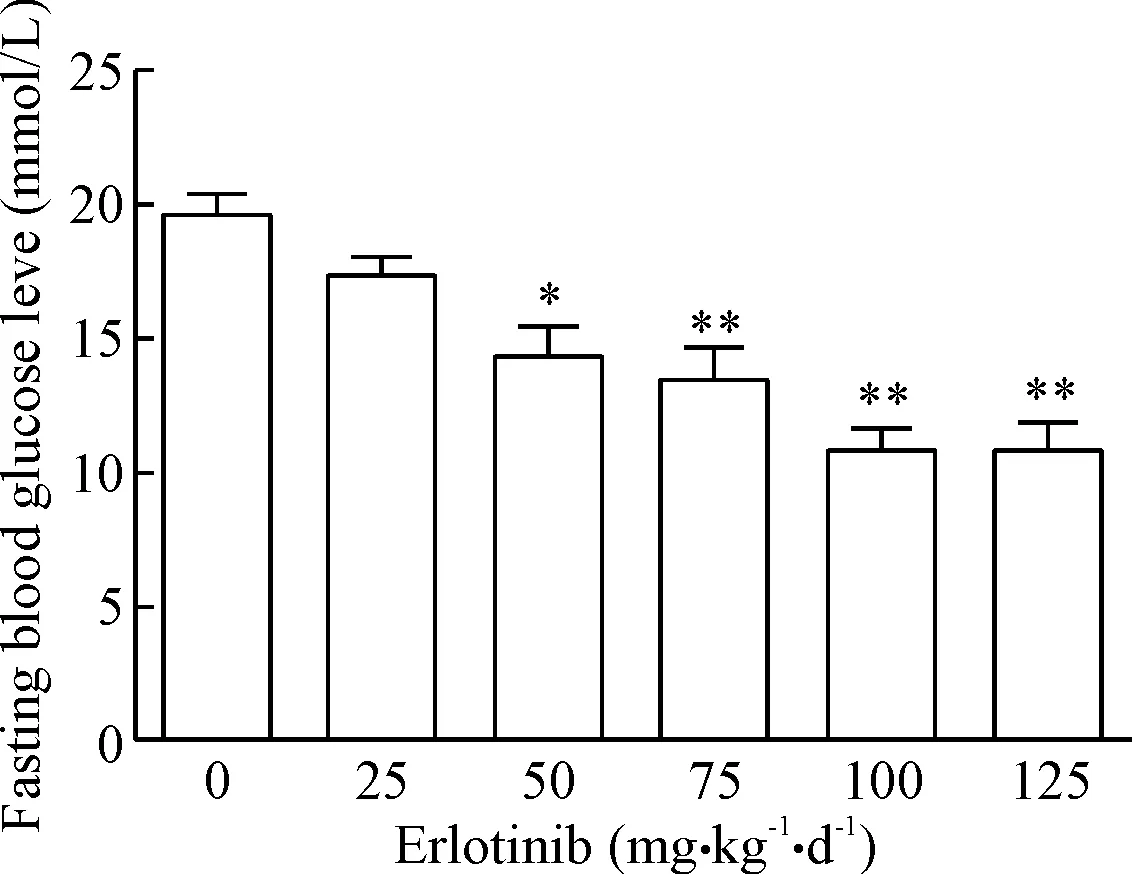
Figure 1.The STZ-induced DN rats were treated by different doses of erlotinib for 3 weeks, and then FBG levels were measured by glucometer. Mean±SD.n= 3.*P<0.05,**P<0.01vs0 mg·kg-1·d-1group.
图1 不同剂量厄洛替尼处理DN大鼠3周后的FBG水平
2 厄洛替尼对STZ诱导糖尿病肾病模型大鼠血糖的影响
我们检测了经STZ造模及erlotinib (100 mg·kg-1·d-1)处理的大鼠空腹血糖水平,结果显示STZ诱导的第6周和第8周,STZ组空腹血糖水平均显著高于control组,差异具有统计学意义(P<0.01);而STZ+erlotinib组空腹血糖水平与STZ组相比明显下降,差异具有统计学意义(P<0.01),见表1。说明erlotinib能明显改善糖尿病肾病大鼠的血糖水平。
3 厄洛替尼对STZ诱导糖尿病肾病模型大鼠24 h尿蛋白和血清肌酐的影响

表1 厄洛替尼(100 mg·kg-1·d-1)处理DN大鼠后各组FBG水平
**P<0.01vscontrol group;##P<0.01vsSTZ group. Week 0 was the time at the beginning of STZ treatment.
我们也检测了经STZ造模及erlotinib (100 mg·kg-1·d-1)处理的大鼠尿24 h蛋白含量,结果显示STZ诱导的第6周和第8周,STZ组24 h尿蛋白水平明显较control组升高,差异具有统计学意义(P<0.01);而相比于STZ组,STZ+erlotinib组尿蛋白水平明显下降(P<0.01),见表2。另外,在第STZ诱导的6周和第8周检测大鼠血清肌酐水平发现,相比于control组,STZ组血清肌酐明显升高,差异有统计学意义(P<0.01);而相比于STZ组,STZ+erloti-nib组血清肌酐明显下降(P<0.05),见表3。这说明erlotinib能明显降低糖尿病肾病大鼠的24 h尿蛋白含量及血清肌酐浓度。
表2 厄洛替尼(100 mg·kg-1·d-1)处理DN大鼠后各组24 h尿蛋白水平
Table 2.The 24 h urine protein levels in DN rats treated with erlotinib were measured by automatic biochemical analyzer (mg. Mean±SD.n=6)
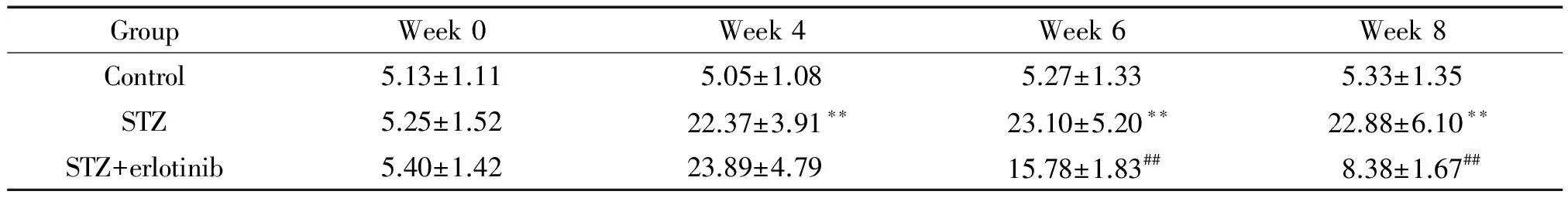
GroupWeek0Week4Week6Week8Control5.13±1.115.05±1.085.27±1.335.33±1.35STZ5.25±1.5222.37±3.91∗∗23.10±5.20∗∗22.88±6.10∗∗STZ+erlotinib5.40±1.4223.89±4.7915.78±1.83##8.38±1.67##
**P<0.01vscontrol group;##P<0.01vsSTZ group. Week 0 was the time at the beginning of STZ treatment.
表3 厄洛替尼(100 mg·kg-1·d-1)处理DN大鼠后各组血清肌酐水平
Table 3.The serum creatinine levels in DN rats treated with erlotinib were measured by automatic biochemical analyzer (μmol/L. Mean±SD.n=6)
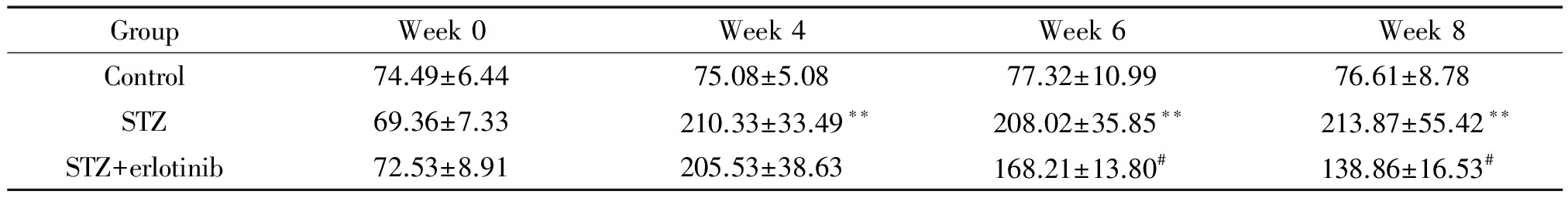
GroupWeek0Week4Week6 Week8Control74.49±6.4475.08±5.0877.32±10.9976.61±8.78STZ69.36±7.33210.33±33.49∗∗208.02±35.85∗∗213.87±55.42∗∗STZ+erlotinib72.53±8.91205.53±38.63168.21±13.80#138.86±16.53#
*P<0.01vscontrol group;#P<0.05vsSTZ group. Week 0 was the time at the beginning of STZ treatment.
4 厄洛替尼对STZ诱导糖尿病肾病模型大鼠肾脏组织病理学变化的影响
在erlotinib处理4周后(即STZ诱导第8周),HE染色结果显示,control组肾小球结构正常,上皮细胞排列整齐,结构清楚,小管间质、肾血管未见明显异常,而STZ组出现肾小球系膜细胞增多,毛细血管基底膜增厚,上皮细胞排列不整齐,结构紊乱,提示STZ诱导大鼠肾脏组织出现了病理性损伤。STZ+erlotinib组较STZ组比,大鼠肾脏病理改变程度明显减轻,见图2。
另外,Masson染色结果显示,control组大鼠肾小球仅基底膜及肾小管间质可见少量的胶原纤维(蓝色),而STZ组大鼠肾小球和肾小管间质中可见大量蓝色深染的胶原纤维,并且明显多于control组,说明有胶原纤维沉积。而STZ+erlotinib组大鼠肾小球和肾小管间质中胶原纤维较STZ组明显减少,见图2。以上研究结果说明erlotinib可明显减轻糖尿病肾病大鼠的肾损伤。
5 厄洛替尼对糖尿病肾病大鼠肾组织中EGFR蛋白水平及磷酸化的影响
Western blot检测结果显示control组、STZ组和STZ+erlotinib组大鼠肾组织中EGFR的蛋白水平没有明显差异;而与control组相比,STZ组大鼠肾组织中EGFR的磷酸化水平明显升高(P<0.01);STZ+erlotinib组与STZ组相比,大鼠肾组织中EGFR的磷酸化水平显著降低(P<0.01),见图3。这一结果说明厄洛替尼抑制了STZ诱导的DN大鼠肾组织中EGFR的激活。
6 厄洛替尼对糖尿病肾病大鼠肾组织中TGFβ信号通路的影响
我们也检测了control组、STZ组和STZ+erlotinib组大鼠肾组织中TGFβ信号分子及其下游信号分子水平的差异。与control组相比,STZ组大鼠肾组织中TGFβ1和p-Smad2/3的蛋白水平明显升高(P<0.01);STZ+erlotinib组与STZ组相比,大鼠肾组织中TGFβ1和p-Smad2/3的蛋白水平显著降低(P<0.01);而各组大鼠肾组织中Smad2/3的蛋白水平无明显差异。此外,与control组相比,STZ组大鼠肾组织中Ⅳ型胶原蛋白和纤连蛋白的水平明显升高(P<0.01);STZ+erlotinib组与STZ组相比,大鼠肾组织中Ⅳ型胶原蛋白和纤连蛋白的表达水平显著降低(P<0.01)。以上结果说明厄洛替尼抑制了STZ组肾组织中TGFβ1-Smad2/3信号通路的激活,从而减少了肾组织中Ⅳ型胶原蛋白和纤连蛋白的产生,减轻了肾损伤,见图4。
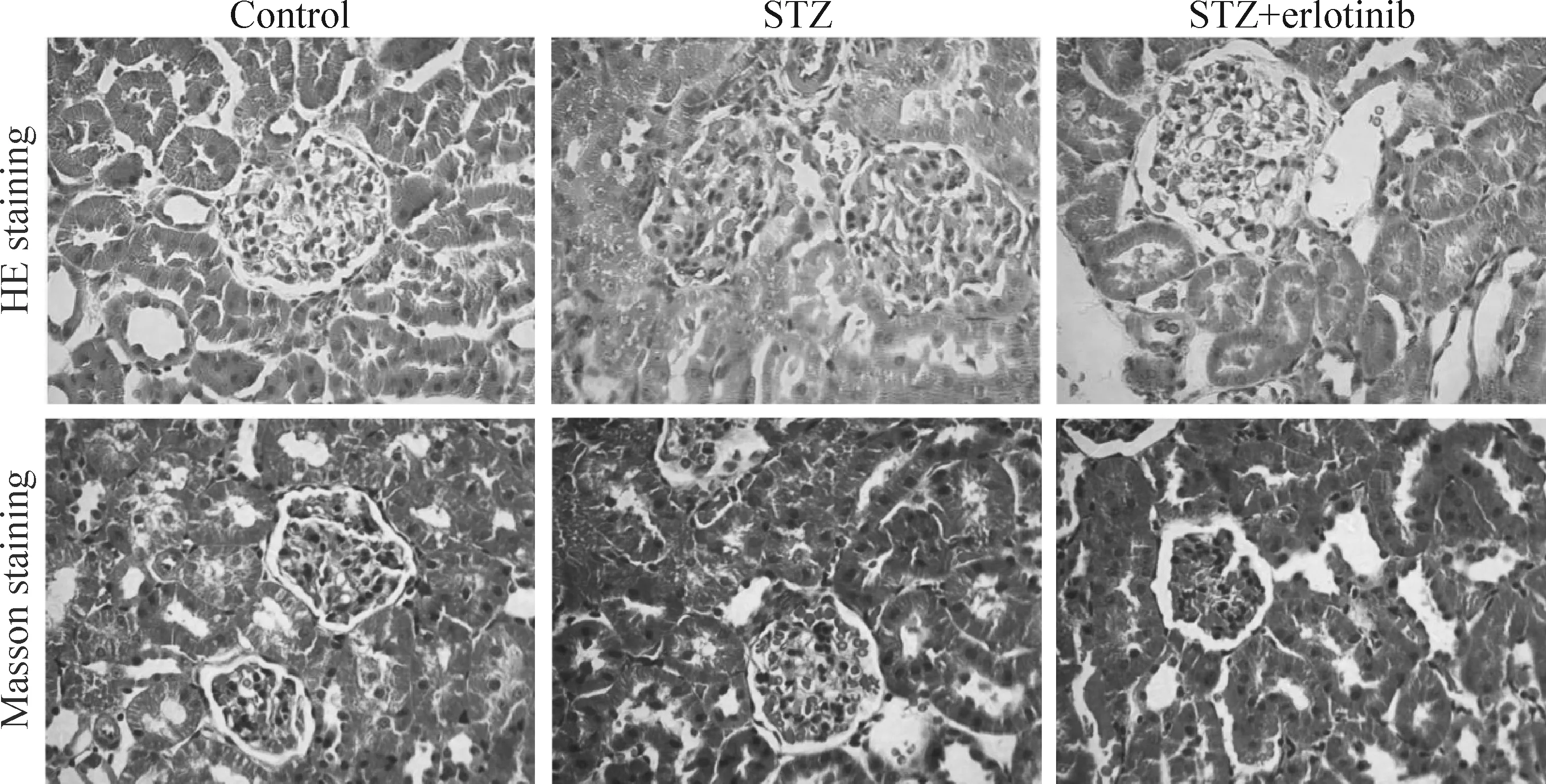
Figure 2.The DN rats were treated with erlotinib (100 mg·kg-1·d-1) for 4 weeks, and then the renal tissues in all groups were stained by HE and Masson staining (×400).
图2 厄洛替尼处理DN大鼠4周后肾组织的HE和Masson染色结果
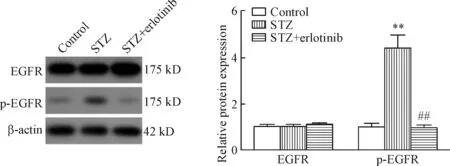
Figure 3.The DN rats were treated with erlotinib (100 mg·kg-1·d-1) for 4 weeks, and then the EGFR and p-EGFR levels in rat kidney tissues were measured by Western blot.**P<0.01vscontrol group;##P<0.01vsSTZ group.
图3 厄洛替尼处理DN大鼠4周后各组大鼠肾组织中EGFR和p-EGFR的水平
7 厄洛替尼对糖尿病肾病大鼠肾组织中氧化应激水平的影响
与control组相比,STZ组大鼠肾组织中ROS的水平明显升高,而STZ+erlotinib组大鼠肾组织中ROS的水平相比于STZ组明显降低(P<0.01)。此外,与control组相比,STZ组大鼠肾组织中的MDA含量明显升高,而STZ+erlotinib组大鼠肾组织中的MDA含量相比于模型组明显降低(P<0.05),见图5。
讨 论
糖尿病肾病是威胁人类生命的糖尿病并发症之一,尽管已有较多的手段用于控制糖尿病肾病的发生发展,然而许多糖尿病患者仍然有较高的风险进展为糖尿病肾病。因此,鉴定糖尿病肾病的危险因子,阐明其抑制因素在糖尿病肾病发生过程中的作用具有重要的意义。研究发现在糖尿病肾病肾组织中EGFR的活化水平较高,抑制EGFR信号通路的活化具有潜在的治疗糖尿病肾病的作用[11-12]。Erlotinib是EGFR的抑制剂,目前较少的研究关注其是否对糖尿病肾病肾组织具有保护作用。在本研究中,我们成功构建了STZ诱导的大鼠糖尿病肾病模型,STZ组大鼠血糖、24 h尿蛋白、血清肌酐水平均显著升高,并且出现异常的肾脏组织病理形态学变化,胶原纤维的产生也明显增多。而erlotinib作用后,大鼠的血糖、24 h尿蛋白、血清肌酐水平均明显降低,肾脏组织的病理形态学异常变化明显改善,胶原纤维的产生也明显减少,表明肾组织的损伤程度明显减轻,揭示erlotinib对糖尿病肾病肾组织具有保护作用。
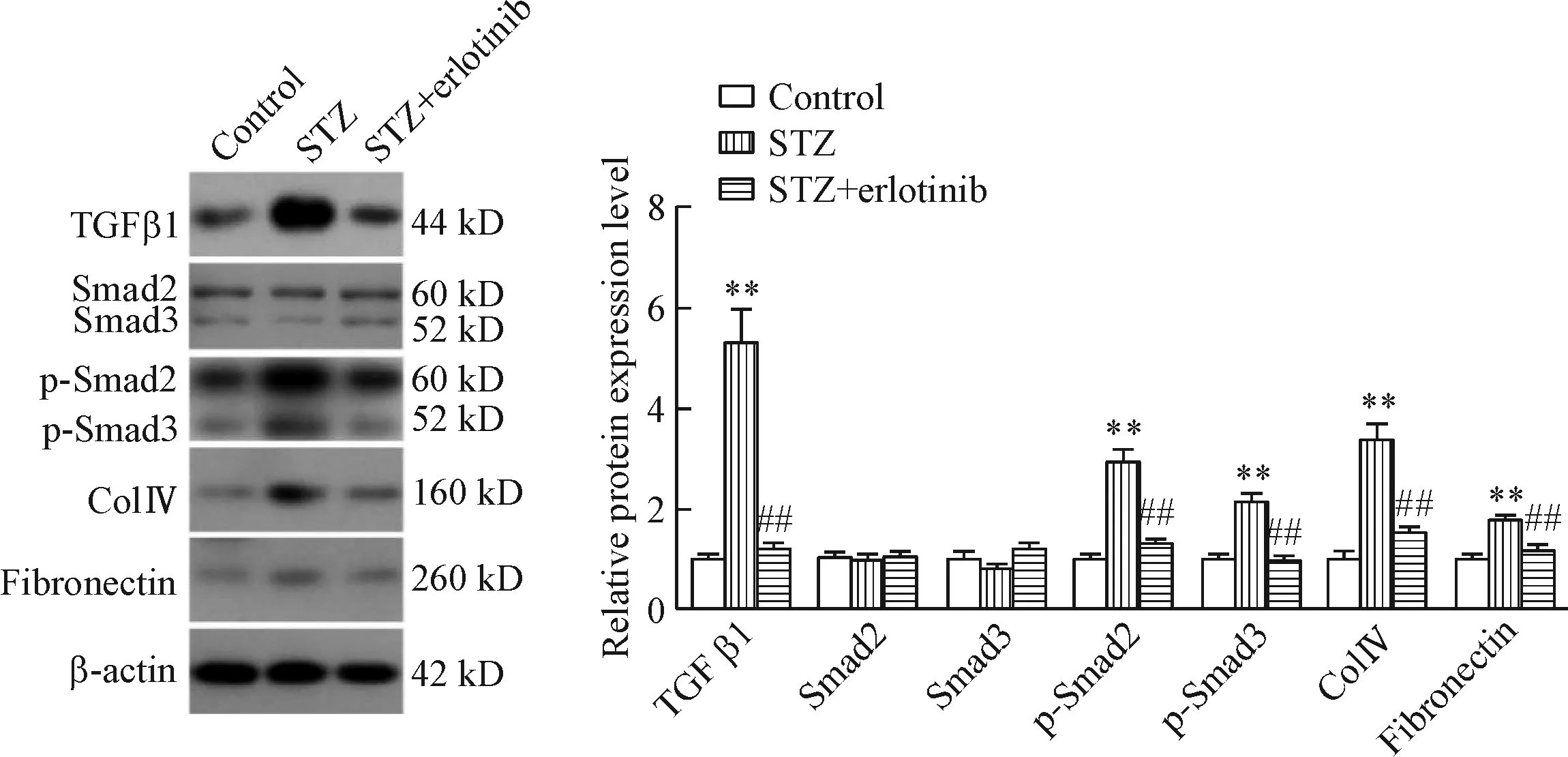
Figure 4.The DN rats were treated with erlotinib (100 mg·kg-1·d-1) for 4 weeks, and then the TGF β1, Smad2/3, p-Smad2/3, ColⅣ and fibronectin levels in rat kidney tissues were measured by Western blot.**P<0.01vscontrol group;##P<0.01vsSTZ group.
图4 厄洛替尼处理DN大鼠4周后各组大鼠肾组织中TGFβ1、Smad2/3、p-Smad2/3、ColⅣ和fibronectin的水平

Figure 5.The DN rats were treated with erlotinib (100 mg·kg-1·d-1) for 4 weeks, and then the levels of ROS and MDA in the rats kidney tissues of each group were detected by ROS assay and MDA assay, respectively. Mean±SD.n=6.*P<0.05,**P<0.01vscontrol group;#P<0.05,##P<0.01vsSTZ group.
图5 厄洛替尼处理DN大鼠4周后各组大鼠肾组织中的ROS水平和MDA水平
TGFβ1是导致纤维化的关键细胞因子,其通过增加细胞外基质的形成,促进了糖尿病肾病的肾小球硬化和肾小管间质纤维化过程[13-15],TGFβ1-Smad2/3信号通路的活化能够明显促进细胞外基质胶原和纤连蛋白的产生[16-17]。而EGFR的活化能介导TGFβ1-Smad2/3信号通路的激活[4, 18]。本课题组研究证实,STZ组大鼠肾组织中EGFR的活化水及TGFβ1的蛋白水平明显增高,Smad2/3的磷酸化水平也显著增加,表明EGFR的活化介导了TGFβ1-Smad2/3信号通路的激活。进一步的研究证实TGFβ1-Smad2/3信号通路的激活导致了STZ组大鼠肾组织中胶原和纤连蛋白水平增加。与STZ组相比,STZ+erlotinib组大鼠肾组织中EGFR和TGFβ1-Smad2/3信号通路的活化水平明显降低,胶原和纤连蛋白的表达水平也显著降低,揭示erlotinib通过抑制EGFR/TGFβ1-Smad2/3信号通路的活化减弱了糖尿病肾病肾组织的纤维化过程。
据文献报道,ROS水平的增加是糖尿病肾病肾组织损伤的重要原因[19],并且EGFR的活化及TGF β1信号通路的激活均能促进ROS水平的增加[10,20]。在本研究中也发现STZ组大鼠肾组织中的ROS及MDA水平显著升高,而与STZ组相比,STZ+erlotinib组大鼠肾组织中的ROS及MDA水平明显降低,表明erlotinib减弱了糖尿病肾病肾组织中的氧化应激反应。
综上所述,erlotinib通过抑制STZ所诱导的糖尿病肾病肾组织EGFR/TGFβ1-Smad2/3信号通路的激活,减弱了肾组织的纤维化和氧化应激反应,减轻了肾损伤,揭示了其保护糖尿病肾病大鼠肾组织的作用。本研究的发现为将erlotinib用于临床治疗糖尿病肾病提供了初步的理论依据。
[1] 赵乐萍, 金雷钢, 施立华, 等. CXCL16 缺失缓解STZ 诱导的糖尿病小鼠的肾脏病变[J]. 中国病理生理杂志, 2016, 32(2): 327-332.
[2] Xu L, Shen P, Bi Y, et al. Danshen injection ameliorates STZ-induced diabetic nephropathy in association with suppression of oxidative stress, pro-inflammatory factors and fibrosis[J]. Int Immunopharmacol, 2016, 38:385-394.
[3] 王国光, 张 翠, 陆晓华, 等. 核黄素对STZ诱导的大鼠糖尿病肾病的治疗作用[J]. 中国病理生理杂志, 2010, 26(7):1395-1398.
[4] Chen J, Chen JK, Harris RC. EGF receptor deletion in podocytes attenuates diabetic nephropathy[J]. J Am Soc Nephrol, 2015, 26(5):1115-1125.
[5] 唐夏莉, 焦德敏, 陈 君, 等. miRNA-126对肺癌 A549细胞的增殖、迁移、侵袭及 EGFR/AKT/mTOR信号通路的影响[J]. 中国病理生理杂志, 2016, 32(3): 458-463.
[6] Pines G, Köstler WJ, Yarden Y. Oncogenic mutant forms of EGFR: lessons in signal transduction and targets for cancer therapy[J]. FEBS Lett, 2010, 584(12):2699-2706.
[7] Chen J, Chen JK, Harris RC. Angiotensin II induces epithelial-to-mesenchymal transition in renal epithelial cells through reactive oxygen species/Src/caveolin-mediated activation of an epidermal growth factor receptor-extracellular signal-regulated kinase signaling pathway[J]. Mol Cell Biol, 2012, 32(5):981-991.
[8] Chen J, Chen JK, Nagai K, et al. EGFR signaling promotes TGFβ-dependent renal fibrosis[J]. J Am Soc Nephrol, 2012, 23(2):215-224.
[9] Tang J, Liu N, Tolbert E, et al. Sustained activation of EGFR triggers renal fibrogenesis after acute kidney injury[J]. Am J Pathol, 2013, 183(1):160-172.
[10]Liang D, Zhong P, Hu J, et al. EGFR inhibition protects cardiac damage and remodeling through attenuating oxidative stress in STZ-induced diabetic mouse model[J]. J Mol Cell Cardiol, 2015, 82:63-74.
[11]Zhang MZ, Wang Y, Paueksakon P, et al. Epidermal growth factor receptor inhibition slows progression of diabetic nephropathy in association with a decrease in endoplasmic reticulum stress and an increase in autophagy[J]. Diabetes, 2014, 63(6):2063-2072.
[12]Koya D. Epidermal growth factor receptor signaling and the progression of diabetic nephropathy[J]. J Diabetes Investig, 2015, 6(5):519-521.
[13]Zhao TT, Zhang HJ, Lu XG, et al. Chaihuang-Yishen granule inhibits diabetic kidney disease in rats through blocking TGF-β/Smad3 signaling[J]. PLoS One, 2014, 9(3):e90807.
[14]Hills CE, Squires PE. The role of TGF-β and epithelial-to mesenchymal transition in diabetic nephropathy[J]. Cytokine Growth Factor Rev, 2011, 22(3):131-139.
[15]Jazi MF, Biglari A, Mazloomzadeh S, et al. Recombinant fibromodulin has therapeutic effects on diabetic nephropathy by down-regulating transforming growth factor-β1 in streptozotocin-induced diabetic rat model[J]. Iran J Basic Med Sci, 2016, 19(3):265-271.
[16]Gruden G, Perin PC, Camussi G. Insight on the pathogenesis of diabetic nephropathy from the study of podocyte and mesangial cell biology[J]. Curr Diabetes Rev, 2005, 1(1):27-40.
[17]Lan HY. Transforming growth factor-β/Smad signalling in diabetic nephropathy[J]. Clin Exp Pharmacol Physiol, 2012, 39(8):731-738.
[18]Chen J, Chen JK, Nagai K, et al. EGFR signaling promotes TGFβ-dependent renal fibrosis[J]. J Am Soc Nephrol, 2012, 23(2):215-224.
[19]Kashihara N, Haruna Y, Kondeti VK, et al. Oxidative stress in diabetic nephropathy[J]. Curr Med Chem, 2010, 17(34):4256-4269.
[20]Yang JH, Kim SC, Kim KM, et al. Isorhamnetin attenuates liver fibrosis by inhibiting TGF-β/Smad signaling and relieving oxidative stress[J]. Eur J Pharmacol, 2016, 783:92-102.
(责任编辑: 卢 萍, 余小慧)
Effect of erlotinib on renal injury in rats with STZ-induced diabetic nephropathy
HUANG Tian, CAI Xi, ZHONG Ling
(DepartmentofNephrology,TheSecondAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400010,China.E-mail: 536576113@qq.com)
AIM: To investigate the effect of epidermal growth factor receptor (EGFR) inhibitor erlotinib on kidney injury in diabetic nephropathy (DN) rat and the underlying mechanism. METHODS: The rat model of DN was induced by intraperitoneal injection of streptozotocin (STZ) at dose of 55 mg/kg. One week after STZ injection, the rats with blood glucose level exceeding 16.7 mmol/L were identified as diabetic. Diabetic rats were randomly divided into 2 groups: STZ group and STZ+erlotinib group. In addition, the normal rats were used as control group. The rats in STZ+erlotinib group were treated with erlotinib at 100 mg·kg-1·d-1for 4 weeks(5th~8th week). The fasting blood glucose (FBG), serum creatinine (SCr) and 24 h urine protein were measured. The pathological changes of the kidney were observed by HE staining and Masson staining. The protein levels of EGFR, p-EGFR, transforming growth factor β1 (TGFβ1), Smad2/3, p-Smad2/3, collagen Ⅳ (ColⅣ) and fibronectin in the kidney tissues were determined by Western blot. The reactive oxygen species (ROS) level and malondialdehyde (MDA) content in the renal tissues were futher analyzed. RESULTS: Compared with control group, the levels of FBG, 24 h urine protein and Scr were significantly increased in STZ group (P<0.01). Compared with STZ group, the levels of FBG, 24 h urine protein and SCr in STZ+erlotinib group were markedly decreased (P<0.05). In additon, the glomerular structure was restored to normal, the proliferative degree of mesangial cells markedly attenuated, and the epithelial cells were in alignment in STZ+erlotinib group. Moreover, erlotinib significantly inhibited the protein levels of p-EGFR, TGFβ1, p-Smad2/3, ColⅣ and fibronectin in the kidney tissues of STZ rats. In addition, erlotinib also significantly inhibited the levels of ROS and MDA in the kidney tissues of STZ rats. CONCLUSION: Erlotinib ameliorates STZ-induced diabetic nephropathy possibly through inhibiting the activation of EGFR/TGFβ1-Smad2/3 signaling pathway in association with suppression of fibrosis and oxidative stress.
Diabetic nephropathy; Erlotinib; Epidermal growth factor receptor; Transforming growth factor β1
1000- 4718(2017)08- 1460- 07
2016- 12- 12
2017- 04- 01
R587.1; R965
A
10.3969/j.issn.1000- 4718.2017.08.019
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13896155895; E-mail: 536576113@qq.com
