大黄煎煮提取主要成分含量变化规律研究
2017-09-03李芳田明国紫薇高士平贾静丽姚丽琴
李芳,田明,国紫薇,高士平,贾静丽,姚丽琴
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
中 药 研 究
大黄煎煮提取主要成分含量变化规律研究
李芳,田明*,国紫薇,高士平,贾静丽,姚丽琴
(黑龙江中医药大学,黑龙江 哈尔滨 150040)
目的:对大黄水煎煮提取游离蒽醌、结合性蒽醌和鞣质类成分含量的变化规律进行研究。方法:采用分光光度法,测定大黄不同煎煮时间游离蒽醌、结合蒽醌和鞣质成分的含量。结果:随着大黄煎煮时间的延长,蒽醌类和鞣质成分含量均逐渐增加,120 min左右达峰值。结论:大黄久煎后,结合蒽醌含量较稳定,鞣质含量增加。
大黄;蒽醌;鞣质;含量测定
大黄味苦性寒,具有泻下导滞,清热泻火的功效,是临床常用中药。大黄中主要含有蒽醌类、鞣质类等多种成分[1-2]。研究表明,蒽醌类是大黄泻下作用的主要有效成分,其中结合型蒽醌作用最强[3]。但是,对其煎煮时间与有效成分的溶出有很多不同的认识[4-5],本文采用紫外-分光光度法,对大黄不同煎煮时间蒽醌类和鞣质类成分含量的变化规律进行研究。
1 实验材料
1.1 药材与试药
大黄饮片购自哈尔滨华泰大药房,经鉴定为蓼科植物掌叶大黄(RheumpalmatumL.)的根和根茎。1,8二羟基蒽醌,购自中国医药上海化学试剂公司;没食子酸,购自中国药品生物制品鉴定所。其余试剂均为分析纯,实验用水为纯化水。
1.2 仪器
电子天平BSA224S(赛多利斯科学仪器北京有限公司);旋转蒸发器RE-52A(上海亚荣生化仪器厂);UV-1601PC紫外-可见分光光度计(日本岛津公司)。
2 实验方法与结果
2.1 大黄不同煎煮时间样品的制备
取大黄饮片粉碎成最粗粉,称取20 g。取水200 mL,置于500 mL双口圆底烧瓶中,回流加热至沸腾,加入大黄粗粉,计时。分别在10、20、30、40、60、80、100、120、140、160、180、200、220、240、260、280、300 min吸取提取液10 mL,并极时补充等量的水。分别将各取样点提取液滤过,收集滤液,密封保存。即得大黄17个不同煎煮时间点的样品。
2.2 样品中蒽醌类成分的含量测定
2.2.1 标准曲线的制备
精密称取干燥至恒重的1,8-二羟基蒽醌对照品1.05 mg,加甲醇定容在10 mL量瓶中,摇匀,得0.105 mg/mL的对照品溶液。分别精密量取对照品溶液0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL、1.2 mL、1.4 mL、1.6 mL置10 mL容量瓶中,1%醋酸镁甲醇溶液稀释至刻度,摇匀。以1%醋酸镁溶液作为空白对照,在510 nm处测定吸收值[6-7],以浓度(μg/mL)为横坐标,吸收值为纵坐标,绘制标准曲线,得回归方程:Y=0.042 2X+0.049 4,R2=0.999 4。
结果表明:1,8-二羟基蒽醌含量在2.10~16.8 μg/mL的范围内与吸收值呈良好线性关系。
2.2.2 游离蒽醌的含量测定
取2.1项下大黄不同煎煮时间点的样品2.0 mL,分别置于分液漏斗中,加入10%盐酸5 mL,加入三氯甲烷溶液萃取4次,每次10 mL,分取三氯甲烷层,剩余的溶液备用。合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇溶解,定量转移至10 mL容量瓶中。从中取2 mL于10 mL量瓶中,加1%醋酸镁甲醇溶液稀释至刻度,摇匀。以1%醋酸镁溶液作为空白对照,在510 nm处测定吸收值。
2.2.3 结合蒽醌的含量测定
取2.2.2项下剩余的溶液,加入10%盐酸溶液5 mL,100 ℃水浴回流1 h,放冷,置分液漏斗中,加入三氯甲烷萃取4次,每次10 mL,分取三氯甲烷层,剩余的溶液备用。合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇溶解,定量转移至10 mL容量瓶中。从中取2 mL于10 mL量瓶中,加1%醋酸镁甲醇溶液稀释至刻度,摇匀。以1%醋酸镁溶液作为空白对照,在510 nm处测定吸收值。
2.3 鞣质类成分的含量测定
2.3.1 标准曲线的制备
精密称定没食子酸对照品2.5 mg,加甲醇定容在50 mL量瓶中,制成0.05 mg/mL的溶液。分别精密量取对照品溶液1.0 mL、2.0 mL、3.0 mL、4.0 mL、5.0 mL至25 mL棕色量瓶中,加磷钼钨酸溶液1.0 mL,再加水11 mL、10 mL、9 mL、8 mL、7 mL,用29%碳酸钠溶液稀释至刻度,摇匀。以随行溶液为空白,在760 nm处测定吸收值[8-9],以浓度(μg/mL)为横坐标,吸收值为纵坐标,绘制标准曲线,得回归方程:Y=0.042 4X+0.139,R2=0.999 4。
2.3.2 鞣质类含量测定
取2.2.3项下剩余的溶液分别置于50 mL量瓶中,加水稀释至刻度,得贮备液。精密量取贮备液各2.0 mL,置于25 mL棕色量瓶中,加水10.0 mL,加磷钼钨酸溶液1.0 mL,用29%碳酸钠溶液稀释至刻度,摇匀。以随行溶液为空白,在760 nm处测定吸收值。
2.4 实验结果
以上述实验测得的吸收度值,代入标准曲线,分别计算游离蒽醌、结合蒽醌和鞣质相对含量,累积折合计算各时间点每100 mL煎煮液中的总含量。总蒽醌含量是游离蒽醌和结合蒽醌含量的加和。计算结果如表1;不同提取时间各含量变化曲线如图1~2。
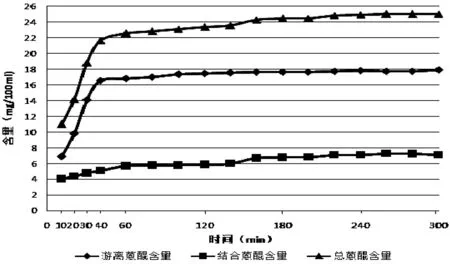
图1 大黄不同提取时间游离蒽醌、结合蒽醌及总蒽醌含量变化曲线图
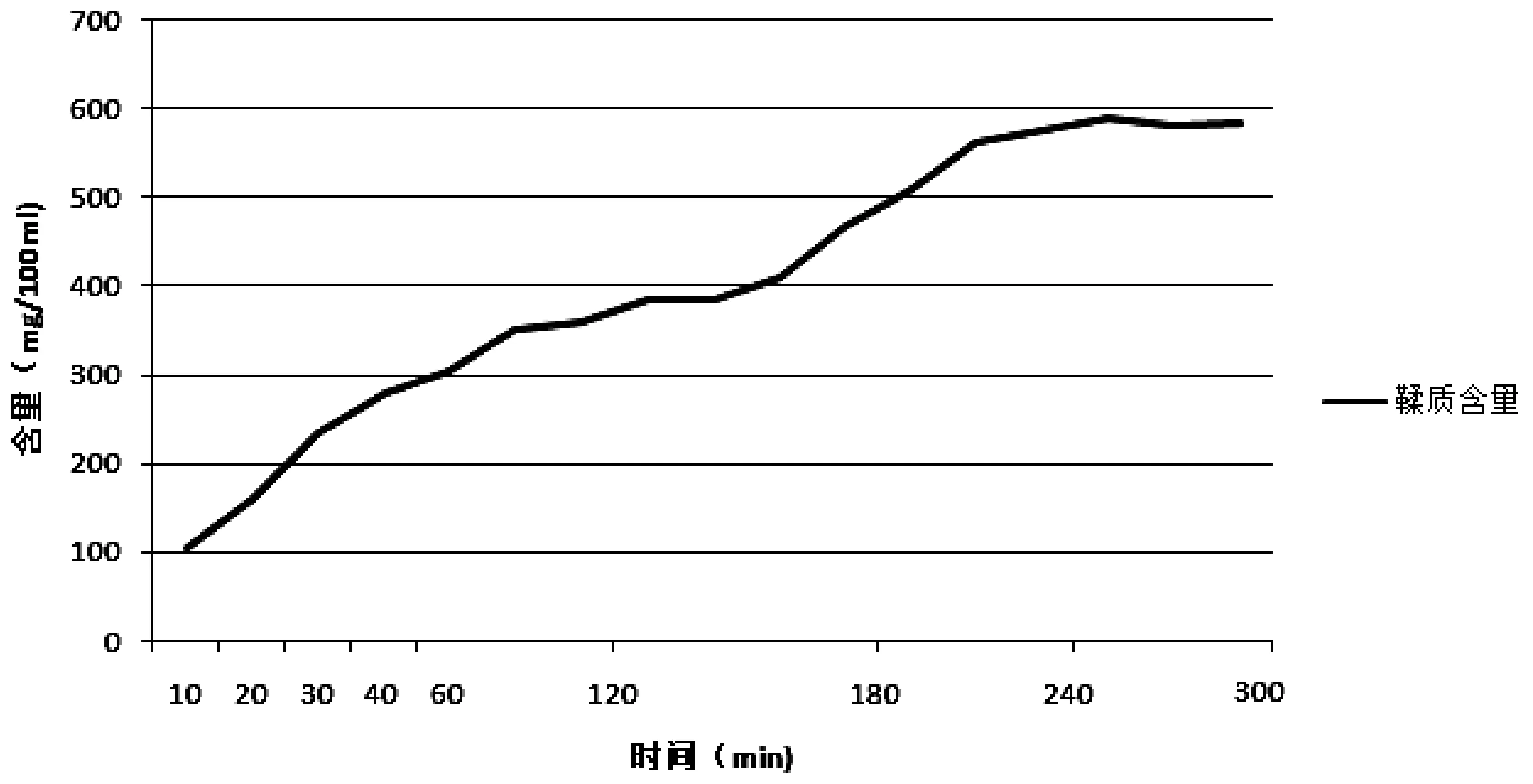
图2 大黄不同提取时间鞣质含量变化曲线图
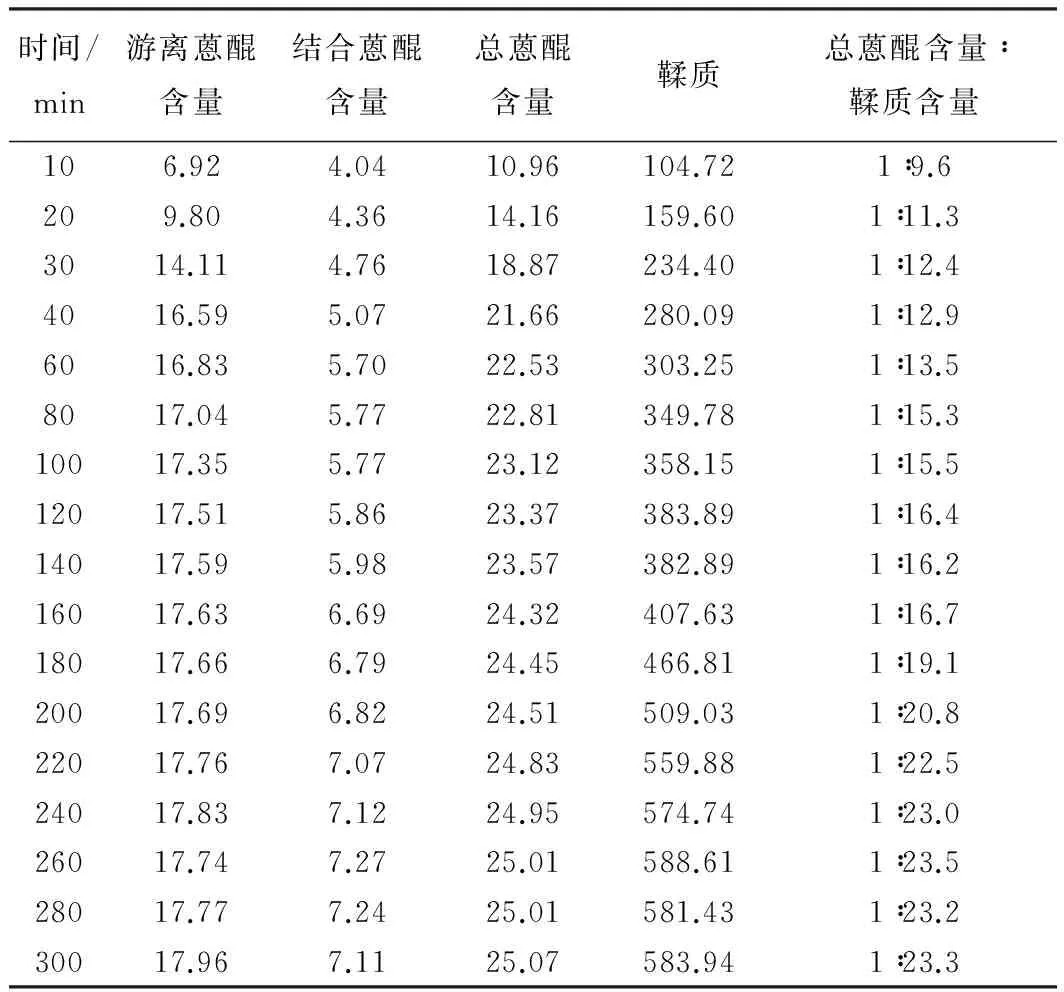
时间/min游离蒽醌含量结合蒽醌含量总蒽醌含量鞣质总蒽醌含量∶鞣质含量106.924.0410.96104.721∶9.6209.804.3614.16159.601∶11.33014.114.7618.87234.401∶12.44016.595.0721.66280.091∶12.96016.835.7022.53303.251∶13.58017.045.7722.81349.781∶15.310017.355.7723.12358.151∶15.512017.515.8623.37383.891∶16.414017.595.9823.57382.891∶16.216017.636.6924.32407.631∶16.718017.666.7924.45466.811∶19.120017.696.8224.51509.031∶20.822017.767.0724.83559.881∶22.524017.837.1224.95574.741∶23.026017.747.2725.01588.611∶23.528017.777.2425.01581.431∶23.230017.967.1125.07583.941∶23.3
3 讨论
现代药学研究表明:大黄中主要活性成分主要是蒽醌类和鞣质,蒽醌类成分是致泻下作用的主要成分,其中结合蒽醌作用最强。而鞣质确有止泻作用,长期服用使致泻作用减弱或致便秘[10]。由上述验结果可见,随着大黄煎煮时间的延长,游离蒽醌和结合蒽醌的含量逐渐增加,游离蒽醌含量从100 min后趋于平稳;结合蒽醌从160 min后趋于平稳;鞣质含量至240 min后趋于平稳。有些文献[11-12]或传统理论认为大黄久煎煮结合蒽醌不稳定,易水解生成游离蒽醌而使泻下作用减弱,所以要后下,短时间煎煮。本实验结果表明:结合蒽醌是比较稳定的,并没有水解而使游离蒽醌增加。大黄久煎使鞣质含量增加,可能是导致泻下作用减弱的原因,这还需要药效学进一步的验证,从大黄总蒽醌和鞣质随煎煮时间溶出比值来看,大黄后下煎煮20 min以内为好。
[1] 傅兴圣,陈菲,刘训红,等.大黄化学成分及药理作用研究新进展[J].中国新药杂志,2011,20(16):1534-1538.
[2] 李佳佳,梁耀月,董世芬,等.大黄酸对3T3-L1前脂肪细胞增殖分化及相关基因表达的影响[J].中医药信息,2017,34(1):1-5.
[3] 唐大轩,谭正怀,梁媛媛,等.大黄蒽醌致泻作用及其机理的初步研究[J].时珍国医国药,2007,18(6):1312-1314.
[4] 雷鹏,李新中,朱诗塔,等.煎煮方法对生大黄主要成分含量的影响[J].中国医院药学杂志,2010,30(4):283-286.
[5] 苏子仁,曾元儿,周华,等.大黄煎煮过程的化学变化初探[J].中国中药杂志,1999,24(5):291-292.
[6] 聂可.大黄药理作用研究及思考[J].山东中医药大学学报,2009,33(3):239-240.
[7] 杨士友,黄世福,田军,等.不同提取方法对大黄泻下成分的影响[J].安徽医药,2004,9(2):90-93.
[8] 郭增军,孙启时,龙丽辉,等.九牛造中总鞣质提取方法和没食子酸含量测定研究[J].中药材,2007,30(11):1390-1401.
[9] 国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:203.
[10] 刘卫华.谈中药鞣质成分在临床中的应用[J].黑龙江中医药,2005(4):55-56.
[11] 刘刚彦,叶强,余葱葱,等.煎煮时间对大黄蒽醌类成分的影响研究[J].陕西中医学院学报,2011,34(2):79-81.
[12] 高应斗,李伯阳.大黄的致泻作用及其机理[J].山西医药杂志,1985,14(5):304-306.
Study on Variation Regularity of Main Components in Rhubarb Decocting
LI Fang, TIAN Ming, GUO Zi-wei, GAO Shi-ping, JIA Jing-li, YAO Li-qin
(HeilongjiangUniversityofChineseMedicine,Harbin150040,China)
Objective:To study the contents of free anthraquinone, bound anthraquinone and tannin in water-coction extract. Methods: The contents of free anthraquinone, bond anthraquinone and tannin in rhubarb were determined by spectrophotometry. Results: The contents of anthraquinones and tannins increased gradually with the prolonging decocting time, and reached the peak in about two hours. Conclusion:The content of bound anthraquinone was stable in long-time decoction of rhubarb with increased tannin.
Rhubarb; Anthraquinone; Tannin; Content determination
2016-11-24
2016-12-15
李芳(1992-),女,硕士研究生,研究方向:中药新药研究与开发。
*通讯作者:田明(1963-),男,教授,硕士研究生导师,研究方向:中药新药研究与开发。
R284.1
A
1002-2392(2017)04-0062-02
