原发性中枢神经系统血管炎诊断和治疗中国专家共识
2017-09-03中国免疫学会神经免疫学分会中华医学会神经病学分会神经免疫学组
中国免疫学会神经免疫学分会 中华医学会神经病学分会神经免疫学组
中国医师协会神经内科医师分会神经免疫专员委业会
原发性中枢神经系统血管炎诊断和治疗中国专家共识
中国免疫学会神经免疫学分会 中华医学会神经病学分会神经免疫学组
中国医师协会神经内科医师分会神经免疫专员委业会
血管炎,原发性;中枢神经系统;共识
原发性中枢神经系统血管炎(primary angiitis of the central nervous system,PACNS;primary central nervous system vasculitis,PCNSV)是主要局限于脑实质、脊髓和软脑膜的中小血管的罕见重度免疫炎性疾病。1922年Harbitz首次报道了一种原因不明的血管炎[1];1959年Cravioto和Feigin将其称为孤立性中枢神经系统血管炎,并作为一种独立疾病首次被提出[2]。1988年Calabrese 和Mallek系统报道了8例该类疾病病例,并将其统一命名为PACNS并系统地提出初步临床诊断标准[3],2009年Birnbaum和Hellmann对既往报道进行综述,提出补充诊断标准[4],2011年Hajj-Ali等[5]依据临床表现、影像学检查及脑组织病理活检结果提出分类标准。PACNS目前仍属于罕见病,全世界报道总数迄今约500余例[6],而且其中有部分患者属于可逆性脑血管收缩综合征(reversible cerebral vasoconstriction syndromes,RCVS)。2015年美国梅奥诊所Salvarani等所报道的163例PACNS患者为目前关于该病最大样本的报道[7]。国内仅有数例PACNS零星报道,尚缺乏大样本研究。随着神经影像和病理活检技术的发展,对该病诊断的临床准确性不断提高。本文专家组针对PACNS的流行病学、临床表现及分类、诊断及治疗进行讨论,形成专家共识,以指导临床诊治PACNS。
1 流行病学
迄今为止,PACNS自然人群的发病率和患病率尚不明确,目前文献报道推算的发生率约2.4/106[6],女性患者稍多[8],美国梅奥诊所的163例样本研究中男女比例约0.8∶1[7]。PACNS可发生于任何年龄,以40~60岁多发,偶见于儿童[8]。
2 临床表现
PACNS通常缓慢起病,少数也可急性起病,病程可有复发缓解,也可进行性加重。临床表现与受累血管大小、血管炎病理分型有关,常无特异性症状和体征。头痛、认知障碍以及持续性局灶神经功能缺损或脑卒中的相关表现是PACNS最常见的临床表现,也是2/3以上PACNS患者的首发症状。偏瘫多见于较大血管受累[8],癫痫多见于儿童。部分成人患者可合并淀粉样血管病。
2.1 头痛 头痛为PACNS的最常见症状,可见于PACNS患者的50%~60%[7],可能与血管炎本身、软脑膜炎性反应、颅内压增高、脑出血或梗死等血管事件有关。头痛的形式程度不一,常表现为亚急性、隐袭起病,少数可呈急性起病、进行性加重。
2.2 脑血管事件 脑血管事件可见于30%~50%的PACNS患者,呈急性起病,多表现为多次发作的、累及不同供血区的多发梗死(40.5%),或短暂性脑缺血发作(25.8%),也可合并脑出血(9.8%~12.2%)。患者可出现局灶神经功能缺损症状(83.0%)〔如失语(24.5%)〕,运动障碍包括瘫痪(4.9%)、共济失调(12.0%~19.0%),视觉症状(15.0%)〔包括视野缺损(18.4%)、持续性或一过性视物成双(14.0%)、视物不清(11.0%)、视乳头水肿(4.3%)、一过性黑矇(1.2%)等〕,其他症状包括帕金森综合征等锥体外系症状(0.6%)、恶心呕吐、眩晕、头晕、构音不清等[7,9]。
2.3 脑病表现 此组表现主要包括癫痫发作(20.2~33%)、精神症状(25%)、意识或认知功能障碍(54~62%)、遗忘综合征(6.1%)等[7,9]。
2.4 脊髓病表现 PACNS中约5%有脊髓受累症状,单纯脊髓受累罕见[10]。患者多伴后背疼痛[11],表现为进行性截瘫[11],累及肢体、骶尾部的麻木感,尿便障碍等[10]。
2.5 视神经炎 PACNS中视神经炎较罕见,目前仅有数例PACNS相关视神经炎的文献报道[12-13],可表现为单侧或双侧视力下降、眼球转动疼痛,可伴有轻度头痛。
3 辅助检查
血清学、脑脊液检查及神经影像学(包括血管造影)异常结果对于PACNS通常不具有特异性,但能为其鉴别诊断提供依据,而且若脑脊液(CSF)检查和头MRI结果均为阴性,则PACNS可能性较小[14]。皮层下联合软脑膜的组织活检发现原发的血管透壁性损害及血管破坏性炎性反应是诊断PACNS的金标准。
3.1 实验室检查 实验室检查主要用于排除与PACNS表现相似的其他疾病,目前尚无明确的实验室检查指标可以用来诊断或除外PACNS。
3.1.1 血清学:血清学检查的主要目的在于排除潜在的相关疾病。少数PACNS可见红细胞沉降率(ESR)、C反应蛋白(CRP)轻度升高[7,9,15-16]。若ESR、CRP升高明显或同时伴有抗中性粒细胞胞质抗体(ANCA)、抗心磷脂抗体(ACLA)、狼疮抗凝物、血清补体、冷沉淀球蛋白等急性期反应物明显升高,应考虑累及全身的感染或炎性反应过程、相关结缔组织病等继发性中枢神经系统血管炎。
3.1.2 CSF:CSF表现异常对于PACNS虽然不具有特异性,但可用于排除感染和恶性病变。PACNS患者通常无颅内压显著升高的征象,多表现为无菌性脑膜炎,患者中约90%CSF的淋巴细胞数(平均<2×105个/L)和蛋白水平(平均<1.2 g/L)可见轻或中度升高[17],活检阳性者升高更明显[7],偶尔可见寡克隆区带阳性、IgG鞘内合成率增高[17]。
3.2 影像学检查 近年来,由于神经影像技术的发展,尤其是脑血管检查技术进步,神经影像学检查在临床上对PACNS的诊断、鉴别诊断及分型具有重要意义。根据检查目标内容,影像学方法可分为三类,(1)血管管腔检查:包括DSA、MRA、CTA及经颅多普勒超声等检查方法;(2)血管管腔和管壁检查:主要包括高分辨磁共振成像(HR-MRI)及黑血序列BB-MRI(T1-weighted fat-blood suppressed sequence)等检查方法,可清晰辨识管腔内部结构;(3)脑实质检查:包括MRI、CT、SPECT、PET等检查方法[18]。
3.2.1 CT:PACNS患者中约1/3~2/3经头颅CT检查可显示不同程度的异常低密度信号影,约12%伴有颅内出血[19],可表现为脑实质、蛛网膜下腔、脑室高密度影[20];也可见深部白质钙化[21]。由于CT敏感度较低,临床常被MRI取代。
3.2.2 MRI:MRI是对PACNS最敏感的影像学检查方法,PACNS患者通过MRI检查约90%~100%可有阳性发现[7,9]。应用MRI不同的序列成像方法更容易发现PACNS的异常表现,常见的颅脑MRI异常表现有以下10种[22],具体见图1。
(1)正常:这种情况见于少数PACNS早期,此时可通过磁灌注成像来提高诊断敏感性[23];
(2)同时累及皮层和皮层下的多发梗死[7,24]:此种情况在PACNS中较常见,可呈中血管或其分支供血区梗死,也可表现为小动脉型梗死,常见部位依次为皮层下白质、深部灰质、深部白质、皮层,呈T2、FLAIR高信号[17,24];
(3)进行性融合的白质病灶[25],此表现易被误诊为脱髓鞘疾病;
(4)DWI多发高信号,可见于PACNS急性期;
(5)脑实质内大小血肿;
(6)脑实质多发微出血:梯度回旋MRI SWI可表现为无症状的多发斑点状微出血灶,结合其他序列的多发缺血证据,更利于诊断PACNS[26];
(7)脑实质多发小的强化病灶[21];
(8)单发或多发大块强化病灶,可伴水肿、小血管强化,易被误诊为肿瘤[27];
(9)血管周围间隙扩大伴强化[28-29];
(10)软脑膜的强化病灶,此表现可见于约9%的PACNS。
脊髓MRI检查多表现为脊髓胸段受累,矢状位可见多发小片状均匀强化,轴位可见后部及软脊膜小点状均匀强化[28]。
近年出现新的针对颅内血管的MRI成像技术,如HR-MRI可见脑部病变处血管管壁向心性增厚及强化〔可以与RCVS鉴别(图2)〕;BB-MRI可清晰辨识管腔内部结构(图3),均有助于PACNS的诊断及鉴别诊断[17,30]。
3.2.3 颅内血管检查:此类检查方法包括DSA、CTA、MRA、超声等,对于诊断PACNS的敏感性不高,阳性结果可作为疑诊PACNS的证据。当受累血管管径小于0.2 mm时,脑血管造影常为阴性结果;当大血管受累时,常表现为双侧大脑半球多发的血管节段性狭窄和狭窄后的扩张,呈串珠样[8,31],也可表现为向心或偏心性管腔狭窄、边缘锐利的多发性闭塞[17,32]、脊髓或脑血管的多发微动脉瘤[20,33-34],具体见图4。
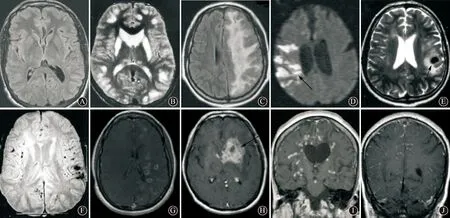
A:正常FLAIR;B:T2皮层下多发梗死;C:FLAIR白质融合病灶;D:DWI多发高信号(箭头所示);E:T2血肿伴周围水肿(箭头所示);F:SWI多发微出血;G:T1多发小的强化病灶;H:T1大块的强化病灶(箭头所示);I:T1血管周围强化;J:T1脑膜强化 图1 PACNS患者的不同序列MRI表现

图2 颈内动脉终末段及M1近端PACNS与RCVS患者HR-MRI表现比较:PACNS患者(41岁女性)右侧颈内动脉终末段及M1近段血管壁强化(A);RCVS患者(61岁女性)双侧A1段和M2段管壁均匀狭窄、未见血管壁强化(B)
目前MRA检查所使用的场强多为1.5 T或3.0 T,其空间分辨率远低于DSA,仅能用于大中血管的评价,包括不需对比剂的时间飞跃序列(time-of-flight MRA)、需对比强化的CE MRA;在高场强(>7.0 T)下MRA分辨率可达到120 μm,可用于评价更小的血管[18]。
血管超声检查中,灰度超声空间分辨率约0.1 mm,可探及大、中血管改变;彩色多普勒超声可提供血流信息,但是难以穿透颅骨,故不常用于PACNS的诊断,不过可用于探测颅外动脉进行鉴别诊断[18]。
3.2.4 其他技术:氟脱氧葡萄糖-PET(fluorode oxyglucose-PET,FDG-PET)可通过检测葡萄糖代谢了解有无血管炎性改变,仅适用于观察管径大于4 mm的血管,并且易受邻近脑组织代谢影响,一般不用于PACNS检查;SPECT可有效评价低灌注,但空间分辨率较低,也不常用于PACNS检查。
3.3 组织活检 脑和脑膜组织活检为诊断PACNS的金标准。PACNS的典型病理改变特征为原发的血管透壁性损害及血管破坏性炎性反应[16]。
3.3.1 主要组织病理分型:PACNS常见的病理类型有肉芽肿性血管炎、淋巴细胞性血管炎、坏死性血管炎、β淀粉样蛋白相关性脑血管炎(Aβ-related angitis,ABRA)等(图5)。
(1)肉芽肿性血管炎:这是最常见的病理类型。该型主要特征是以血管为中心的单核细胞浸润伴肉芽肿形成,肉芽肿可见于管壁全层,主要以淋巴细胞、噬细胞和浆细胞浸润为主,也可见朗格汉斯细胞和巨细胞浸润。
(2)淋巴细胞性血管炎:这是次常见的病理类型,突出表现为血管周围大量淋巴细胞及少量浆细胞浸润,后期可出现血管壁的扭曲和破坏,而脑实质内炎性反应并不明显[8]。

图3 一例34岁男性PACNS患者脑动脉MRA与BB-MRI表现对比:MRA(A)可见右颈内动脉末端及M1段重度狭窄(箭头所示);黑血序列BB-MRI可见管腔内部狭窄(B),局部放大(C图为B图中方框内容的放大)后,相应放大的管壁可见中度管壁强化(图D中箭头所示)
(3)坏死性血管炎:该型病情较重,预后较差,主要累及小肌性动脉,表现为血管壁急性炎性反应、透壁样血管坏死和内弹力层破坏,多伴有蛛网膜下腔出血[8]。
(4)ABRA:约占活检阳性PACNS的1/4,常为软脑膜、皮层小血管周围巨细胞、淋巴细胞浸润性炎性反应、淀粉样蛋白沉积,可伴肉芽肿形成,也可见局灶出血、纤维素样坏死、栓塞及再通[35]。
3.3.2 病理诊断标准:脑组织病理活检的诊断PACNS的标准为:(1)淋巴细胞性炎性反应:脑实质、软硬膜血管周围2层以上淋巴细胞浸润,(2)管壁改变,管壁模糊不清、内皮细胞明显可见,(3)缺血改变,(4)噬神经细胞现象,(5)脑水肿,(6)除外其他诊断。符合上述(1)-(6)条为确诊的PACNS,符合(2)-(6)条为很可能的PACNS[36]。
3.3.3 取材及注意事项: 由于PACNS系斑片状侵犯脑组织,脑深部取材受限,活检假阴性率约25%;在MRI异常区域靶向取材、脑实质软脑膜联合取材、开放式活检等可以增加阳性率[17]。脑组织活检为有创性检查,目前引起出血、感染等并发症几率约4.9%,引起神经功能缺失后遗症几率约1%[8]。因此进行活检术取材时应注意:(1)位于非优势侧的强化病灶为理想的活检部位,若病灶均为明确的神经功能区,可选择非病灶区替代进行活检;(2)应选取病灶的中心部位,最好包括软硬脑膜或脊膜;(3)缺乏脑实质病灶时,最好选非优势半球额颞叶取材,并应含有软硬脑膜及皮层。
4 诊断标准
4.1 诊断标准 近年来临床倾向于将PACNS视为有多种临床及病理亚型的谱系疾病。目前仍以脑活检为诊断PACNS的金标准,临床诊断仍旧广泛沿用Calabrese 和Mallek 1988年的诊断标准[3]。具体如下:
·临床标准
患者病史或临床检查提示有神经功能缺损,通过多方面评价后仍不能用其他病变解释。
·影像学和组织学标准
由影像和/或病理证实的中枢神经系统血管炎性过程。
·排除标准
无任何证据显示有系统性血管炎,或有任何证据显示血管炎为继发性,如梅毒性血管炎。
注:应符合以上所有条件,儿童型PACNS要求发病年龄大于1个月、小于18岁。
4.2 补充标准 2009年Birnbaum 和Hellmann等在此基础上提出了新的补充诊断标准[4],用以排除RCVS。
·确诊的PACNS:活检确诊的PACNS(金标准);
·很可能的PACNS:A缺乏活检资料;B血管造影、MRI、CSF表现符合PACNS表现。
5 临床分型
2011年Hajj-Ali等[5]提出依据临床表现、影像学检查(主要包括脑血管造影、头和脊髓MRI)及脑组织病理活检结果进行分型的标准;2015年美国梅奥诊所回顾了163例PACNS患者后将其按临床表现分为五型。综合上述观点并根据脑脊髓血管受累的大小,将PACNS分为造影阳性型(中、大血管受累型)、造影阴性型(小血管受累型)及脊髓型(少数累及脊髓)三种类型,再根据临床表现及脑组织病理结果进一步分为几种亚型。
5.1 脑血管造影阳性型
5.1.1 根据受累血管大小分亚型:此型可根据受累血管大小进一步分为近端血管受累型(颈内动脉、椎动脉、基底动脉、大脑前中后动脉近端)、远端血管受累型(颅内动脉及次级分枝或更小血管)。脑血管造影阳性型患者近端远端多同时受累,而远端血管受累(91.2%)较近端血管受累(66.4%)更常见,且远端血管(82.3%)比近端血管(54.9%)更常见双侧受累,更常见偏瘫、持续性神经功能缺损或脑卒中、TIA、视野缺损等表现。
5.1.2 根据临床表现分亚型:根据临床表现可分为脑梗死型、颅内出血型及快速进展型。(1)脑梗死型:约见于一半的PACNS,是PACNS中最常见的类型,可见于任何年龄,尤其多见于年轻人,多累及双侧大脑半球多血管不同供血区,MRI可见T2、DWI高信号,可通过磁共振灌注成像增加敏感度。(2)颅内出血型:此型可见于约12%的PACNS,亚急性起病,多见于女性,脑实质出血较蛛网膜下腔出血更常见。其深部脑白质血肿多由血管破裂引起,而出血性皮层梗死多与再灌注损伤相关[37]。此型患者常见剧烈头痛,头痛程度逐渐加重、持续时间逐渐延长,可经治疗后改善,MRI可见颅内及脑膜强化病灶,血管造影表现多符合血管炎改变且可表现为双侧多发大、中、小血管受累。病理表现多提示坏死性血管炎。与其他类型的PACNS相比,较少见认知功能障碍、持续性神经功能缺损。对糖皮质激素(简称“激素”)、免疫抑制剂反应好,病情稳定后需要维持治疗的比例低于非出血型(62.5%vs. 86.1%,P=0.03)[19]。(3)快速进展型:约占PACNS的8%,为所有PACNS中预后最差的一型,致死率高,较其他类型更常见下肢瘫痪或四肢瘫痪,造影多见双侧多发大血管受累,MRI可见双侧皮层及皮层下多发梗死,活检阳性者表现为坏死性血管炎或肉芽肿型。一经诊断应当立刻静脉甲泼尼龙冲击联合环磷酰胺进行强化治疗[38]。
5.2 脑血管造影阴性型 此型又称小血管受累型。小血管定义为管径小于300 μm的脑血管[18]。小血管受累更常见认知障碍表现,多根据活检结果明确诊断。依据临床表现和组织病理的不同,此型可以分为下述类型。
5.2.1 肉芽肿性PACNS:脑组织活检可见小血管肉芽肿性血管炎。此型表现为隐袭起病的头痛、弥漫性或局灶性神经功能受损,患者中90%伴无菌性脑膜炎;造影偶见血管壁破坏引起的多发动脉瘤形成,随自身修复可自行消失[33]。该型患者MRI常表现为颅内单发或多发的占位病灶,常被误诊为颅内肿瘤,8%患者MRI可见软脑膜强化。有脑膜强化的患者常急性起病,与无脑膜强化的PACNS相比,发病较晚,认知功能障碍更常见,治疗反应及预后相对较好[39]。
5.2.2 淋巴细胞性PACNS:此型主要见于造影阴性的儿童患者[9],可与肉芽肿性的PACNS有相似的临床、影像及脑脊液表现,不同点在于脑活检可见血管壁多克隆性淋巴细胞浸润,大部分以T细胞为主[13,40],少数以B细胞为主[41]。MRI可见脑室周围沿血管走行的线状强化[13],部分MRI可见团块样病灶。此型发病较早,平均发病年龄37岁,患者中癫痫发作较为多见。激素、免疫抑制剂联用效果较好[42],但复发率较高。复发及难治性患者可试用利妥昔单抗进行治疗[43]。
5.2.3 ABRA型:约占活检阳性PACNS的1/4,其中70%患者的APOE基因型为ε4/ε4,部分ABRA可检测到Aβ1-42蛋白抗体阳性[44]。此型发病较晚,常在70岁以后,多表现为急性起病的认知行为异常、局灶性神经功能缺损、癫痫及罕见类型的头痛;CSF蛋白升高较明显;头颅MRI常见脑膜强化、脑叶出血,梗死少见[45],29%出现团块样病灶,SWI相可见皮层与皮层下交界区的微出血。虽然大部分ABRA的血管炎对激素治疗有一定反应[35],但由于其淀粉样血管病变对免疫抑制治疗无效,故该型预后不良[5]。
5.3 脊髓型 此型约占PACNS的5%[10]。脊髓受累可发生在脑部受累之前、之后,也可与之同时发生,单独脊髓受累罕见[10]。脊髓受累以胸段常见,亚急性起病,表现为下肢进行性无力、远端麻木,尿便障碍。脊髓病变患者常预后不良[11]。
6 鉴别诊断
6.1 PACNS需要鉴别的疾病 PACNS病变仅累及中枢神经系统,但临床表现多样且多数不具特异性,确诊常需依据病理活检。因此,临床诊断PACNS时需与多种疾病进行鉴别,具体见表1[5]。
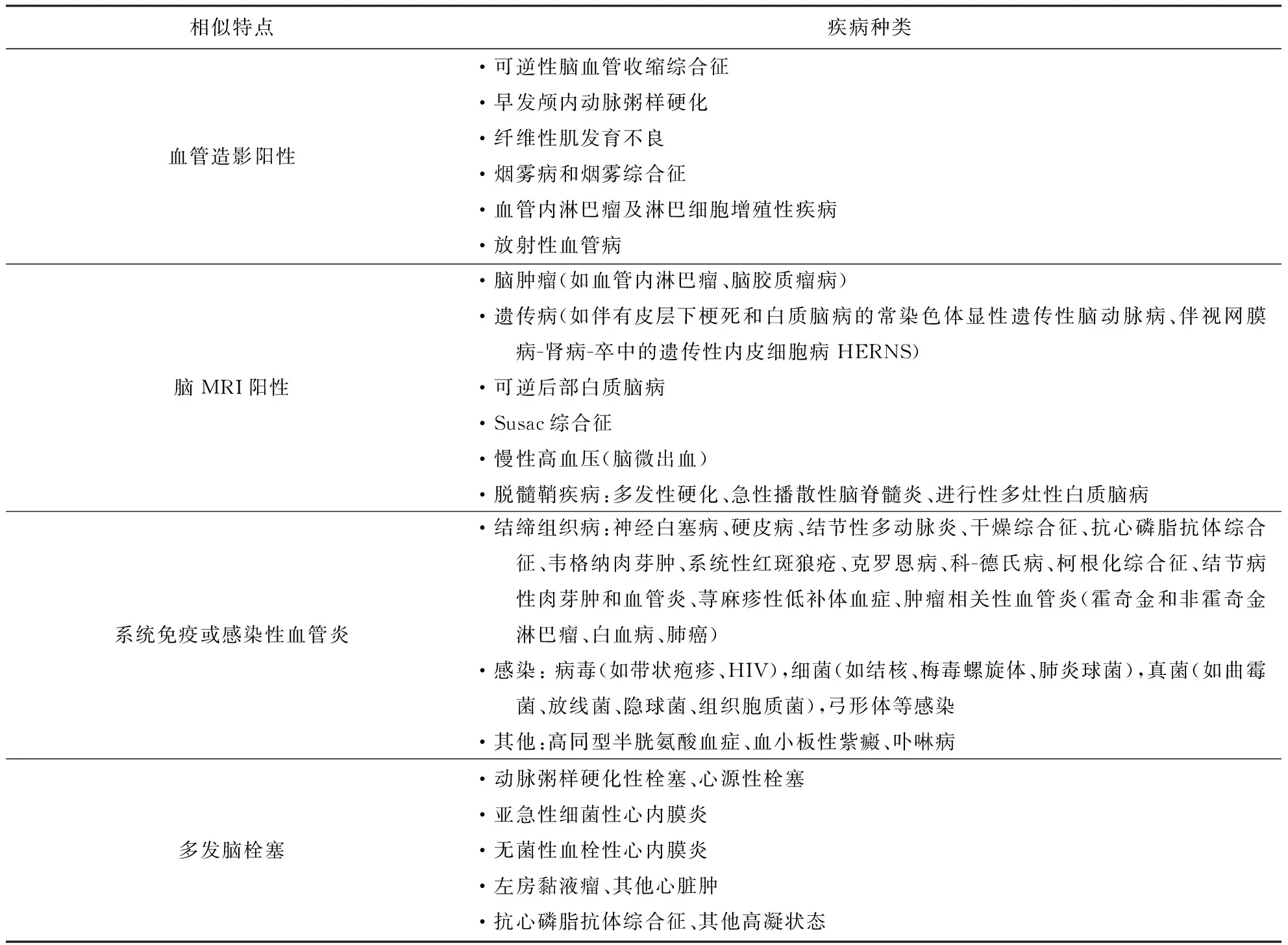
表1 诊断PACNS需进行鉴别的相关疾病[5]
6.2 重要鉴别疾病
6.2.1 RCVS:大血管受累型PACNS需注意与该病进行鉴别,RCVS多见于20~40岁的年轻女性,前驱期可有抑郁、偏头痛,多急性起病,单相病程,典型表现为雷击样头痛起病、不明原因缺血性脑卒中[46]。多有刺激血管痉挛的诱因如产后、生理刺激以及药物(如血管收缩药物:处方药包括琥珀酸舒马曲坦和选择性5-羟色胺或5-羟色胺去甲肾上腺素再摄取抑制剂;非处方药如芍药苷、减肥药和含安非他命的运动兴奋剂;非法药物如可卡因和大麻等)的使用等;RCVS无脑出血时CSF白细胞及蛋白水平多正常,是与PACNS相鉴别的关键点。DSA或CTA可见颅内大小血管相对一致性受累,多为向心性变细,半数可见节段性扩张,呈穿线腊肠样改变,HR-MRI多无血管壁强化[12],MRI多见血管源性水肿及分水岭梗死[47]。RCVS活检无异常发现。一般使用血管扩张剂如钙通道阻滞剂治疗[4],而激素可能加重病情[46],免疫抑制剂无效。大部分RCVS临床预后较好,病程呈自限性、单相病程,3周左右症状消退,1个月后无新发症状,脑血管DSA或CTA异常常在3个月内恢复[48]。
6.2.2 继发性中枢神经系统血管炎:此类疾病均先有系统性血管炎或自身免疫病的表现,通常较晚累及脑部,病情进展或对疾病的治疗可能导致的代谢或感染并发症,也有可能造成中枢神经系统损害,需小心排除[49]。巨细胞动脉炎、Takayasu’s动脉炎、川崎病可表现为大血管受累;结节性多动脉炎多表现为中等血管受累;Churg-Strauss综合征、韦格纳肉芽肿、显微镜下多发血管炎(microscopic polyangiitis,MPA)、过敏性紫癜等主要表现为小血管受累[18]。原发性系统性血管炎继发中枢神经系统受累少见,该病可有相关血清学或CSF标记物升高,除神经白塞病对激素反应较好外,大多预后不良。
6.2.3 感染性动脉炎:水痘-带状疱疹病毒、结核分枝杆菌、人类免疫缺陷病毒、C型肝炎病毒等可累及脑动脉,造成类似PACNS的影像学及CSF表现,应仔细筛查CSF中相关抗体、必要时使用聚合酶联反应(PCR)检测CSF中病原体核酸以除外感染性动脉炎,以免误用免疫抑制剂治疗造成严重后果[17]。
6.2.4 早发颅内动脉粥样硬化:此病变是青年患者脑血管造影阳性常见的病因之一,多有糖尿病、高血压等脑血管病危险因素,头痛不是其突出症状,CSF检查多正常[17]。
6.2.5 伴皮层下梗死和白质脑病的常染色体显性遗传性脑动脉病(cerebral autonomic dominanarteriopathy with subcortical infarcts and leukoencephalopathy,CADASIL):此病多见于中年患者,常染色体显性遗传,多表现为反复发作的皮层下梗死、先兆性偏头痛、精神及认知障碍、癫痫等,可有与PACNS类似的临床及MRI表现,但CADASIL多有阳性家族史且DSA结果多为阴性可供鉴别,必要时可进行皮肤活检,皮下小动脉血管平滑肌细胞的基底膜内的嗜锇颗粒有助于诊断CADASIL,而notch 3基因突变则可以最终明确诊断CADASIL[50]。
6.2.6 淀粉样脑血管病(cerebral amyloid angiopathy,CAA):ABRA需注意与该病鉴别。与ABRA相比,CAA发病年龄更晚,认知功能受累更多,局灶神经功能缺损或脑出血比例更多;多见脑叶出血、血管源性水肿、占位效应,脑膜强化更少,活检仅见淀粉样物质沉积,而无炎性反应[45]。淀粉样脑血管病相关炎性反应(CAA-related inflammation,CAA-RI)表现介于ABRA和CAA之间[45]。
7 治疗
激素是治疗PACNS的主要手段,约一半以上患者需要增加免疫抑制剂治疗,约1/5患者对强化免疫治疗仍反应欠佳。由于PACNS是一组异质性疾病,应针对具体类型进行个体化治疗[7]。对于病情危重者可予甲泼尼龙冲击治疗后改为泼尼松口服逐渐减量并联合环磷酰胺,序贯治疗3个月;轻症患者可直接口服激素,并根据疗效决定是否联合使用免疫抑制剂[9]。具体见图6。若免疫抑制治疗无效,应当重新评估可能的致病原因,之后再次制定治疗方案。治疗过程中可复查MRI、腰穿(检测CSF)以监测病情变化,如出现症状加重、病灶增多,除考虑疾病复发还应考虑到机会性感染、药物不良反应及毒性作用的可能[46]。
7.1 一线治疗 一线治疗药物包括激素、环磷酰胺,适用于急性发病患者。急性期可予甲泼尼龙冲击治疗1 g/d,静脉点滴3~5 d,或泼尼松按体质量1 mg/(kg·d)(最大剂量80 mg/d)口服治疗1周,若反应较好,可以泼尼松口服逐渐减量序贯治疗[14],序贯治疗期限为2~3个月。如减量过程中症状加重,可将剂量提高至之前有效的最低剂量,待症状稳定后再次尝试减量。诊疗过程中应注意预防感染、骨质疏松等并发症。
对于病情较重的患者,可加用环磷酰胺按体质量2 mg/(kg·d)口服或每个月1 g/m2体表面积静脉使用,用药期间每2周检查1次全血细胞计数,并注意预防卡氏肺孢子菌肺炎感染[14]。维持3~6个月稳定缓解后可换用低毒性免疫抑制剂如硫唑嘌呤、吗替麦考酚酯继续6~12个月的维持治疗[14]。由于甲氨蝶呤毒性较高,不建议用于治疗PACNS。在启动治疗4个月后应进行疗效评价,如无缓解,应考虑终止一线治疗并改用其他治疗方案。
7.2 二线治疗 二线治疗药物包括吗替麦考酚酯、硫唑嘌呤等毒性较低的免疫抑制剂。造影阴性、活检阳性、MRI可见脑膜明显强化的小血管受累型PACNS预后较好,可选用该类药物进行治疗[51]。吗替麦考酚酯可用于PACNS的初发、再发治疗及维持治疗,也适用于难治性或儿童型PACNS;可在维持治疗期发挥激素减量效应;与环磷酰胺相比,缓解率较高,不良反应及毒性作用较小,主要为白细胞减低。具体用法:吗替麦考酚酯诱导缓解及维持缓解均为1~2 g/d[51]。硫唑嘌呤也常用于激素减量过程中免疫抑制治疗,用法:2~3 mg/(kg·d)(Ⅳ级推荐),一般9~12个月可见症状改善[52]。
7.3 三线治疗 三线治疗药物主要是肿瘤坏死因子α拮抗剂(anti-TNF-α)或利妥昔单抗等生物制剂。出现以下情况可考虑使用:(1)一线、二线治疗均无效或不耐受(C级推荐);(2)神经功能缺损持续不缓解或继续进展并由MRI证实;(3)使用足量激素及免疫抑制剂治疗仍复发2次以上;(4)激素一旦减至7.5 mg/d即复发[53]。因缺乏相关证据,故不建议单独使用TNF-α拮抗剂或将其作为新发PACNS的一线治疗及激素的附加治疗手段[53]。较为常见的TNF-α拮抗剂的使用方法:英夫利昔单抗按体质量5 mg/kg单次使用;伊纳西普25 mg每周2次,之后按体质量25 mg/(kg·周),连用8个月[54]。利妥昔单抗用于淋巴细胞性PACNS效果较好,使用方法:每次1 g,第一次给药14 d后给予第二次,共两次[55];或每周给药375 mg/m2体表面积,每6~9个月连用2周[52]。也有文献报道直接使用利妥昔单抗作为一线治疗方案。使用生物制剂过程中应注意感染、肿瘤等并发症。
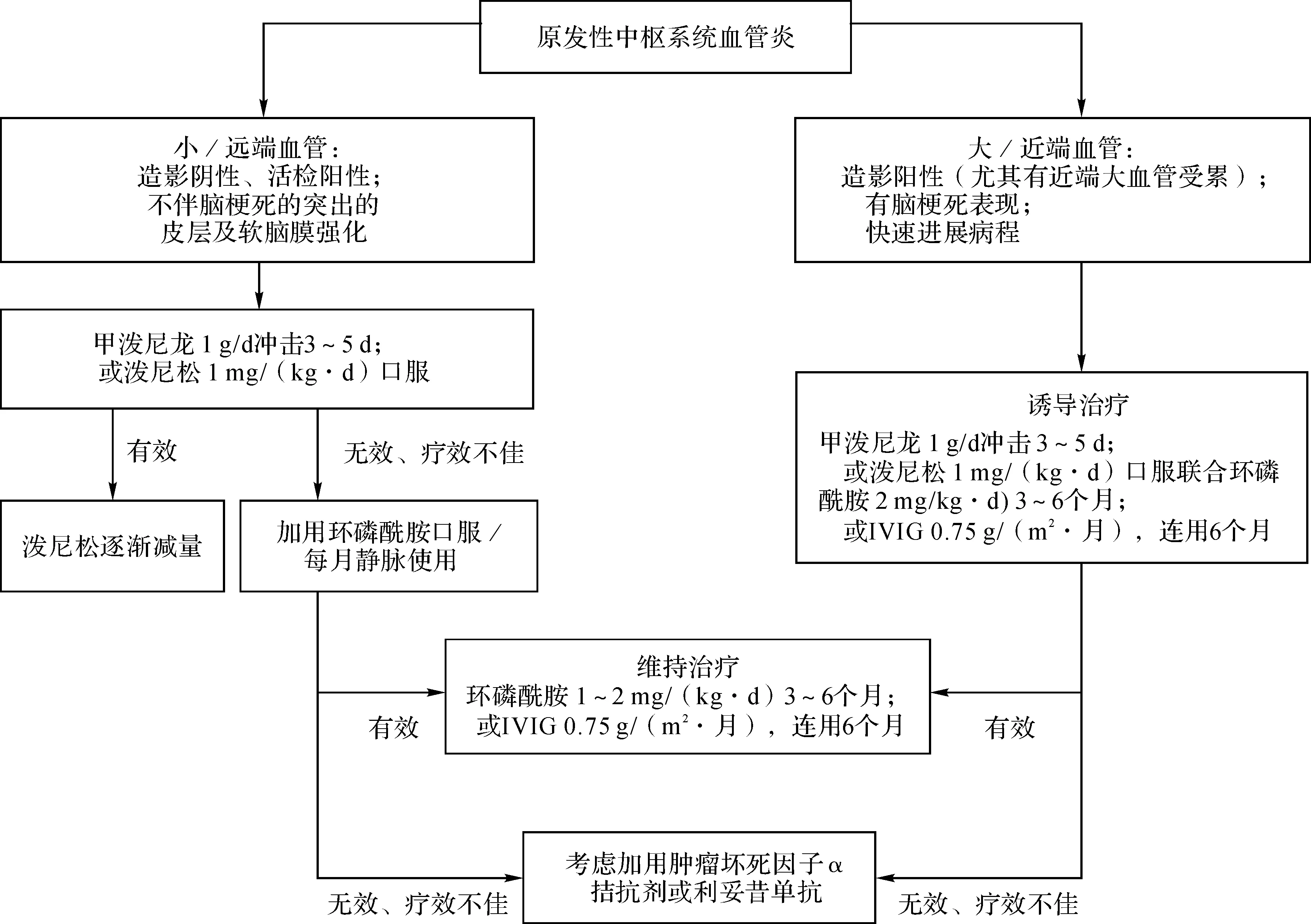
图6 PACNS治疗示意图(图中kg为体质量单位,m2为体表面积单位)
8 预后
PACNS总体预后较差,约有1/4~1/3复发[7,9],死亡率6%~15%,多死于脑梗死[7]。PACNS预后与具体类型有关,中、大血管受累型中的快速进展型预后最差[7],脊髓受累型亦预后不良[11];小血管受累型中肉芽肿型对一线或二线药物治疗反应好,但容易复发,频繁复发者(至少1年复发1~2次)可能需要三线治疗,淋巴细胞型、ABRA型预后相对较好。早期诊断并开始激素、免疫抑制治疗可明显改善预后。可通过MRI监测疾病活动性[17],初始治疗后每4~6周复查MRI,药物减量期应每3~4个月复查MRI以了解有无无症状的疾病进展,新病灶或新症状的出现往往提示疾病仍在活动。
编写组成员名单(按姓氏笔画排序)
卜碧涛(华中科技大学同济医学院附属同济医院);王永刚(上海交通大学附属仁济医院);王丽华(哈尔滨医科大学附属第二医院神经内科);王佳伟(首都医科大学附属北京同仁医院);王津存(第四军医大学西京医院);王维治(哈尔滨医科大学附属第二医院神经内科);王满侠(兰州大学第二医院神经内科);方树友(郑州大学附一院神经科);卢德宏(首都医科大学宣武医院病理科);吉维忠(青海省人民医院);成江(宁夏医科大学总医院);刘广志(北京大学人民医院神经内科);刘卫彬(中山大学附属第一医院);安中平(天津市环湖医院);许贤豪(北京医院神经内科);杜彦辉(宁夏医科大学总医院);李宏增(陕西省第四军医大学唐都医院神经内科);李泽宇(内蒙古医科大学附属医院神经内科);李柱一(陕西省第四军医大学唐都医院神经内科);李海峰(山东大学齐鲁医院);肖保国(上海复旦大学华山医院神经病学研究所);吴卫平(解放军总医院南楼神经内科);吴晓牧(江西省人民医院);邱伟(中山大学附属第三医院神经内科);余刚(重庆医科大学附属第一医院);汪鸿浩(南方医院);张华(北京医院神经内科);张旭(温州医科大学附属第一医院);张星虎(首都医科大学附属北京天坛医院);张美妮(山西医科大学第一医院);陈向军(复旦大学附属华山医院);金涛(吉林大学附属第一医院);周文斌(中南大学湘雅医院);周红雨(四川大学华西医院);郑雪平(青岛大学附属医院);屈洪党(蚌埠医学院附属医院);赵玉武(上海交通大学附属第六人民医院);胡学强(中山大学附属第三医院);段瑞生〔山东大学附属千佛山医院(山东省千佛山医院)〕;侯熙德(南京医科大学附属第一医院神经科);施福东(天津医科大学总医院);秦新月(重庆医科大学附属第一医院);莫雪安(广西医科大学神经病学研究所);徐竹(贵州医学院);徐雁(北京协和医院神经内科);高枫(北京大学第一医院);高聪(广州医科大学附属第二医院);郭力(河北医科大学第二医院);黄德晖(解放军总医院);戚晓昆(海军总医院神经内科);董会卿(首都医科大学宣武医院);景筠(首都医科大学附属北京同仁医院);程琦(上海交通大学医学院附属瑞金医院);曾丽莉(上海交通大学医学院附属瑞金医院);楚兰(贵阳医学院附属医院);管阳太(第二军医大学附属长海医院神经内科);廖小平(海南医学院);魏东宁(北京市解放军309医院神经内科)
致谢 特别感谢首都医科大学宣武医院病理科主任卢德宏教授在百忙中参加专家共识讨论,在PACNS的病理诊断标准、病理分型及提供病理资料等方面提出了宝贵意见和帮助。
[1]Harbitz F. Unknown forms of arteritis, with special reference to their relation to syphilitic arteritis and periarteritis nodosa[J]. Am J Med Sci, 1922, 1(163): 250-272.
[2]Cravioto H, Feigin I. Noninfectious granulomatous angiitis with a predilection for the nervous system[J]. Neurology, 1959, 9:599-609.
[3]Calabrese LH, Mallek JA. Primary angiitis of the central nervous system. Report of 8 new cases, review of the literature, and proposal for diagnostic criteria[J]. Medicine (Baltimore), 1988, 67(1): 20-39.
[4]Birnbaum J, Hellmann DB. Primary angiitis of the central nervous system[J]. Arch Neurol, 2009, 66(6): 704-709.
[5]Hajj-Ali RA, Singhal AB, Benseler S, et al. Primary angiitis of the CNS[J]. Lancet Neurol, 2011, 10(6): 561-572.
[6]Berlit P, Kraemer M. Cerebral vasculitis in adults: what are the steps in order to establish the diagnosis? Red flags and pitfalls[J]. Clin Exp Immunol, 2014, 175(3): 419-424.
[7]Salvarani C, Brown RD Jr, Christianson T, et al. An update of the Mayo clinic cohort of patients with adult primary central nervous system vasculitis: description of 163 patients[J]. Medicine (Baltimore), 2015, 94(21): e738.
[8]Giannini C, Salvarani C, Hunder G, et al. Primary central nervous system vasculitis: pathology and mechanisms[J]. Acta Neuropathol, 2012, 123(6): 759-772.
[9]de Boysson H, Zuber M, Naggara O, et al. Primary angiitis of the central nervous system: description of the first fifty-two adults enrolled in the French cohort of patients with primary vasculitis of the central nervous system[J]. Arthritis Rheumatol, 2014, 66(5): 1315-1326.
[10]Salvarani C, Brown RD Jr, Calamia KT, et al. Primary CNS vasculitis with spinal cord involvement[J]. Neurology, 2008, 70(24): 2394-2400.
[11]Solis OE, Mehta RI, Kalanithi S, et al. Primary angiitis of the CNS (PACNS) with predominant cranial neuropathy and spinal cord involvement[J]. Neuropathology, 2010, 30(3): 267-272.
[12]Rao NM, Prasad PS, Flippen CC, et al. Primary angiitis of the central nervous system presenting as unilateral optic neuritis[J]. J Neuroophthalmol, 2014, 34(4): 380-385.
[13]Hassan AS, Trobe JD, McKeever PE, et al. Linear magnetic resonance enhancement and optic neuropathy in primary angiitis of the central nervous system[J]. J Neuroophthalmol, 2003, 23(2): 127-131.
[14]Hajj-Ali RA. Primary angiitis of the central nervous system: differential diagnosis and treatment[J]. Best Pract Res Clin Rheumatol, 2010, 24(3): 413-426.
[15]Salvarani C, Brown RD Jr, Hunder GG. Adult primary central nervous system vasculitis[J]. Lancet, 2012, 380(9843): 767-777.
[16]Salvarani C, Brown RD Jr, Calamia KT, et al. Primary central nervous system vasculitis: Analysis of 101 patients[J]. Ann Neurol, 2007, 62(5): 442-451.
[17]Hajj-Ali RA, Calabrese LH. Primary angiitis of the central nervous system[J]. Autoimmun Rev, 2013, 12(4): 463-466.
[18]Gomes LJ. The role of imaging in the diagnosis of central nervous system vasculitis[J]. Curr Allergy Asthm R, 2010, 10(3): 163-170.
[19]Salvarani C, Brown RD Jr, Calamia KT, et al. Primary central nervous system vasculitis presenting with intracranial hemorrhage[J]. Arthritis Rheum, 2011, 63(11): 3598-3606.
[20]Pillai SH, Sreedharan SE, Menon G, et al. Primary CNS vasculitis presenting as intraventricular bleeding[J]. Ann Indian Acad Neur, 2016, 19(3): 406-408.
[21]Orr SL, dos Santos MP, Jurencak R, et al. Central nervous system venulitis presenting as migraine[J]. Headache, 2014, 54(3): 541-544.
[22]Powers WJ. Primary angiitis of the central nervous system: diagnostic criteria[J]. Neurol Clin, 33(2), 2015: 515-526.
[23]Kuker W. Cerebral vasculitis: imaging signs revisited[J]. Neuroradiology, 2007, 49(6): 471-479.
[24]Singh S, John S, Joseph TP, et al. Primary angiitis of the central nervous system: MRI features and clinical presentation[J]. Australas Radiol, 2003, 47(2): 127-134.
[25]Ho MG, Chai WX, Vinters HV, et al. Unilateral hemispheric primary angiitis of the central nervous system[J]. J Neurol, 2011, 258(9): 1714-1716.
[26]Ay H, Sahin G, Saatci I, et al. Primary angiitis of the central nervous system and silent cortical hemorrhages[J]. Am J Neuroradiol, 2002, 23(9): 1561-1563.
[27]You G, Yan W, Zhang W, et al. Isolated angiitis of the central nervous system with tumor-like lesion, mimicking brain malignant glioma: a case report and review of the literature[J]. World J Surg Oncol, 2011, 9 :97.
[28]Campi A, Benndorf G, Filippi M, et al. Primary angiitis of the central nervous system: serial MRI of brain and spinal cord[J]. Neuroradiology, 2001, 43(8): 599-607.
[29]Salvarani C, Brown RD Jr, Huston J 3rd, et al. Prominent perivascular enhancement in primary central nervous system vasculitis[J]. Clin Exp Rheumatol, 2008, 26(3 Suppl 49): S111.
[30]Pfefferkorn T, Linn J, Habs M, et al. Black blood MRI in suspected large artery primary angiitis of the central nervous system[J]. J Neuroimaging, 2013, 23(3): 379-383.
[31]Zuccoli G, Pipitone N, Haldipur A, et al. Imaging findings in primary central nervous system vasculitis[J]. Clin Exp Rheumatol, 2011, 29(1 Suppl 64): S104-109.
[32]Bai HX, Zou YJ, Lee AM, et al. Diagnostic value and safety of brain biopsy in patients with cryptogenic neurological disease: A systematic review and meta-analysis of 831 cases[J]. Neurosurgery, 2015, 77(2): 283-295.
[33]Nishikawa M, Sakamoto H, Katsuyama J, et al. Multiple appearing and vanishing aneurysms: primary angiitis of the central nervous system. Case report[J]. J Neurosurg, 1998, 88(1): 133-137.
[34]Yoong MF, Blumbergs PC, North JB. Primary (granulomatous) angiitis of the central nervous system with multiple aneurysms of spinal arteries[J]. J Neurosurg, 1993, 79(4): 603-607.
[35]Danve A, Grafe M, Deodhar A. Amyloid beta-related angiitis—A case report and comprehensive review of literature of 94 cases[J]. Semin Arthritis Rheu, 2014, 44(1): 86-92.
[36]Alrawi A, Trobe JD, Blaivas L, et al. Brain biopsy in primary angiitis of the central nervous system[J]. Neurology, 1999, 53(4): 858-860.
[37]Greenan TJ, Grossman RI, Goldberg HI. Cerebral vasculitis MRimaging and angiographic correlation[J]. Radiology, 1992, 182(1): 65-72.
[38]Salvarani C, Brown RD Jr, Calamia KT, et al. Rapidly progressive primary central nervous system vasculitis[J]. Rheumatology, 2011, 50(2): 349-358.
[39]Salvarani C, Brown RD Jr, Calamia KT, et al. Primary central nervous system vasculitis with prominent leptomeningeal enhancement: a subset with a benign outcome[J]. Arthritis Rheum, 2008, 58(2): 595-603.
[40]Iwase T, Ojika K, Mitake S, et al. Involvement of CD45RO+T lymphocyte infiltration in a patient with primary angiitis of the central nervous system restricted to small vessels[J]. Eur Neurol, 2001, 45(3): 184-185.
[41]Myung J, Kim B, Yoon BW, et al. B-cell dominant lymphocytic primary angiitis of the central nervous system: Four biopsy-proven cases[J]. Neuropathology, 2010, 30(2): 123-130.
[42]Gan C, Maingard J, Giles L, et al. Primary angiitis of the central nervous system presenting as a mass lesion[J]. J Clin Neurosci, 2015, 22(9): 1528-1531.
[43]de Boysson H, Boulouis G, Dequatre N, et al. Tumor-like presentation of primary angiitis of the central nervous system[J]. Stroke, 2016, 47(9): 2401-2404.
[44]Hermann DM, Keyvani K, van de Nes J, et al. Brain-reactive beta-amyloid antibodies in primary CNS angiitis with cerebral amyloid angiopathy[J]. Neurology, 2011, 77(5): 503-505.
[45]Salvarani C, Hunder GG, Morris JM, et al. A beta-related angiitis comparison with CAA without inflammation and primary CNS vasculitis[J]. Neurology, 2013, 81(18): 1596-1603.
[46]Lucke M, Hajj-Ali RA. Advances in primary angiitis of the central nervous system[J]. Curr Cardiol Rep, 2014, 16(10): 533.
[47]Singhal AB, Topcuoglu MA, Fok JW, et al. Reversible cerebral vasoconstriction syndromes and primary angiitis of the central nervous system: Clinical, imaging, and angiographic comparison[J]. Ann Neurol, 2016, 79(6): 882-894.
[48]Miller TR, Shivashankar R, Mossa-Basha M, et al. Reversible cerebral vasoconstriction syndrome, Part 1: epidemiology, pathogenesis, and clinical course[J]. AJNR Am J Neuroradiol, 2015, 36(8): 1392-1399.
[49]Hajj-Ali RA, Calabrese LH. Diagnosis and classification of central nervous system vasculitis[J]. J Autoimmun, 2014, 48-49: 149-152.
[50]Engelter ST, Rueegg S, Kirsch EC, et al. CADASIL mimicking primary angiitis of the central nervous system[J]. Arch Neurol, 2002, 59(9): 1480-1483.
[51]Salvarani C, Brown RD, Christianson TJH, et al. Mycophenolate mofetil in primary central nervous system vasculitis[J]. Semin Arthritis Rheu, 2015, 45(1): 55-59.
[52]Gotkine M, Vaknin-Dembinsky A. Central nervous system vasculitis[J]. Curr Treat Option Neurol, 2013, 15(3): 367-374.
[53]Pipitone N, Olivieri I, Salvarani C, et al. Recommendations of the Italian Society of Rheumatology for the treatment of the primary large-vessel vasculitis with biological agents[J]. Clin Exp Rheumatol, 2012, 30(1): S139-S161.
[54]Salvarani C, Brown RD Jr, Calamia KT, et al. Efficacy of tumor necrosis factor a blockade in primary central nervous system vasculitis resistant to immunosuppressive treatment[J]. Arthritis Rheum, 2008, 59(2): 291-296.
[55]Salvarani C, Brown RD Jr, Huston J 3rd, et al. Treatment of primary CNS vasculitis with rituximab: case report[J]. Neurology, 2014, 82(14): 1287-1288.
(本文编辑:邹晨双)
10.3969/j.issn.1006-2963.2017.04.001.
胡学强(510630中山大学附属第三医院神经内科),Email:huxueqiangqm@aliyun.com;董会卿(100053 首都医科大学宣武医院神经内科神经),Email: shshtt@sina.com
R747.9
C
1006-2963(2017)04-0229-11
2017-05-16)
