基于动力学过程的固体推进剂降速机理
2017-09-03吴世曦李忠友唐承志庞爱民
吴世曦,苗 楠,姚 南,李忠友,唐承志,庞爱民
(湖北航天化学技术研究所,湖北 襄阳 441003)
基于动力学过程的固体推进剂降速机理
吴世曦,苗 楠,姚 南,李忠友,唐承志,庞爱民
(湖北航天化学技术研究所,湖北 襄阳 441003)
根据朗缪尔单分子吸附原理和AP分解的质子转移机理,分别在AP晶体界面和气相混合区中确立物质守恒关系,分析了AP在不同分解速率下气相混合区中NH3和HClO4的气相分子浓度关系;将其与AP晶体气固交界面的反应强度进行关联,建立了一种能够分析压强变化状态对推进剂燃速影响的动力学机理,并推导了相应的物理过程,通过实验将AP/降速剂(CaCO3或NH4C2O4)的TG-DSC分析结果与药条燃速结果进行了对比。结果表明,该降速机理能够解释降速剂对推进剂燃速和压强指数的多种作用,CaCO3能够使AP的热失重分解温度出现一定程度的前移,因此对控制推进剂的高压压强指数有利,而NH4C2O4不具备这种效果。
高氯酸铵;AP;降速机理;郎缪尔吸附理论;固体推进剂;动力学;降速剂
引 言
为了设计更高效的固体推进剂降速剂,前苏联固体推进剂专家Glaskova将潜在的降速途径分为3类[1]:第一类为降速剂分解出的氨使分解反应平衡左移;第二类为降速剂与高氯酸结合成更加稳定的化合物;第三类为降速剂阻止高氯酸分解。这3类途径都是在实验的基础上总结而来,能够为筛选降速剂提供帮助。Glaskova的理论对降速剂研究具有开创性意义。然而在实际研究中也出现了一些该理论无法解释的问题。
居建国等[2]应用热分析方法研究了钙、锶、钡的碳盐等降低AP复合推进剂燃速的作用机理。结果表明,与草酸铵等铵盐抑制AP分解反应不同。碳酸盐在一定程度上加快AP分解,使AP分解峰的起始温度提前了5~20℃。殷金其等[3]采用激光阴影高速摄影、扫描电子显微镜、X光电子能谱,对含和不含CaCO3的3种夹心件及复合推进剂的燃烧过程、燃面形貌、化学成分和覆盖分数分别进行了研究和测定。结果表明,CaCO3在AP自爆燃发生前的低压下提高AP的燃速,而在自爆燃发生后的高压下起降速作用。主要表现为CaCO3首先与AP反应生成CaCl2并促使AP熔化,使推进剂燃速升高。然后燃面上的CaCl2含量随压强上升而增加,这又抑制了AP分解,降低了推进剂燃速。
针对上述问题,本研究通过对AP晶体表面的吸附、解离和反应过程进行物理分析,建立了一种能够分析压强变化状态对推进剂燃速影响的动力学机理,以期为后续研制固体推进剂新型降速剂提供参考。
1 动力学模拟方法
1.1 模型的构建
根据朗缪尔单分子层吸附理论和AP分解的质子转移理论,可以将AP晶体上方分为3个区域:凝聚吸附区、气相混合区和反应区。凝聚吸附区是AP晶体表面,常常吸附有NH3与HClO4分子,这些吸附的分子需突破较高的反应能垒才能发生剧烈反应[4-6]。因此在正常情况下,AP晶体表面的反应速度缓慢,形成低反应概率的吸附区。而NH3和HClO4会向气相扩散,形成同样低反应概率的混合区。当气相HClO4接近火焰后,受大量吸热的影响会分解出ClO-自由基,以此与NH3快速反应放热,形成出现大概率反应的反应区。由于分解时整体气流流动方向向上,并且生成的自由基会被很快消耗掉而难以扩散回混合区和吸附区,所以反应区的作用更多是为AP持续分解提供热量,即在热力学过程影响反应进行,而吸附区和混合区中因为缺少自由基,只能依赖分子间有效碰撞来推动反应进行,即在动力学过程影响反应进行[7-10]。本研究针对吸附区和混合区的动力学运动机理进行建模,分析这一过程对AP整体反应的影响。简易的动力学模型如图1所示,为了简便清晰,图中省略了充斥在气相中的NH3与HClO4的反应产物。
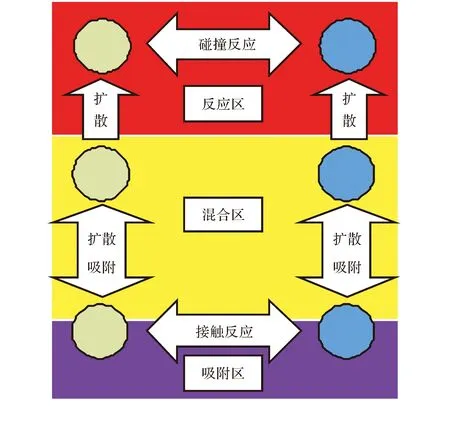
图1 动力学模型简图Fig.1 The figure of dynamical model
为了更直接地分析凝聚吸附作用对AP分解的影响,假设NH3与HClO4反应所产生的H2、CO、N2等反应产物不会与AP晶体表面产生吸附作用,所以结合对AP颗粒分解过程的分析,假设直接爆燃的关键反应是由发生在晶体表面上的NH3与HClO4之间的碰撞所引起的[10-14]。AP受热分解为零级反应,所产生的NH3与HClO4为等量生成,并首先吸附在AP颗粒晶体表面,然后再释放到气相环境中,这表明AP自分解的零级反应速率常数并非无穷大。同时假设AP反应的控速步骤为NH3与HClO4在AP凝聚吸附表面的碰撞反应。因此本动力学分析专注于被吸附在AP晶体颗粒表面的NH3与HClO4的反应速率,总反应式如图2所示。图2中第一行反应式代表吸附区中NH3(l)与HClO4(l)的反应附区,第二行反应式代表混合区中NH3(g)与HClO4(g)的状态,第三行反应式代表反应区中NH3(g)与HClO4(g) 的反应。
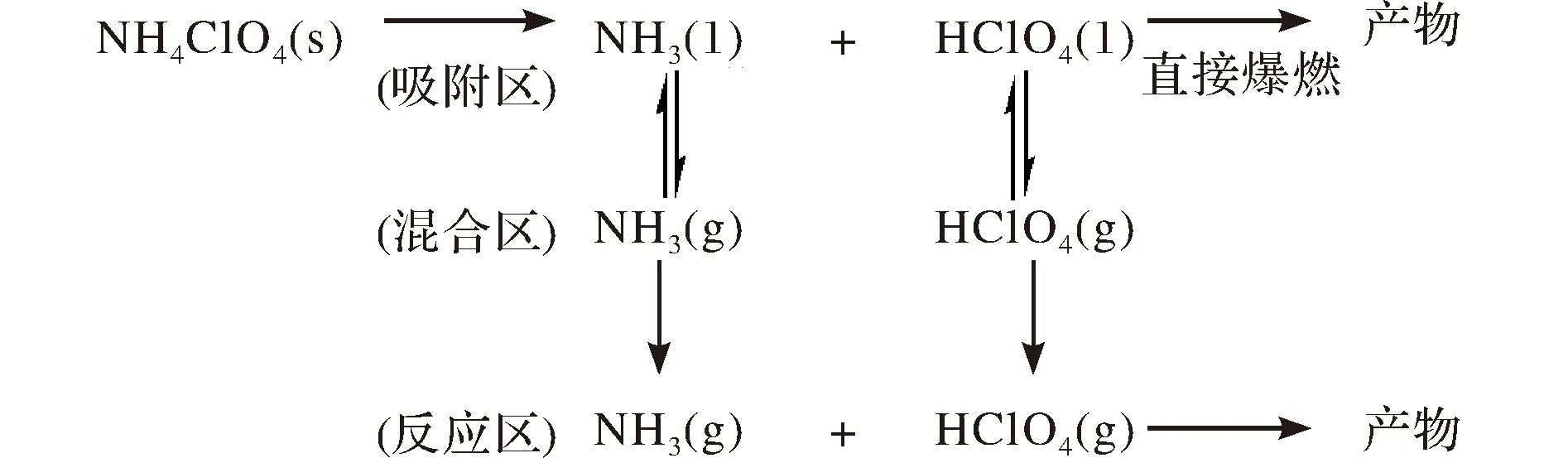
图2 AP分解方式Fig.2 The decomposition steps of AP
1.2 模型的推导
1.2.1 界面物质守恒模型
设NH3在AP晶体表面吸附面积占总面积的百分比为x1,HClO4在晶体表面吸附面积占总面积的百分比为x2,则有:
x1+x2=x
(1)
根据朗缪尔单分子层吸附原理,设a1表示撞击可吸附部位的气相NH3分子与晶面的吸附几率;a2表示撞击可吸附部位的气相HClO4分子与晶面的吸附几率;b1表示每秒内气相中NH3撞击在单位面积表面上的摩尔数;b2表示每秒内气相中HClO4撞击在单位面积表面上的摩尔数;f1表示每秒每单位面积从NH3分子完全覆盖的表面扩散到气相中的NH3分子摩尔数;f2表示每秒每单位面积从HClO4分子完全覆盖的表面扩散到气相中的HClO4分子摩尔数;K0表示AP在自爆燃发生前分解为NH3与HClO4的速率常数。该过程如图3所示。
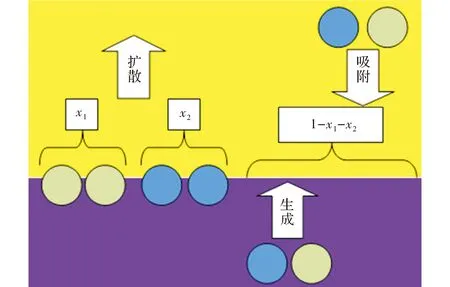
图3 反应动力学模型简图Fig.3 The figure of reaction dynamic model
NH3与HClO4在AP颗粒表面的直接爆燃反应为控速反应,则分解、吸附和扩散过程的速率均远大于该反应,即在所选取的燃烧准稳态中,这些过程被认为已到达平衡态。于是以晶体吸附区表面为控制体,在选取的任意燃烧准稳态中,新吸附或者分解在AP表面的分子必然等于从AP表面新扩散到气相的分子,于是可以推导出方程(2)和方程(3):
(a1b1+K0)(1-x)=f1x1
(2)
(a2b2+K0)(1-x)=f2x2
(3)
则根据代数运算可知:
x=1-fixi/(aibi+K0)
(4)
f1x1/(a1b1+K0)=f2x2/(a2b2+K0)
(5)
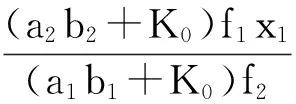
(6)
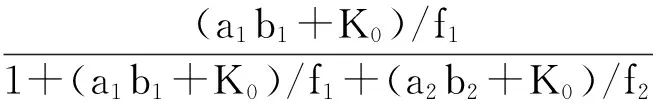
(7)
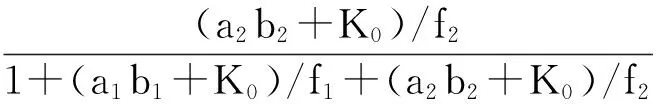
(8)
设s0为AP晶体分解的总面积,则s1为NH3的吸附面积,s2为HClO4的吸附面积:
s1=x1s0
(9)
s2=x2s0
(10)
因为AP晶体表面NH3与HClO4的接触反应为整体反应的最低速率控制步骤,所以AP表面的爆燃反应速率ω即可表示推进剂中AP的分解燃烧速率,而K为反应常数,则可得公式:
ω=Ks1s2
(11)
为简化方程,设φi=(aibi+K0)/fi,则可得:
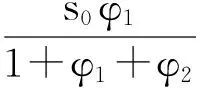
(12)
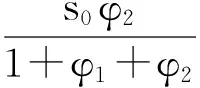
(13)
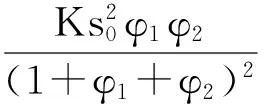
(14)
公式(14)为NH3与HClO4接触反应速率的完全表达式。
当假设气体均为理想气体,且处于热力学平衡状态时,分子速度服从Maxwellian分布,bi与气体分子浓度、温度和分子质量有关[15-16],为方便后文推导,将除分子浓度影响之外的其他部分设为ξ(T,mi),表示温度和分子质量对气体分子碰撞概率的影响函数。而根据统计力学分析,K0、ai与温度以及化合物自身性质有关,与气相压力或分子浓度无关[16-17]。根据从Sonine多项式一级展开得到的精确运动学理论[18-19],fi所表示的扩散速度可用方程(19)表示,则可得如下关系:
bi=ciξ(T,mi)
(15)
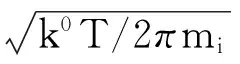
(16)
K0=K0(T)
(17)
ai=ai(T)
(18)
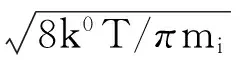
(19)
以上各式中,ξ(T,mi)和fi(T,mi)都与温度呈正比,与分子质量呈反比,而因为混合区中碰撞反应为控速步骤,NH3与HClO4在气体混合区分子浓度均处于较低的数量级,可以假设fi比bi对φi有更大的影响[17-18];AP初始分解速率常数K0和分子吸附概率ai与温度有关;单位时间内从单位面积的晶面扩散到气相分子的摩尔数fi与温度呈正比,与分子质量呈反比。同时,ξ、K0、ai、fi只与温度、分子质量、碰撞体积等强度量有关,而与分子浓度等广延量无关。由NH3与HClO4各自的原子量和原子半径估算,则可得:
f1≫f2>1
(20)
ξ1>ξ2
(21)
a1≈a2
(22)
K0≠∞
(23)
c3≥c1∝c2≠∞
(24)
根据上述各式可以将AP表面自爆燃反应速率公式简化为:
φ1≪φ2
(25)
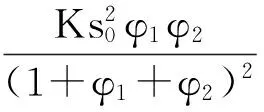
(26)
1.2.2 气相物质守恒模型
反应气相中存在NH3、HClO4和其他产物相对于气体产物的分子浓度,NH3、HClO4的气体含量很低,因此在混合区气相中NH3、HClO4之间的碰撞概率很低,可以将整个扩散体系简化为NH3/产物、HClO4/产物的两个二元扩散体系来考虑,而体系内其他产物分子浓度为c3,分压为p3。由道尔顿分压定律可知:
p1+p2+p3=p
(27)
ci=pi/RT
(28)
代入式(26),并用θ表示压强的变化系数,则可以得到:
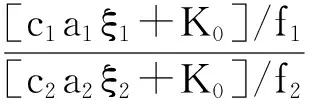
(29)
即AP燃烧分解速率除了与反应温度有关以外,还与压强变化所导致的动力学性能变化有关。这就需要进一步讨论气相中NH3和HClO4相对分子浓度的大小。选取整个混合区为控制体,分子进入混合区和离开混合区的物质的量也是相等的[18-19],则有:
f1x1s0-a1b1(1-x1-x2)s0+D13c0=0
(30)
f2x2s0-a2b2(1-x1-x2)s0+D23c0=0
(31)
将两式简化可得:
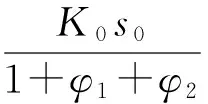
(32)
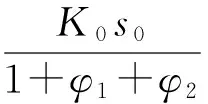
(33)
由此可知,NH3和HClO4在混合区中相对分子浓度的大小与AP分解速率有关。具体可分为以下3种情况:
(34)
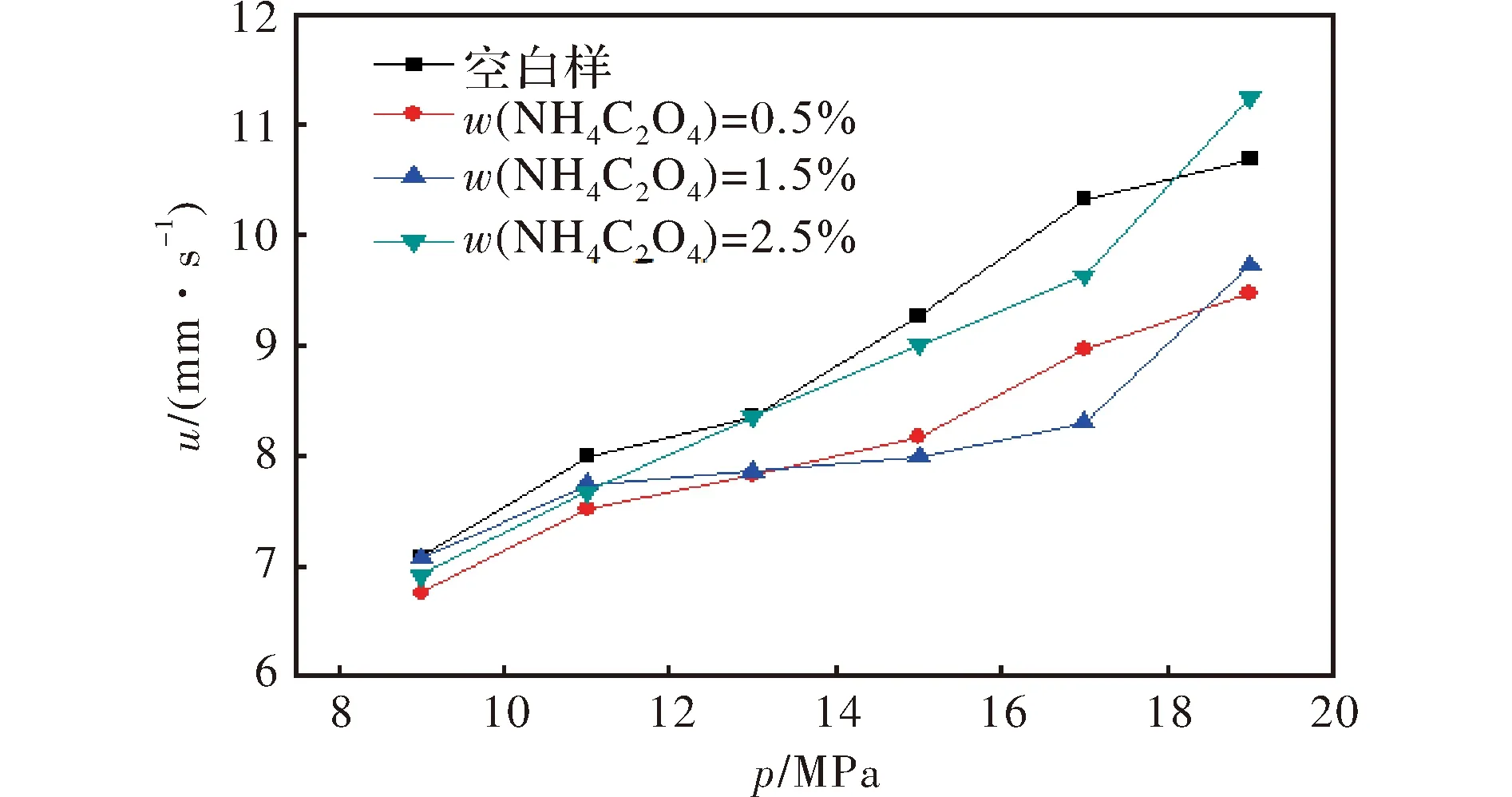
则D13>D23,而c1 当压强升高,即θ>1时,可得: (35) 即AP爆燃速率的动力学控制部分随着压强的升高而降低(热力学控制部分仍然随着压强的升高而升高)。 当压强下降,即1>θ>0时,可得: (36) 即AP爆燃速率中的动力学控制部分随着压强的降低而升高。由此发现,适当提高K0可以帮助HClO4脱离AP晶体表面的束缚,从而使HClO4分子浓度在气相混合区中占优势,进而对推进剂的压强指数起到抑制作用。 当压强升高,即θ>1时,可得: (37) 即AP爆燃速率的动力学控制部分也随着压强的升高而升高。 当压强下降,即1>θ>0时,可得: (38) 即AP爆燃速率的动力学控制部分也随着压强的降低而降低。由此发现,在初始分解速率K0不足以帮助HClO4对抗AP晶面束缚时,NH3的分子浓度在混合区往往占据优势,这会导致含AP推进剂的压强指数往往会处在较高的水平。 2.1 AP/CaCO3的TG-DSC分析 为了直观地表明AP分解峰温提前对固体推进剂燃速的影响,以CaCO3在典型配方中的性能表现为例进行说明,使用TG-DSC分析仪测定其对AP热分解的影响,结果如图4所示。 图4 CaCO3/AP的TG-DSC曲线Fig.4 The TG-DSC curves of CaCO3/AP 从图4中可以看出,加入CaCO3后,AP的低温分解峰基本不变,高温分解峰出现前移。对高温分解峰进一步观察发现,加入CaCO3不仅使AP的高温分解峰前移,还使整个峰型更加尖锐和突出。这表明AP的高温分解变得更加剧烈和迅速。再结合TG曲线也可以看出,在出现高温分解的部位,含有CaCO3的AP样品的失重曲线具有更大的失重梯度,这也证明了CaCO3使AP出现分解加速的现象。 2.2 CaCO3对推进剂燃速的影响 采用水下声发射法测试了含有CaCO3的推进剂药条燃速,结果如图5所示。 图5 CaCO3对推进剂燃速的影响Fig.5 Effection of CaCO3 on the propellant burning rate 由图5可见,虽然CaCO3能够加快AP的热分解,但却限制了推进剂压强指数在高压出现跃升的现象。而在没有燃速调节剂的情况下,AP自身具有一定的自分解速率。在没有燃速催化剂的空白对照组中,AP的自由燃烧过程会随着压强的升高而不断加速。这就说明在没有燃速催化剂的情况下,AP自身分解速率难以减弱晶体表面对HClO4的束缚,因而不可避免地引起固体推进剂压强指数在高压跃升的现象。同时应该指出,因为CaCO3对AP热分解具有双重作用,其降低推进剂燃速的作用更多依靠控制压强指数来体现,表现为在高压强段的降速效果远远优于低压强段。 2.3 降温剂NH4C2O4对推进剂燃速的影响 为了进一步介绍该机理,除使用CaCO3以外,还使用NH4C2O4进行燃速实验。NH4C2O4是固体推进剂中的典型降温剂,能够显著降低推进剂燃烧火焰,可以认为是降低AP分解以及NH3和HClO4表面接触反应的反应常数,常被作为固体推进剂降速剂使用。但是NH4C2O4却不能有效控制推进剂在高压状态下的压强指数。为了用实验验证相关机理,研究了不同含量NH4C2O4在9~19MPa对推进剂燃速的影响,如图6所示。 图6 不同含量NH4C2O4对推进剂高压段燃速的影响Fig.6 Effection of different NH4C2O4 content on the propellant burning rate at high pressure 从图6中可以看出,当NH4C2O4质量分数为0.5%时,固体推进剂在高压区域的燃速比空白对照组有所下降,而当NH4C2O4质量分数增至1.5%和2.5%时,相应的燃速值出现了不降反升的异常波动。这验证了理论模型的分析,说明NH4C2O4虽然成功降低了AP的初始分解速率,但是在其气相混合区中NH3的分子浓度要大于HClO4,而且NH4C2O4的热分解要早于AP。配方中NH4C2O4含量的增加意味着AP上方混合区的NH3/ HClO4的分子浓度比会进一步增大,对AP的直接爆燃反应速率增加有增益作用,并且还会进一步放大压强增加所导致的压强指数跃升作用。 (1)适当增强AP分解可以帮助HClO4脱离AP晶体表面的束缚,使HClO4分子浓度在气相混合区中占优势,可以降低AP自爆燃的反应速率,进而对AP整体反应的压强指数起到抑制作用。 (2)在AP分解不足以帮助对抗AP晶面束缚时,NH3的分子浓度在混合区往往占据优势,自爆燃反应难以控制,导致推进剂高压压强指数处于不可控制的状态。 [1] Glaskova A P, Popova P P. About burning inhibitors of ammonium nitrate and perchlorate and its mixtures[J]. Doklody Acodemii Nauk SSSR, 1967, 177(6): 1341-1344. [2] 居建国,张仁,江瑜.添加降低高氯酸铵复合推进剂燃速的作用机理研究[J].推进技术,1988(4):45-50. JU Jian-guo, ZHANG Ren, JIANG Yu. The burning mechanism of mechanism of propellant with ammonium perchlorate[J].Journal of Propulsion Technology, 1988(4):45-50. [3] 殷金其,李葆萱,王克秀,等.含碳酸钙的负压强指数复合固体推进剂燃烧机理[J].宇航学报,1991(3):43-50. YIN Jin-qi, Ll Bao-xuan, WANG Ke-xiu, et al. The burning mechanism of pressure exponent propellant with CaCO3[J]. Journal of Astronautics, 1991(3):43-50. [4] Jacobs P W M, Whitehead H M. Decomposition and combustion of ammonium perchlorate[J]. Chemical Reviews, 1969(69): 551-590. [5] Jacobs P W M, Pearson G S. Mechanism of the decomposition of ammonium perchlorate[J]. Combustion and Flame, 1969(13):419-430. [6] Mayer S W, Weinberg E K, Schieler L. Procedures for suppressing premature exothermic decomposition in ammonium perchlorate[J]. AIAA Journal, 1970(8):1328-1334. [7] Khairetdinov E F, Boldyrev V V. The mechanism of the low-temperature decomposition of NH4ClO4[J].Thermochimica Acta, 1980(41):63-86. [8] Boldyrev V V. Topochemistry and topochemical reactions[J]. Reactivity of Solid, 1990(8):231-246. [9] Zhu R S, Lin M C. A computational study on the decomposition of NH4ClO4: comparison of the gas-phase and condensed-phase results[J]. Chemical Physics Letters, 2006(431):272-277. [10] Davies J V, Jacobs P W M. Thermal decomposition of ammonium perchlorate[J]. Transactions of the Faraday Society, 1967(63):1737-1748. [11] Kaidymov B I. Effect of ammonia on the thermal decomposition of orthorhombic and cubic ammonium perchlorate[J]. Thermochimica Acta, 1983(62):87-99. [12] Collins L W, Haws L D. The thermochemistry of explosives: a review[J]. Thermochimica Acta, 1977(21):1-38. [13] Boldyrev V V, Lomovsky O I, Zaikova T O, et al. Variation of the reactivity of solids near the interface reagent-product of the topochemical reaction[J]. Journal of Solid State Chemistry, 1984(51): 127-130. [14] Devi T G, Kannan M P, Hema B. Thermal decomposition of cubic ammonium perchlorate—the effect of barium doping[J].Thermochimica Acta, 1996(285): 269-276. [15] Anderson R C. Some problems in chemical kinetics and reactivity.[J]. Physics Today, 2009, 12(5):44-46. [16] Glasstone B S, An K J L. The Theory of Rate Processes[M]. New York:McGraw-Hill Book Company, 1941. [17] Frenkel Ia I. Chemical kinetics and chain reactions[C]∥Chemical Kinetics and Chain Reactions. Oxford:Clarendon Press,1935:1150-1150. [18] Hirschfelder J O, Curtiss C F, Bird R B. Molecular theory of gases and liquids[J]. The Quarterly Review of Biology, 1956,31(8):17-18. [19] Penner B S S. Chemistry Problems in Jet Propulsion[M]. New York:Pergamon Press, 1957. Dynamical Mechanism for Reducing Burning Rate of Solid Propellant WU Shi-xi, MIAO Nan, YAO Nan, LI Zhong-you, TANG Cheng-zhi, PANG Ai-min (Hubei Institute of Aerospace Chemotechnology, Xiangyang Hubei 441003,China) Based on the Langmuir adsorption theory and proton transfer mechanism of AP decomposition, the conservation of matter between solid and gas phases was utilized to determine the concentrations of NH3and HClO4in the gas phase for AP decomposing at different rates. Combining the gas concentrations with the reactions occurring on the solid-gas interfaces, a dynamic mechanism is proposed to elucidate the effects of changes in pressure on propellant burning rates,and physical processes had been deduced.According to experiments of AP/burning rate inhibitor (CaCO3or NH4C2O4), results of both TG-DSC and burning rate test were compared. The results show that this mechanism can explain the processes that negative burning-rate catalysts act to effect the burning rates and pressure exponents. CaCO3can decrease the thermal decomposition temperature of AP.So it is useful for controlling the pressure cxponents of propellants at high pressure.Nevertheless,NH4C2O4do not have this effect. ammonium perchlorate; AP;mechanisms for decreasing burning rates; Langmuir adsorption theory; solid propellant; dynamical mechanism; burning rate inhibitor 10.14077/j.issn.1007-7812.2017.04.016 2017-01-25; 2017-06-19 总装备部预先研究项目(No.9140A28020115HT42001) 吴世曦(1984-),男,高级工程师,从事固体推进剂燃烧性能研究。E-mail:shixi_wu@outlook.com TJ55;V512 A 1007-7812(2017)04-0086-06
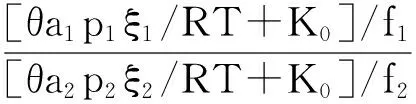
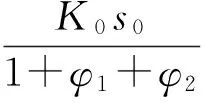
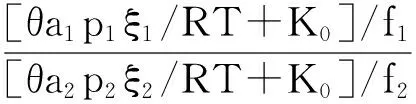
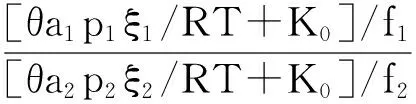
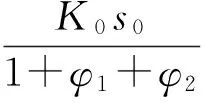
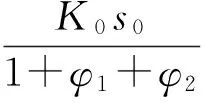
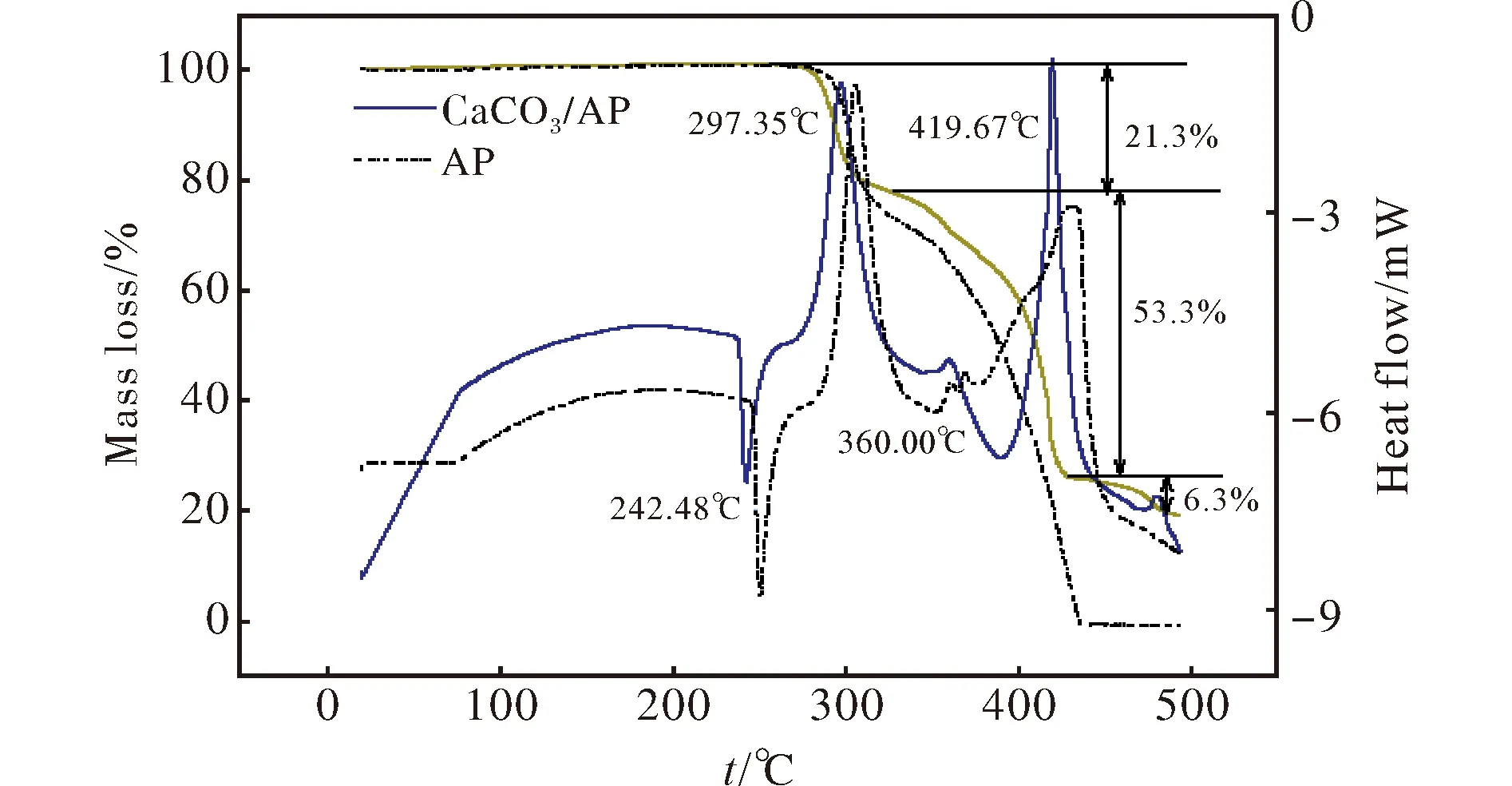
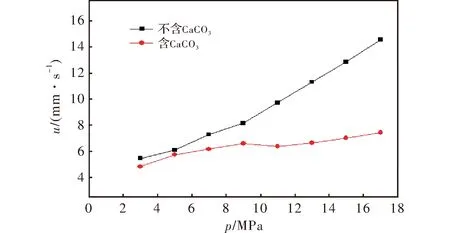
2 实验结果与讨论
3 结 论
