辽宁地区猪繁殖与呼吸综合征病毒分离株ORF5基因的遗传变异分析
2017-09-01赵晓彤顾贵波杨本勇李树博申贯男
关 淼,赵晓彤,曹 东,顾贵波,杨本勇,李树博,申贯男,魏 萍
(1.东北农业大学,黑龙江 哈尔滨 150000;2.辽宁省动物疫病预防控制中心 辽宁省动物医学研究院,辽宁 沈阳 110164)
辽宁地区猪繁殖与呼吸综合征病毒分离株ORF5基因的遗传变异分析
关 淼1,2,赵晓彤2,曹 东2,顾贵波2,杨本勇2,李树博2,申贯男2,魏 萍1*
(1.东北农业大学,黑龙江 哈尔滨 150000;2.辽宁省动物疫病预防控制中心 辽宁省动物医学研究院,辽宁 沈阳 110164)
为研究辽宁地区猪繁殖与呼吸综合征病毒(PRRSV)ORF5基因的生物学特性及遗传变异情况,通过RT-PCR方法对PRRSV阳性样品的ORF5基因进行扩增,应用DNA Star软件对检测的序列进行比对和遗传变异分析。结果显示,分离的8株PRRSV的ORF5基因全长为603 bp,均属北美型,不同分离株间的核苷酸、氨基酸同源性分别为91.5%~99.0%、88.1%~98.5%;遗传变异分析表明,分离株处于不同的进化分支,但均属于亚群3,为高致病性PRRSV。以上结果表明,辽宁地区主要流行毒株为高致病性PRRSV,在不同地区有不同的PRRSV毒株同时流行,但具有相同的进化来源。
辽宁地区; 猪繁殖与呼吸综合征病毒; ORF5; 遗传变异
猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS)是由猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)引起的高度接触性传染病,又称蓝耳病,其临床表现为高热、呼吸系统疾病、妊娠母猪的繁殖障碍、新生及断奶仔猪死亡等[1]。该病自20世纪80年代在美国被首次报道以后,在世界其他各地区也陆续被发现[2];我国自1996年首次在流产胎儿中分离到PRRSV以后,也在国内各省份迅速扩散开来。2006年,我国首次分离到高致病性猪繁殖与呼吸综合征病毒(highly pathogenic porcine reproductive and respiratory syndrome virus,HP-PRRSV),其致病力大幅增强[3],已成为目前我国各猪场的主要流行毒株[4]。PRRS被认为是在世界范围内最具有毁灭性的猪病之一[5],给各国的养猪业都造成了不可估量的经济损失。
PRRSV有10个开放性阅读框(ORFs)[6],其中ORF5编码的糖蛋白GP5是该病毒的最主要保护性抗原蛋白,具有较强的抗原性,且变异性最大。因此,通过针对ORF5基因的遗传变异研究在一定程度上可以反映PRRSV的遗传多样性。
我国针对PRRS主要采取强制免疫的方法进行防控,在目前的环境条件下,该病毒更容易发生变异和重组,研究表明,现在国内的PRRSV经历了快速的演变,可以规避疫苗诱发的免疫应答[7]。因此,研究ORF5的遗传变异对于PRRSV疫苗的研发具有重要意义。为深入了解PRRSV ORF5的遗传变异情况,对 2014—2015年辽宁地区分离的PRRSV毒株ORF5基因进行遗传变异分析,以了解辽宁地区PRRSV的遗传变异规律,旨在为PRRSV疫苗的研发提供理论依据,为辽宁地区PRRS免疫策略的制定提供参考。
1 材料和方法
1.1 供试病毒样品
根据辽宁省的生态区域特点,将供试病毒样本采集区域划分为4个区域(表1),在不同区域范围内采集猪组织样品,使用荧光定量RT-PCR试剂盒进行初步检测,将PRRSV核酸阳性的样本于-80 ℃低温保存。

表1 供试病毒样本采集区域划分
1.2 主要试剂
RNA提取试剂盒、One Step PrimeScript RT-PCR试剂盒、DNA凝胶回收试剂盒、pMD18-T载体等均购自宝生物工程(大连)有限公司。荧光定量RT-PCR检测试剂盒购自达安基因股份有限公司。
1.3 主要仪器
荧光定量PCR仪(7500 Fast)购自美国ABI公司,PCR仪(C1000)购自美国BIO-RAD公司,电泳仪(DYY-6C)购自北京六一仪器厂,高速低温离心机(Z323K)购自德国HERMLE公司,凝胶成像系统购自美国BIO-RAD公司。
1.4 PRRSV ORF5基因扩增及序列测定
参照GenBank中国内外已注册的PRRSV毒株的ORF5基因序列[8-9],设计 1对引物,上游引物序列:5′-AGCCTGTCTTTTTGCCATTCT-3′;下游引物序列:5′-CTTTTGTGGAGCCGTGCTATC-3′,由生工生物工程(上海)股份有限公司合成。选取Ct值较小的PRRSV核酸阳性样本,参考RNA提取试剂盒说明书提取总RNA。参考One Step PrimeScript RT-PCR试剂盒说明书进行ORF5基因全序列PCR扩增,琼脂糖凝胶电泳鉴定。PCR产物纯化后克隆到pMD18-T载体,阳性质粒样本送宝生物工程(大连)有限公司测序。
1.5 PRRSV ORF5基因序列分析
应用生物学分析软件DNA Star对测定的序列进行拼接和编辑,应用MegAlign软件对测定的核苷酸序列与从GenBank中选取的国内外22个ORF5参考序列(其中国外参考序列6个,国内参考序列16个)(表2)进行同源性比较,并绘制遗传进化树,进行系统多样性及遗传变异分析。

表2 PRRSV参考序列
2 结果与分析
2.1 ORF5基因的扩增结果
由图1可见,在约603 bp的位置出现了扩增条带,与预期片段大小相符。并按照供试病毒样本采集区域和年份,将供试病毒分别命名为LNeast2014、LNnorth2014、LNsouth2014、LNwest2014、LNeast2015、LNnorth2015、LNsouth2015、LNwest2015。

M:DNA分子标准DL2000;1—8:样品ORF5基因;9:阳性对照;10:阴性对照图1 ORF5基因扩增结果
2.2 ORF5基因序列的同源性分析
基因序列测定结果显示,测序的8个PRRSV ORF5基因全长为603 bp,编码200个氨基酸。将测定的ORF5基因核酸序列与国内外代表性毒株及近年分离的毒株的ORF5基因核酸序列进行比较分析发现,本研究测序鉴定的毒株均属于PRRSV基因2型,即北美株,且属于HP-PRRSV变异株。ORF5基因序列同源性分析结果见图2,本研究分离的8株毒株ORF5基因间同源性为91.5%~99.0%,其中2014年分离株ORF5基因间同源性为91.5%~98.8%;2015年分离株ORF5基因间同源性为96.8%~98.7%。与北美型代表株VR2332和国内代表株CH-1a ORF5基因间同源性分别为86.2%~89.1%、91.0%~95.2%;与变异株代表株JXA1、JXwn06和HUN4基因间同源性分别为93.7%~99.5%、94.0%~99.2%、93.9%~99.3%;与疫苗株JXA1 P80和TJM基因同源性分别为93.4%~99.2%、93.2%~98.8%;与2007年和2011年辽宁分离株基因同源性分别为93.4%~98.5%、92.2%~96.2%。同一年份在辽宁不同地区分离株之间的基因同源性存在差异,表明在同一时期不同地区有不同的PRRSV毒株同时流行。
2.3 ORF5基因序列的遗传变异分析
从图3可以看出,2014—2015年辽宁分离株属于同一亚群,具有较近的亲缘关系。LNnorth2014、LNeast2014、LNsouth2014、LNsouth2015、LNnorth2015、LNwest2015分离株与JXA1 P80处于同一分支,LNeast2015分离株与TJM处于同一分支,说明辽宁不同地区分离株虽然有相同的进化来源,但是在外界环境压力、本身基因特性以及长期的遗传演化过程中发生了不同程度的基因变异。2014年、2015年PRRSV辽宁分离株与2007年及2011年的辽宁分离株虽然属于同一亚群,但是处于不同的分支,也说明了辽宁地区PRRSV已经发生了基因变异。
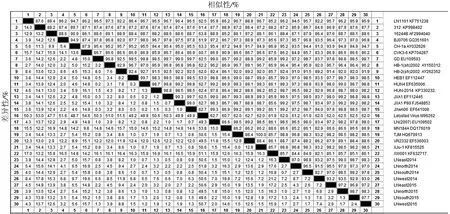
图2 ORF5基因全序列同源性分析
2.4 ORF5氨基酸序列分析
将ORF5基因测定序列推导的氨基酸序列与GenBank中收录的22株国内外PRRSV ORF5基因序列推导的氨基酸序列进行比较分析,本研究分离的8株毒株ORF5基因推导的氨基酸序列间同源性为88.1%~98.5%,其中2014年分离株ORF5基因推导的氨基酸序列间同源性为88.1%~97.5%;2015年分离株ORF5基因推导的氨基酸序列间同源性为94.0%~97.5%。与北美型代表株VR2332和国内代表株CH-1a ORF5基因推导的氨基酸序列间同源性分别为84.1%~88.1%、89.1%~92.5%;与变异株代表株JXA1、JXwn06和HUN4基因推导的氨基酸序列间同源性分别为92.0%~99.0%、92.5%~98.5%、92.5%~98.5%;与疫苗株JXA1 P80和TJM基因推导的氨基酸同源性分别为91.0%~99.0%、90.5%~97.0%;与2007年和2011年辽宁分离株基因推导的氨基酸序列同源性分别为92.0%~98.0%、90.0%~93.5%(图4)。

图3 基于ORF5基因全序列的遗传进化树

图4 ORF5基因全序列推导的氨基酸同源性分析
3 结论与讨论
根据病毒抗原性的差异,PRRSV可以分为2个血清型,基因1型和基因2型,即欧洲型和北美型,基因2型主要在北美和亚洲流行[10-11],在我国的主要流行毒株为北美型。近些年,我国也有欧洲型流行的报道,Zhou等[12]在2011年进行的PRRSV患病率调查中分离到欧洲型PRRSV,Li等[13]于2012年在我国北部地区分离到欧洲型PRRSV。在韩国、泰国等其他亚洲国家也有北美型、欧洲型2种毒株同时流行的报道[14-16]。PRRSV有10个开放性阅读框(ORFs),包括ORF1a、ORF1b、ORF2a、ORF2b、ORF3、ORF4、ORF5a、ORF5、ORF6和ORF7,其中ORF5基因编码的病毒糖基化囊膜蛋白GP5是该病毒主要的结构蛋白,具有较强的免疫原性,能够诱导产生中和抗体[17-18]。同时PRRSV的基因在合成的时候容易出现内在性错误,在不同的病毒分离株中,可能出现点突变、插入、缺失以及重组等,在其全基因组中以ORF5和NSP2基因变异性最大[4,19]。有研究发现,在ORF5编码的GP5蛋白序列上,特别是在中和表位和N-糖基化位点[13,20-22],有广泛的氨基酸位点替换,所以常基于ORF5基因序列构建PRRSV的遗传进化树,并进行遗传演化规律分析[23-29]。
Zhou等[9]研究发现,目前中国的PRRSV基因2型毒株可以分为3个不同亚群,基因分析结果显示,亚群1以VR2332为代表株,亚群2以MN184A为代表株;大部分中国流行毒株属于亚群3并有多个分支,这个分支全部由中国流行株组成,其代表毒株为JXwn06和HB-1(sh)2002。
通过遗传进化树分析可以看出,本研究测序鉴定的毒株均属于PRRSV基因2型的亚群3,但位于不同的分支。2014年及2015年辽宁地区分离株之间没有明显的年度特征,也没有明显的地域特征,这说明辽宁地区流行毒株的遗传进化过程存在交叉关系,这可能与不同地区之间的生猪调运有关。目前,我国针对PRRSV的主要防控方法为强制免疫,不同时间、不同地区之间使用的疫苗也有区别,不同分离株与疫苗株亲缘关系较近可能与疫苗种类多、免疫强度大的情况有关。通过遗传演化多样性分析发现,LNnorth2014、LNsouth2014分离株ORF5基因与疫苗株JXA1 P80处于同一分支,LNeast2015与TJM处于同一分支,提示可能存在弱毒疫苗株返强或者弱毒株与野毒株之间发生了基因重组现象。目前,在生猪防控PRRSV过程中,疫苗使用量大、次数多、种类多,造成了在猪群中弱毒株和野毒株同时存在的现象,增加了弱毒株返强以及病毒之间发生基因重组的风险[30]。
目前,PRRSV仍然广泛存在于世界各地的猪群中,影响着养猪业的健康发展,造成的经济损失不可估量。本研究通过对2014—2015年辽宁地区PRRSV ORF5基因进行序列比对及遗传进化分析发现,在辽宁地区PRRSV分离株主要为北美型,辽宁地区PRRSV的遗传变异具有多样性和复杂性。对PRRSV遗传变异分析有助于了解该病毒在辽宁地区的流行演化规律,为PRRS的科学防控提供了重要的参考依据。
[1] Meulenberg J J.PRRSV,the virus[J].Vet Res,2000,31(1):11-21.
[2] Keffaber K K.Reproductive failure of unknown etiology[J].Am Assoc Swine Pract News,1989,1(2):1-10.
[3] 童广志,周艳君,郝晓芳,等.高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J].中国预防兽医学报,2007,9(5):323-326.
[4] Liu J K,Wei C H,Yang X Y,etal.Genetic diversity and evolutionary characterization of Chinese porcine reproductive and respiratory syndrome viruses based on NSP2 and ORF5[J].Arch Virol,2013,158(8):1811-1816.
[5] Kvisgaard L K,Hjulsager C K,Kristensen C S,etal.Genetic and antigenic characterization of complete genomes of type 1 porcine reproductive and respiratory syndrome viruses(PRRSV) isolated in Denmark over a period of 10 years[J].Virus Res,2013,178(2):197-205.
[6] Firth A E,Zeventhoven-Dobbe J C,Will N M,etal.Discovery of a small arterivirus gene that overlaps the GP5 coding sequence and is important for virus production[J].J Gen Virol,2011,92(Pt 5):1097-1106.
[7] Li B,Fang L,Guo X,etal.Epidemiology and evolutionary characteristics of the porcine reproductive and respiratory syndrome virus in China between 2006 and 2010[J].J Clin Microbiol,2011,49(9):3175-3183.
[8] Egli C,Thür B,Liu L,etal.Quantitative TaqMan RT-PCR for the detection and differentiation of European and North American strains of porcine reproductive and respiratory syndrome virus[J].J Virol Methods,2001,98(1):63-75.
[9] Zhou L,Yang X,Tian Y,etal.Genetic diversity analysis of genotype 2 porcine reproductive and respiratory syndrome viruses emerging in recent years in China[J].Biomed Res Int,2014.doi:10.1155/2014/748068.
[10] Brar M S,Shi M,Murtaugh M P,etal.Evolutionary diversification of type 2 porcine reproductive and respiratory syndrome virus[J].J Gen Virol,2015,96(Pt 7):1570-1580.
[11] Shi M,Lemey P,Singh Brar M,etal.The spread of type 2 Porcine Reproductive and Respiratory Syndrome Virus(PRRSV) in North America:A phylogeographic approach[J].Virology,2013,447(1/2):146-154.
[12] Zhou Z,Liu Q,Hu D,etal.Complete genomic characterization and genetic diversity of four European genotype porcine reproductive and respiratory syndrome virus isolates from China in 2011[J].Virus Genes,2015,51(3):375-384.
[13] Li B,Gao S,Zhou T,etal.Complete genome sequence of European genotype porcine reproductive and respiratory syndrome virus strain LNEU12 in northern China[J].Genome Announc,2014,2(5):e00957-14.
[14] Jantafong T,Sangtong P,Saenglub W,etal.Genetic diversity of porcine reproductive and respiratory syndrome virus in Thailand and Southeast Asia from 2008 to 2013[J].Vet Microbiol,2015,176(3/4):229-238.
[15] Lee J A,Lee N H,Lee J B,etal.Genetic diversity of the Korean field strains of porcine reproductive and respiratory syndrome virus[J].Infect Genet Evol,2016,40:288-294.
[16] Nguyen V G,Kim H K,Moon H J,etal.ORF5-based evolutionary and epidemiological dynamics of the type 1 porcine reproductive and respiratory syndrome virus circulating in Korea[J].Infect Genet Evol,2014,21:320-328.
[17] Roques E,Girard A,St-Louis M C,etal.Immunogenic and protective properties of GP5 and M structural proteins of porcine reproductive and respiratory syndrome virus expressed from replicating but nondisseminating adenovectors[J].Vet Res,2013,44(1):17.
[18] Cao Z X,Jiao P R,Huang Y M,etal.Genetic diversity analysis of the ORF5 gene in porvine reproductive and respiratory syndrome virus samples from South China[J].Acta Vet Hung,2012,60(1):157-164.
[19] Deng M C,Chang C Y,Huang T S,etal.Molecular epidemiology of porcine reproductive and respiratory syndrome viruses isolated from 1991 to 2013 in Taiwan[J].Arch Virol,2015,160(11):2709-2718.
[20] Li J,Yin Y,Guo B,etal.Sequence analysis of the NSP2,ORF5,and ORF7 genes of 11 PRRS virus isolates from China[J].Virus Genes,2012,45(2):256-264.
[21] Xie J,Cui T,Cui J,etal.Epidemiological and evolutionary characteristics of the PRRSV in Southern China from 2010 to 2013[J].Microb Pathog,2014,75:7-15.
[22] 范旭,李伟娟,刘玉松,等.猪繁殖与呼吸综合征病毒河南分离株的遗传变异分析[J].河南农业大学学报,2010,44(2):172-176.
[23] Arruda A G,Friendship R,Carpenter J,etal.Investigation of the occurrence of porcine reproductive and respiratory virus in swine herds participating in an area regional control and elimination project in Ontario,Canada[J].Transbound Emerg Dis,2017,64(1):89-100.
[24] 冷雪,李真光,王雪凤,等.高致病性猪繁殖与呼吸综合征病毒ORF5基因的变异分析[J].吉林农业大学学报,2012,34(4):443-448.
[25] 王小敏,何孔旺,周忠涛,等.猪繁殖与呼吸综合征病毒变异株的分离鉴定及遗传变异分析[J].华北农学报,2014,29(1):232-238.
[26] 张明亮,张春杰,程相朝,等.豫西地区PRRSV新近流行株ORF5基因变异及Nsp2基因特征分析[J].河南农业科学,2012,41(1):137-141.
[27] 韩一超,刘文俊,姚敬明,等.猪繁殖与呼吸综合征病毒Shanxi-6株全基因序列分析[J].华北农学报,2014,29(2):62-65.
[28] 卢晓艳,周永辉,李伟娟,等.猪繁殖与呼吸综合征病毒河南分离株NSP2和GP5基因遗传变异分析[J].华北农学报,2012,27(2):100-104.
[29] 王凤雪,温永俊,刘准,等.高致病性PRRSV TJ株和致弱毒TJM株Nsp2测序及结构分析[J].河南农业大学学报,2011,45(1):86-90.
[30] 张显浩,陈瑞爱,李冰,等.2012年—2014年我国东南地区HP-PRRSV GP5基因的遗传进化与变异分析[J].中国预防兽医学报,2015,37(1):71-74.
Genetic Variation Analysis of ORF5 Gene of PRRSV Isolates in Liaoning Area
GUAN Miao1,2,ZHAO Xiaotong2,CAO Dong2,GU Guibo2,YANG Benyong2,LI Shubo2, SHEN Guannan2,WEI Ping1*
(1.Northeast Agricultural University,Harbin 150000,China; 2.Liaoning Province Veterinary Medicine Institute,Liaoning Center for Provincial Animal Epidemic Disease Control and Prevention,Shenyang 110164,China)
In order to study the biological characteristics and the genetic variation of porcine reproductive and respiratory syndrome virus(PRRSV) ORF5 gene in Liaoning area between 2014 and 2015,the full sequence of PRRSV ORF5 gene was amplified by RT-PCR from the PRRSV positive swine,and the sequence alignment and genetic variation analysis were conducted by DNA Star.The results showed that the ORF5 gene of 8 PRRSV strains was 603 bp,which belonged to the American mutant strain.Compared with representative strains,the nucleotide and amino acid homology were 91.5% to 99.0% and 88.1% to 98.5%,respectively.The genetic variation analysis suggested that the isolated strains were in different branches of evolution,but they were located in the subgroup 3.These results indicated that the main epidemic strain in Liaoning area between 2014 and 2015 was the highly pathogenic PRRSV,and various PRRSV strains existed in different regions of Liaoning at the same time,which had the same evolutionary origin.
Liaoning area; PRRSV; ORF5; genetic variation
2017-01-16
辽宁省自然科学基金指导计划项目(20170540477);辽宁省农业攻关项目(2015202013)
关 淼(1982-),男,辽宁鞍山人,兽医师,硕士,主要从事动物疫病研究与防控工作。 E-mail:yuerjianggm@163.com
*通讯作者:魏 萍(1962-),男,山东潍坊人,教授,博士,主要从事传染病与流行病学研究。 E-mail:weiiping@yahoo.com.cn
S855.3
A
1004-3268(2017)08-0137-06
