1株猪传染性胃肠炎病毒的分离鉴定及其生物学特性研究
2017-09-01李晓楠唐青海姚伦广阚云超
李晓楠,唐青海,*,李 羽,王 瑾,姚伦广,阚云超,杨 海
(1.南阳师范学院 河南省伏牛山昆虫生物学重点实验室/昆虫生物反应器河南省工程实验室,河南 南阳 473061;2.衡阳师范学院 生命科学与环境学院/生物药物研究所,湖南 衡阳 421008)
1株猪传染性胃肠炎病毒的分离鉴定及其生物学特性研究
李晓楠1,唐青海1,2*,李 羽1,王 瑾1,姚伦广1,阚云超1,杨 海2
(1.南阳师范学院 河南省伏牛山昆虫生物学重点实验室/昆虫生物反应器河南省工程实验室,河南 南阳 473061;2.衡阳师范学院 生命科学与环境学院/生物药物研究所,湖南 衡阳 421008)
采集1例疑似感染猪传染性胃肠炎病毒(TGEV)仔猪的粪便,运用RT-PCR方法和血清学方法对病料进行TGEV检测,并应用猪睾丸细胞(ST)进行病毒分离培养,分别采用免疫过氧化物酶单层细胞染色法(IPMA)和RT-PCR方法检测病毒在ST细胞中的增殖动态,应用RT-PCR方法扩增分离TGEVS1基因,经序列测定后,采用DNAStar 7.0和Mega 5.0软件对TGEV进行生物信息学分析。结果表明,病料接种到ST细胞培养后,出现明显细胞病变效应(CPE);RT-PCR检测结果显示,TGEV核酸阳性;血清学鉴定TGEV抗原阳性。将分离毒株命名为TGEV-NY。感染12 h后,IPMA检测结果阳性,且可从细胞培养上清中检出TGEV核酸。序列测定分析表明,分离毒株S1基因开放阅读框(ORF)为2 220 bp,编码740个氨基酸。进化分析显示,分离毒株与我国2006年分离的SC-Y毒株亲缘关系最近,分离毒株属于基因Ⅰ群。
猪传染性胃肠炎病毒; 分离培养; 免疫过氧化物酶单层细胞染色法;S1基因
传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV)是冠状病毒科(Coronaviridae)成员,该病毒是引起猪胃肠炎的主要病原体。所有年龄段的猪均能够被该病毒感染,尤其以哺乳期仔猪易感性最强,发病率和死亡率最高,哺乳动物死亡率可高达100%[1-2]。TGEV是囊膜病毒,遗传物质为正链、单股RNA,基因组的1/3碱基编码结构蛋白和非结构蛋白,编码基因按照5′-rep-S-3a-3b-E-M-N-ORF7-3′顺序排列。其中,纤突蛋白(S蛋白)、跨膜蛋白(M蛋白)、小包膜蛋白(E蛋白)和核衣壳蛋白(N蛋白)为病毒结构蛋白。S蛋白不仅是介导病毒吸附宿主细胞、入侵机体的主要结构蛋白,也是刺激机体产生抗TGEV中和性抗体的主要抗原蛋白。S蛋白是一种糖基化蛋白,肽链全长约为1 450个氨基酸,糖基化分子质量为128~160 ku,其N端的S1区有4个抗原位点,分别为A、B、C和D表位。其中,A表位可刺激机体产生中和抗体,并能够与机体的氨肽酶N(aminopeptidase N,APN)结合,从而介导病毒感染[3-5]。因此,S1蛋白也是TGEV基因工程疫苗、诊断、分子流行病学调查分析和遗传变异研究的主要蛋白[6-10]。本研究从采自南阳地区1份疑似TGEV感染粪样中分离培养TGEV,并进行核酸和血清学鉴定,研究其体外培养特性和进化特征,为进一步开展更广泛的流行病学调查、建立新的血清学诊断方法及开发新型疫苗奠定基础。
1 材料和方法
1.1 菌株、质粒及主要试剂
1.2 病料的采集和处理
收集病料(病猪粪便)200 μg左右,置于已灭菌的EP管中,加入1 mL PBS溶液,充分混匀,放于-20 ℃和37 ℃反复冻融3次,振荡15 s,3 000 r/min离心2 min,取上清放于-20 ℃冰箱保存。样品编号为NY。
1.3 病料的RT-PCR检测
根据GenBank上公布的TGEV-S核酸序列(TGEV-S收录号为EU074218),在保守区设计1对特异性引物,TGEV-S-F:5′-ACTAAGCTTTTAGCTTACATCACATGGCGTTACAG-3′, TGEV-S-R:5′-ACTGGATCCATGAAAAAATTATTTGTGGT-3′,扩增片段大小为2 220 bp。取步骤1.2中200 μL上清,应用Trizol试剂提取总RNA,取2 μg总RNA,采用PrimeScriptⅡFirst Strand cDNA合成试剂盒合成第一链cDNA,取2 μL合成产物进行PCR扩增。采用50 μL PCR反应体系,2 μL模板DNA,上、下游引物(10 μmol/L)各1 μL,5× Primer Buffer 10 μL,dNTP 4 μL,Prime STAR GXL DNA聚合酶1 μL,ddH2O 31 μL。PCR反应程序:95 ℃预变性4 min;98 ℃ 10 s,60 ℃ 30 s,68 ℃ 5 min,35个循环;68 ℃ 7 min,4 ℃保存。以吉林五星疫苗毒为阳性对照,以ddH2O为阴性对照。取PCR反应产物5 μL,用1.2%琼脂糖凝胶电泳进行检测。
1.4 病毒的分离培养
ST细胞用含10%胎牛血清的MEM培养基(青霉素钠和硫酸链霉素各100 μg/mL),在37 ℃、5% CO2培养箱中传代培养,待细胞长至80%时,用PBS洗涤1次,并将培养基更换为无血清培养基。将1.2中处理上清,经0.22 μm滤器进行无菌过滤,接种细胞(体积比1∶10)。每间隔24 h观察细胞病变效应(CPE),在CPE达80%以上时,冻融3次,收获病毒,按照上述方法将病毒进行连续传代培养,另设定正常细胞为对照。
1.5 病毒在ST细胞中的增殖动态检测
日本的立法模式采用的是混淆可能性包含于商标近似的判定标准。这种模式的好处是考虑因素比较全面,而且对商标近似的判定将会更加准确,因为其依靠商标混淆可能性的判定因素来确定。日本商标法37条提炼了8个商标侵权的行为要件。因为日本的判定标准在前文中也进行分析了,主要采用“商标近似+商品类似”的方法,后来又凝练成三要素的判定方法,但是在司法实践中日本也并非全是按照这种判定方法进行审理商标侵权案件的,在1959年以后,多册进行修改,也出现很多典型的判例,最后在司法实践和理论探讨中形成了混淆可能性包含于商标近似的判定标准。
1.5.1 病毒感染上清RT-PCR检测 将ST细胞接种到8个直径为35 mm培养皿中,保持密度适当,以24 h长至80%为宜;将分离得到的第3代病毒(F3)接种至ST细胞,每个培养皿接种剂量为4×103TCID50,留1个培养皿不接种病毒为对照。弃掉培养皿中的培养基,加入2 mL无血清的培养基,取10 μL病毒液加入到培养基中,充分摇匀,在37 ℃、5% CO2条件下培养,分别收集单层接毒后4、6、8、12、24、48 h样品。每个培养皿取上清200 μL提取RNA,用于RT-PCR检测,检测方法如1.3所述,以不接毒细胞为阴性对照,扩增片段大小为718 bp。
1.5.2 免疫过氧化物酶单层细胞染色法(IPMA)检测细胞中病毒动态 IPMA方法参考文献[11]改进后进行,每个培养皿细胞用2 mL PBS洗涤3次,真空干燥,加入1.5 mL 4%的多聚甲醛,室温条件下固定1 h,真空干燥,加入1.5 mL 按1∶20比例稀释的TGEV S1蛋白多克隆抗体(本实验室制备),37 ℃条件下孵育1 h。PBS洗涤3次。加入1.5 mL经1∶3 000倍稀释的HRP-SPA,37 ℃孵育1 h,PBS洗涤3次,加入1.5 mL AEC底物显色液,37 ℃孵育15 min。弃掉反应液,蒸馏水冲洗2次,每个培养皿中加入终止液2 mL。
1.6 TGEV-NYS1基因的克隆及序列分析
将1.3中得到PCR产物采用Axygen公司PCR产物纯化试剂盒进行纯化,纯化后的产物按1∶1的比例与Premix ExTaq混合,经95 ℃ 5 min、68 ℃ 20 min反应后,用Axygen公司PCR产物纯化试剂盒进行纯化。将纯化产物与pET28a载体连接,转化至DH5α感受态细胞中,筛选阳性克隆后提取质粒进行酶切和序列测定,将得到的重组载体命名为pET28a-TGEV-S1。将测序序列与GenBank中公布的TGEV-133(登录号JQ693049)等33株(毒株信息见表1)S1全基因序列进行比对,运用Mega 5.0软件进行分析,通过邻接法比较,构建系统进化树,分析分离毒株的进化地位。

表1 TGEV参考毒株信息
2 结果与分析
2.1 病料的RT-PCR检测
从图1可以看出,样品NY和阳性对照均扩增出了2 220 bp条带,与预期片段长度一致。这一结果表明,样品NY为TGEV核酸阳性。
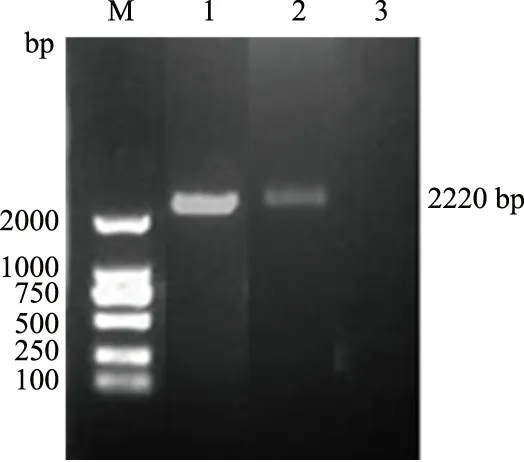
M:Marker 2000;1:样品NY;2:阳性对照;3:阴性对照图1 RT-PCR检测结果
2.2 病毒的分离培养
鉴于病料NY中TGEV核酸阳性,将处理过的病料按同步接毒的方式接种至ST细胞,培养72 h,未接种病料的对照细胞生长正常,接种病料的细胞出现典型的TGEV细胞病变,细胞变圆、脱落、拉网(图2)。连续接种培养3代,均出现出明显的CPE。将分离培养的病毒命名为TGEV-NY。

图2 TGEV-NY毒株的细胞病变情况
2.3 TGEV-NY毒株在ST细胞中的增殖动态检测结果
2.3.1 病毒感染上清RT-PCR检测结果 从图3可以看出,TGEV-NY感染12 h后,从细胞培养上清中能够检出TGEV核酸,且随着感染时间的延长,扩增条带亮度增强。

M:Marker 5000;1—7依次为感染4、6、8、12、24 h后的细胞上清,48 h后的阴性细胞上清,感染48 h后的阳性细胞上清;8:阳性对照图3 TGEV感染细胞上清的核酸RT-PCR扩增结果
2.3.2 IPMA检测细胞中病毒动态 经IPMA检测发现,感染后6 h和8 h,细胞中可见极少量特异性染色阳性细胞,阳性细胞在细胞核周围呈棕红色染色;感染12 h后可检出大量阳性细胞,随着时间的延长,染色范围越来越大,阳性细胞越来越多,可观察到成片感染病毒的细胞。感染24~48 h后染色效果最佳。未接毒的细胞在培养48 h后仍然生长良好(图4)。
2.4 TGEV-NYS1基因的克隆及序列分析
用引物TGEV-S-F和TGEV-S-R对TGEV-NY进行扩增,结果显示,特异性条带大小为2 220 bp,与预期大小相符,表明扩增到了TGEV-NY毒株的S1基因。将基因纯化回收克隆至pET28a载体并命名为pET28a-TGEV-NY-S1,重组载体经Hind Ⅲ和EcoR Ⅰ酶切,得到相应大小的目的条带,表明重组载体构建成功。经序列测定,表明扩增基因为S1基因,其全长为2 220 bp,编码740个氨基酸。将测序所得序列提交至NCBI数据库中进行比对发现,TGEV-NY株与美国、英国、韩国等国际参考毒株的核苷酸和氨基酸序列的相似性都高于85%。利用Mega 5.0软件,以邻接法对选取的来自美国、韩国、英国等多个国家的33个参比序列构建进化树(图5)。

图4 IPMA检测TGEV-NY在ST中的增殖动态
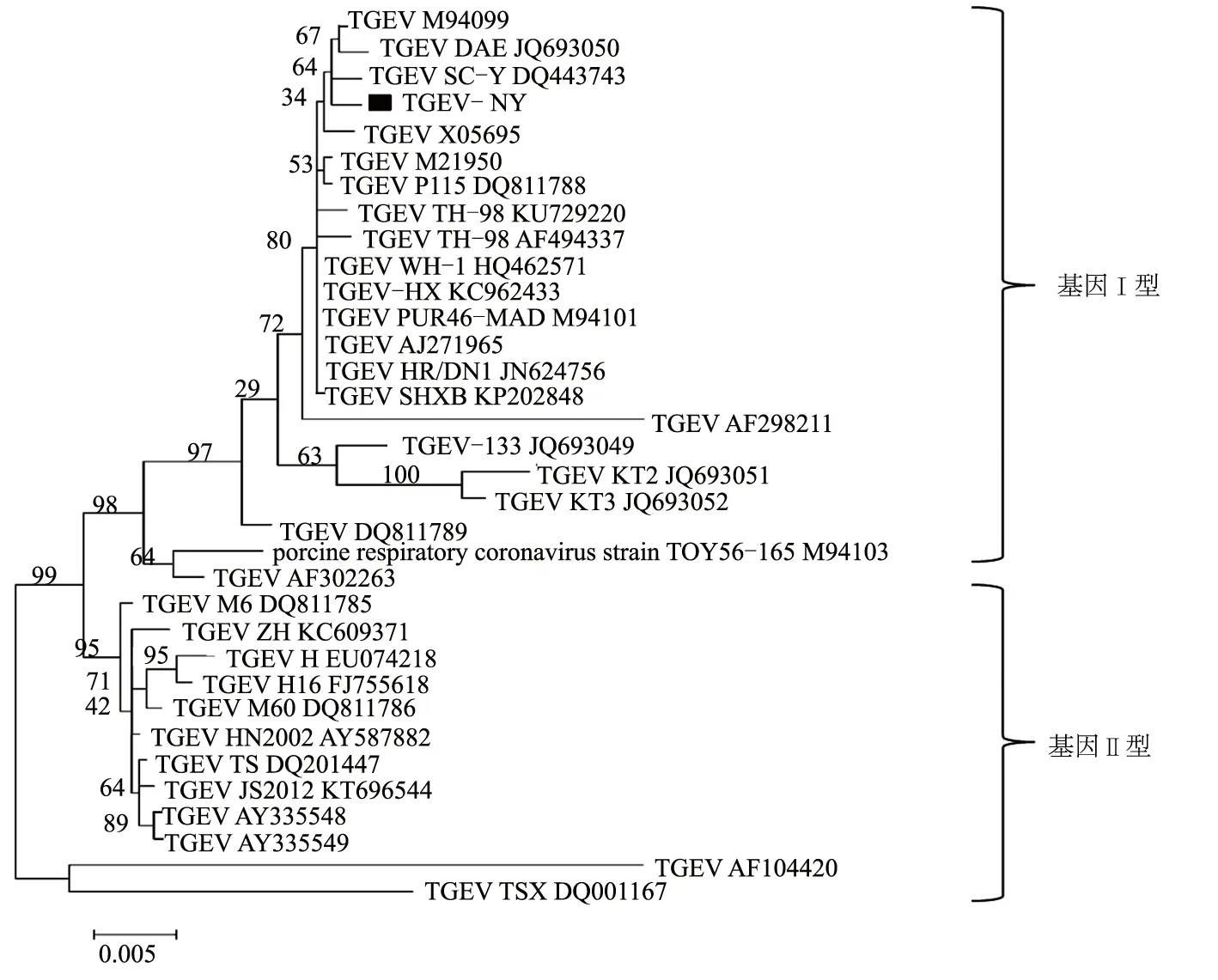
图5 TGEV毒株S1基因系统进化树
结果表明,TGEV的S1基因可以分为2个群(基因Ⅰ型和基因Ⅱ型),TGEV-NY分离株与中国株TGEV SHXB KP202848、美国株TGEV PUR46-MAD M94101、韩国株TGEV DAE JQ693050等同属于基因Ⅰ型,与中国株TGEV SC-Y DQ443743距离最近。
3 结论与讨论
目前,临床上用于TGEV核酸诊断最常用的方法有普通RT-PCR和实时荧光定量RT-PCR[12-14]。本研究在临床发现1例以呕吐、水样腹泻和脱水为特征的病例,疑似文献报道TGEV感染出现的症状[15]。经RT-PCR检测,病料的TGEV核酸检测结果呈阳性。随后,将病料接种ST细胞培养72 h,出现典型的CPE。由于TGEV毒株的不同,对细胞的感染力和增殖动态有一定的差异。ST细胞接种TGEV-NY毒株后,出现CPE的时间与接种时的病毒量、接种方法和细胞密度等因素有关。普遍认为细胞密度为80%左右时接种病毒,以2%左右的胎牛血清培养基作为维持液进行培养,比较适合病毒的增殖[15]。本研究采用同样细胞密度接种病毒,以无血清的培养基进行培养,这样既能够排除血清中的某些因子对病毒分离培养的影响,又能节约培养成本。
目前,TGEV病毒抗原检测方法有胶体金试纸条法、ELISA法和间接免疫荧光等方法[16-18]。ELISA法能通过吸光度检测病毒的含量,但不能直观显示病毒在细胞中的分布状态;间接免疫荧光需在荧光显微镜下观察,对设备要求高、操作复杂,且假阳性率较高。IPMA法等已经用于多种病毒如马动脉炎病毒[11]、猪流感病毒[19]、猪戊型肝炎病毒[20]、犬细小病毒[21-22]、猪圆环病毒[23]等及其相应抗体的检测。为了研究TGEV-NY的体外感染增殖特性,本研究采用IPMA法检测了病毒在ST细胞中感染的早期增殖动态。结果显示,病毒接种后24 h和48 h,TGEV核酸阳性结果较为明显,与之对应的细胞IPMA染色也为阳性;感染6 h后至感染12 h后这个阶段病毒的增殖相对较慢。病毒感染24 h后,TGEV感染阳性细胞明显增多,而且染色较早期感染更深,说明细胞内的病毒抗原含量增加;感染48 h后,90%以上的细胞均为TGEV抗原阳性,说明感染后24~48 h为TGEV在ST细胞中的快速增殖阶段。
前人研究表明,TGEV仅有1种血清型,但从其基因组核酸特征将其划分为基因Ⅰ型和基因Ⅱ型[1,24]。为了确定TGEV-NY毒株的基因型,测定了该病毒S1基因序列,生物信息学分析显示,TGEV-NY属于基因Ⅰ型,与中国株TGEV SC-Y DQ443743距离最近,与英国株TGEV AF104420、中国株TGEV TSX DQ001167距离较远。根据文献报道,我国的大部分地区流行的毒株也以基因Ⅰ型毒株较多[15]。S蛋白氨基端是TGEV识别靶细胞和决定病毒组织噬性的密切相关区,不同毒株的氨基端变异程度差异很大[7],将S1基因作为TGEV分子流行病学调查的靶基因对于掌握临床流行毒株分子进化和抗原变异情况具有重要的指导意义,可为病原监控、开发与流行毒株相匹配的诊断试剂和疫苗提供基础数据[25]。
综上,本研究成功分离鉴定了1株TGEV基因Ⅰ型毒株,研究了其体外培养特性,为进一步开展该病毒的诊断和疫苗研究提供了基础材料。
[1] 斯特劳B E,阿莱尔S D,蒙加林W L.猪病学[M].赵德明,张中秋,沈建忠,译.8版.北京:中国农业大学出版社,2000:305-339.
[2] Zhang Q,Hu R,Tang X,etal.Occurrence and investigation of enteric viral infections in pigs with diarrhea in China[J].Archives of Virology,2013,158(8):1631-1636.
[3] Meng F,Zhao Z,Li G,etal.Bacterial expression of antigenic sites A and D in the spike protein of transmissible gastroenteritis virus and evaluation of their inhibitory effects on viral infection[J].Virus Genes,2011,43(3):335-341.
[4] Meng F,Ren Y,Suo S,etal.Evaluation on the efficacy and immunogenicity of recombinant DNA plasmids expressing spike genes from porcine transmissible gastroenteritis virus and porcine epidemic diarrhea virus[J].PLoS One,2013,8:57-68.
[5] Laviada M D,Videgain S P,Moreno L,etal.Expression of swine transmissible gastroenteritis virus envelope antigens on the surface of infected cells:Epitopes externally exposed[J].Virus Research,1990,16(3):247-254.
[6] Zhao Q,Zhu J,Zhu W,etal.A monoclonal antibody against transmissible gastroenteritis virus generated via immunization of a DNA plasmid bearing TGEVS1 gene[J].Monoclon Antib Immunodiagn Immunother,2013,32:50-54.
[7] Hu X Jr,Li N Jr,Tian Z Jr,etal.Molecular characterization and phylogenetic analysis of transmissible gastroenteritis virus HX strain isolated from China[J].BMC Vet Res,2015,11:72.
[8] Reguera J,Ordono D,Santiago C,etal.Antigenic modules in the N-terminal S1 region of the transmissible gastroenteritis virus spike protein[J].Journal of General Virology,2011,92(Pt 5):1117-1126.
[9] Yuan X M,Lin H X,Fan H J.Efficacy and immunogenicity of recombinant swinepox virus expressing the A epitope of the TGEV S protein[J].Vaccine,2015,33(32):3900-3906.
[10] Elia G,Decaro N,Martella V,etal.An ELISA based on recombinant spike protein S for the detection of antibodies to transmissible gastroenteritis virus of swine-like canine coronaviruses[J].Journal of Virological Methods,2010,163(2):309-312.
[11] Hornyak A,Denes B,Szeredi,etal.Diagnostic application of immunoperoxidase monolayer assay using monoclonal antibodies produced against equine arteritis virus 14-kDa nucleocapsidprotein[J].Hybridoma and Hybridomics,2004,23(6):368-372.
[12] 李金磊,王亚宾,崔保安,等.猪传染性胃肠炎病毒SYBR-Green Ⅰ荧光定量PCR检测方法的建立[J].河南农业大学学报,2011,45(3):315-317.
[13] Vemulapalli R,Gulani J,Santrich C.A real-time TaqMan RT-PCR assay with an internal amplification control for rapid detection of transmissible gastroenteritis virus in swine fecal samples[J].Journal of Virological Methods,2009,162(1/2):231-235.
[14] Zhao J,Shi B,Huang X,etal.A multiplex RT-PCR assay for rapid and differential diagnosis of four porcine diarrhea associated viruses in field samples from pig farms in East China from 2010 to 2012[J].Journal of Virological Methods,2013,194(1/2):107-112.
[15] Hu W,Yu Q,Zhu L,etal.Complete genomic sequence of the coronavirus transmissible gastroenteritis virus SHXB isolated in China[J].Archives of Virology,2014,159(9):2295-2302.
[16] Rodák L,Smíd B,Nevoránková Z,etal.Use of monoclonal antibodies in blocking ELISA detection of transmissible gastroenteritis virus in faeces of piglets[J].Journal of Veterinary Medicine,2005,52(3):105-111.
[17] Simkins R A,Weilnau P A,Van Cott J,etal.Competition ELISA,using monoclonal antibodies to the transmissible gastroenteritis virus(TGEV) S protein,for serologic differentiation of pigs infected with TGEV or porcine respiratory coronavirus[J].Am J Vet Res,1993,54(2):254-259.
[18] Lu W,Osorio F,Rhodes M,etal.A capture-enzyme immunoassay for rapid diagnosis of transmissible gastroenteritis virus[J].Journal of Veterinary Diagnostic Investigation,1991,3(2):119-123.
[19] Direksin K,Joo H,Goyal S M.Animmunoperoxidase monolayer assay for the detection of antibodies against swine influenza virus[J].Journal of Veterinary Diagnostic Investigation,2002,14(2):169-171.
[20] Liang H,Wang H,Zhang L,etal.Development of a novel immunoperoxidase monolayer assay for detection of swine Hepatitis E virus antibodies based on stable cell lines expressing the ORF3 protein[J].Acta Veterinaria Hungarica,2014,62(2):243-256.
[21] 卜宾,李生涛,毛倩倩,等.1株犬细小病毒的分离鉴定及其生物学特性研究[J].河南农业科学,2015,44(8):121-127,140.
[22] 毛倩倩,周灵,唐青海,等.犬细小病毒NY株VP2蛋白多克隆抗体的制备与鉴定[J].中国畜牧兽医,2016,43(7):1659-1666.
[23] 黄立平,刘长明,危艳武,等.猪圆环病毒1型抗体 IPMA检测方法的建立及应用[J].中国兽医科学,2008,38(9):738-742.
[24] Kemeny L J.Antibody response in pigs inoculated with transmissible gastroenteritis virus and cross reactions among ten isolates[J].Canadian Journal of Comparative Medicine:Revue Canadienne de Medecine Comparee,1976,40(2):209-214.
[25] 张莉,康雪燕,章振华,等.毕赤酵母表达的猪传染性胃肠炎病毒纤突糖蛋白及其免疫原性分析[J].华北农学报,2015,40(6):84-90.
Isolation and Identification of a Transmissible Gastroenteritis Virus Strain NY and Its Biological Characterization
LI Xiaonan1,TANG Qinghai1,2*,LI Yu1,WANG Jin1,YAO Lunguang1,KAN Yunchao1,YANG Hai2
(1.Henan Provincial Engineering Laboratory of Insect Bio-reactor/Henan Provincial Key Laboratory of Funiu Mountain in Insect Biology,Nanyang Normal University,Nanyang 473061,China; 2.Institute of Biological Medicine,College of Life Sciences and Environment,Hengyang Normal University,Hengyang 421008,China)
The faeces samples were collected from a pig with severe diarrhoea,transmissible gastroenteritis virus(TGEV) nucleotide was amplified by reverse transcription polymerase chain reaction(RT-PCR) and serological methods to isolate the new TGEV strain.The filtered samples were inoculated into ST cells to isolate viruses,then the characterization of the viruses propagated in ST cells were determined by immunoperoxidase monolayer assay(IPMA) and RT-PCR.TGEVS1 gene was amplified by RT-PCR and sequenced,analyzed by solftware DNAStar 7.0 and Mega 5.0.Results showed that significant cytopathic effect(CPE) of ST cells inoculated the sample was observed;RT-PCR detection results showed that the culture samples were TGEV nucleotide positive,as well as serologic test results showed that the culture samples were TGEV antigenic positive.The isolated virus strain was named TGEV-NY.TGEV could be detected in the ST cells 12 hours post infection(hpi) by IPMA,as well as TGEV nucleotide could be detected by RT-PCR in the culture supernant.Nucleotide sequences showed that the open reading frame ofS1 gene was 2 220 bp encoding 740 aa.Phylogenetic analysis showed that TGEV-NY strain belonged to the gene groupⅠ,shared close genetic relationship with TGEV strain SC-Y which was isolated in 2006 from China.
transmissible gastroenteritis virus; isolation and culture; immunoperoxidase monolayer assay;S1 gene
2016-12-02
河南省重点科技攻关项目(142102110101);河南省高等学校重点科研项目(16A230023);南阳师范学院研究生创新基金项目(2016CX008);衡阳师范学院引进人才专项(16D20)
李晓楠(1989-),女,河南南阳人,在读硕士研究生,研究方向:生物制药与疫苗工程。E-mail:929016862@qq.com
*通讯作者:唐青海(1982-),男,湖南祁阳人,讲师,博士,主要从事生物制药与疫苗工程研究。 E-mail:qinghaitang109@126.com
S855.3
A
1004-3268(2017)08-0131-06
