鸭源鸡杆菌外膜蛋白A基因克隆及结构与功能分析
2017-09-01王继洋王坤芃彭志锋王川庆
王 艳,王继洋,王坤芃,彭志锋,杨 霞,王川庆
(河南农业大学 牧医工程学院,河南 郑州 450002)
鸭源鸡杆菌外膜蛋白A基因克隆及结构与功能分析
王 艳,王继洋,王坤芃,彭志锋,杨 霞,王川庆*
(河南农业大学 牧医工程学院,河南 郑州 450002)
为筛选鸭源鸡杆菌(G.anatis)潜在的保护性抗原基因,参考GenBank中G.anatisUMN179的外膜蛋白A(OmpA)基因序列设计1对引物,对鸭源鸡杆菌PDS-RZ-1-SLG(RZ)株的OmpA基因进行克隆,并应用相关软件对其核苷酸及氨基酸序列进行生物信息学分析。结果显示,OmpA基因大小为1 083 bp,编码360个氨基酸;鸭源鸡杆菌RZ株的OmpA与UMN179、F149及12656/12的OmpA氨基酸相似性分别为93.2%、95.2%、92.7%;OmpA蛋白分子质量为38.4 ku,等电点为6.77,具有稳定性,N端有1个疏水性的α螺旋信号肽。
鸭源鸡杆菌;OmpA基因; 克隆; 结构与功能分析
鸡杆菌属(Gallibacterium)细菌属于巴氏杆菌科,为革兰氏阴性菌,其中鸭源鸡杆菌(Gallibacteriumanatis)为其代表种[1],且是健康禽类上呼吸道和下生殖道的一种常在菌。研究发现,该菌与蛋鸡的输卵管炎、腹膜炎、败血症、肝炎及呼吸道疾病密切相关,能够造成产蛋鸡产蛋数量和质量下降,死亡率上升,给养鸡业带来了巨大的经济损失[2-4]。由于鸭源鸡杆菌本身抗原多样性的存在[5]和当前抗生素的滥用,使得该菌多重耐药性危害逐年加重[6],也使得疫苗的研制困难重重。鸭源鸡杆菌致病机制复杂,目前只有少数毒力因子得到确认。因此,对鸭源鸡杆菌的毒力因子进行研究,不仅有利于研究鸭源鸡杆菌致病机制,还可为其新型疫苗的研发奠定基础。
外膜蛋白(outer membrane proteins,OMPs)是镶嵌于革兰氏阴性菌细胞壁中的膜蛋白,在病原菌的致病过程中发挥重要作用,能够激发宿主的体液免疫和细胞免疫,且具有良好的免疫保护作用,因此,可将外膜蛋白作为亚单位疫苗的主要候选抗原[7]。OmpA属于细菌外膜蛋白家族成员之一,不仅作为细菌外膜的结构蛋白和离子通道,还在菌体感染过程中对宿主细胞的侵袭、粘附、血清抗体的产生、免疫逃逸及免疫靶位中扮演着重要的角色[8-11]。目前,关于鸭源鸡杆菌OmpA的研究较少。为此,对鸭源鸡杆菌OmpA全基因进行扩增,运用生物信息学等相关软件对其编码的蛋白质结构和功能进行预测,并对潜在的线性B细胞抗原表位及理化特性进行预测分析,旨在为OmpA基因功能的研究、鸭源鸡杆菌诊断方法的建立及新型高效疫苗的研制提供参考。
1 材料和方法
1.1 菌株与质粒
鸭源鸡杆菌 PDS-RZ-1-SLG(RZ)菌株[12]、大肠杆菌(E.coli)DH5α由河南农业大学传染病学教研室保存;载体pMD18-T购自TaKaRa公司。
1.2 主要试剂
酵母粉、琼脂粉、胰蛋白胨(北京奥博星生物技术有限责任公司);绵羊血琼脂平板(郑州安图生物工程有限公司);PCR产物纯化试剂盒、TaqMaster Mix、限制性内切酶、T4DNA连接酶、250 bp Ladder Marker(TaKaRa公司)。
1.3 引物设计与合成
参考鸭源鸡杆菌 UMN179OmpA全基因序列,使用软件Primer Premier 6.0设计1对特异性引物,上游引物OmpA-F:5′-ATGAAAAAGACTGCAATCGCA-3′,下游引物OmpA-R:5′-TTATTGTTCGATTGTTTGTTGGTG-3′。引物由生工生物工程(上海)股份有限公司合成。预期片段大小为1 086 bp。
1.4 细菌培养
取-70 ℃保存的甘油菌RZ菌株于绵羊血平板划线复苏,37 ℃培养18 h,挑取单个菌落接种于普通肉汤培养基中,37 ℃条件下200 r/min振荡培养12 h。
1.5OmpA基因的克隆
用煮沸法粗提RZ菌株的基因组作为DNA模板,用引物OmpA-F/OmpA-R扩增OmpA全基因。PCR反应体系50 μL,反应参数:95 ℃预变性5 min;95 ℃ 30 s、56 ℃ 30 s、72 ℃ 50 s,32个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳检测。用试剂盒回收纯化PCR产物,并克隆至载体pMD18-T,转化到E.coliDH5α感受态细胞,PCR和酶切鉴定为阳性的质粒送生工生物工程(上海)股份有限公司测序鉴定。
1.6 OmpA结构与功能分析
根据预测的氨基酸序列,使用软件Multiple Sequence Alignment和MEGA 6.0,将RZ菌株 OmpA氨基酸序列分别与12656/12、F149及UMN179的OmpA氨基酸序列进行比对分析。应用Protparam软件分析OmpA的分子质量、氨基酸组成及等电点。应用Proscale和DNAStar程序中的Protean分析OmpA的亲水性和疏水性。应用在线软件SignalP 4.1 Server预测OmpA的信号肽,使用Swiss-Model运算服务器和PRED-TMBB预测分析OmpA三级结构及跨膜β桶拓扑结构[13-14]。应用程序MegAline和在线软件IEDB Analysis Recource预测OmpA潜在的线性B细胞抗原表位。
2 结果与分析
2.1OmpA基因克隆结果
以RZ菌株基因组DNA为模板扩增OmpA全基因,产物经1%琼脂糖凝胶电泳检测,在约1 000 bp处有1条特异DNA条带(图1)。酶切鉴定结果表明,重组质粒pMD18-OmpA构建成功(图2)。成功克隆OmpA全基因,并获得OmpA全基因核苷酸序列,序列登录号为KY411917。
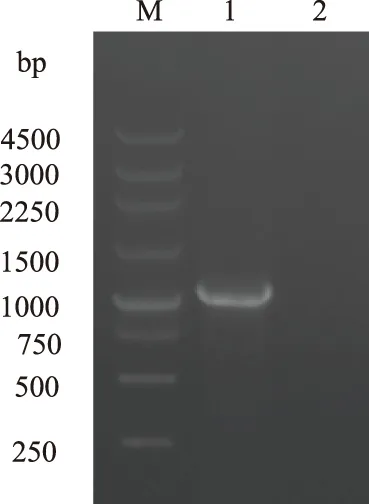
M.250 bp DNA Ladder;1.OmpA基因扩增产物;2.空白对照图1 OmpA基因PCR扩增
2.2 OmpA的氨基酸序列特征
测序结果显示,RZ菌株的OmpA基因全长为1 083 bp,包含了OmpA基因完整开放性阅读框,编码由360个氨基酸组成的外膜蛋白。RZ菌株OmpA基因核苷酸序列推导的氨基酸序列与鸭源鸡杆菌 UMN179、12656/12及F149的OmpA氨基酸序列相似率分别为93.2%、92.7%、95.2%。MEGA 6.0软件分析结果显示,与12656/12、UMN179、F149菌株相比,RZ菌株OmpA在47—54位缺失8个氨基酸(N-I-Y-G-Q-D-A-Y),在190—198位多7个氨基酸(E-N-S-A-F-A-G)(图3)。
2.3 OmpA的理化性质
RZ菌株OmpA由360个氨基酸组成,理论分子质量为38.4 ku,等电点为6.77,分子式为C1708H2662-N470O531S4。理论半衰期为30 h,不稳定系数为31.90,为稳定蛋白。负电荷残基数(D+E)为36个,正残基数(R+K)为34个。OmpA由20种氨基酸组成,其中含量较高的氨基酸残基有A(13.1%)、V(9.7%)、S(9.2%)、G(8.9%)和L(6.9%);含量较低的氨基酸残基有M(0.6%)、C(0.6%)、W(0.6%)。亲水性分析结果显示,OmpA在95、97、98、288、289、290位氨基酸亲水性分值最高(2.44),有较强的疏水性;在13位分值最低(-2.39),有较强的亲水性。主要疏水部位在37—64、85—104、136—154、246—264、278—297、316—332、243—360位氨基酸,主要亲水部位在4—20、154—172、206—212、222—243、337—341位氨基酸。

M.250 bp DNA Ladder;1.pMD18-OmpA双酶切;2.OmpA基因PCR产物图2 重组质粒pMD18-OmpA酶切鉴定

图3 鸭源鸡杆菌RZ菌株OmpA氨基酸序列特征及其二级结构位点
2.4 OmpA信号肽及结构预测
为进一步了解鸭源鸡杆菌RZ菌株OmpA在菌体中的分布位置,使用在线软件SignalP 4.1 Server分析,结果显示,OmpA存在信号肽序列,为α螺旋结构,位于N端1—22位(图4),表明鸭源鸡杆菌 OmpA为分泌性膜蛋白。三级结构预测结果显示,OmpA为β桶状孔道,由10个反平行β折叠片构成,面向基质的一侧有少量短的转角,面向外侧的一端存在大量较长的环(图5);应用PRED-TMBB预测发现,OmpA存在拓扑结构,为跨膜蛋白,其中37—62、86—103、133—149、179—193、216—231位氨基酸暴露于膜外;1—27、74—76、115—121、165—169、205—206、243—360位氨基酸位于膜内部;28—36、63—73、77—85、104—114、122—132、150—164、170—178、194—204、207—215、232—242位氨基酸构成的β折叠片为穿膜区(图5)。
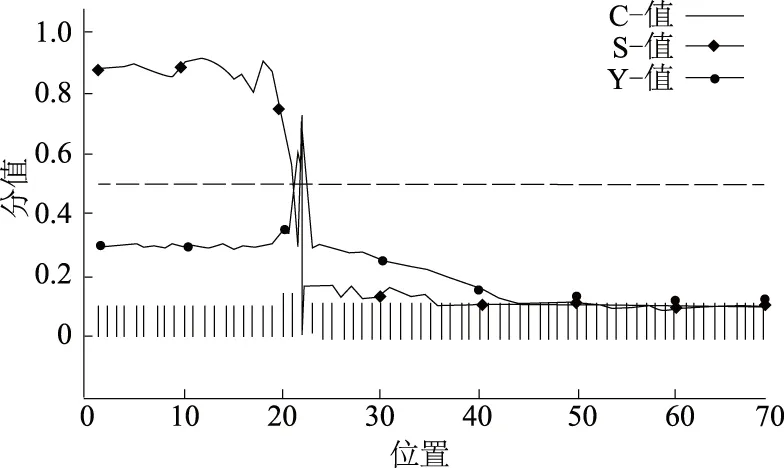
图4 鸭源鸡杆菌 RZ菌株OmpA信号肽预测
2.5 OmpA线性 B细胞抗原表位分析
IEDB Analysis Resource分析结果显示,RZ菌株OmpA的主要线性B细胞抗原表位有10个,分别位于20—31、44—56、91—101、138—148、185—205、216—225、246—255、273—296、315—331、340—360位氨基酸(图6)。

图5 鸭源鸡杆菌RZ菌株OmpA三维(A)及跨膜拓扑结构(B)预测

图6 鸭源鸡杆菌RZ菌株OmpA的线性B细胞抗原表位分析结果
3 结论与讨论
测序结果表明,鸭源鸡杆菌OmpA基因保守性很高,与UMN179、F149及12565/12菌株的OmpA基因相似性达到92.7%~97.3%,氨基酸相似性达到92.7%~95.2%;预测结果显示,鸭源鸡杆菌 OmpA由20种氨基酸组成,在OmpA N端有一个22个氨基酸构成的典型信号肽,存在部分极性氨基酸残基和两亲性反平行β折叠片,以单体形式存在,与其他已知革兰氏阴性菌外膜蛋白OmpA结构相似[15-18]。氨基酸序列中存在5个膜外区域(N端37—62、86—103、133—149、179—193、216—231位),且该蛋白质氨基酸高变区均位于表面。这些膜外区域的变异,一方面可能通过影响蛋白质孔道大小,调节其对不同分子的渗透性;另一方面,可能在鸭源鸡杆菌接触不同的外部环境时,为适应环境而导致氨基酸改变[19],这需要进一步通过定点突变等方法来验证其具体变异机制。该预测结果对于进一步解析OmpA在鸭源鸡杆菌适应不同环境及致病机制等方面发挥的作用具有重要意义。
外膜蛋白位于病原菌表面,通常在与宿主相互作用的过程中直接呈递给宿主的免疫系统,这就导致其更易于被免疫系统识别并刺激宿主产生免疫反应,而外膜蛋白的线性B细胞抗原表位在免疫识别和结合过程中发挥着重要作用,可直接影响疫苗的免疫效果[20]。本研究对鸭源鸡杆菌 OmpA氨基酸序列抗原表位预测发现,该序列中存在 10个B细胞抗原表位,2个(44—56、185—205位)处于高变区,其他8个(20—31、91—101、138—148、216—225、246—255、273—296、315—331、340—360位)均处于高度保守区。有5个抗原表位暴露于膜表面,这就提示鸭源鸡杆菌 OmpA不仅具有较好的抗原性,而且不同菌株之间存在交叉免疫保护,可作为亚单位疫苗候选抗原。这一预测与巴氏杆菌科其他病原菌OmpA的研究相符[11,21-22]。
本研究通过对鸭源鸡杆菌 OmpA分子特征进行预测发现,OmpA位于病原菌表面,高度保守且稳定存在,其氨基酸的高变区均位于胞外环,具有多个高度保守的线性B细胞抗原表位。预测分析并不能完全真实地反映其天然状态,但是却可以简化筛选过程,对进一步深入研究其抗原性和免疫原性具有很好的参考价值,也对进一步解析鸭源鸡杆菌的致病机制具有指导意义。
[1] Christensen H,Bisgaard M,Bojesen A M,etal.Genetic relationships among avian isolates classified asPasteurellahaemolytica,ActinobacillussalpingitidisorPasteurellaanatiswith proposal ofGallibacteriumanatisgen.nov.,comb.nov.and description of additional genomospecies withinGallibacteriumgen.nov[J].International Journal of Systematic and Evolutionary Microbiology,2003,53(1):275-287.
[2] Bojesen A M,Nielsen S S,Bisgaard M.Prevalence and transmission of haemolyticGallibacteriumspecies in chicken production systems with different biosecurity levels[J].Avian Pathology,2003,32(5):503-510.
[3] Neubauer C,De Souza-Pilz M,Bojesen A M,etal.Tissue distribution of haemolyticGallibacteriumanatisisolates in laying birds with reproductive disorders[J].Avian Pathology,2009,38(1):1-7.
[4] Paudel S,Alispahic M,Liebhart D,etal.Assessing pathogenicity ofGallibacteriumanatisin a natural infection model:The respiratory and reproductive tracts of chickens are targets for bacterial colonization[J].Avian Pathology,2013,42(6):527-535.
[5] 王珊,陈陆,付仁一,等.我国部分地区蛋鸡群鸭源鸡杆菌血清流行病学调查[J].中国预防兽医学报,2011,33(2):114-117.
[6] 郭伦涛.鸡杆菌地方分离株耐药性及耐药基因的研究[D].郑州:河南农业大学,2010.
[7] Pore D,Mahata N,Pal A,etal.Outer membrane protein A (OmpA) ofShigellaflexneri2a,induces protective immune response in a mouse model[J].PLoS One,2011,6(6):e22663.
[8] Dabo S M,Confer A W,Quijano-Blas R A.Molecular and immunological characterization ofPasteurellamultocidaserotype A:3 OmpA:Evidence of its role inP.multocidainteraction with extracellular matrix molecules[J].Microbial Pathogenesis,2003,35(4):147-157.
[9] Smith S G,Mahon V,Lambert M A,etal.A molecular Swiss army knife:OmpA structure,function and expression[J].FEMS Microbiology Letters,2007,273(1):1-11.
[10] Pore D,Chowdhury P,Mahata N,etal.Purification and characterization of an immunogenic outer membrane protein ofShigellaflexneri2a[J].Vaccine,2009,27(42):5855-5864.
[11] Carpenter T,Khalid S,Sansom M S.A multidomain outer membrane protein fromPasteurellamultocida:Modelling and simulation studies of PmOmpA[J].Biochimica Et Biophysica Acta,2007,1768(11):2831-2840.
[12] 郑鹿平.我国鸡群鸡杆菌的首次分离鉴定及生物学特性初步研究[D].郑州:河南农业大学,2010.
[13] 唐中伟,周志江.产志贺毒素EHEC国内分离株Stx2基因的克隆及生物信息学分析[J].山西农业科学,2011,39(2):167-169.
[14] 高歌,孙荡,茅翔.猪Ⅱ型圆环病毒江苏株全基因进化及ORF3蛋白的生物信息学分析[J].山西农业科学,2012,40(8):881-885.
[15] Bagos P G,Liakopoulos T D,Spyropoulos I C,etal.PRED-TMBB:A web server for predicting the topology of β-barrel outer membrane proteins[J].Nucleic Acids Research,2004,32:400-404.
[16] Buchanan S K.Beta-barrel proteins from bacterial outer membranes:Structure,function and refolding[J].Current Opinion in Structural Biology,1999,9(4):455-461.
[17] Cowan S W,Schirmer T,Rummel G,etal.Crystal structures explain functional properties of twoE.coliporins[J].Nature,1992,358(6389):727-733.
[18] Stathopoulos C.Bacterial outer membrane proteins:Topological analyses and biotechnological perspectives[J].Membrane & Cell Biology,1999,13(1):3-21.
[19] Lampe M F,Wong K G,Kuehl L M,etal.Chlamydiatrachomatismajor outer membrane protein variants escape neutralization by both monoclonal antibodies and human immune sera[J].American Society for Microbiology,1996,65(1):317-319.
[20] Subramaniam S,Huang B,Loh H,etal.Characterization of a predominant immunogenic outer membrane protein ofRiemerellaanatipestifer[J].Clinical & Diagnostic Laboratory Immunology,2000,7(2):168-174.
[21] Warhurst D C,Craig J C,Adagu I S,etal.The relationship of physico-chemical properties and structure to the differential antiplasmodial activity of the cinchona alkaloids[J].Malaria Journal,2003,2(1):26-39.
[22] Pati U S,Srivastava S K,Roy S C,etal.Immunogenicity of outer membrane protein ofPasteurellamultocidain buffalo calves[J].Veterinary Microbiology,1995,52(3/4):301-311.
Cloning of the Outer Membrane Protein A Gene ofGallibacteriumanatisand Analysis of Its Structure and Function
WANG Yan,WANG Jiyang,WANG Kunpeng,PENG Zhifeng,YANG Xia,WANG Chuanqing*
(Animal Science and Veterinary Medicine,Henan Agricultural University,Zhengzhou 450002,China)
To screen potential protective antigen genes for developing genetic engineering vaccine ofGallibacteriumanatis,a pair of primers were designed according toG.anatisUMN179OmpAgene sequence published in Genbank,and theOmpAgene ofG.anatisPDS-RZ-1-SLG was cloned and sequenced.In addition,the bioinformatics analyses ofOmpAnucleotide and amino acid sequences were made with bioinformatics tools and online servers.The results showed that theOmpAgene was 1 083 bp in size,encoding 360 amino acid residues.Compared with the amino acid sequences of theOmpAofG.anatisUMN179,F149 and 12656/12,the similarity were 93.2%,95.2% and 92.7%,respectively.OmpA is a stable protein,with a relative molecular weight of 38.4 ku and a isoelectric point of 6.77,containing a hydrophobic leader peptide region,which is likely to consist of a long stretch of α helical structures in N-terminal end.
Gallibacteriumanatis;OmpAgene; cloning; structure and function analysis
2017-03-21
国家自然科学基金项目(3177130375);河南省高校科技创新团队与支持计划资助项目(14IRTSHN015)
王 艳(1990-),女,河南信阳人,在读硕士研究生,研究方向:动物传染病发病机制及防制。 E-mail:1078070117@qq.com
*通讯作者:王川庆(1954-),男,河南濮阳人,教授,博士,主要从事动物传染病发病机制及防制研究。 E-mail:wchuanq@163.com
S831.7
A
1004-3268(2017)08-0147-05
