热应激诱导奶牛乳腺上皮细胞凋亡及其对HSP70基因表达的影响
2017-09-01张响英唐现文陈静波李腾腾
张响英,唐现文,陈静波,李腾腾
(1.江苏农牧科技职业学院,江苏 泰州 225300; 2.南京农业大学,江苏 南京 210095)
热应激诱导奶牛乳腺上皮细胞凋亡及其对HSP70基因表达的影响
张响英1,2,唐现文1,陈静波1,李腾腾1
(1.江苏农牧科技职业学院,江苏 泰州 225300; 2.南京农业大学,江苏 南京 210095)
为探讨热应激对乳腺上皮细胞凋亡的影响,以体外培养的奶牛乳腺上皮细胞为模型,取对数生长期的乳腺上皮细胞分别置于39 ℃和41 ℃热处理1 h(以37 ℃正常培养的细胞为对照),在37 ℃恢复培养0、6、12 h后收集细胞,采用MTT法检测细胞生长抑制率,Annexin V/PI 双染法检测细胞凋亡,比色法分析Caspase-3活性,荧光定量PCR检测HSP70基因的表达水平。结果表明,39 ℃热应激组细胞生长抑制率和死亡率高峰期均发生在热修复6 h,细胞死亡率为15.42%,而41 ℃热应激组发生在热修复12 h,细胞死亡率高达23.18%;高温处理后,Caspase-3活性呈上升趋势;39 ℃热应激组在热恢复6 h,HSP70基因表达量显著高于对照组,41 ℃热应激组在热恢复0、6、12 h,HSP70基因的表达量分别为对照组的3.53倍、5.61倍和2.93倍。综上可知,高温应激激活了Caspase-3活性,从而诱导乳腺上皮细胞凋亡,并随高温强度的增加而作用增强,同时高温诱导了HSP70基因过表达,协助细胞获得热耐受性。
乳腺上皮细胞; 热应激; 细胞凋亡;HSP70基因
热应激是指机体应对环境高温所产生的非特异性免疫应答反应。奶牛耐寒畏热,环境温度过高时,便会出现热应激反应,导致机体代谢紊乱、产奶量下降、抗病力降低等,探索奶牛的热应激调控机制可提高奶牛生产性能。研究发现,热应激能降低细胞的活力,诱导细胞凋亡和热休克蛋白(HSPs)表达[1-3]。HSP70作为最重要的HSPs成员,分布在各种细胞中,其在细胞内的聚集或消退与细胞耐热性的获得或丧失密切相关[4]。在正常状态下,细胞内存在一定量的HSP70,无DNA结合活性的热休克转录因子1(HSF-1)单体在胞浆内与HSP70结合形成复合体,当高温应激时,外界信号刺激HSF-1活化,与热休克元件(HSE)结合,诱导HSP表达,阻断Caspase级联反应,从而抑制细胞凋亡[5-6]。不同种类细胞抵抗高温应激的能力,因热处理温度和时间的不同而存在差异。研究报道,间断和持续高温处理均可诱导奶牛乳腺上皮细胞凋亡[7-8]。本研究以体外培养的奶牛乳腺上皮细胞为模型,探讨不同温度处理对细胞凋亡及HSP70基因表达的影响,进一步揭示乳腺的热应激调控机制,以期为缓解奶牛热应激提供理论依据。
1 材料和方法
1.1 试剂和仪器
试剂:DMEM(Gibco公司)、犊牛血清(杭州四季青生物工程材料有限公司)、MTT(Amresco公司)、Caspase-3活性检测试剂盒(上海哈灵生物科技有限公司)、荧光定量PCR试剂盒(Zoonbio公司)、DEPC水(Sigma公司)、Trizol试剂(大连宝生物工程有限公司)等。
仪器:CO2培养箱、无菌操作台、高速低温离心机、WFJ7200型可见分光光度计、酶联免疫仪、凝胶成像系统、FTC2000荧光定量PCR仪等。
1.2 细胞培养及处理
采用组织块法培养奶牛乳腺上皮细胞[9]。取刚屠宰的健康荷斯坦奶牛乳腺组织,剔除脂肪,剪成1~2 mm3的小块进行接种培养,经纯化后取对数生长期细胞用于试验。试验分对照组(CK)、39 ℃热应激组和41 ℃热应激组。(1)对照组:37 ℃培养乳腺上皮细胞24 h,收集细胞;(2)39 ℃热应激组:将正常培养的乳腺上皮细胞置于39 ℃处理1 h,立即放回37 ℃恢复培养,分别在恢复培养的0、6、12 h收集细胞;(3)41 ℃热应激组:将正常培养的乳腺上皮细胞置于41 ℃处理1 h,立即放回37 ℃恢复培养,分别在恢复培养的0、6、12 h收集细胞。
1.3 细胞生长抑制率检测
收集各组处理细胞,加入MTT试剂培养4 h,吸弃上清,然后加入DMSO,静置30 min,在酶标仪上测定490 nm处的吸光值,计算抑制率。细胞生长抑制率=(对照组OD均值-试验组OD 均值)/对照组OD均值×100%。
1.4 乳腺上皮细胞凋亡检测
收集各组处理细胞,采用Annexin V/PI双染法检测细胞凋亡,按照试剂盒使用说明用流式细胞仪检测,统计细胞凋亡数,计算细胞死亡率。细胞死亡率=细胞早期凋亡率+细胞晚期凋亡率(坏死率)。
1.5 Caspase-3活性检测
使用Caspase-3 比色试剂盒,按照使用说明检测Caspase-3的活性。
1.6 荧光定量PCR检测HSP70基因表达量
从GenBank数据库中获得目的基因mRNA序列,运用Primer Premier 5.0软件设计PCR引物,引物序列见表1。

表1 HSP70和GAPDH基因的荧光定量PCR引物
用Trizol试剂盒提取细胞总RNA,紫外分光光度计检测其纯度和浓度,然后反转录获取cDNA,按照以下反应体系进行PCR扩增:SYBRMIX 12.5 μL,上、下游引物各0.5 μL,ROX Dye 2.5 μL,cDNA 2.0 μL,用无菌去离子水补充体系至25 μL。反应条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,共40个循环。样本基因HSP70的表达强度用其对应的GAPDH基因的量进行校正,即△Ct=Ct(HSP70基因)-Ct(GAPDH基因),其相对表达量采用2-ΔΔCt法进行分析。
1.7 数据分析
数据以平均值±标准差表示,采用SPSS17.0软件中的One-Way ANOVA进行统计分析。
2 结果与分析
2.1 热应激对奶牛乳腺上皮细胞生长抑制率的影响
与对照组相比,39 ℃热应激组在热恢复0、6、12 h的细胞生长抑制率分别为14.07%(P>0.05)、 28.13%(P<0.05)和22.02%(P<0.05),41℃热应激组细胞生长抑制率显著增加,热恢复0、6、12 h分别为17.13%(P>0.05)、39.76%(P<0.01)和43.73%(P<0.01);与39 ℃热应激组相比,41 ℃热应激组热恢复0 h细胞生长抑制率差异不显著,热恢复6、12 h细胞抑制率分别提高了11.63个百分点(P<0.05)和21.71个百分点(P<0.01)。以上结果表明,热应激抑制了奶牛乳腺上皮细胞的生长增殖,温度越高抑制作用愈明显。
2.2 热应激对奶牛乳腺上皮细胞凋亡的影响
由表2可知,热应激诱导乳腺上皮细胞死亡,并随高温强度的增加而作用增强,39 ℃热应激组细胞死亡高峰期出现在热修复6 h左右,死亡率为15.42%。与对照组相比,热恢复6 h时,39 ℃热应激组细胞晚期凋亡率(坏死率)提高了6.49个百分点(P<0.05);41 ℃热应激组细胞死亡高峰期出现在热修复12 h,死亡率高达23.18%。
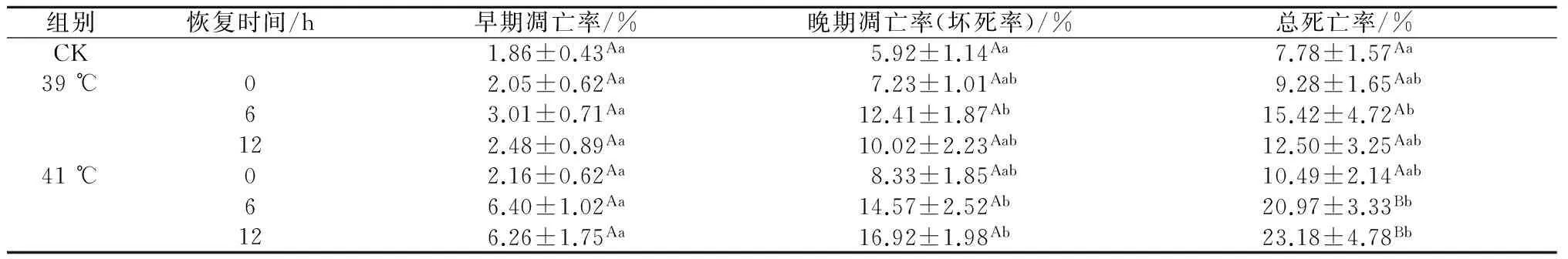
表2 热应激对乳腺上皮细胞凋亡的影响
注:同列数据不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01)。
2.3 热应激对奶牛乳腺上皮细胞Caspase-3活性的影响
从图1可以看出,高温处理后,Caspase-3活性呈上升趋势。与对照组相比,39 ℃和41 ℃热应激组在热恢复0 h时,Caspase-3活性变化均不明显,39 ℃热应激组在热恢复6 h时 Caspase-3活性显著上升(P<0.05),41 ℃热应激组在热恢复6、12 h,Caspase-3活性分别为对照组的4.55倍(P<0.01)、5.31倍(P<0.01);在热恢复6、12 h,41 ℃热应激组Caspase-3活性显著高于39 ℃热应激组。提示热应激反应激活了凋亡级联反应中的关键因子Caspase-3的活性,从而引发细胞凋亡。
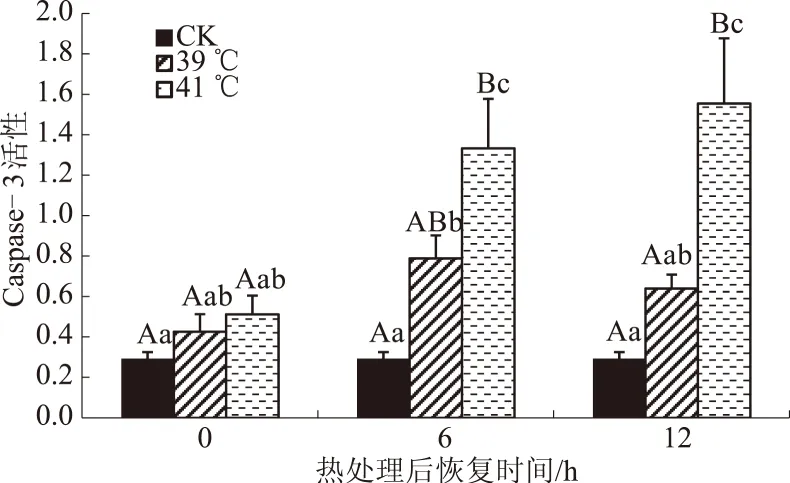
同一时间不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),下同图1 热应激对乳腺上皮细胞Caspase-3活性的影响
2.4 热应激对奶牛乳腺上皮细胞HSP70基因表达的影响
从图2可以看出,与对照组相比,39 ℃热应激组在热恢复6 h,HSP70 基因表达量显著高于对照组(P<0.05),41 ℃热应激组在热恢复0、6、12 h,HSP70基因的表达量分别为对照组的3.53倍(P<0.05)、5.61倍(P<0.01)和2.93倍(P<0.05);在热恢复6 h,41 ℃热应激组HSP70基因的表达量显著高于39 ℃热应激组。说明热应激可提高奶牛乳腺上皮细胞HSP70基因的转录水平,从而保护细胞免受伤害。
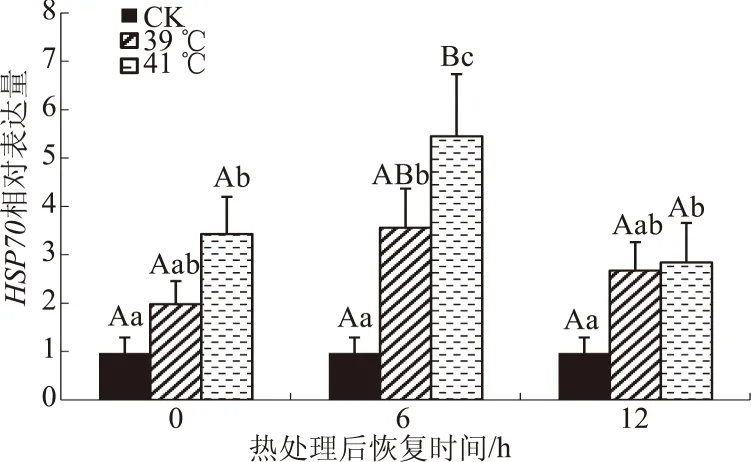
图2 热应激对奶牛乳腺上皮细胞HSP70基因表达的影响
3 结论与讨论
乳腺细胞的增殖和凋亡共同处在动态平衡之中,这对乳腺的发育和功能的形成都有重要作用[10]。乳腺细胞凋亡是一个非常复杂的过程,不仅可自发产生,也受高温、缺氧、射线、感染、药物等多种因素的影响[11-13]。管英俊等[14]对原代培养神经细胞的研究表明,高温可使神经细胞的表面结构和内部微细结构发生明显变化,降低LDH活性,诱导DNA片段形成,从而诱发原代培养神经细胞凋亡。杜娟等[3]报道,高温使细胞G/M 期阻滞,诱导乳腺细胞凋亡,形态上表现为染色质浓缩、线粒体肿胀、空泡化、形成凋亡小体。热应激对细胞的死亡诱导是一个延迟、渐进的过程。本试验发现,39 ℃热应激组细胞生长抑制率和死亡率高峰期均发生在热修复6 h,而41 ℃热应激组细胞死亡高峰期则出现在热修复12 h左右,死亡率为23.18%。O’Neill等[15]将人淋巴细胞置于43 ℃环境热处理1 h,在热恢复12~18 h细胞凋亡达最高峰,提示高温诱导的细胞凋亡呈时间依赖性。人的白血病细胞系HL-60细胞43 ℃热处理1 h,热恢复12 h出现死亡最高峰[16]。可见,细胞死亡是细胞遭受应激的后续事件,不同的应激因素,不同的细胞类型,其高峰期出现的时间也不一致。
Caspase家族是半胱氨酸依赖性细胞死亡蛋白酶,是细胞凋亡过程中的关键元件[17],其中Caspases-3是细胞凋亡过程中最主要的终末剪切酶,处于凋亡级联反应的下游,是多种凋亡刺激信号传递的汇聚点,是细胞程序性死亡的介导者和执行者[18]。本研究发现,高温处理后,Caspase-3活性呈上升趋势,在热恢复6 h和12 h,41 ℃热应激组Caspase-3活性均显著高于39 ℃热应激组。正常情况下,Caspase-3以无活性的酶原形式存在于胞浆中,而在细胞凋亡早期阶段,Caspase-3被激活,裂解相应的胞浆胞核底物,最终引起细胞凋亡,Caspase-3活化是细胞凋亡进入不可逆阶段的标志。
HSP70是细胞在应激状态下启动的一系列特殊基因编码合成的蛋白质,具有多种生物学功能,如参与分子伴侣功能,提高细胞的应激耐受性,参与细胞骨架的形成与修复等[19]。高热、缺氧、机械刺激、射线等多种有害因素刺激均可诱导HSP70的产生[20-21]。荧光定量PCR分析结果表明,奶牛乳腺上皮细胞在41 ℃高温应激后0~12 h内引发HSP70基因过表达,细胞凋亡率明显增高,这与郭亮等[7]的报道相一致。这可能是因为损伤的细胞内蛋白质变性、聚集、错折叠等现象大大增多,通过一系列机制诱导HSP70基因表达量上升。热应激后,HSP70高强度表达是评价组织细胞危险性的生物标志[22],也提高了细胞的耐热能力。HSP使细胞产生耐热性的分子机制可能与HSP可防止细胞内蛋白质的错误折叠或聚集有关。热应激条件下,细胞DNA合成、RNA 转录及翻译均会受到抑制,蛋白质发生变性、错误聚集甚至降解,细胞膜通透性改变[23]。Segal等[24]研究发现,热应激状态下细胞内蛋白质变性导致功能丧失,HSP70基因表达量升高,提高了细胞对高温的耐受性。
[1] Santos M J,Carvalh O F,Sousa C,etal.Cytotoxicity and cell signaling induced by continuous mild hyperthermia in freshly isolated mouse hepatocytes[J].Toxicology,2006,224:210-218.
[2] Lacetera N,Bernabucci U,Scalia D,etal.Heat stress elicits different responses in peripheral blood mononuclear cells from Brown Swiss and Holstein cows[J].Journal of Dairy Science,2006,89(12):4606-4612.
[3] 杜娟,狄和双,郭亮,等.高温对乳腺上皮细胞生长及凋亡的影响[J].动物学报,2006,52(5):959-965.
[4] Njemini R,Lambert M,Demanet C,etal.Elevated serum heat-shock protein 70 levels in patients with acute infection:Use of an optimized enzyme-linked immunosorbent assay[J].Scandinavian Journal of Immunology,2003,58(6):664-669.
[5] Morano K A,Thiele D J.Heat shock factor function and regulation in response to cellular stress,growth,and differentiation signals[J].Gene Expression,1999,7(4/6):271-282.
[6] Hwang I Y,Quan J H,Ahn M H,etal.Toxoplasmagondii infection inhibits the mitochondrial apoptosis through induction of Bcl-2 and HSP70[J].Parasitology Research,2010,107(6):1313-1321.
[7] 郭亮,杜娟,狄和双,等.单一或连续高温处理对奶牛乳腺细胞的生长及凋亡的影响[J].南京农业大学学报,2007,30(3):100-104.
[8] 周振峰,崔瑞莲,王加启,等.热应激对体外培养奶牛乳腺上皮细胞生长、凋亡及其热休克蛋白mRNA转录的影响[J].畜牧兽医学报,2010,41(5):600-607.
[9] 狄和双,杜娟,王利刚,等.组织灌流与贴壁法体外培养奶牛乳腺组织的比较研究[J].生物工程学报,2006,22(6):1040-1046.
[10] Gteen K A,Atreuli C H.Apoptosisregulation in the mammary gland[J].Cell Mol Life Sci,2004,61(15):1867-1883.
[11] Park S,Matsumura F.Characterization of anti-apoptotic action of TCDD as a defensive cellular stress response reaction against the cell damaging action of ultra-violet irradiation in an immortalized normal human mammary epithelial cell line,MCF10A[J].Toxicology,2006,217(2/3):139-146.
[12] Du J,Di H S,Guo L,etal.Hyperthermia causes bovine mammary epithelial cell death by a mitochondrial-induced pathway[J].Journal of Thermal Biology,2008,33(1):37-47.
[13] Chen Z H,Na H K,Hurh Y J,etal.4-Hydroxyestradiol induces oxidative stress and apoptosis in human mammary epithelial cells:Possible protection by NF-kappaB and ERK/MAPK[J].Toxicology and Applied Pharmacology,2005,208(1):46-56.
[14] 管英俊,高英茂,隽兆东,等.高温对元代培养的神经细胞的影响[J].解剖学杂志,2000,23(1):15-19.
[15] O’Neill K L,Fairbairn D W,Smith M J,etal.Critical parameters influencing hyperthermia-induced apoptosis in human lymphoid cell lines[J].Apoptosis,1998,3(5):369-375.
[16] Poe B S,O’Neill K L.Caffeine modulates heat shock induced apoptosis in the human promyelocytic leukemia cell line HL-60[J].Cancer Letters,1997,121(1):1-6.
[17] Gao C,Tsuchida N.Activation of caspases in p53-induced transactivation-independent apoptosis[J].Japanese Journal of Cancer Research,1999,90(2):180-187.
[18] Hengartner M O.The biochemistry of apoptosis[J].Nature,2000,407(12):770-776.
[19] Yenari M A,Liu J,Zheng Z,etal.Antiapoptotic and anti-inflammatory mechanisms of heat-shock protein protection[J].Annals of the New York Academy of Sciences,2005,1053:74-83.
[20] 李莲,宋维龙,周磊,等.不同应激对HeLa细胞增殖、凋亡及热休克蛋白70表达的影响[J].癌变·畸变·突变,2005,17(5):272-275.
[21] Mosser D D,Caron A W,Bourget L,etal.Role of the human heat shock proteinHSP70 in protection against stress-induced apoptosis[J].Molecular and Cellular Biology,1997,17(9):5317-5327.
[22] Khanolkar-Young S,Young D B,Colston M J,etal.Nerve and skin damage in leprosy is associated with increased intralesional heat shock protein[J].Clinical and Experimental Immunology,1994,96(2):208-213.
[23] Sonna L A,Fujita J,Gaffin S L,etal.Invitedreview:Effects of heat and cold stress on mammalian gene expression[J].Journal of Applied Physiology,2002,92(4):1725-1742.
[24] Segal G,Rone Z.Regulation of heat shock response in bacteria[J].Ann N Y Acad Sci,1998,851(1):147-151.
Effects of Heat Stress on Apoptosis and Expression ofHSP70 mRNA in Bovine Mammary Epithelial Cells
ZHANG Xiangying1,2,TANG Xianwen1,CHEN Jingbo1,LI Tengteng1
(1.Jiangsu Agri-animal Husbandry Vocational College,Taizhou 225300,China;2.Nanjing Agricultural University,Nanjing 210095,China)
To explore the effects of heat stress on the apoptosis of the bovine mammary epithelial cells and the expression ofHSP70 mRNA,the logarithmic growth phase mammary epithelial cells were exposed to 39 ℃ and 41 ℃ for 1 h(the control group was cultured at 37 ℃),and cells were collected in the recovery times at 0,6,12 h.Cell growth inhibition rate was detected by MTT method,cell apoptosis was measured by Annexin V/PI double staining method,Caspase-3 activity was detected by colorimetric assay and the expression level ofHSP70 was tested by RQ-PCR.The results showed that the highest growth inhibition rate and maximum death rate of mammary epithelial cells occurred in the recovery 6 h against 39 ℃ and the cell mortality rate was 15.42%,while they occurred in the recovery 12 h against 41 ℃ and the largest cell mortality rate was 23.18%.After high temperature treatment,the activity of Caspase-3 increased.The expression level ofHSP70 mRNA in the recovery 6 h against 39 ℃was significantly higher than that in control.And it was 3.53 times,5.61 times and 2.93 times significantly higher than that of control in the recovery 0,6,12 h respectively against 41 ℃.This suggested that heat stress activated the activity of Caspase-3 in the mammary epithelial cells and induced cell apoptosis with the increase of temperature.At the same time,the cells over-expressedHSP70 by heat stress,and could acquire tolerance.
mammary epithelial cells; heat stress; cell apoptosis;HSP70
2017-02-26
江苏省科技支撑计划项目(BE2008306-2);江苏农牧科技职业学院大学生创新创业项目(201612806053P)
张响英(1974-),女,山东烟台人,副教授,博士,主要从事动物遗传繁育与生物技术研究。 E-mail:724673081@qq.com
S823;Q256
A
1004-3268(2017)08-0142-05
