地塞米松抑制胆管瘢痕成纤维细胞的体外研究*
2017-09-01李克跃石承先汤可立刘振华黎涛张帅民徐贤刚
李克跃,石承先,汤可立,刘振华,黎涛,张帅民,徐贤刚
(贵州省人民医院 肝胆外科,贵州 贵阳 550002)
地塞米松抑制胆管瘢痕成纤维细胞的体外研究*
李克跃,石承先,汤可立,刘振华,黎涛,张帅民,徐贤刚
(贵州省人民医院 肝胆外科,贵州 贵阳 550002)
目的研究地塞米松(DEX)对体外培养的兔胆管瘢痕模型成纤维细胞(MF)中I型胶原、结缔组织生长因子(CTGF)及第10号染色体丢失的张力蛋白同源的磷酸酶基因(PTEN)表达的影响。方法对家兔采用切开再吻合方法复制胆管瘢痕模型并获取MF,经细胞鉴定后对MF给予不同浓度的DEX(0.00、0.01、0.05和0.25 mg/ml)干预48 h,活细胞计数法试剂盒测定各组细胞增殖水平;实时聚合酶链反应检测各组细胞I型胶原、CTGF和PTEN mRNA表达水平;Western blot检测各组细胞I型胶原和PTEN蛋白表达水平。结果在DEX干预48 h后,MF增殖受抑制,细胞I型胶原、CTGF mRNA和蛋白表达下调,PTEN mRNA和蛋白表达上调(P<0.05),呈浓度依耐性。结论DEX可能具有抑制胆管瘢痕及良性胆道狭窄形成的作用,其机制之一可能与MF中I型胶原、CTGF及PTEN的调控有关。
胆管瘢痕;成纤维细胞;抑制;体外;地塞米松
良性胆道狭窄(benign biliary stricture,BBS)的直接原因是胆道增生性瘢痕的形成,其发病率逐年增高。成纤维细胞大量增殖、Ⅰ型胶原过度积聚及结缔组织生长因子(connective tissue growth factor,CTGF)的过高表达等是瘢痕及BBS的主要特征[1-4]。第10号染色体丢失的张力蛋白同源的磷酸酶基因(phosphataseand tensin homolog deleted on chromosome 10,PTEN)可抑制皮肤瘢痕的形成[5-6]。地塞米松(Dexamethasone,DEX)已被用于防治皮肤瘢痕形成[7-9]。但DEX对BBS的作用尚不清楚。本研究对BBS胆管成纤维细胞使用DEX进行干预,现报道如下。
1 材料与方法
1.1 实验材料
抗-Ⅰ型胶原蛋白抗体(SAB2100463)、抗-PTEN蛋白抗体(PLA0133)、抗-波形蛋白单克隆抗体(V2258)、抗 -细胞角蛋白单克隆抗体(C-1801)及聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜购自美国Sigma公司,抗-β-肌动蛋白(β-actin)单克隆抗体、辣根过氧化物酶(horseradish peroxidase,HRP)标记的第二抗体购自北京全式金生物技术有限公司,电化学发光(electrochemical luminescence,ECL)试剂盒(美国Millipore公司),SYBR Premix Ex TaqTM(Tli RNase H Plus)(大连宝生生物工程公司有限公司),4',6- 二脒基 -2- 苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(瑞士 Roche 公司),全蛋白提取试剂盒、UNIQ-10柱式Trizol总RNA提取试剂盒、逆转录试剂盒、β-actin引物、Trizol、胰酶(0.25%)、活细胞计数法试剂盒(cell counting kit-8,CCK-8)、胎牛血清(fetal bovine serum,FBS)、达尔伯克改良伊格尔培养基(dulbecco's modified eagle medium,DMEM)购自上海生工生物工程股份有限公司,Ⅰ型胶原、CTGF、PTEN引物购自上海Introgen公司,Ⅰ型胶原正向引物:5'-AGAACGGAGATGACGG AGAA-3',反向引物:5'-CCAAACCACTGAAACCTC TGT-3';CTGF 正向引物:5'-GGCTAAGTTCTGCGGA GTATG-3',反向引物:5'-CAGGCACAGGTCTTGATG AA-3';PTEN 正向引物:5'-AAACAGTAGAGGAGCC ATCAAATC-3',反向引物:5'-TCAGAGTCAGTGGTG TCAGAAT-3';β-actin 正向引物:5'-CTCTCCACCT TCCAGCAGAT-3',反向引物:5'-TGGCTCTAACAGT CCGCCTA-3'。地塞米松磷酸钠注射液(武汉华中药业有限公司,批号:20150204),家兔4只购自贵州医科大学实验动物中心。
1.2 动物模型的复制、细胞的获取及细胞鉴定
清洁级家兔4只,其中2只用于正常对照组,2只用于复制BBS模型,术前12 h禁食,分笼饲养,动物的饲养在贵州医科大学实验动物中心进行。动物未出现死亡、胆瘘等并发症。采用2.5%戊巴比妥钠溶液(40~45 mg/kg体重)静脉注射麻醉,取上腹部正中切口,切开皮肤及皮下组织,暴露胆总管,BBS模型组在近十二指肠处游离长约1 cm的胆总管,横向切开胆总管,长约其周径的1/3,用Dexon线缝合胆总管,逐层关腹[3]。正常对照组开腹后就关腹,不打开胆总管。各组术后禁食12 h后正常进食。取BBS模型组及正常对照组术后1周胆管壁[3],胆管组织用磷酸盐缓冲溶液(phosphate buffer solution,PBS)清洗3次后剪为2~3 mm3大小,转移至25 cm2培养瓶中,放入37℃、5%二氧化碳CO2培养箱中贴壁4 h,加入少许含 20%(v/v)FBS、100 u/ml青霉素、100 mg/ml链霉素的DMEM培养液进行培养[10]。使用差速贴壁法分离,纯化成纤维细胞,细胞生长至80%~90%融合时传代。选择第3代成纤维细胞进行细胞鉴定。使用细胞免疫荧光法检测波形蛋白和细胞角蛋白抗体的表达,进行成纤维细胞的鉴定[10]。实验所用细胞为第3~5代成纤维细胞。
1.3 分组及各组细胞的处理
实验分组如下:正常胆管成纤维细胞(normal bile duct fibroblasts,NF)组;BBS 模型胆管成纤维细胞(model fibroblasts,MF)组;MF+ 不同浓度的DEX 组(DEX浓度分别为0.01,0.05和0.25 mg/ml)。细胞经消化后,转移到6孔板(细胞增殖测定用96孔板),细胞密度为2×105个/孔(细胞增殖测定2×104个/孔)。含10%FBS的培养基培养4 h后改为不含FBS的培养基饥饿过夜,根据分组的不同加用含对应浓度药物的培养基在37℃、5%C02培养箱分别培养48 h。
1.4 观察指标及测定方法
1.4.1 成纤维细胞 采用细胞免疫荧光法,胰酶消化细胞,按照2×105个/孔均匀接种至带有玻璃片的6孔板中,24 h后进行免疫荧光操作,具体步骤如下:PBS清洗细胞,4%多聚甲醛室温固定15 min;PBS清洗后加入0.1%Triton-100室温孵育10 min,PBS清洗后加入10%山羊血清室温封闭30 min,吸取150 μl第一抗体(波形蛋白和细胞角蛋白稀释至1∶200)滴在封口膜上,将盖玻片倒扣于封口膜,4℃孵育过夜。将盖玻片放入6孔板中,PBS清洗后加入含山羊抗小鼠的Alexia第二抗体室温孵育30 min,PBS 清洗后滴加稀释的 DAPI(1∶100);封片剂封片,荧光显微镜下观察并拍照。阴性对照以PBS代替第一抗体,排除非特异性的第二抗体结合。
1.4.2 成纤维细胞增殖的测定 按CCK-8说明书进行操作。将成纤维细胞按照2×104个/孔接种于96孔板,100μl/孔,重复5次/孔。细胞在37℃、5%CO2培养箱培养24 h后根据分组的不同,加入对应浓度的DEX分别培养48 h,加入CCK-8试剂10 μl/孔培养2.5 h,在酶标仪上450 nm波长处测定每孔的光密度(optical density,OD)值,采用扣除本底策略来消除误差。
1.4.3 各组细胞中I型胶原、CTGF及PTEN mRNA表达的检测 采用用荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRTPCR)分别提取各组细胞总RNA,将纯度好、完整性高的RNA合成cDNA。qRT-PCR反应体系为20 μl,其中正反向引物各 0.8 μl,样品 cDNA 2 μl,双蒸水 6 μl,2×SYBRR Premix 10 μl,ROX Reference Dye(50×)0.4 μl,每个样品重复 4 次。PCR 反应条件为:95℃预变性 30 s,95℃变性 5 s,60℃退火30 s,共40个循环。使用ABI Stepone software v 2.3 qRTPCR系统采集数据并分析结果,熔解曲线为单峰表示引物特异性好,β-actin为内参,采用2-△△Ct方法计算目的基因的相对表达量。
1.5 各组细胞中I型胶原及PTEN蛋白表达的检测
采用Western blot检测分别提取各组细胞总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度,用聚丙烯酰胺凝胶进行蛋白电泳,PVDF转膜后给予封闭,按1∶5 000稀释目的蛋白的一抗,在4℃冰箱内孵育过夜,以三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline and tween 20,TBST)在摇床上洗PVDF膜3次。按1∶5 000稀释二抗,在室温下振荡孵育2 h,以TBST清洗PVDF膜3次,10 min/次。电化学发光后用显影和定影方法对胶片进行拍照和扫描,β-actin蛋白为内参,以Quantity One系统分析目的条带的相对灰度值。
1.6 统计学方法
数据分析采用SPSS 16.0统计软件,计量资料以均数±标准差(±s)表示,多组间比较用方差分析,两两比较用Bonferroni法,P<0.05为差异有统计学意义。
2 结果
2.1 成纤维细胞的鉴定
镜下可见原代培养的胆管成纤维细胞部分呈不规则三角形,胞质淡而透明,折光弱,细胞核较大,呈椭圆形,通常含2或3个核,随后逐渐变为梭形的单个核细胞,为成纤维样细胞。第3代成纤维细胞波形蛋白细胞免疫荧光阳性,细胞角蛋白细胞免疫荧光阴性,符合成纤维细胞的特点。见图1。
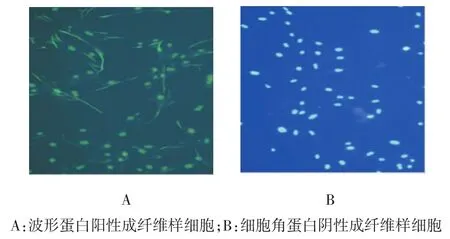
图1 兔胆管成纤维细胞的鉴定 (荧光显微镜×100)
2.2 各组增殖水平的比较
NF组OD值为(0.329±0.005),MF组 OD值为(0.531±0.007),MF+DEX 0.01 mg/ml组 OD 值为(0.501±0.007),MF+DEX 0.05 mg/ml组 OD 值为(0.458±0.004),MF+DEX 0.25 mg/ml组 OD 值为(0.398±0.004),经单因素方差分析,差异有统计学意义(F=1 120.000,P=0.000);MF组的 OD 值较 NF组的高,MF+DEX组OD值较MF组低。见图2。
2.3 各组I型胶原、CTGF及PTEN mRNA表达的比较
各组细胞Ⅰ型胶原mRNA的相对表达量:NF组为(1.000±0.002),MF 组为(2.957±0.023),MF+DEX 0.01 mg/ml组为(2.718±0.054),MF+DEX 0.05 mg/ml组为(2.453±0.053),MF+DEX 0.25 mg/ml组为(2.182±0.036),经单因素方差分析,差异有统计学意义(F=1 629.000,P=0.000);MF 组的Ⅰ型胶原mRNA表达较NF组高,MF+DEX组的Ⅰ型胶原mRNA表达较MF组低。见表1。
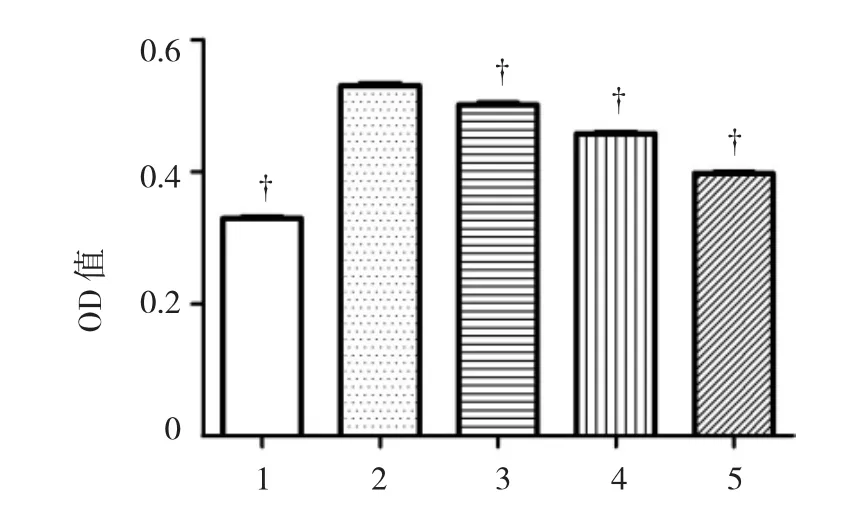
图2 不同组别细胞增殖水平比较 (±s)
各组细胞CTGF mRNA的相对表达量:NF组为(1.000±0.003),MF 组为(3.365±0.009),MF+DEX 0.01 mg/ml组为(2.952±0.035),MF+DEX 0.05 mg/ml组为 (2.542±0.047),MF+DEX 0.25 mg/ml组为(2.007±0.045),经单因素方差分析,差异有统计学意义(F=3 026.000,P=0.000);MF 组 CTGF mRNA表达较NF组高,MF+DEX组CTGF mRNA表达较MF组低。见表1。
各组细胞PTEN mRNA的相对表达量:NF组为(1.000±0.006),MF 组为(0.416±0.024),MF+DEX 0.01 mg/ml组为(0.448±0.009),MF+DEX 0.05 mg/ml组 为 (0.537±0.053),MF+DEX 0.25 mg/ml组 为(0.620±0.029),经单因素方差分析,差异有统计学意义(F=304.179,P=0.000);MF 组 PTEN mRNA 表达较NF组低,MF+DEX组PTEN mRNA表达较MF组高。见表1。
2.4 各组I型胶原和PTEN蛋白表达水平的比较
各组细胞Ⅰ型胶原蛋白的相对表达量:NF组为(1.000±0.021),MF 组为(2.706±0.032),MF+DEX 0.01 mg/ml组为(2.643±0.043),MF+DEX 0.05 mg/ml组为 (2.175±0.060),MF+DEX 0.25 mg/ml组为(1.847±0.028),经单因素方差分析,差异有统计学意义(F=1 256.000,P=0.000);MF组Ⅰ型胶原蛋白表达较NF组高,MF+DEX组Ⅰ型胶原蛋白表达较MF组低。见表2和图3。
各组细胞PTEN蛋白的相对表达量:NF组为(1.000±0.044),MF 组为(0.494±0.049),MF+DEX 0.01 mg/ml组为(0.535±0.038),MF+DEX 0.05 mg/ml组为 (0.623±0.028),MF+DEX 0.25 mg/ml组为(0.680±0.015),经单因素方差分析,差异有统计学意义(F=116.637,P=0.000);MF 组 PTEN 蛋白表达较NF组低,MF+DEX组PTEN蛋白表达较MF组高。见表2和图3。
表1 各组Ⅰ型胶原、CTGF及PTEN mRNA表达的比较(±s)

表1 各组Ⅰ型胶原、CTGF及PTEN mRNA表达的比较(±s)
注:†与MF组比较,P<0.05
组别 Ⅰ型胶原 CTGF PTEN NF 组 1.000±0.002†1.000±0.003†1.000±0.006†MF 组 2.957±0.023 3.365±0.009 0.416±0.024 MF+DEX 0.01 mg/ml组 2.718±0.054†2.952±0.035†0.448±0.009 MF+DEX 0.05 mg/ml组 2.453±0.053†2.542±0.047†0.537±0.053†MF+DEX 0.25 mg/ml组 2.182±0.036†2.007±0.045†0.620±0.029†F值 1 629.00 3 026.00 304.179P值 0.000 0.000 0.000
表2 各组Ⅰ型胶原和PTEN蛋白表达水平的比较 (±s)
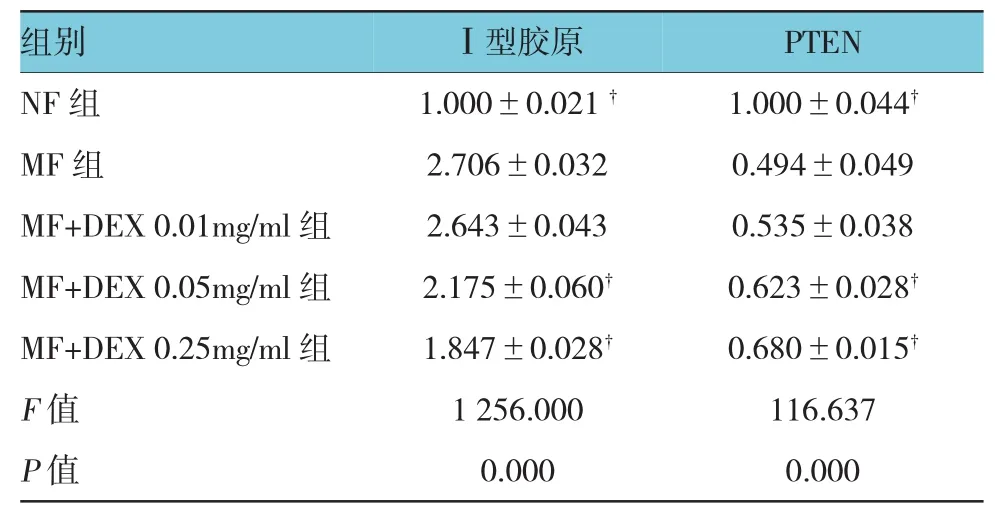
表2 各组Ⅰ型胶原和PTEN蛋白表达水平的比较 (±s)
注:†与MF组比较,P<0.05
组别 Ⅰ型胶原 PTEN NF组 1.000±0.021†1.000±0.044†MF 组 2.706±0.032 0.494±0.049 MF+DEX 0.01mg/ml组 2.643±0.043 0.535±0.038 MF+DEX 0.05mg/ml组 2.175±0.060†0.623±0.028†MF+DEX 0.25mg/ml组 1.847±0.028†0.680±0.015†F值 1 256.000 116.637P值 0.000 0.000

图3 各组I型胶原和PTEN蛋白表达水平的比较
3 讨论
在损伤修复的过程中,不可避免会形成不同程度的增生性疤痕,轻微的瘢痕可以通过组织塑形得以纠正,过多的瘢痕则难以通过简单的组织塑形予以解决[11]。增生性瘢痕在胆道的形成伴随着较高的BBS发病率。
成纤维细胞是重要的组织修复细胞,来源于胚胎时期的间充质细胞。组织损伤后,成纤维细胞大量增殖并转化为肌成纤维细胞,一方面收缩创面,另一方面分泌细胞外基质填补创面。正常情况下,一旦创面被完全表皮化,组织修复过程趋于停止,成纤维细胞及肌成纤维细胞等组织修复细胞就开始加速凋亡,细胞外基质的分泌就减少;另一方面,一旦成纤维细胞及肌成纤维细胞等组织修复细胞持续过度增殖、细胞外基质过度积聚,则形成增生性瘢痕[12]。胶原是构成细胞外基质的骨架,尤其是Ⅰ型胶原是细胞外基质的重要组成部分。在胆管瘢痕修复及BBS形成过程中,成纤维细胞大量增殖,同时转化为肌成纤维细胞收缩创面、分泌大量包括Ⅰ型胶原在内的细胞外基质填补创面,成纤维细胞和肌成纤维细胞是胆管瘢痕修复及BBS形成过程中的主要效应细胞[3-4]。本研究结果提示,BBS模型胆管成纤维细胞中Ⅰ型胶原的表达较正常胆管成纤维细胞中的表达增高,提示大量Ⅰ型胶原的产生在BBS形成过程中可能发挥重要作用。
CTGF是一种可刺激成纤维细胞增殖和胶原沉积的生长因子,可由成纤维细胞、内皮细胞及平滑肌细胞合成分泌。CTGF可以直接作用于成纤维细胞等间充质来源细胞,促进细胞增殖和合成包括Ⅰ型胶原在内的细胞外基质,还能作为转化生长因子-β1(transforming growth factor-β1,TGF-β1)和c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)的下游蛋白介导其促瘢痕形成[13]。而TGF-β1是目前已知的与瘢痕及胆管瘢痕形成最重要的细胞因子。研究表明,CTGF对TGF-β1诱导的肌成纤维细胞分化是必需的,但仅CTGF不足以引起肌成纤维细胞的分化和胶原基质的收缩[14]。研究发现,CTGF在胆管瘢痕组织中的表达增高,并且可能是通过TGF-β1/Smads/CTGF通路在胆管瘢痕修复和BBS形成过程中发挥重要作用[2]。本研究结果提示,BBS模型胆管成纤维细胞中CTGF的表达较正常胆管成纤维细胞中上调,提示CTGF在BBS形成过程中可能发挥重要作用。
PTEN作为一种肿瘤抑制基因,在中枢神经系统、心脏、肝脏、肾脏、胃肠道及皮肤等全身多器官有表达。研究发现,通过对皮肤瘢痕成纤维细胞转染PTEN基因后,成纤维细胞蛋白激酶 B(protein kinase B,AKT)活性降低,细胞增殖、胶原合成受抑制,细胞凋亡增加,PTEN可能通过调控PTEN/AKT和PTEN/磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/AKT 通路抑制皮肤瘢痕的形成[5,15]。调控瘢痕成纤维细胞中PTEN的表达是瘢痕治疗的措施之一[15-17]。本研究结果提示,PTEN在胆管成纤维细胞中有表达,并且BBS模型胆管成纤维细胞中PTEN mRNA和蛋白表达较正常胆管成纤维细胞下调,提示PTEN的下调在BBS形成过程中可能发挥重要作用。
地塞米松是临床常用的糖皮质类激素,具有较强的抗炎、免疫抑制等作用。研究表明,地塞米松能抑制皮肤瘢痕成纤维细胞增殖,抑制瘢痕形成,而机制可能与其调控瘢痕成纤维细胞中TGF-β1/Smads信号转导通路等因素有关[7-9]。本实验结果提示,地塞米松能下调BBS模型胆管成纤维细胞中Ⅰ型胶原、CTGF mRNA及蛋白的表达,同时上调该细胞中PTEN mRNA和蛋白表达,从而抑制该细胞的增殖,且浓度越高(DEX 0.05~0.25 mg/ml),抑制作用越强。提示DEX抑制BBS形成的作用机制之一可能与其对BBS模型胆管成纤维细胞中Ⅰ型胶原、CTGF及PTEN的调控有关。
总之,与正常胆管成纤维细胞比较,BBS胆管成纤维细胞增殖加快,而Ⅰ型胶原和CTGF的表达上调,PTEN的表达下调,DEX可能具有抑制BBS形成的作用,其机制之一可能与其对BBS胆管成纤维细胞中Ⅰ型胶原、CTGF及PTEN的调控有关。
[1]HUANG C,AKAISHI S,OGAWA R.Mechanosignaling pathways in cutaneous scarring[J].Arch Dermatol Res,2012,304(8):589-597.
[2]GENG Z M,ZHENG J B,ZHANG X X,et al.Role of transforming growth factor-beta signaling pathway in pathogenesis of be nign biliary stricture[J].World J Gastroenterol,2008,14(31):4949-4954.
[3]GENG Z M,YAO Y M,LIU Q G,et al.Mechanism of benign biliary stricture:a morphological and immunohistochemical study[J].World J Gastroenterol,2005,11(2):293-295.
[4]XU J,GENG Z M,MA Q Y.Microstructural and ultrastructural changes in the healing process of bile duct trauma[J].Hepatobiliary Pancreat Dis Int,2003,2(2):295-299.
[5]GUO L,CHEN L,BI S,et al.PTEN inhibits proliferation and functions of hypertrophic scar fibroblasts[J].Mol Cell Biochem,2012,361(1/2):161-168.
[6]SANG P F,WANG H,WANG M,et al.NEDD4-1 and PTEN expression in keloid scarring[J].Genet Mol Res,2015,14(4):13467-13475.
[7]SYED F,BAYAT A.Superior effect of combination vs.single steroid therapy in keloid disease:a comparative in vitro analysis of glucocorticoids[J].Wound Repair Regen,2013,21(1):88-102.
[8]WRZESZCZ A,DITTRICH B,HAAMANN D,et al.Dexamethasone released from cochlear implant coatings combined with a protein repellent hydrogel layer inhibits fibroblast proliferation[J].J Biomed Mater Res A,2014,102(2):442-454.
[9]SCHWARTZE J T,BECKER S,SAKKAS E,et al.Glucocorticoids recruit tgfbr3 and smad1 to shift transforming growth factor-beta signaling from the tgfbr1/smad2/3 axis to the acvrl1/smad1 axis in lung fibroblasts[J].J Biol Chem,2014,289(6):3262-3275.
[10]LI K Y,SHI C X,HUANG J Z,et al.Tetramethylpyrazine effects on the expression of scar-related genes in rabbit benign biliary stricture fibroblasts[J].J Coll Physicians Surg Pak,2016,26(10):813-817.
[11]GAUGLITZ G G,KORTING H C,PAVICIC T,et al.Hypertrophic scarring and keloids:pathomechanisms and current and emerging treatment strategies[J].Mol Med,2011,17(1/2):113-125.
[12]HU B,PHAN S H.Myofibroblasts[J].Curr Opin Rheumatol,2013,25(1):71-77.
[13]SHI L,CHANG Y,YANG Y,et al.Activation of JNK signaling mediates connective tissue growth factor expression and scar formation in corneal wound healing[J].PLoS One,2012,7(2):DOI:10.1371/journal.pone.0032128.
[14]GARRETT Q,KHAW P T,BLALOCK T D,et al.Involvement of CTGF in TGF-beta1-stimulation of myofibroblast differentiation and collagen matrix contraction in the presence of mechanical stress[J].Invest Ophthalmol Vis Sci,2004,45(4):1109-1116.
[15]ZHU H Y,LI C,BAI W D,et al.MicroRNA-21 regulates hTERT via PTEN in hypertrophic scar fibroblasts[J].PLoS One,2014,9(5):DOI:10.1371/journal.pone.0097114.
[16]LIU Y,WANG X,YANG D,et al.MicroRNA-21 affects proliferation and apoptosis by regulating expression of PTEN in human keloid fibroblasts[J].Plast Reconstr Surg,2014,134(4):DOI:10.1097/PRS.0000000000000577.
[17]GONCALVES M B,MALMQVIST T,CLARKE E,et al.Neuronal RARβ signaling modulates pten activity directly in neurons and via exosome transfer in astrocytes to prevent glial scar formation and induce spinal cord regeneration[J].J Neurosci,2015,35(47):15731-15745.
(童颖丹 编辑)
Inhibitory effect of Dexamethasone on rabbit bile duct scar fibroblastsin vitro*
Ke-yue Li,Cheng-xian Shi,Ke-li Tang,Zhen-hua Liu,Tao Li,Shuai-min Zhang,Xian-gang Xu
(Department of Hepatobiliary Surgery,Guizhou Provincial People's Hospital,Guiyang,Guizhou 550002,China)
ObjectiveTo investigate the effect of Dexamethasone (DEX)on expressions of collagen I,connective tissue growth factor (CTGF),and phosphatase and tensin homolog deleted on chromosome 10(PTEN)genes in rabbit bile duct scar model fibroblasts (MF)in vitro.MethodsRabbit bile duct scar model was established to culture MF.The MF were identified,and then treated by different concentrations of DEX(0,0.01,0.05 and 0.25 mg/ml).After respective incubation for 48 h,cell proliferation was investigated by CCK-8;relative mRNA expressions of collagen-I,CTGFandPTENwere assessed by qRT-PCR;relative protein expressions of collagen-I and PTEN were investigated by Western blot.ResultsDEX significantly inhibited cell proliferation,down-regulated both mRNA and protein expressions of collagen-I andCTGF,and significantly up-regulated both mRNA and protein expressions ofPTEN(P<0.05)in the MF in a dosedependent manner.ConclusionsDEX may have preventive and therapeutic effect on bile duct scar and benign biliary stricture.Effect of DEX in anti-bile duct scar and benign biliary stricture may be partly through regulating collagen-I,CTGFandPTENexpressions in MF.
bile duct scar;fibroblast;inhibitory effect;in vitro;Dexamethasone
R575.7
A
10.3969/j.issn.1005-8982.2017.17.002
1005-8982(2017)17-0007-06
2017-01-23
贵州省科技厅—贵州省人民医院联合基金[No:黔科合LH字(2016)7146]
