大鼠脑梗死后交叉性小脑神经机能联系不能的DTI评价
2017-08-31林亚南程敬亮赵珊珊张晓楠
林亚南,程敬亮,张 勇,杨 璐,赵珊珊,张晓楠
(郑州大学第一附属医院,河南 郑州 450000)
大鼠脑梗死后交叉性小脑神经机能联系不能的DTI评价
林亚南,程敬亮,张 勇,杨 璐,赵珊珊,张晓楠
(郑州大学第一附属医院,河南 郑州 450000)
目的:通过DTI检测大鼠大脑中动脉闭塞(Middle cerebral artery occlusion,MCAO)后梗死核心远隔区域扩散参数的变化情况,并运用免疫组化检测脑组织RGMa蛋白的表达。检测脑梗死核心区域及双侧小脑半球的扩散情况及病理改变,进一步了解交叉性神经机能联系不能(Crossed cerebellar diaschisis,CCD)的相关机制。方法:将所有动物随机分为2组,实验组56只,对照组14只。实验组及对照组大鼠在模型制作成功后1 h、3 h、6 h、9 h、12 h、24 h和72 h分别行MRI动态观察,并用免疫组化法检测大鼠双侧小脑半球RGMa蛋白的表达。结果:实验组大鼠MCAO后各时间点,磁共振成像结果示:双侧小脑半球与正常对照组相比,FA值均降低,12 h降至最低,对侧(右侧)小脑半球较同侧(左侧)小脑半球降低更明显。免疫组化结果示:双侧小脑半球与正常对照组相比,RGMa蛋白表达均升高,至24 h达最高峰,对侧小脑半球较同侧小脑半球升高更明显。结论:磁共振DTI技术结合RGMa蛋白病理学检查可以发现幕上脑梗死后CCD现象,并可以解释CCD发生的相关机制。
脑梗塞;大鼠;磁共振成像
脑梗死是最常见的脑血管病,具有高发病率、高致残率和高致死率的特点。脑梗死不仅可以造成梗死核心区域的病理生理变化,也可引起远隔区域的继发性改变。其发生机制与神经机能联系不能(Crossed cerebellar diaschisis,CCD)学说有关,是指幕上局灶性脑损伤可以造成与它有纤维联系的远隔区域短暂的功能改变。以往关于CCD的研究多采用正电子发射断层成像 (Positron emission tomography,PET)和单光子发射计算机断层成像 (Singlephoton emission computed tomography,SPECT) 技术。但是以上两种技术检查费用昂贵,而且具有辐射,因此探索新的磁共振技术来研究CCD现象就非常重要。
本研究采用磁共振弥散张量成像(Diffusion tensor imaging,DTI)对大鼠大脑中动脉闭塞(Middle cerebral artery occlusion,MCAO)后不同时间点不同部位脑组织的表观扩散系数及部分各向异性分数情况进行检测,并运用免疫组织化学检测与磁共振检查相应时间点、相应部位脑组织的RGMa蛋白的表达。以此来检测脑梗死核心区域及双侧小脑半球的扩散情况及病理改变,进一步了解CCD的相关机制。
1 材料与方法
1.1 实验动物和主要仪器、试剂
成年健康雄性清洁级SD大鼠,体质量270~320g。Signa HDxt 3.0T 磁共振扫描仪(GE 公司,德国),大鼠多通道线圈(辰光医疗器械有限公司,上海,型号CG-MUC22-H300-AG,孔径 5 cm×5 cm),病理图文分析系统(千屏影像工程公司,武汉),兔抗RGMa特异性抗体(Abcam公司,美国),RGMa蛋白免疫组化试剂盒(中杉生物技术有限公司,北京)。
1.2 大鼠脑梗死模型的建立及实验动物分组
将所有动物按照随机数字表法随机分为2组。实验组 (MCAO 组):56 只,10%水合氯醛 (0.3mL/100 g体质量),采取腹腔注射进行麻醉,参照改良的Longa法建立大鼠左侧MCAO模型。参照Longa等[1]确立的评分方法进行评分,标准为:0分,无任何神经损伤症状;1分,对侧前肢不能完全伸展;2分,行走时向对侧绕圈;3分,站立时向对侧倾倒;4分,不能独立行走,丧失意志。出现以上表现,评分达2~3分的大鼠视为造模成功,并纳入实验组。假手术组不产生以上任何类似表现。对照组(假手术组):14只,仅暴露左侧大脑中动脉,不插入线栓,余操作同实验组。术后单笼饲养,注意保温,密切观察动物的行为变化及生命体征。实验组及对照组大鼠在模型制作成功后 1 h、3 h、6 h、9 h、12 h、24 h 和 72 h 分别行MRI动态观察,各实验点大鼠8只。
1.3 磁共振检查及后处理
实验组及对照组大鼠分别行横轴位T1加权成像和T2加权成像、矢状位T2加权成像、DWI、DTI序列扫描。扫描参数如下:快速自旋回波FSE序列T1WI,TR/TE=360ms/23.3ms, FOV=70mm×70mm,NEX=4.00,矩阵 320×256;快速自旋回波 FSE 序列T2WI,TR/TE=2 300ms/115.3ms,FOV=70mm×70mm,NEX=4.00,矩阵 256×256;单次激发的 SE/EPI序列DWI,TR/TE=2350ms/78.9ms,FOV=110mm×110mm,NEX=4.00,矩阵 96×96;DTI:TR/TE=2 500ms/92.2ms,FOV=110mm×110mm,NEX=4.00, 矩阵 128×128,b值=500 s/mm2,方向数为 16。
1.4 磁共振图像后处理
应用美国GE公司提供的后处理工作站进行图像的后处理及一系列数据统计。图像后处理技术:DTI, 图像传输至 Functool 5.4.07软件进行后处理,进入DTI处理界面。调阈值(所有脑实质被绿色斜线覆盖)→点击计算获得ADC图和FA图,将获得的图像批量保存,在梗死核心和双侧小脑半球设置感兴趣区 (Regions of interest,ROI), 在 ADC 图和FA图上进行测量,记录数据,每个部位均重复测量3次取平均值。
1.5 免疫组化法检测大鼠双侧小脑半球RGMa蛋白的表达
MCAO 组大鼠按照相应时间点(1 h、3 h、6 h、9 h、12 h、24 h、72 h)扫描后,每个时间点各取2只大鼠进行标本制作。过量麻醉大鼠后,用持针器开胸,钝性分离并暴露出心脏,用注射器抽取0.3mL的2.5%肝素钠注入左心室,剪去右心耳,于左心室灌注约200mL的9%生理盐水直至澄清,以排除脑血管内血液的干扰,断头取脑,用4%的多聚甲醛液固定备用。
大鼠脑组织切片常规脱蜡后,滴加3%的H2O2适温孵育5~10min,蒸馏水冲洗3次。滴加兔血清封闭液(5%),保持室温20min,甩去多余的液体。随后滴加1∶100的兔抗RGMa抗体,4℃孵育过夜。生物素标记的山羊抗兔IgG,保持37℃孵育30min。辣根酶标记的链霉卵白素,37℃中孵育30min,然后用PBS溶液冲洗。DAB显色后苏木素复染,脱水,二甲苯透明,中性树胶封片,光学显微镜下照相进行定量分析,具体如下:每个组织块连续切片3张,每张切片随机选取5个视野,高倍镜下(400×)观察分析并采集图像。以Image Pro Plus 6.0(Media Cybernetics公司)软件获取整合光密度(Integrated optical density,IOD)和面积(单位为像素)值。 本实验规定平均光密度=IOD/面积×1 000,作为目的蛋白表达定量比较的指标。
实验流程图如下:
2 结果
2.1 MCAO大鼠双侧小脑半球脑组织的FA值及ADC值结果
本研究制作的MCAO模型的成功率为50%,失败原因包括模型制作过程中大鼠失血过多而死亡、模型制作后动态观察中死亡及模型制作后行MRI检查发现未出现基底节区梗死等。基底节区梗死面积由点状至大片状不等。大鼠MCAO后每个时间点,双侧小脑半球与正常对照组相比,FA值均降低,12 h降至最低,对侧(右侧)小脑半球较同侧(左侧)小脑半球降低更明显,见表1及图1。大鼠MCAO后每个时间点,双侧小脑半球与正常对照组相比,ADC值均降低,12 h降至最低,后有所回升,但仍低于对照组;梗死对侧小脑半球较梗死同侧小脑半球降低更明显,见表2。
2.2 MCAO大鼠双侧小脑半球脑组织RGMa蛋白的表达
大鼠MCAO后每个时间点,双侧小脑半球与正常对照组相比,RGMa蛋白表达均升高,24 h达最高峰,对侧(右侧)小脑半球较同侧(左侧)小脑半球升高更明显,见表3及图2。
2.3 磁共振FA值及ADC值的变化与RGMa蛋白表达的相关性
本研究结果显示:大鼠MCAO后双侧小脑半球FA值的变化与RGMa蛋白表达的变化显著负相关(Spearman 相关性检验, 相关系数 r=-0.341,P<0.05)。大鼠MCAO后双侧小脑半球ADC值的变化与RGMa蛋白表达的变化显著负相关(Spearman相关性检验,相关系数 r=-0.341,P<0.05)。
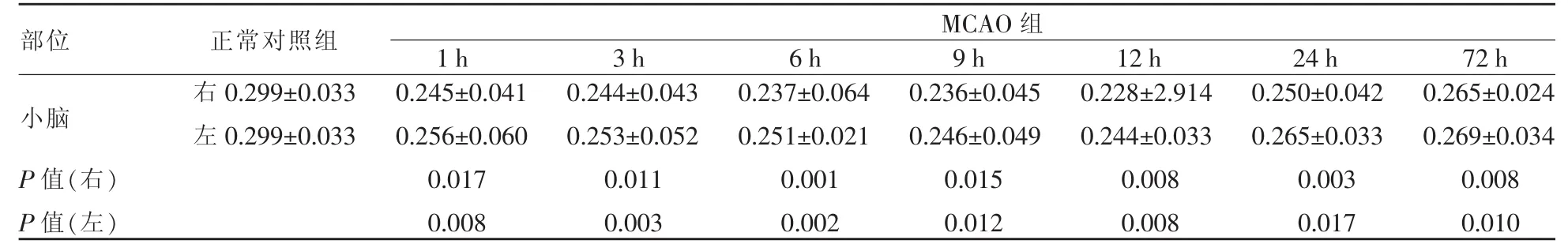
表1 正常对照组及MCAO后不同时间点FA值变化

表2 对照组及MCAO后不同时间点ADC值变化(单位:×10-4/mm2)
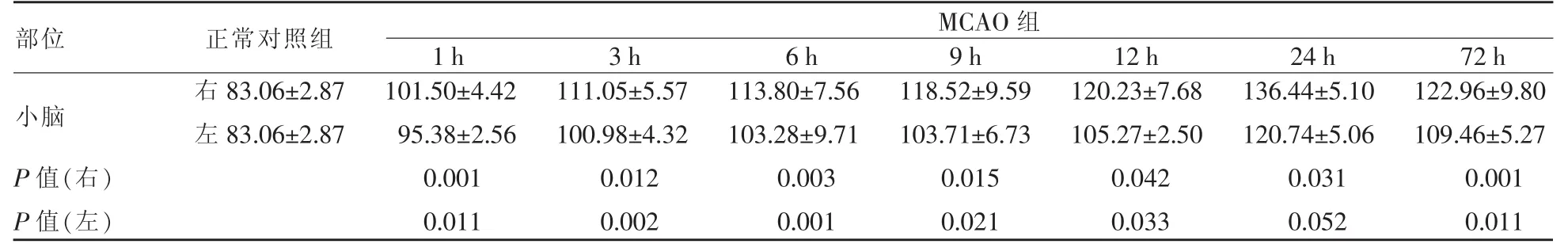
表3 正常对照组及MCAO后不同时间点RGMa值变化(单位:OD/μm2)
3 讨论
本研究通过DTI检测大鼠MCAO后梗死核心远隔区域的扩散参数的变化情况。磁共振DTI评价幕上脑梗死后远隔区域的变化,国内外鲜有此类文献报道。DTI是基于扩散加权成像基础上发展起来的一项无创性观察体内水分子扩散运动的新技术[2-5],我们可以利用此检查手段来检测脑梗死后远隔区域(小脑)的扩散情况的变化。并与病理学指标轴突生长抑制因子RGMa相结合,来探讨幕上脑梗死后交叉性小脑CCD的相关机制。
3.1 DTI对大鼠MCAO后交叉性小脑CCD的分析
以往大多数国内外学者多采用DTI技术来评价急性期脑梗死核心区域的扩散参数的变化,而对于幕上脑梗死后远隔区域(丘脑、桥脑及小脑)的信号变化的研究却极少。本研究通过改良的Longa法建立大鼠MCAO模型后发现,梗死核心区域和双侧小脑半球的FA值及ADC值在脑梗死后1 h开始降低,12 h达到最低,然后有所回升,但仍低于正常对照组,并没有达到假性正常化,分析此原因可能是因为本实验采用的是改良的MCAO模型,梗死较为彻底。本实验结果证实梗死区域远隔部位即小脑的扩散参数随梗死核心区变化而变化。出现此现象的原因可能为超急性期幕上梗死后,大脑微循环灌注量降低,当跌落至膜衰竭阈值时,就会导致神经细胞的细胞膜Na+-K+泵功能受损,细胞外的水分子进入细胞内导致细胞毒性水肿,因此,细胞内水分子扩散受限,FA值及ADC值降低,然后将启动神经细胞死亡。此时,由大脑皮层发出的神经信号的传输就会或多或少的受到影响,双侧大脑间通过纵横交错的神经纤维相联系,受控制的远隔区域就会发生功能受限。本研究中,双侧小脑的FA值及ADC值的变化均与正常对照组存在统计学差异,说明本研究MCAO模型的幕上梗塞脑组织影响到连接双侧大脑半球的胼胝体联合纤维及CPC通路信号的正常传导,使梗死远隔部位发生功能受限。而神经活动的变化,会造成其偶联的相应部位血流量发生相应的改变[6],组织内的ADC值反映水分子扩散及毛细血管灌流[7],故幕上脑梗死后就出现了远隔部位ADC值的差异。FA值反映组织内水分子扩散的程度和方向,FA值的降低反映了相应区域脑组织内神经纤维束的排列失去了方向性和一致性,因此远隔部位FA值的降低可能提示了神经传导通路的障碍,特别是与CCD相关的皮质-桥-小脑通路的损伤[8]。

图1a~1h 分别为正常对照组大鼠以及MCAO后大鼠双侧小脑半球1 h、3h、6 h、9 h、12 h、24 h及72 h彩色FA图,随着梗死时间的延长,MCAO大鼠双侧小脑半球FA值逐渐降低,且以右侧小脑半球明显。 图2a~2d 分别为正常对照组大鼠以及MCAO后大鼠右侧小脑半球1 h、24 h及72 h免疫组化RGMa蛋白的表达,随着梗死时间的延长,阳性区积分光密度值逐渐增加。Figure 1a~1h.Color FA maps of normal control group rats and rats after MCAO at 1 h,3 h,6 h,9 h,12 h,24 h and 72 h.With the prolongation of infarct time,the bilateral cerebellar hemispheres FA value of MCAO rats was gradually decreased,and the right cerebellar hemisphere was significantly decreased. Figure 2a~2d. RGMa expression(immunohistochemi-cal staining)of normal control group rats and rats after MCAO at 1 h,24 h and 72 h.With the prolongation of infarct time,the integral light density of positive area increased gradually.

本研究中,双侧小脑半球的FA值及ADC值均随梗塞核心区域的变化而变化,提示幕上脑梗死后CCD的存在,而且大脑梗死对侧小脑半球较脑梗死同侧小脑半球FA值和ADC值变化幅度大,两者相比具有统计学意义。出现这种现象的原因可能是因为大脑皮层多数的神经纤维交叉到对侧小脑,而很少一小部分则传导至同侧小脑,因此左侧大脑半球梗死后,影响较重的则是右侧小脑半球,而不是左侧小脑半球。
3.2 RGMa评价幕上脑梗死后CCD的发生
幕上脑梗死造成机体神经功能的缺损,这不仅与梗死灶局部损伤后神经细胞的凋亡和坏死有关,而且也与梗死灶远隔区域的相关部位的继发性神经细胞的凋亡和坏死有关。细胞凋亡和坏死发生的严重程度和速度受许多因素的影响,有研究提示与神经生长抑制因子、神经营养障碍、脑局部血流减少、蛋白合成抑制以及神经递质调节失衡等因素有关。其中,神经生长抑制因子的作用被认为是最重要的影响因素。近几年的研究发现,RGMa是一种新的具有抑制轴突生长作用的神经生长抑制因子,它主要介导神经管闭合及排斥性轴突导向信号,并控制着神经元的生长、增殖及分化。其可以存在于正常大鼠的脉络丛、小脑浦肯野纤维、血管周围及脑干神经元中。Schwab等[9]研究成年哺乳动物脊髓和脑外伤中发现在中枢神经系统损伤后,RGMa出现在轴突生长抑制物中,再用微量泵对其给予抗RGMa抗体进行干预后,结果则有利于神经功能的康复,因此推测RGMa参与了中枢神经系统损伤后的轴突生长抑制作用,抗RGMa抗体则可以通过中和RGMa蛋白来显著促进轴突的生长及受损神经纤维的再生。而Brinks等[10]的研究表明,给予海马CAI区皮层特异性RGMa抗体后,则轴突生长出现混乱,不能到达正确的靶区,因此,RGMa的过高及过低表达均不利于轴突的生长发育。RGMa对神经轴突生长的抑制作用在体内外实验已经被证实[11],但是以往的在体研究主要局限于脊髓损伤,在脑缺血中关于RGMa的作用研究较少。我们的研究发现,在大鼠脑梗死后1 h就有RGMa蛋白表达的升高,至24 h达到高峰,72 h时稍有下降,但仍高于正常脑组织RGMa蛋白的表达。这表明幕上梗死核心区及梗死远隔部位即小脑RGMa蛋白表达的升高与缺血区轴突数量减小密切相关。在急性脑缺血早期,RGMa蛋白的过度表达不利于轴突与树突之间形成正确的神经环路,抑制神经纤维的再生,阻碍了神经功能的康复。RGMa蛋白主要通过破坏神经纤维的髓鞘化来抑制轴突的生长,而神经纤维髓鞘化的破坏会导致脑组织内水分子扩散的异常,表现为ADC值及FA值的降低。因此幕上脑梗死区域及远隔区域的双侧小脑半球RGMa蛋白的持续性高表达与磁共振FA值的降低具有显著的负相关,因此这说明RGMa蛋白与磁共振DTI检查相结合可以用来解释CCD发生的病理基础。
总之,本研究通过建立大鼠MCAO模型,观察大鼠幕上梗死核心区FA值、ADC值的降低及RGMa蛋白表达的升高,同时发现梗死远隔区域即小脑也随着时间变化发生相似的改变。此结果证实了磁共振DTI技术联合RGMa蛋白的病理学检查可以发现幕上脑梗死后CCD现象的发生,并可以解释CCD发生的相关机制,为幕上脑梗死后观察远隔区域的继发性改变提供了一种新的无创性技术。
[1]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[2]Zheng G,Chen X,Xu B,et al.Plasticity of language pathways in patients with low-grade glioma:a diffusion tensor imaging study[J].Neural Regen Res,2013,8(7):647-654.
[3]Kwon YH,Jang SH,Yeo SS.Age-related changes of lateral ventricular width and periventricular white matter in the human brain:a diffusion tensor imaging study[J].Neural Regen Res,2014,9(9):986-989.
[4]Meng X,Wang Q,Hou J,et al.Diffusion tensor imaging of normal-appearing white matter in unilateral cerebral arterial occlusive disease[J].JMagn Reson Imaging,2013,38(3):650-654.
[5]Zhang Y,Wan S,Zhang X.Geniculocalcarine tract disintegration after ischemic stroke:a diffusion tensor imaging study[J].AJNR,2013,34(10):1890-1894.
[6]王美豪,程敬亮,杨运俊,等.MRI上梗死灶体积及分布状况与交叉性小脑神经机能联系不能的相关性研究 [J].放射学实践,2013,28(3):260-263.
[7]LeBihan D,Breton E,Lallemand D,et al.MR imaging of intravoxel incoherent motion:application to diffusion and perfusion in neurologic disorders[J].Radiology,1986,161(2):401-407.
[8]李捷,王大明,胡浩宇,等.弥散张量成像动态观察脑出血及脑梗死引起椎体束继发损伤[J]. 实用放射学,2011,27(4):483-486.
[9]Schwab J,Conrad S,Monnier P,et al.Spinal cord injury induces lesional expression pattern of the repulsive guidance molecule(RGM)[J].Neurosci,2005,21(6):1569-1576.
[10]Brinks H,Conrad S,Vogt J,et al.The repulsive guidance molecule RGMa is involved in the formation of afferent connections in the dentate gyrus[J].Neurosci,2004,24(15):3862-3869.
[11]温莉莉,韩芳,石玉秀.RGMa在创伤后精神应激障碍大鼠内侧前额皮质的表达变化 [J].中国医科大学学报,2012,41(12):1065-1072.
Diffusion tensor imaging analysis of crossed cerebellar diaschisis after cerebral infarction in rats
LIN Ya-nan,CHENG Jing-liang,ZHANG Yong,YANG Lu,ZHAO Shan-shan,ZHANG Xiao-nan
(The First Affiliated Hospital of Zhengzhou University,Zhengzhou 450000,China)
Objective:To detect the change of diffusion parameter in remote regions of the infarct core after middle cerebral artery occlusion(MACO)in rats using diffusion tensor imaging(DTI),to detect the RGMa protein expression of the brain tissue by immunohistochemistry,and to detect the diffusion and pathological changes of the cerebral infarction core area and bilateral cerebellar hemispheres,and to further understand the relevant mechanism of crossed cerebellar diaschisis(CCD).Methods:All the animals were random ly divided into experimental group(n=56)and control group(n=14).After making the successful model,the control group and the experimental group rats underwent MRI at 1 h,3 h,6 h,9 h,12 h,24 h and 72 h,and the expression of RGMa protein was detected by immunohistochemistry in the bilateral cerebellar hemispheres of rats.Results:The results of MRI in the experimental group at each time point after MCAO in rats showed that the FA values were all decreased in the bilateral cerebellar hemisphere compared with normal control group,and the FA values were decreased to the lowest at 12 h,and the FA value of the contralateral(right)cerebellar hemisphere was significantly lower than that of the ipsilateral(left)cerebellar hemisphere.The results of immunohistochemistry showed that the expressions of RGMa protein were increased in the bilateral cerebellar hemisphere compared with the normal control group,and the expression were increased to the peak at 24 h,and the expression of the contralateral cerebellar hemisphere was significantly higher than that of the ipsilateral cerebellar hemisphere.Conclusion:The MR DTI combined with RGMa protein pathology can be used to detect the phenomenon of CCD after supratentorial cerebral infarction,and to explain the mechanism of CCD.
Brain infarction;Rats;Magnetic resonance imaging
R743.33;R445.2
A
1008-1062(2017)04-0240-05
2016-06-23;
2016-08-10
林亚南(1987-),女,河南郑州人,医师。 E-mail:1208847397@qq.com
程敬亮,郑州大学第一附属医院,450000。E-mail:cjr.chjl@vip.163.com
