系统性红斑狼疮患者高密度脂蛋白抗氧化能力和亚型分布及对氧磷酶1活性分析
2017-08-31高田原田琼刘文丽穆欣张键
高田原,田琼,刘文丽,穆欣,张键
(西安交通大学第一附属医院,西安 710061)
·论著·
系统性红斑狼疮患者高密度脂蛋白抗氧化能力和亚型分布及对氧磷酶1活性分析
高田原,田琼,刘文丽,穆欣,张键
(西安交通大学第一附属医院,西安 710061)
目的 探讨系统性红斑狼疮(SLE)患者高密度脂蛋白(HDL)抗氧化能力和亚型分布及对氧磷酶1(PON1)活性的相关性。方法 采用常规方法检测50例SLE和50例健康对照组红细胞沉降率(ESR)、血清载脂蛋白A1(ApoA1)、高密度脂蛋白胆固醇(HDL-C)、白细胞介素(IL)-6、MCP-1、SAA等多种SLE相关标志物;采用分光光度法检测总HDL抗氧化能力;用lipoprintsystem分析HDL亚型;以酶水解底物对氧磷法和乙酸乙酯法检测PON1对氧磷酶活性及其芳香酯酶活性。结果 与健康对照组比,SLE组HDL-C(P=0.012)和ApoA1(P=0.003)浓度显著下降;SLE组总HDL抗氧化能力(P=0.002)、HDL亚型(P<0.05)浓度、PON1芳香酯酶活性(P=0.001)显著低于对照组;SLE组hsCRP、ESR、IL-6、MCP-1、SAA显著增加(P<0.05)。SLE组HDL-C和总HDL抗氧化能力与PON1芳香酯酶活性及PON1对氧磷酶活性成正相关(P<0.05),与ESR、hsCRP、IL-6、MCP-1、SAA呈负相关(P<0.05),其中PON1芳香酯酶活性和ESR与总HDL抗氧化能力最具相关性。结论 HDL抗氧化能力及PON1活性降低、HDL亚型改变、系统性炎症增加等多因素可能导致SLE患者动脉粥样硬化风险的增加。
系统性红斑狼疮;高密度脂蛋白抗氧化能力;高密度脂蛋白亚型;对氧磷酶1
系统性红斑狼疮(Systemic lupus erythematosus, SLE)是一种好发于育龄期女性,可累及全身任何脏器的慢性炎症性自身免疫性疾病。SLE患者的心血管疾病发病率和死亡率较高[1]。研究表明,SLE患者体内常见高水平的甘油三酯(TG)、高水平的低密度脂蛋白(LDL)、低水平的高密度脂蛋白(HDL)等血脂异常现象,血脂异常增加了SLE患者早期心血管疾病尤其是动脉粥样硬化的危险[2]。但是,目前研究仅探讨SLE患者体内血脂代谢物、对氧磷酶1(PON1)及炎症标志物浓度与SLE疾病的关联性[3-4],未阐明这些因素、亚型或活性对SLE的影响。因此,本研究收集50例SLE患者标本,检测分析SLE患者HDL抗氧化能力、HDL亚型分布、PON1活性以及炎症标志物浓度,探讨HDL抗氧化能力和亚型分布、PON1活性及炎症标志物对SLE的临床意义。
1 资料与方法
1.1 一般资料 收集我院2013年1月—2015年12月SLE患者50例和健康体检者50例全血。所有SLE患者诊断均符合1997年美国风湿病学会(ACR)制订的SLE的诊断标准[5]。伴有其他系统疾病,如肾衰竭[GFR<60mL/mi n(1.73m2)]、糖尿病等,引起血脂代谢异常的SLE者,或服用口服避孕药或他汀类药物等影响血脂水平的SLE者排除在外。入选的SLE患者男7例,女43例,平均年龄(32.5±8.4)岁,系统性红斑狼疮疾病活动指数(SLEDAI)评估SLE活动度[6];对照组为我院保健科体检者,身体健康,无明显器质性病变,其中男8例,女42例,平均年龄(31.8±9.9)岁。对照组与SLE组患者的年龄、性别和身体质量指数(BMI)差异均无统计学意义。本研究获医院伦理委员会审批,且患者或家属签署知情同意书。
1.2 研究方法 所有研究对象均取晨空腹肘静脉血按常规方法检测血细胞数、血糖、红细胞沉降率(ESR)、肝功能、肾功能。血清中高敏C反应蛋白(hs-CRP)、血清载脂蛋白A1(ApoA1)、载脂蛋白B(ApoB)、脂蛋白(a)[LP(a)]浓度采用免疫比浊法检测。总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)采用酶法检测。用酶联免疫吸附试验(ELISA)检测SLE自身免疫抗体、抗磷脂综合征各类抗体(a-dsDNA,a-Sm,a-SSA,a-SSB;a-CL IgA,a-CL IgG,a-CL IgM,a-B2 IgA,a-B2 IgG,a-B2 IgM)、免疫球蛋白(IgA、IgG、IgM)、C3和C4补体、免疫复合物浓度、细胞因子、急性期标志物、氧化型低密度脂蛋白(oxLDL)、MCP-1。SLE患者疾病活动用SLEDAI作为评价依据,SLEDAI评分>5分判定为疾病活动[6]。HDL抗氧化活性检测参考Gaál等[7]报道的方法。采用酶学动力学方法[8]以对氧磷作为底物检测PON1的磷酯酶活性;根据Eckerson等[9]的方法以乙酸苯酯作为底物检测 PON1的芳香酯酶活性。用lipoprintsystem分析HDL亚型,其中大密度HDL包括HDL1-HDL3,中等密度HDL包括HDL4-HDL7,小密度HDL包括HDL8-HDL10。
1.3 统计学分析 采用SPSS 17.0进行统计学分析。所有计量资料采用Kolmogorov-Smirnov进行正态性检验。其中正态分布的计量资料用x±s平表示,组间均数差异采用student’s t检验,非正态分布计量资料用中位数[四分范围(IQR)]表示,组间比较采用Mann-Whitney U检验。采用Pearson或Spearman相关系数评估两变量之间的相关性。采用多元回归(向后剔除法)分析预测总HDL抗氧化活性与多因素的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 SLE组及健康对照组临床资料、实验室检查结果(包括脂蛋白浓度等)SLE患者组平均病程为(6.25±5.62)年,SLEDAI评分6.0(2.0~12.0),最低SLEDAI评分0,最高SLEDAI评分38。SLE组HDL和ApoA1显著低于健康对照组,而TG和ApoB100显著高于健康对照组,见表1。
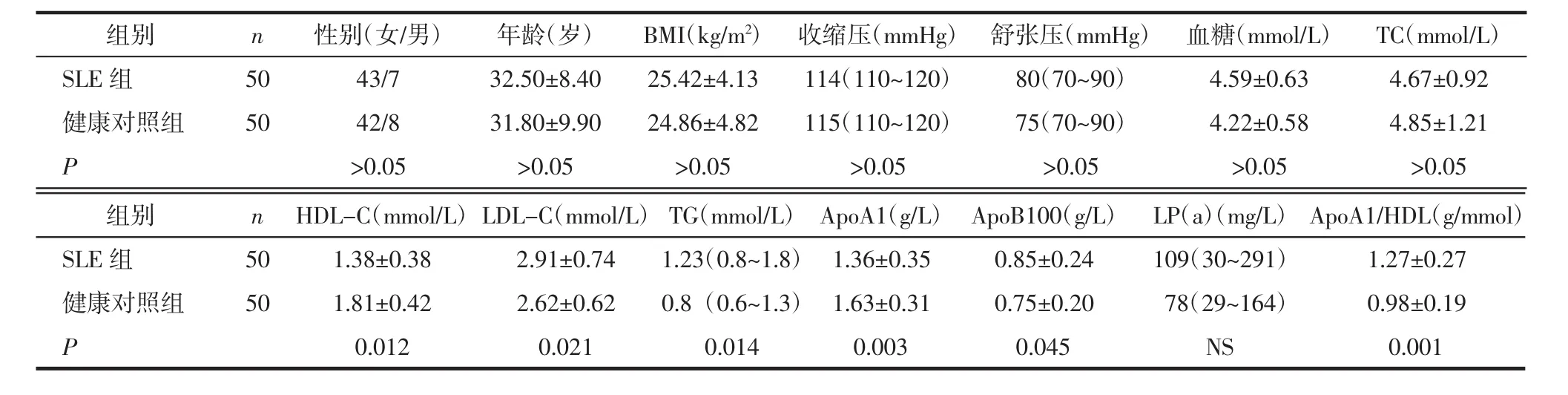
表1 研究对象临床特征及实验室检查资料
2.2 SLE患者HDL抗氧化能力、PON1活性、炎症标志物分析 与健康对照组比较,SLE组PON1活性低于对照组但差异无统计学意义;SLE组PON1芳香酯酶活性显著低于对照组。由于PON1活性与HDL密切相关,SLE组PON1活性的减弱可能与SLE组HDL浓度降低有关,本研究采用PON1酶活性/HDL比值评价PON1酶活性,结果表明SLE组PON1对氧磷酶活性/HDL、PON1芳香酯酶活性/ HDL均显著高于对照组。SLE组总HDL抗氧化能力显著低于对照组。与对照组比较,SLE组炎症标志物及炎症因子浓度(包括hsCRP、ESR、IL-6、MCP-1、SAA)显著增加(P<0.05),见表2。
2.3 SLE患者HDL亚型比较分析 采用lipoprint system比较分析2组研究对象血清HDL亚型,结果发现SLE组大、中、小密度HDL浓度均显著低于对照组(P<0.05),但SLE组三者HDL在总HDL所占比例与对照组相比无统计学意义,见表3。
2.4 SLE患者HDL、PON1活性和炎症标志物相关性分析 SLE组HDL-C和总HDL抗氧化能力均与PON1芳香酯酶活性、PON1对氧磷酶活性、ESR、hsCRP、IL-6、MCP-1、SAA相关,见表4。其中,SLE组HDL-C和总HDL抗氧化能力均与PON1芳香酯酶活性及PON1对氧磷酶活性成正相关(P<0.05),与ESR、hsCRP、IL-6、MCP-1、SAA呈负相关(P<0.05)。此外,SLE组总HDL抗氧化能力与免疫复合物也呈负相关性(r=-0.575,P<0.001),但是SLE疾病活动度与ApoA1、HDL-C和总HDL抗氧化能力不相关(结果未显示)。
SLE组PON1对氧磷酶活性与大密度HDL浓度(r=0.354,P=0.019)及其占总HDL的比例(r= 0.345,P=0.021)及呈正相关,却与中等密度HDL占总HDL比例呈负相关(r=-0.318,P=0.017)。SLE组PON1芳香酯酶活性与小密度HDL亚型呈正相关(r=0.380,P=0.003),与anti-SBB呈负相关(r=-0.331,P=0.011)。对照组PON1对氧磷酶活性及PON1芳香酯酶活性与各组份HDL无相关性。此外,SLE疾病活动度(SLEDAI评分)与OxLDL呈正相关(r=0.371,P=0.013)。SLE患者OxLDL浓度与SAA浓度(r=0.321,P=0.033)、ESR(r=0.305,P= 0.037)、hsCRP浓度(r=0.293,P=0.048)呈正相关性。
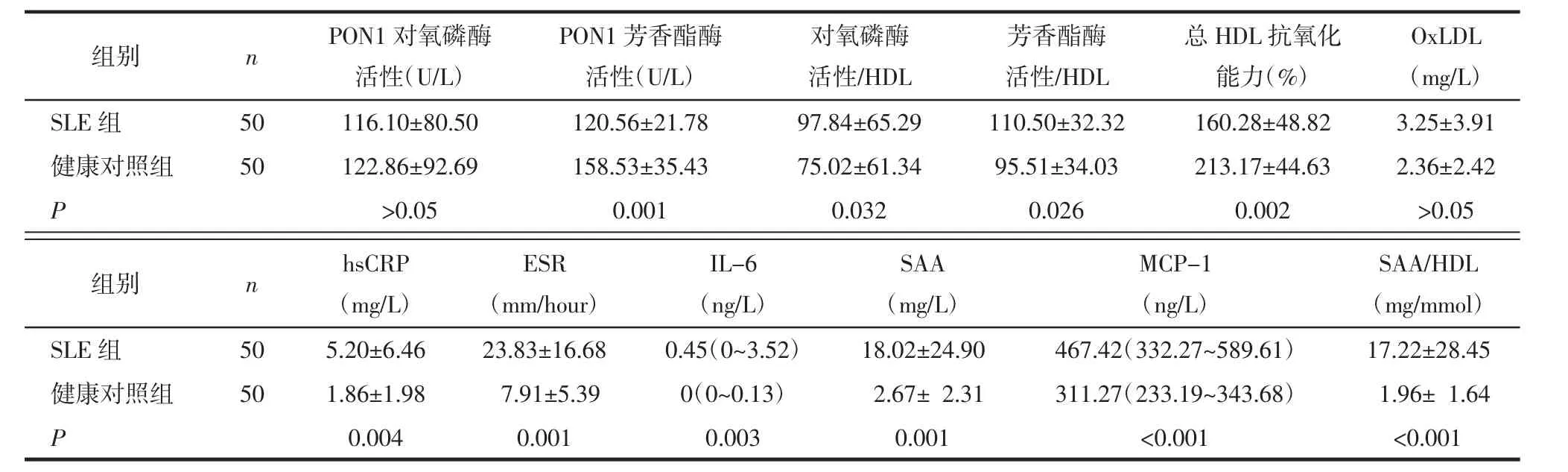
表2 2组HDL抗氧化能力、PON1活性及炎症标志物比较

表3 2组HDL亚型比较

表4 SLE患者HDL及其总抗氧化能力与PON1活性和炎症标志物相关性分析
多元回归(向后剔除法)进一步分析SLE患者IL-6、hsCRP、MCP-1、SAA、ESR、PON1芳香酯酶活性共6个因素对总HDL抗氧化能力的影响,结果发现:PON1芳香酯酶活性(P=0.029,beta=0.358)和ESR(P=0.008,beta=0.59)与总HDL抗氧化能力与最具相关性。
3 讨论
SLE是一种多脏器受累的慢性免疫复合物介导的炎性疾病。SLE患者体内常见高水平的TG和LDL、低水平的HDL的血脂异常“狼疮谱”[2]。本研究50例SLE患者大部分处于SLE疾病活动期,SLE组TG升高、HDL降低,符合SLE“狼疮谱”特征。HDL水平降低已成为SLE临床特征之一。HDL参与体内胆固醇逆向转运,将外周细胞内的胆固醇脂逆向转运至肝脏,因而具有抗动脉粥样硬化的作用[10]。此外,HDL具有抗氧化作用,能保护LDL不被氧化,减轻或阻止LDL对血管内皮细胞的破坏。因此,HDL降低将增加SLE患者患动脉粥样硬化的风险。
ApoA1是HDL一个主要的组成部分,参与HDL抗氧化作用。ApoA1浓度或结构的改变会导致HDL功能缺陷。本研究发现SLE组ApoA1显著降低,提示SLE患者HDL抗氧化能力可能因此受到影响。另外,HDL的抗氧化功能依赖ApoA1在多种酶如PON1的作用下,阻止LDL的氧化、减弱其氧化活性。PON1是一种由肝脏合成,存在于血液和肝脏的水解脂酶,能够水解脂质过氧化物,防止低密度脂蛋白被氧化修饰,从而阻止动脉粥样硬化病的发生。由此,本研究后续比较了SLE患者总HDL抗氧化能力和PON1活性的变化,结果发现SLE患者总HDL抗氧化能力和PON1活性(尤其是PON1芳香酯酶活性)显著降低,说明总HDL抗氧化能力和PON1活性可能是SLE早发动脉粥样硬化的原因之一。Ahmed等[4]研究发现SLE患者PON1对氧磷酶活性显著下降,与本研究结果类似。本研究PON1对氧磷酶活性低于对照组但差异无统计学意义,这可能的与检测方法和样本量大小有关。
HDL是一类功能、组成、密度、颗粒大小极不均一的脂蛋白。根据双向电泳免疫印迹法可将HDL分为多种亚型。HDL各亚型所含ApoA1量差异较大,在代谢综合征、肥胖、高脂血症等情况下HDL各亚型的分布发生改变,HDL亚型分布的改变可能参与了动脉粥样硬化的发病过程[11]。因此本研究分析了SLE患者HDL亚型分布,结果发现SLE组大、中、小密度HDL浓度均显著低于对照组。不同亚型HDL可携带不同的酶及结构蛋白从而导致HDL亚型功能差异。小密度HDL颗粒主要携带抗氧化作用的酶,如PON1,它们也是胆固醇逆向转运过程中发挥重要作用的脂质受体。本研究SLE患者小密度HDL下降且与PON1芳香酯酶活性呈正相关,进一步说明HDL亚型分布可能也影响SLE患者动脉粥样硬化的进展。
炎症反应是系统性红斑狼疮的标志,许多研究已经证实在系统性红斑狼疮中IL-6、MCP-1、γ-干扰素和急性期蛋白均增加[12]。本研究证实SLE患者hsCRP、IL-6、MCP-1、SAA显著升高,且与HDL-C和总HDL抗氧化能力呈负相关,说明炎症反应可能也影响HDL抗氧化功能。此外,ESR是反映免疫和炎症性疾病活动程度的指标,在一些疾病如肿瘤、SLE、结核及感染性疾病中,ESR往往显著升高。ESR水平可以作为判断SLE病情活动程度的重要参考指标[13]。本研究证实SLE患者ESR显著升高,与文献报道一致[14]。经多元回归分析发现PON1芳香酯酶活性和ESR与总HDL抗氧化能力与最具相关性,进一步说明HDL抗氧化能力与PON1芳香酯酶活性和ESR密切相关,也与SLE患者动脉粥硬化发生相关。
综上所述,SLE患者HDL抗氧化能力及PON1活性降低、HDL亚型改变、系统性炎症增加,这些因素可能与SLE患者动脉粥样硬化发生密切相关。早期检查SLE患者HDL抗氧化能力及亚型分布将有利于早期防治SLE动脉粥样硬化的发生。
[1] 刘丽,张婷婷,叶益聪,等.系统性红斑狼疮患者心血管疾病危险因素分析[J].中国心血管杂志,2014,42(9):753-758.
[2] Tselios K,Koumaras C,Gladman DD,et al.Dyslipidemia in systemic lupus erythematosus:just another comorbidity?[J].Semin ArthritisRheum,2016,45:604-610.
[3] 庞春燕,王晓燕,鲁芙爱,等.系统性红斑狼疮患者血脂异常的临床分析[J].天津医药,2013,42(1):15-17.
[4] Ahmed MM,Elserougy EM,Al-Gazzar II,etal.Anti-apolipoprotein A-Iantibodiesand paraoxonase 1 activity in systemic lupuserythematosus[J].Excli J,2013,12:719-732.
[5] 中华医学会风湿病学分会.系统性红斑狼疮诊断及治疗指南[J].中华风湿病学杂志,2010,14(5):342-347.
[6] Tan EM,Cohen AS,Fries JF,etal.The 1982 revised criteria for the classification of systemic lupus erythematosus[J].Arthritis Rheum, 1982,25:1271-1277.
[7] Gaál K,Lörincz H,Seres I,et al.Characterization of a novel highdensity lipoprotein antioxidant capacity assay and its application to high-density lipoprotein fractions[J].Clin Biochem,2013,46:825-827.
[8] La Du BN.Structural and functional diversity of paraoxonases[J]. NatMed,1996,2:1186-1187.
[9]Eckerson HW,Wyte CM,La Du BN.The human serum paraoxonase/arylesterase polymoprhism[J].Am JHum Genet,1983,35: 1126-1138.
[10]Assmann G,Gotto AM Jr.HDL cholesteroland protective factors in atherosclerosis[J].Circulation,2004,109:Ⅲ8-Ⅲ14.
[11]Superko HR,Pendyala L,Williams PT,etal.High-density lipoprotein subclassesand their relationship to cardiovascular disease[J].J Clin Lipidol,2012,6:496-523.
[12]Gottschalk TA,Tsantikos E,Hibbs ML.Pathogenic inflammation and its therapeutic targeting in systemic lupus erythematosus[J]. Front Immunol,2015,6:550.
[13]Dima A,OprisD,JurcutC,etal.Is there stilla place for erythrocyte sedimentation rate and C-reactive protein in systemic lupuserythematosus?[J].Lupus,2016,25:1173-1179.
[14]Icli A,Cure E,Cure MC,et al.Endocan levels and subclinical atherosclerosis in patientswith systemic lupuserythematosus[J].Angiology,2016,67:749-755.
High Density Lipoprotein Antioxidant Capacity and Subtype Distribution and Analysis of Paraoxonase-1 Activity in Patientsw ith System ic Lupus Erythematosus
Gao Tianyuan,Tian Qiong,LiuWenli,Mu Xin,Zhang Jian
The FirstAffiliated HospitalofXi'an Jiaotong University,Xi'an 710061,China
Objective In order to investigate the relationship between systemic lupuserythematosus(SLE)and high-density lipoprotein (HDL)antioxidant capacity,HDL subfractions,paraoxonase-1 (PON1)activity.M ethods Several factors, including ESR,ApoA1,HDL-C,IL-6,MCP-1 and SAA were determined by normalmethods in 50 SLE patients and 50 healthy controls.HDL antioxidant capacity was determined spectrophotometricalmethod.Lipoprint system was used for HDL subfraction analysis.PON1 paraoxonase activity and arylesterase activity analyzed using paraoxon and phenylacetate as the substrate.Results Compared with healthy controls,HDL-C (P=0.012)and ApoA1 (P=0.003)concentrations decreased significantly in SLE subjects.TotalHDL antioxidantcapacity(P=0.002),HDL subfractions(P<0.05)a nd PON1 arylesterase activity (P=0.001)were significantly reduced in SLE patients.The levels of hsCRP,ESR,IL-6,MCP-1 and SAA were significantly elevated in SLE patients(P<0.05).HDL-Cand totalHDL antioxidantcapacity correlated positivelywith PON1 paraoxonase activity and arylesterase activity,and negatively with hsCRP,ESR,IL-6,MCP-1 and SAA,respectively.PON1 aryl esterase activity and ESR were independent predictors of total HDL antioxidant capacity.Conclusion Reduction of HDL antioxidantand PON1 activity,alteration of subfractions distribution and inflammationmay contribute to the increased atherosclerosis risk ofSLE patients.
Systemic lupus erythematosus;High density lipoprotein antioxidant capacity;High density lipoprotein subpopulation;High density lipoprotein subfractions;Paraoxonase-1
R593.24+1
A
1672-0709(2017)01-0016-04
2016-07-12)
陕西省科技攻关项目(编号:2014K11-02-03-13)
张键,E-mail:yiiling10@163.com
