不同性别2型糖尿病患者发生代谢综合征的危险因素分析
2017-08-22罗加凯李志红苑晓超
罗加凯,李志红,尹 飞,苑晓超,王 鑫
(保定市第一中心医院 内分泌二科,河北 保定 071000)
·论著·
不同性别2型糖尿病患者发生代谢综合征的危险因素分析
罗加凯,李志红,尹 飞,苑晓超,王 鑫
(保定市第一中心医院 内分泌二科,河北 保定 071000)
目的 探讨不同性别2型糖尿病(T2DM)患者发生代谢综合征(MS)的危险因素。方法 回顾性分析T2DM患者3 251例,比较不同性别患者合并MS、未合并MS的基本资料及实验室指标,分析不同性别T2DM患者发生MS的危险因素。结果 ①高密度脂蛋白胆固醇(HDL-C)是男性T2DM患者发生MS的保护因素;年龄、糖尿病家族史、吸烟史、体重指数(BMI)、收缩压(SBP)、舒张压(DBP)、甘油三脂(TG)、血尿酸(SUA)、合并肾病均是男性T2DM患者发生MS的危险因素。②HDL-C是女性T2DM患者发生MS的保护因素;年龄、BMI、SBP、TG、糖化血红蛋白(HbA1c)均是女性T2DM患者发生MS的危险因素。结论 对于不同性别的患者,在筛查T2DM患者合并MS时,应侧重其高发的危险因素。
糖尿病,2型;代谢综合征X;性别分布;危险因素
2型糖尿病(T2DM)以糖代谢异常为主要特征,随病程进展,常伴随一系列急慢性并发症,严重危害患者的健康;同时患者常伴有超重、肥胖、高血脂症、高血压病、高尿酸血症等各种代谢指标异常。2010 年中国国家疾病控制中心和中华医学会内分泌学分会调查18 岁以上人群糖尿病患病率为11.6%,约为1.13亿;糖尿病前期患病率为50.1%,其中仅25.8%的患者接受了治疗,接受治疗的仅39.7%的患者血糖达标[1],目前糖尿病呈现“三低”特点,即低诊断率、低治疗率、低达标率的情况。本研究通过回顾性分析不同性别T2DM患者发生代谢综合征(MS)相关危险因素及影响机制。 现报道如下。
1 资料与方法
1.1 病例选择 回顾性分析2014年1月至2016年5月就诊于我科的住院T2DM患者3 251例,其中男性MS患者1 221例,非MS患者520例;女性MS患者1 027例,非MS患者483例。一般情况良好,未合并心脏、肝脏、肾脏等脏器功能衰竭。排除1型糖尿病、妊娠期糖尿病、其他特殊类型的糖尿病(如药物、内分泌疾病以及创伤、急性感染等应激状态导致的糖代谢异常)。
1.2 诊断标准T2DM按照1999年世界卫生组织(WHO)糖尿病专家委员会制定的诊断标准。MS按照2004 年中华医学会糖尿病学分会(CDS)提出的诊断标准,具有以下4个组分中3 项及以上可以诊断为MS:①体重指数(BMI)≥25kg/m2;②高血糖:空腹血糖(FPG)≥6.1mmol/L及(或)餐后2小时血糖(2hPG)≥7. 8mmol/L,及(或)诊断为糖尿病正在接受治疗者;③高血压:血压≥140/90mmHg(1mmHg=0.133kPa),及(或)确诊高血压病史正在接受治疗者;④血脂紊乱:TG≥1.7mmol/L及(或)HDL-C<1.0mmol/L(女)或0.9mmol/L(男)[2]。
1.3 观察指标 收集患者一般资料包括:年龄、性别、糖尿病病程、糖尿病家族史、身高、体重、血压、长期吸烟史(连续5年,平均每天10支及以上)、长期饮酒史(饮酒量折算成乙醇量为男性>140g/周或女性>70g/周,并且持续1年以上)及是否合并肾病等。计算BMI=体重/身高2。次日清晨空腹状态抽取静脉血,测定FPG、糖化血红蛋白(HbA1c)、总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、尿素氮(BUN)、肌酐(Cr)、血尿酸(SUA)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、谷氨酰胺转移酶(GGT)及纤维蛋白原。
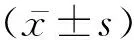
2 结 果
2.1 女性T2DM患者一般资料及实验室检查指标 女性T2DM患者合并MS与非MS比较,年龄、病程、BMI、SBP、DBP、TC、HDL-C、LDL-C、BUN、SUA、HbA1c、 纤维蛋白原差异有统计学意义(P<0.05);ALT、AST、GGT、Cr、FPG差异无统计学意义(P>0.05)。见表1。
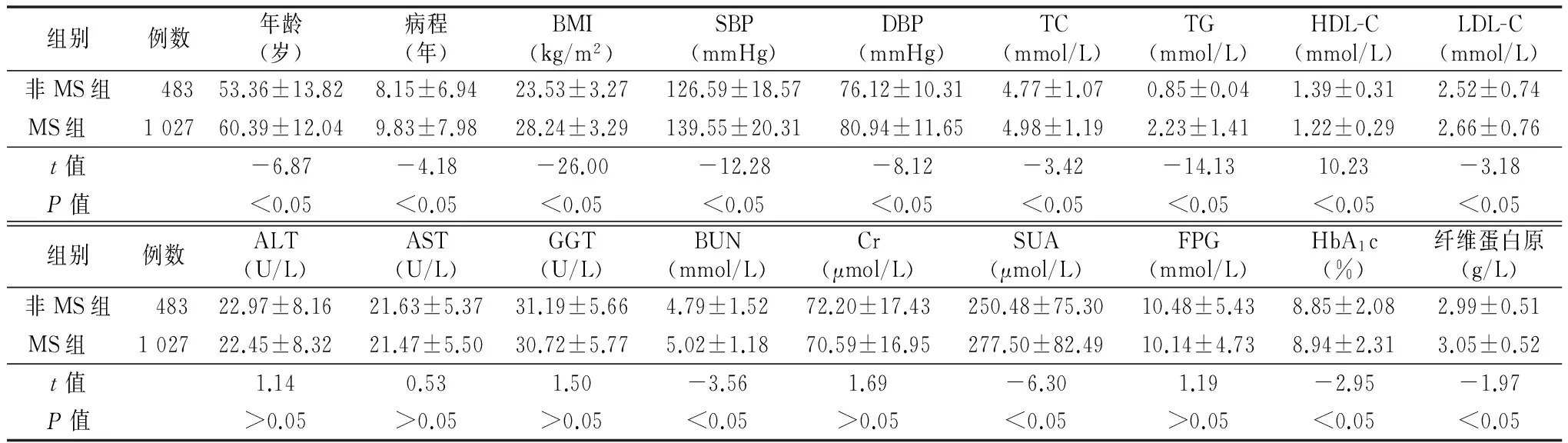
表1 两组女性T2DM患者一般资料及实验室检查指标比较
2.2 男性T2DM患者一般资料及实验室检查指标 男性T2DM患者合并MS与非MS比较,年龄、BMI、SBP、DBP、TC、TG、HDL-C、ALT、SUA差异有统计学意义(P<0.05);病程、LDL-C、AST、GGT、BUN、Cr、FPG、HbA1c、纤维蛋白原差异无统计学意义(P>0.05)。见表2。
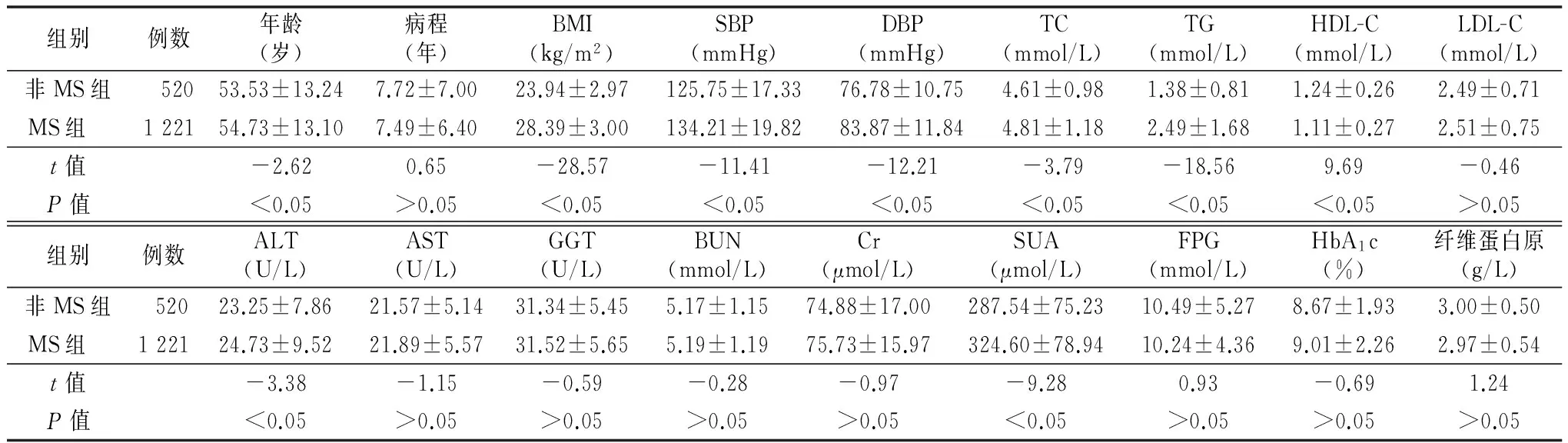
表2 两组男性T2DM患者一般资料及实验室检查指标比较
2.3Logistic回归分析 以MS为应变量,以年龄、性别、病程、糖尿病家族史、吸烟史、饮酒史、BMI、SBP、DBP、TC、TG、LDL-C、HDL-C、SUA、Cr、FPG、HbA1c、纤维蛋白原及合并肾病为自变量进行Logistic回归分析。结果显示,①HDL-C是男性T2DM患者发生MS的保护因素;年龄、糖尿病家族史、吸烟史、BMI、SBP、DBP、TG、SUA、合并肾脏并发症均是男性T2DM患者发生MS的危险因素。②HDL-C是女性T2DM患者发生MS的保护因素;年龄、BMI、SBP、TG、HbA1c均是女性T2DM患者发生MS的危险因素。见表3~5。
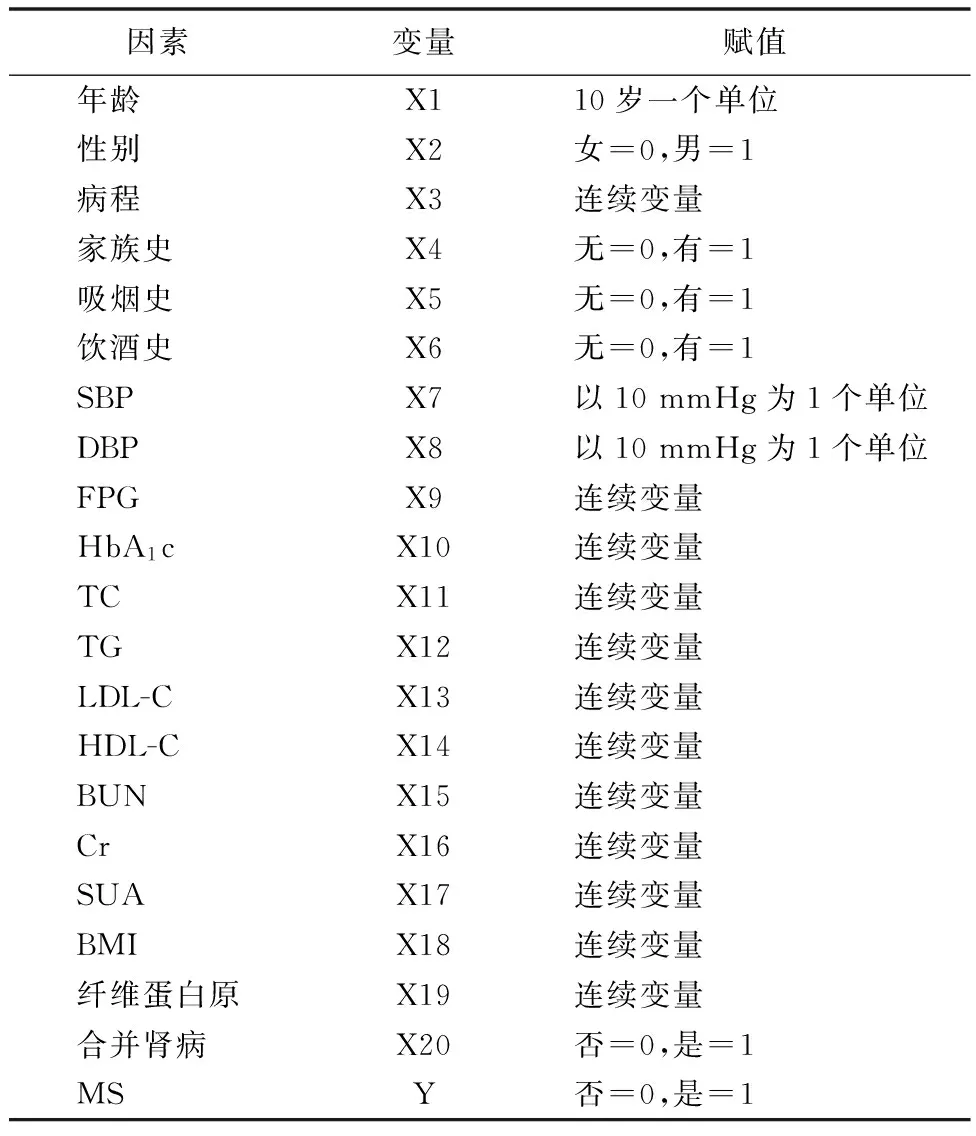
表3 MS可能相关的危险因素赋值
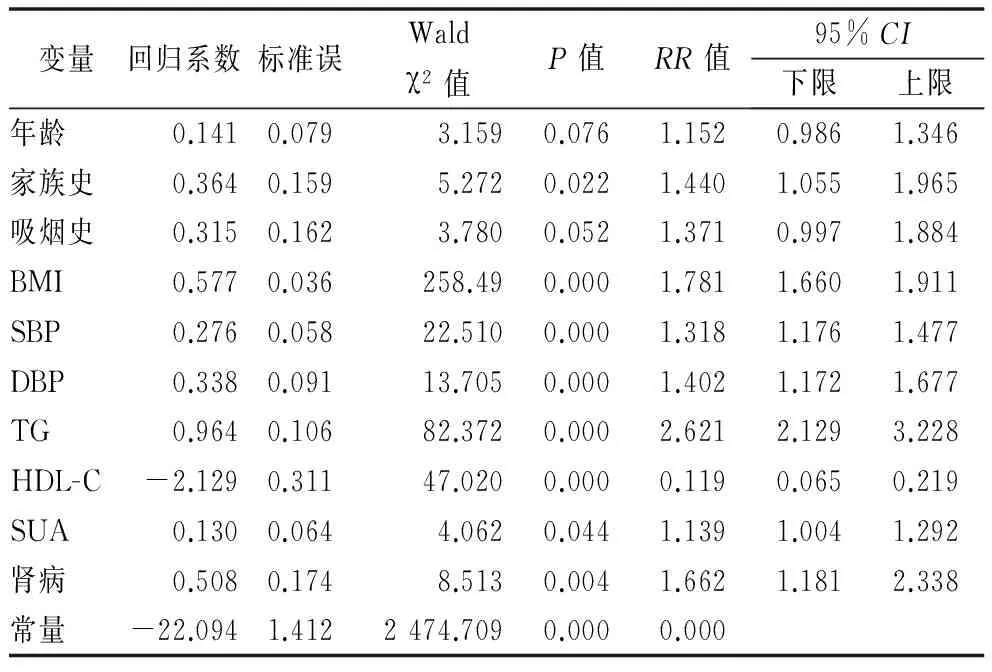
表4 男性T2DM患者合并MS危险因素分析
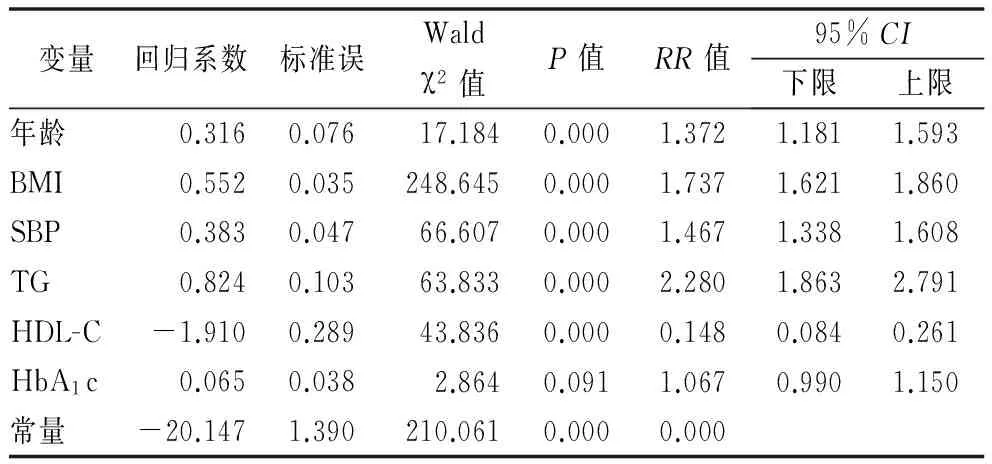
表5 女性T2DM患者合并MS危险因素分析
3 讨 论
T2DM与胰岛素的抵抗及胰岛β细胞功能减退相关,美国糖尿病协会(ADA)研究显示,胰岛素β细胞功能在糖尿病前期以每年1.7%缓慢下降,确诊糖尿病后4~5年则以每年18.2%加速下降[3]。长期高血糖及其导致的慢性血管并发症严重危害着人类的身心健康,给个人和社会带来了沉重的负担。许樟荣等[4]从医疗经济学角度研究显示,糖尿病患者的医疗费用80%用于慢性并发症的诊治,其中50%以上用于心血管疾病的治疗,而心血管并发症60%~75%成为糖尿病患者致死致残的原因。高血糖与大血管病变具有共同的患病基础,即共同土壤学说,即高热量饮食,缺乏运动导致的超重/肥胖,伴随的胰岛素抵抗,高血压和脂代谢紊乱等是糖尿病和大血管病变的共同基础,氧化应激特别是线粒体的氧化应激和慢性低水平炎症是内在原因[5]。张明琛等[6]研究显示,在早发T2DM患者(即糖尿病的诊断年龄≤40岁),超过50%存在糖尿病大血管并发症。陈立立等[7]研究显示:糖尿病慢性血管并发症导致MS发病率增加的机制可能有:血管内皮细胞损伤、血液高凝状态、局部缺血状态、炎症反应、细胞因子、多元醇通路及其活性增强、晚期糖基化终末产物(AGEs)增加、蛋白激酶C(PKC)活性增加、肾素-血管紧张素-醛固酮(RAAS)系统的激活、脂毒性和糖毒性。刘超等[8]研究MS发病机制常与胰岛素抵抗、高血糖、高血脂、腹型肥胖、遗传、年龄、体力活动减少、慢性炎症状态、激素代谢异常密切相关。
本研究显示年龄每上升10岁,T2DM患者发生MS的患病率分别增加1.152和1.372倍。可能的原因是:随着年龄增长,人体功能逐渐走向衰老阶段,细胞、组织、器官和整体的糖代谢、脂代谢能力均呈现退行性改变,使老化机体更易感于一系列慢性疾病,包括糖尿病及MS。同时,随着年龄的增长,饮食结构的改变和运动量减少,导致体内脂肪含量增加和肌肉含量减少,腹部与内脏脂肪沉积,造成骨骼肌对胰岛素的敏感性下降;而血浆中游离的脂肪酸浓度的增加导致胰岛素抵抗加剧,使得血糖、血压、血脂及BIM增加,进而导致MS患病风险增加。
糖尿病家族史、吸烟史均能提高T2DM合并MS的患病率。梅尔维尔等[9]研究显示:糖尿病家族史与糖尿病前期风险相关,有家族史的人群比无家族史的人群患糖尿病前期的风险增加40%,即前者患糖尿病前期的风险是后者的1.4倍,但进行多因素分析,将参与者的年龄、性别、BMI考虑进来时该风险只增加26%。有家族史的与无家族史的患者相比,胰岛素的分泌模式更容易出现紊乱,胰岛素分泌呈现不稳定状态,患者更易出现胰岛素抵抗指数下降和血糖上升[10];遗传背景使得胰岛β细胞第一相分泌功能减退,更容易导致糖尿病的发生[11]。Willi等[12]研究显示:轻度吸烟组(<20支/d)与未吸烟组发生糖尿病的相对危险度为1.29,重度吸烟组(>20支/d)与未吸烟组发生糖尿病的相对危险度为1.61,表明吸烟的程度与发生糖尿病的危险性呈现剂量反应关系。提示早期对有T2DM家族史及有吸烟史者进行早期干预可以一定程度降低MS的患病率。
本研究发现,SUA是男性T2DM合并MS的危险因素,可能与非绝经期女性体内的雌激素具有促进SUA排泄的作用有关。SUA成为MS危险因素的相关机制有:①长期高尿酸血症状态下,尿酸盐结晶容易沉积于胰岛β细胞中,导致胰岛细胞破坏而加剧糖代谢异常,诱发糖尿病及其并发症的发生发展;②高尿酸增加可激活氧化应激反应,导致胰岛素敏感性降低,从而导致胰岛素抵抗;③高尿酸血症可引起体内高瘦素血症,促进高胰岛素血症和胰岛素抵抗的发生,同时高瘦素血症和BMI成正相关,容易增加BIM,促进超重/肥胖形成;④高尿酸血症容易导致低脂联素状态的产生,升高血液TG和LDL-C的含量,降低血液HDL-C的含量,导致血脂代谢的紊乱;⑤高尿酸血症可激活体内RAAS系统、促进肾小管对NA+吸收能力增强,造成水钠潴留,容易导致血压异常。可见高尿酸血症与血糖、血压、血脂及BIM的异常变化是密不可分的[13]。
肾病是糖尿病患者最严重和常见的并发症之一,30%左右的糖尿病患者会并发肾病[14]。糖尿病肾病患者更容易出现MS的原因有:①糖尿病肾病病理学常见肾小球硬化及内皮细胞的损伤,更容易抑制内皮性一氧化氮合酶,Akt蛋白激酶,蛋白合成酶激酶3a的磷酸化,这些蛋白的磷酸化抑制反应与体内的炎症反应密切相关,导致体内慢性炎症反应;②体内的一系列细胞因子,例如瘦素、白介素6、肿瘤坏死因子α、脂联素等参与肥胖相关性肾病,促进胰岛素抵抗;③肾脏小动脉玻璃样变性、肌内膜增厚及激活RAAS系统,促进氧化应激反应,抑制了胰岛素信号传导使得患者更易出现慢性肾病性高血压[15]。由此可见糖尿病肾病患者更易出现代谢组分异常聚集。
高血压病一定程度增加了T2DM合并MS的患病率,本研究显示,男性SBP每增加10mmHg发生MS的风险增加1.318倍;DBP每增加10mmHg发生MS的风险增加1.402倍;女性SBP每增加10mmHg发生MS的风险增加1.467倍;血压异常增加MS患病率的可能机制:在高血压的状态,毛细血管密度下降,影响胰岛素和葡萄糖在靶细胞的传输过程和弥散能力,引起血流分布的不均匀性,妨碍肌细胞对葡萄糖的摄取和利用。高血压患者肌组织中有氧化能力增强、糖酵解能力降低、对胰岛素敏感性降低,导致血糖代谢的异常。高血压时肾脏对胰岛素的清除能力下降,血胰岛素水平升高,同时脂肪组织对胰岛素的敏感性下降。高血压状态促进胰岛素抵抗的同时可影响机体血脂代谢、血糖代谢,参与MS的各项病理生理学过程[16]。
随着TG上升及HDL-C下降,T2DM患者合并MS的患病率均呈一定程度的上升。探究相关机制可能有:①随着TG水平增高,DM早期或轻型患者,由于摄食量过多,脂肪容易形成沉积而导致超重、肥胖,高浓度的血脂容易沉积于血管壁,导致血管腔狭窄、血流受阻,同时由于胆固醇带正电荷能中和红细胞及血小板表面的负电荷,使红细胞和血小板的聚集能力增强,纤维蛋白原含量上升,血液处于高凝状态导致血流动力学异常、血流速度下降,引发视网膜组织的缺血、缺氧,出现眼底动脉硬化;②高血脂改变了细胞膜的脂质结构,容易出现微循环障碍;③游离脂肪酸(FFA)的异常升高,导致高活性反应分子性氧簇(ROS)和活性氮簇 (RNS)生成增多,激活了氧化应激反应,降低外周组织对胰岛素的敏感性,加重了胰岛素的抵抗,从而导致患者糖脂代谢异常加剧;④脂类代谢紊乱通过非酶促糖基化及多元醇通路、促炎症因子诱导血管内皮细胞黏附因子的表达,导致血管内皮细胞功能受损,血管平滑肌增殖,导致血管内皮细胞损伤、氧化应激及血栓形成;这些机制均极大的促进糖尿病微血管并发症的形成及发展[17]。
T2DM患者的胰岛素敏感性常与腹部脂肪的沉积呈现明显的负相关,而超重/肥胖作为MS的促使因素,促使胰岛素抵抗的发生。2008年全国流行病学调查研究显示:T2DM患病率为9.7%,超重/肥胖患者中T2DM的患病率为33.3%[18]。肥胖通常能引起一系列慢性代谢性疾病,研究发现,肥胖人群的糖尿病、高血压、心血管疾病的患病率远高于正常体重人群[19]。本研究显示,随着BMI每增加1kg/m2,男女T2DM患者发生MS的风险分别增加1.781和1.737倍。可见随着BMI增加可一定程度增加T2DM患者MS的患病率。
Logistic回归分析显示,FPG不是T2DM患者合并MS的危险因素,原因可能为本研究属于回顾性而非前瞻性研究,多数患者在入院前已经接受常规降糖方案甚至强化降糖方案治疗;伴发较多并发症且病情较重的患者因饮食减少及接受积极治疗等因素反而使FPG降低。HbA1c是血中葡萄糖与血红蛋白游离氨基发生非酶促糖基化反应的产物,反映患者最近2~3个月平均血糖水平。其浓度与血糖水平相关,是监测糖尿病患者血糖控制指标。前瞻性糖尿病UKPDS研究显示,HbA1c水平与糖尿病慢性并发症之间存在正相关[20]。本研究显示,HbA1c每增加1%,女性T2DM患者发生MS的患病率增加1.067倍。持续高糖状态加重MS可能原因有:糖代谢紊乱,持续高血糖状态可增强机体氧化应激反应,氧自由基生成增多,通过多元醇旁路以及蛋白质的非酶糖基化途径损伤机体,导致机体胰岛细胞朝着凋亡方向进展,血糖难以控制,一定程度增加T2DM患者代谢组分紊乱。
综上所述,对于不同性别的患者,在筛查T2DM合并MS时,应侧重其高发的危险因素,这样更容易早发现、早诊断、早治疗。
[1]XuY,WangL,HeJ,etal.PrevalenceandcontrolofdiabetesinChineseadults[J].JAMA,2013,310(9):948-959.
[2] 中华医学会糖尿病学分代谢综合征研究协作组.中华医学会糖尿病学分会关于代谢综合征的建议[J].中华糖尿病杂志,2004,12(3):156-161.
[3] 杨涛. 专家专题报告6:ADA关于2型糖尿病β细胞衰竭专家共识[J].中华内分泌代谢杂志,2015,31(9):832-833.
[4] 许樟荣,王玉珍,刘彦君,等.2型糖尿病合并不同数目代谢综合征组分患者的临床表现对血管病变的影响[J].中国糖尿病杂志,2006,14(4):250-252.
[5] 武红梅,范振迁,郑少雄.高血糖的大血管病变[J].中华糖尿病杂志,2014,6(11):788-791.
[6] 张明琛,张宏武,茅江峰,等.早发2型糖尿病患者的血糖控制现况以及大血管并发症危险因素分析[J].中华糖尿病杂志,2014,6(14):808-812.
[7] 陈立立,胡仁明.2型糖尿病发病的炎症机制[J].中华糖尿病杂志,2012,4(4):248-251.
[8] 刘超,狄红杰.进一步深入研究代谢综合征的发病机制临床干预[J].中华内分泌代谢杂志,2015,31(3):199-200.
[9] 梅尔维尔,王燕飞. 2型糖尿病家族史的影响有多大? [J]. 糖尿病临床,2013,7(10):466.
[10] 高洪伟,王海宁,洪天配,等.2型糖尿病家族史是糖耐量正常个体发生代谢综合征的独立危险因素[J].中国糖尿病杂志,2008,16(2): 83-86.
[11] 孙晓晖,王颜刚,綦玉琴,等.左旋精氨酸刺激试验评价遗传背景对正常糖耐量者和初诊糖尿病患者胰岛β细胞功能的影响[J].中华内科杂志,2010,49(1):19-23.
[12]WilliC,BodenmannP,GhaliWA,etal.Activesmokingandtheriskoftype2diabetes:asystematicreviewandmeta-analysis[J].JAMA,2007,298(22):2654-2664.
[13] 王集华.高尿酸血症与代谢综合征各组分间的相关性分析[J].吉林医学,2016,37(1):70-72.
[14]Duran-SalgadoMB,Rubio-GuerraAF.Diabeticnephropathyandinflammation[J].JAMA,2013,310(9):948-959.
[15] 眭维国,王磊,戴勇.代谢综合征与慢性肾脏病[J].国际泌尿系统杂志,2015,35(1):145-149.
[16] 赵晏铎,张永莉.代谢综合征各组分与高血压关系研究的进展[J].心血管康复医学杂志,2015,24(1):110-113.
[17] 欧洲心脏病学会与欧洲糖尿病研究学会.糖尿病、糖尿病前期与心血管病指南[J].糖尿病临床,2013,7(12):537-551.
[18]YangW,LuJ,WengJ,etal.PrevalenceofdiabetesamongmenandwomeninChina[J].NEnglJMed,2010,362(12):1090-1101.
[19]BiY,LuJ,WangW,etal.Cohortprofile:riskevalutionofcancersinChinesediabeticindividuals:alongitudinal(REACTION)study[J].JDiabetes,2014,6(2):147-157.
[20]UKProspectiveDiabetesstudy(UKPDS)Group.Intensivebloodglucosecotrolwithsulphonylureasorinsulincomparedwithconventionaltreatmentandriskofcomplicationinpatientswithtype2diabetes(UKPDS33)[J].Lancet,1998,352(9131):837-853.
Riskfactorsofmetabolicsyndromeindifferentgenderpatientswithtype2diabetesmellitus
LuoJiakai,LiZhihong,YinFei,YuanXiaochao,WangXin
DepartmentofEndocrinology,BaodingFirstCentralHospital,Baoding071000,China
LiZhihong,lizhihonglfz@126.com
ObjectiveToexploreriskfactorsofmetabolicsyndrome(MS)indifferentgenderpatientswithtype2diabetesmellitus(T2DM).MethodsTotally3 251T2DMpatientswerechosentocarryonaretrospectivecase-controlstudy,generalinformationandlaboratoryexaminationamongdifferentgenderpatientswithMSandwithoutMSwerecompared,andtheriskfactorsofMSindifferentgenderT2DMpatientswereanalyzedbyusingbinarylogisticregressionanalysis.Results①Highdensitylipoproteincholesterol(HDL-C)wasaprotectivefactorofMSinmaleT2DMpatients;age,familyhistoryofdiabetes,smokinghistory,bodymassindex(BMI),systolicbloodpressure(SBP),diastolicbloodpressure(DBP),triglyceride(TG),serumuricacid(SUA)andrenalcomplicationwereriskfactorsofMSinmaleT2DMpatients. ②HDL-CwasaprotectivefactorofMSinfemaleT2DMpatients;age,BMI,SBP,TGandHbAlcwereriskfactorsofMSinfemaleT2DMpatients.ConclusionThehighriskfactorsshouldbefocusedonscreeningforMSofdifferentgenderT2DMpatients.
diabetesmellitus,type2;metabolicsyndromeX;sexdistribution;riskfactors
河北省重点科技研究计划(ZL20140182)
李志红,Email:lizhihonglfz@126.com
R
A
1004-583X(2017)08-0676-05
10.3969/j.issn.1004-583X.2017.08.008
2017-03-14 编辑:王秋红
