电感耦合等离子体放射光谱法测定抗癌药物米铂中微量金属杂质及其安全性评价
2017-08-17普绍平邱学翁栾春芳缪祥宏廖云星
彭 娟,普绍平,胡 劲,邱学翁,栾春芳,缪祥宏,廖云星
(1.昆明贵研药业有限公司,云南昆明 650106;2.昆明理工大学,云南昆明 650093)
·实验研究·
电感耦合等离子体放射光谱法测定抗癌药物米铂中微量金属杂质及其安全性评价
彭 娟1,2,普绍平1,胡 劲2,邱学翁1,栾春芳1,缪祥宏1,廖云星1
(1.昆明贵研药业有限公司,云南昆明 650106;2.昆明理工大学,云南昆明 650093)
目的建立测定抗癌药物米铂中微量金属杂质的电感耦合等离子体放射光谱(ICP-AES)法,为评价米铂的金属残留对人体的影响提供方法。方法试样于600℃灼烧后经HCl-HNO3溶解,用ICP-AES法直接测定抗癌药物米铂中的微量金属杂质。结果对分析方法进行了验证,线性相关系数(r)为0.99 91~1.000 0,方法精密度为1.1% ~5.3%,准确度为85.22% ~109.60%,均符合药典要求;通过测定,计算出了钯(Pd)、铑(Rh)、铱(Ir)、钌(Ru)、镍(Ni)、铬(Cr)、铜(Cu)、锰(Mn)、铁(Fe)、锌(Zn)的实际日接触量,远小于允许日接触量(PDE)。结论ICP-AES法简便、快速、准确,米铂中的金属残留物被充分除去,该药进入人体后,金属杂质的微量残留不会影响人体健康,无安全隐患。
电感耦合等离子体放射光谱法;米铂;微量金属杂质;残留量;日接触量
米铂(miriplatin)的化学名为(SP-4-2)-[(1R,2R)-环己基-1,2-二胺-N,N′]双(十四烷酸-O)合铂一水合物,是一种与碘油有高亲和力的顺铂衍生物,是一种溶于专用混悬液碘化油、肝动脉内给药的新型铂类抗癌药物,属第3代铂类抗癌药物,于2009年在日本批准上市,临床用于肝细胞癌的治疗[1-4]。铂是合成米铂原料药的主要起始物料,含有钯(Pd)、铑(Rh)、铀(Au)、铱(Ir)、钌(Ru)、铋(Bi)、锡(Sn)、铅(Pb)、锌(Zn)、铜(Cu)、镁(Mg)、铬(Cr)、锰(Mn)、铁(Fe)、镍(Ni)等金属杂质[5]。同时,合成过程中也可能会引入这些杂质。这些残留的金属通常不具有治疗作用,尤其是Pd,Rh,Ir,Ru,Ni,Cr,Cu,Mn,Zn等金属杂质的残留,具有遗传毒性,他们的某些化合物可能会刺激眼部,引起皮肤过敏、气喘,进而引发皮肤炎、口腔炎和黏膜炎等症状[6-8]。因此,基于对人体健康带来的潜在风险的考虑和质量控制的需要,应对米铂原料药中金属杂质的残留进行严格控制。米铂的原料合成报道较多[10-12],杂质和含量的测定也有报道[13-14],但尚无米铂原料药微量金属杂质测定的方法报道,国内对米铂原料药中金属残留量的控制限度还缺乏明确的技术要求,欧盟EDQM对金属残留提出了明确要求。本研究中根据EMEA《金属催化剂或金属试剂残留量限度规定的指导》[15]的有关要求,通过电感耦合等离子体放射光谱(ICP-AES)法对米铂原料药中Pd,Rh,Ir,Ru,Ni,Cr,Cu,Mn,Zn等金属杂质元素进行测定,为米铂中微量金属杂质的控制和安全性评价提供方法。
1 仪器与试药
1.1 仪器
Optima 7000 DV型电感耦合等离子体发射光谱仪(美国PE公司,波长示值误差为±0.03 nm);AB135-S型电子天平(上海梅特勒托利多公司,精度为0.01 mg)。
1.2 试药
米铂原料药(昆明贵研药业有限公司,批号分别为M20160703,M20160803,M20160818);Pd(批 号 为15080312),Rh(批 号 为 15080312),Au(批 号 为15062412),Ir(批 号 为 20150817),Ru(批 号 为20150724),Bi(批 号 为 15070712),Sn(批 号 为15071612),Pb(批 号 为 15082512),Zn(批 号 为15083172),Cu(批 号 为 15091472),Mg(批 号 为15082772),Cr(批 号 为 14061912),Mn(批 号 为15090872),Al(批 号 为 15091472),Fe(批 号 为14071512)和Ni(批号为15082872)标准贮备液(国家钢铁材料测试中心钢铁研究总院,质量浓度为1000 mg/L);水为重蒸馏水(昆明贵研药业有限公司);氩气(昆明梅塞尔气体产品有限公司,批号为 201604019,纯度≥99.999%);盐酸(西陇化工股份有限公司,批号为100224-1,含量为36.0%~38.0%),硝酸(成都市科龙化工试剂厂,批号为 201510401,含量为 65.0%~68.0%),均为优级纯。
2 方法与结果
2.1 仪器最佳工作条件
分析功率:1.3 kW;冷却气流量:15 L/min;辅助气流量:0.2 L/min;雾化器流量:0.8 L/min;进样速率:1.5 mL/min;观测高度:线圈上方15 mm;杂质元素的分析波长:详见表1。

表1 杂质元素的分析波长(nm)
2.2 溶液制备
2.2.1 标准级差溶液的制备
第1组标准溶液:分别移取Pd,Rh,Au,Ir,Ru,Bi,Sn,Pb,Zn标准贮备溶液(1 000 mg/L)1 mL,注入100 mL容量瓶中,加10%(1+9)盐酸稀释至刻度,摇匀,即得质量浓度为10 mg/L的混合标准溶液。用逐步稀释的方法配制成一组有5个级差的标准溶液,其质量浓度分别为0,0.1,0.2,0.5,1.0 mg/L。
第2组标准溶液:分别移取Cu,Mg,Cr,Mn,Al,Fe,Ni标准贮备溶液(1 000 mg/L)1 mL,注入100 mL容量瓶中,加10%(1+9)盐酸稀释至刻度,摇匀,即得质量浓度为10 mg/L的混合标准溶液。用逐步稀释的方法配制成一组有5个级差的标准溶液,其质量浓度分别为0,0.08,0.2,0.5,1.0 mg/L。
2.2.2 供试品溶液的制备及测定程序
日常检测时,称取米铂供试品1.25 g,置50 mL坩埚中,把坩埚放入马沸炉中,升温至600℃时保温2 h,冷却,取出,加入1 mL硝酸和3 mL盐酸,在电热板上低温溶解,浓缩至近干,用10%(1+9)盐酸溶解,移至25 mL容量瓶中,加10%(1+9)盐酸冲洗3次,冲洗液合并于容量瓶中,并加同溶剂稀释至刻度,摇匀,即得供试品溶液。在选定仪器条件下,分别取空白溶液、标准溶液、供试品溶液适量,于所选波长处依次进样测定 Pd,Rh,Au,Ir,Ru,Bi,Sn,Pb,Zn,Cu,Mg,Cr,Mn,Al,Fe,Ni 16种元素,测定溶液的发射强度值,计算机绘制工作曲线,并自动打印测定结果。
2.3 酸度对测定的影响
盐酸的引入会使测试溶液的提升速率和测定元素的谱线强度发生变化,谱线强度的变化与提升速率的变化成正比。为了解酸度对待测元素的影响,作了5%,10%,15%,20%盐酸介质溶液试验。结果,5%的盐酸测定值偏大,10%和20%的盐酸测定值变化较小,不影响测定结果,故本试验中选择10%盐酸介质溶液。
2.4 铂基体干扰
米铂中含铂24.9%,考察铂基体对杂质元素测定的干扰和影响时,用纯铂(纯度为99.99%)配制成质量浓度为10 g/L的溶液,用 ICP-AES法测定其在Pd,Rh,Au,Ir,Ru,Bi,Sn,Pb,Zn,Cu,Mg,Cr,Mn,Al,Fe,Ni所选波长处的干扰质量浓度值。结果Pd为0.208 mg/L,Au为-0.163 mg/L,Bi为0.171 mg/L,其他元素均小于0.1 mg/L。说明铂基体对Pd,Au,Bi有影响,可采用多元谱线拟合解决;对其余影响小的元素,可用背景干扰更正。
2.5 背景干扰更正
光谱仪有背景自动校正功能,用待测样品作光谱图,参照计算机屏幕上所显示的每条谱线陈列图及标识谱线,背景和校正后的强度值,在谱线两侧选择背景扣除的最低值波长位置,并输入计算机,分析时自动进行背景校正。
2.6 杂质元素间的相互影响
用质量浓度为10 mg/L的各杂质元素溶液(介质为10%盐酸溶液),通过标准溶液做工作曲线,用ICP-AES法测定其在各杂质元素所选波长处的干扰浓度值,结果均小于0.04 mg/L。因杂质元素的含量低,各元素之间不存在相互影响。
2.7 方法学考察
2.7.1 杂质元素的检测限及定量限
检测限:在拟订仪器工作条件下,用标准溶液作工作曲线,取50 g/L供试品溶液连续测定10次,计算标准偏差,以标准偏差的3倍计算各杂质元素的检测限。结果见表2。

表2 杂质元素的检测限(mg/L)
定量限:在拟订仪器工作条件下,用标准溶液作工作曲线,取50 g/L供试品溶液连续测定10次,计算标准偏差,以标准偏差的10倍计算各杂质元素的定量限。结果见表3。
2.7.2 线性关系考察
在拟订仪器工作条件下,取2.2.1项下两组标准级差溶液,依次进样,计算线性相关系数。结果相关系数(r)为0.9991~1.0000,符合标准规定(r≥0.999)[16]。详见表4。

表3 杂质元素的定量限(mg/L)
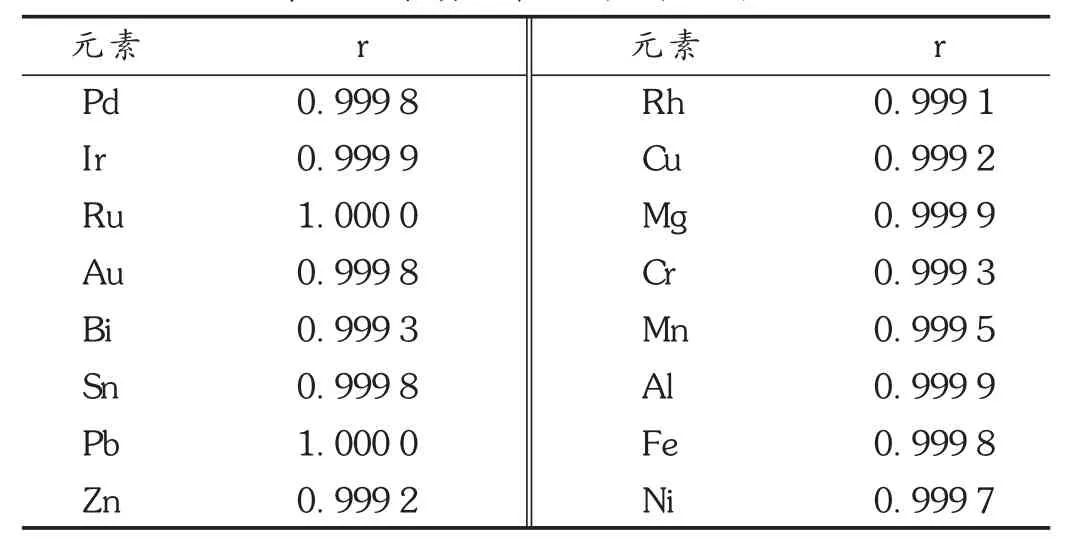
表4 杂质元素的线性相关系数
2.7.3 精密度试验
平行称取18份米铂供试品,精密称定,每份各0.5 g,按2.2.2项下方法制备供试品溶液,分别置10 mL容量瓶中,在9份供试品溶液中加入1 mL 10 mg/L的Pd,Rh,Au,Ir,Ru,Bi,Sn,Pb,Zn混合标准溶液,另9份供试品溶液中加入1 mL 10 mg/L的Cu,Mg,Cr,Mn,Al,Fe,Ni混合标准溶液,再用10%(1+9)盐酸稀释至刻度,摇匀,测定。结果的 RSD为 1.1%~5.3%,符合规定(RSD≤8%)[16]。详见表5。

表5 精密度试验结果(n=9)
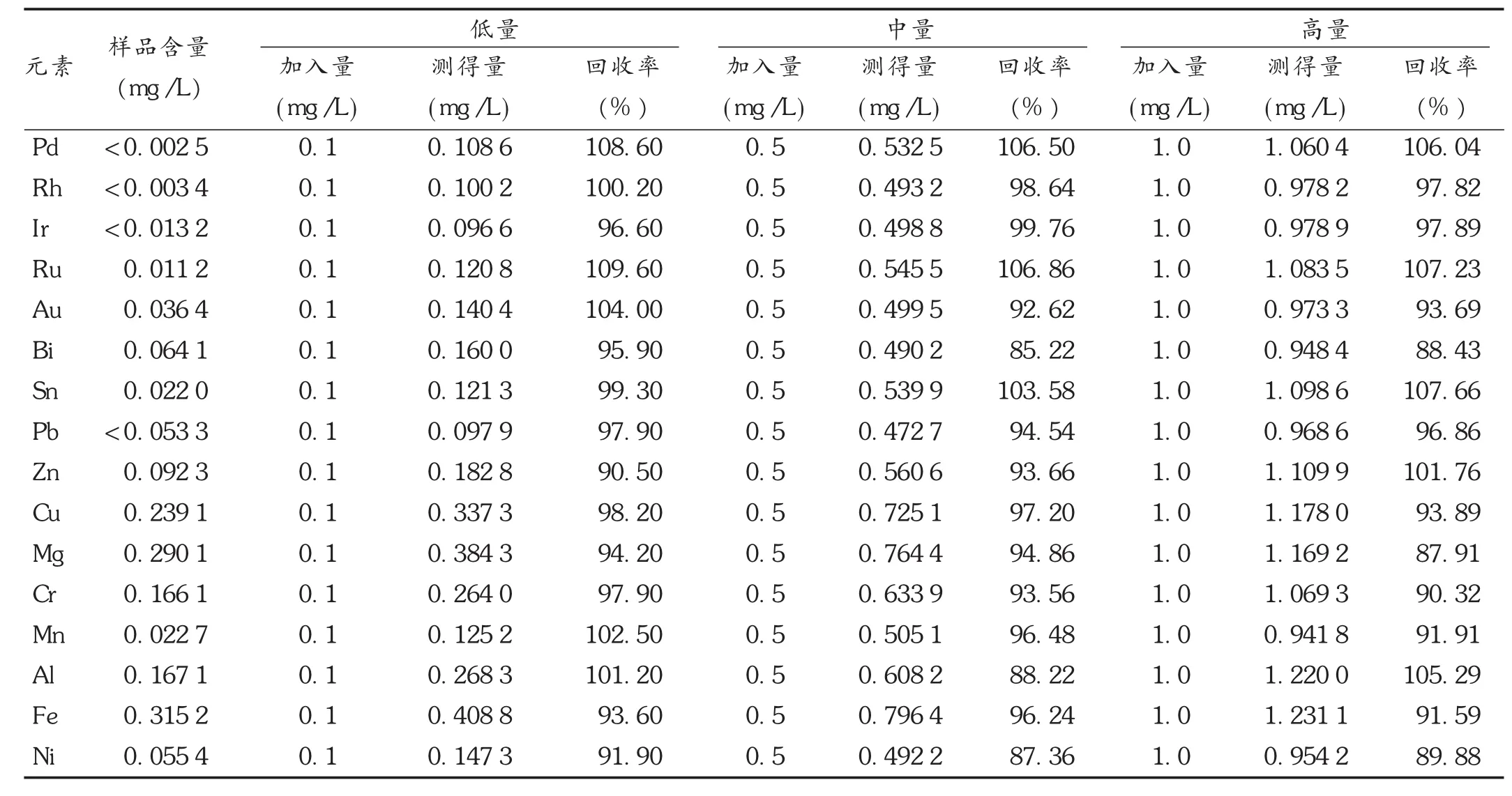
表6 加标回收试验结果(n=3)
2.7.4 加标回收试验
平行称取19份米铂供试品,精密称定,每份各0.5 g,1份作本底,按2.2.2项下方法制备供试品溶液,分别置10 mL容量瓶中,设计3种不同杂质元素的浓度,每种浓度分别制备3份供试品溶液,进样测定,计算回收率。结果低量的加标回收率为90.50%~109.60%,中量的加标回收率为85.22%~106.85%,高量的加标回收率为87.91%~107.66%,符合规定(回收率限度为75% ~120%)[16]。
2.8 试验样品分析
选择 3个连续批号(批号分别为 M20160703,M20160803,M20160818)的米铂供试品,按2.2.2项下方法进行供试品处理和测定,列入指导原则[15]需严格控制的金属杂质元素包括Pd,Ir,Rh,Ru,Ni,Cr,Cu,Mn,Fe,Zn,其在米铂原料药中残留量的测定结果见表7。

表7 米铂原料药中金属杂质元素残留量的测定结果(×10-6)
2.9 金属杂质元素实际日接触量的确定
根据日本药局方发布的注射用米铂说明书,每日给药量为70 mg/d,根据2.4项中金属杂质元素残留量的测定结果,米铂原料药中Pd,Ir,Rh,Ru,Ni,Cr,Cu,Mn,Fe,Zn的实际日接触量见表8。
3 讨论
米铂供试品中如果存在有机物,加王水(HNO3∶HCl=1∶3)溶解,静置,冷却后会有沉淀析出,影响测定。因此本试验中采用先灼烧尽有机物,再加王水的前处理方式制备供试品溶液。另外,为了使有机物完全挥发,选择在600℃保温2 h,使供试品溶液具有代表性。
合成米铂原料药的主要起始物料是铂,该物料中残留Pd,Rh,Au,Ir,Ru,Bi,Sn,Pb,Zn,Cu,Mg,Cr,Mn,Al,Fe,Ni等金属杂质会带入最终产品米铂原料药中。试验样品于600℃灼烧后用HCl-HNO3溶解,采用ICPAES法测定米铂原料药中的16种金属杂质元素,线性相关系数 r为0.999 1~1.000 0,精密度试验结果的RSD为 1.1%~5.3% ,加标回收率为 85.22%~109.60%,符合2015年版《中国药典》的规定。用该方法可在1个工作日内完成多批次多个金属杂质元素的测定,比原子吸收光谱法缩短3个工作日,且还能降低分析成本。该方法简便、快速、准确,可用于测定米铂中的金属残留。
米铂原料药的合成过程中,除了反应起始物料金属铂本身带来的金属杂质外,合成工艺中并未使用到其他金属催化剂或金属试剂,且经过还原、水解、取代反应,以及多次水洗和重结晶,残留在成品中的金属杂质已经很少。本试验先考虑了盐酸介质浓度对测定的影响,消除了铂基体和背景干扰及金属杂质元素间相互影响的前提下,开展了 Pd,Rh,Au,Ir,Ru,Bi,Sn,Pb,Zn,Cu,Mg,Cr,Mn,Al,Fe,Ni 16种金属杂质元素的方法学考察。对于金属杂质的安全性评价,列入指导原则[15]需严格控制的金属杂质元素包括Pd,Ir,Rh,Ru,Ni,Cr,Cu,Mn,Fe,Zn,它们均具有遗传毒性,其残留如果超过标准要求,会影响人体健康,并会带来安全隐患,其余金属杂质元素对健康和安全影响较小,无需进行安全性评价。结果表明,Pd,Ir,Rh,Ru,Ni,Cr,Cu,Mn,Fe,Zn的实际日接触量远小于PDE的30%[15],按照现行工艺流程,金属残留物可被充分除去,该药进入人体后,金属杂质的微量残留不会影响人体健康,也不会带来安全隐患。
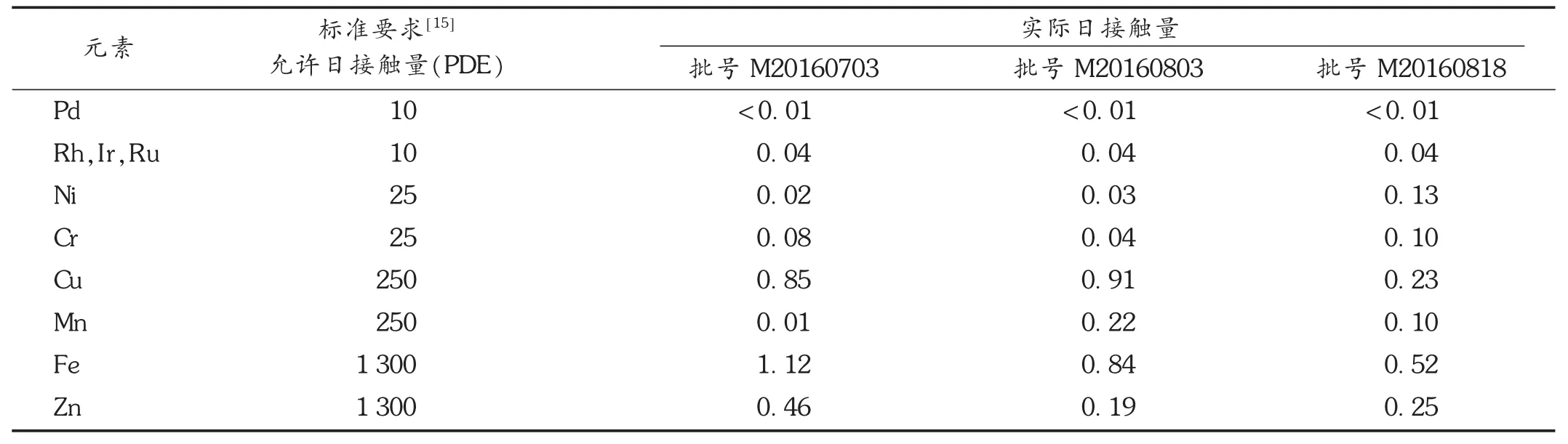
表8 米铂原料药中金属杂质元素的实际日接触量( g/d)
本试验中是用3批连续的中试产品进行的测试,在后续研究中,考虑再增加3批中试批次产品和3批连续商业规模化产品,进行金属杂质元素的测定,如果金属残留物仍可被充分除去,则该指标可以考虑不纳入米铂原料药的质量标准中,不作为日常规模化生产的测试项。
[1]王雪微,井丽丽,李泉妙,等.米铂原料药中光学异构体杂质研究[J].中国新药杂志,2015,24(2):231-234.
[2]赵 俊,马俊杰.肝癌介入治疗新药米铂的药理与临床研究[J].中国新药杂志,2012,21(18):2097-2099.
[3]Iwazawa J,Ohue S,Yasumasa K,et al.Transarterial chemoembolization with miriplatin-lipiodol emulsion for neuroendocrine metastases of the liver[J].World Journal of Radiology,2010,2(12):468-471.
[4]陈 宏,普绍平,丛艳伟,等.铂类抗肿瘤药物的设计开发进展[J].中国科学,2015,45(7):679-691.
[5]谭文进,方 卫,石 红,等.海绵铂[M].北京:中国标准出版社,2004:34-36.
[6]Committee for medicinal products for human use.Guideline on the Limits of Genotoxic Impurities[M].European Medicines Agency/Committee for Medicinal Products for Human Use,2006:1-8.
[7]Cristaudo A,Sera F,Severino V,et al.Occupational hypersensitivity to metal salts,including platinum,in the secondary industry[J].Allergy,2005,60(2):159-164.
[8]Merget R,Kulzer R,Dierkes-Globisch A,et al.Exposure-effect relationship of platinum salt allergy in a catalyst production plant: conclusions from a 5-year prospective cohort study[J].Journal of Allergy&Clinical Immunology,2000,105(2):364-370.
[9]Gebel T,Lantzsch H,Plessow K,et al.Genotoxicity of platinum and palladium compounds in human and bacterial cells[J].Mutation Research,1997,389(2-3):183-190.
[10]王庆琨,周利民,普绍平,等.铂抗肿瘤药物米铂的合成[J].中国药学杂志,2013,48(18):1594-1595.
[11]王庆琨,普绍平,栾春芳,等.铂类抗肿瘤药物米铂的合成及结构表征[J].中国新药杂志,2011,20(17):1715-1717.
[12]王庆琨,普绍平,朱泽兵,等.抗肿瘤药米铂的合成工艺改进[J].中国药物化学杂志,2012,22(1):36-37.
[13]范振华 .RP-HPLC法测定米铂的含量[J].药学研究,2016,35(1):25-26.
[14]董其松.HPLC测定注射用米铂的含量[J].食品与药品,2016,18(2):120-122.
[15]Committee for medicinal products for human use.Guideline on the specification limits for residues of metal catalysts or metal reagents[M].London:European Medicines Agency,2008:1-34.
[16]蔡 红,浩云涛,薛 军,等.中国药典-药品质量标准分析方法验证指导原则[M].北京:中国医药科技出版社,2015:374-377.
Determination of Trace Metal Impurities in Anti-Cancer Drug of Miriplatin by ICP-AES and Its Safety
Peng Juan1,2,Pu Shaoping1,Hu Jin2,Qiu Xueweng1,Luan Chunfang1,Miao Xianghong1,Liao Yunxing1
(1.Guiyan Phamaceuitical Co.,Ltd.,Kunming,Yunnan,China 650106; 2.Kunming University of Science and Technology,Kunming,Yunnan,China 650093)
Objective To establish an ICP-AES method for the determination of the anticancer drug of miriplatin to evaluate the effect of the metal residue on the human body.M ethods The samples were ignited in 600℃ and then dissolved with HCl-HNO3.Trace impurities in the anticancer drug of Miriplatin were determined by ICP-AES.Results The analytical method of miriplatin was validated.The linearcorrelation coefficient(r) was0.999 1-1.000 0,the precision was1.1% -5.3% and the accuracy was 85.22% -109.60%,which conforms to the requirements of Chinese Pharmacopoeia.By the determination of the metal residues in the samples,the calculated actual daily exposure and concentration of the metal Pd,Rh,Ir,Ru,Ni,Cr,Cu,Mn,Fe and Zn were much less than the permitted daily exposures(PDE).Conclusion The ICP-AES method is simple,rapid and accurate.The metal residues can de adequately removed from the active pharmaceutical ingredients.The micro metal residues will not affect human health and lead to the safety hazard.
ICP-AES;miriplatin;trace metal impurities;amount of residue;daily exposures
R927.11;R979.1
A
1006-4931(2017)13-0009-05
2017-01-15;
2017-02-24)
10.3969/j.issn.1006-4931.2017.13.003
云南省科技型中小企业技术创新资金项目[2014SC016];云南省昆明市科技计划项目[2012-03-01-B-H-04-0006]。
彭娟,女,硕士研究生,高级工程师,研究方向为铂抗癌药物的制备和分析方法,(电话)0871-68328096(电子信箱)ynpengjuan@163.com。
普绍平,男,彝族,博士研究生,高级工程师,研究方向为铂抗癌药物的制备,(电话)0871-68328147(电子信箱)pushaoping@163.com。
