硫素营养水平对产油尖状栅藻光合生理及生化组成的影响
2017-08-16王倩雅李爱芬张成武
王倩雅 张 莹 李爱芬 张成武
(暨南大学水生生物研究中心, 广州 510632)
硫素营养水平对产油尖状栅藻光合生理及生化组成的影响
王倩雅 张 莹 李爱芬 张成武
(暨南大学水生生物研究中心, 广州 510632)
以产油尖状栅藻(Scenedesmus acuminatus)为实验材料, 在持续300 μmol photons/(m2·s)光照条件下, 选用3种不同初始Na2SO4浓度(2.0S、1.0S对照、0.25S)的改良BG-11培养基, 在Φ3.0 cm×60 cm光生物反应器中进行通气培养, 研究分析硫素营养水平与尖状栅藻产油过程光合生理和生化组成的关系。实验结果表明, 初始硫素浓度对尖状栅藻生长有显著的影响(P<0.05), Na2SO4初始浓度为2.0S实验组的生物量最高, 为7.47 g/L, 显著高于1.0S组(6.43 g/L)和0.25S组(4.17 g/L)(P<0.05), 说明加富硫素营养可促进藻细胞的生长。尖状栅藻细胞的叶绿素a、b以及总类胡萝卜素含量变化均与培养基中初始硫素营养水平呈正相关。在培养初期低硫营养有利于藻细胞快速积累碳水化合物, 0.25S实验组碳水化合物含量最高, 占干重的44.37%, 比1.0S和2.0S组分别高出14.43%和13.78%, 培养后期总碳水化合物和蛋白含量均发生不同程度的降低, 转向大量累积油脂, 0.25S实验组的总脂含量最高, 达55.15% DW, 显著高于1.0S和2.0S组(P<0.05)。藻细胞的光合放氧速率、PSⅡ最大光能转化效率(Fv/Fm)、实际光能转换效率(Yield)以及相对电子传递效率(ETR)均与培养液的初始硫素浓度呈正相关, 在整个培养周期中呈先上升后下降的趋势。77 K低温荧光显示, 尖状栅藻在培养初期2个光系统之间存在光能调配现象。上述结果说明, 尖状栅藻细胞的生长、油脂积累和光合生理状况与硫素营养水平直接相关。
尖状栅藻; 硫素营养; 油脂积累; 光合生理参数
微藻作为水生生态系统中的重要生产者, 分布广泛, 种类繁多, 在食品、能源、环境等方面具有广泛应用意义[1]。现阶段产油微藻积累油脂制备生物柴油, 已成为开发新型清洁可替代化石能源的研究热点。如何提高藻细胞单位油脂的产量, 已成为利用微藻规模化生产生物燃料及高附加值产品的重要前提。
微藻油脂的积累与光合作用密切相关, 光合过程中产生的NAD(P)H和固定的CO2是油脂合成的重要基础[2]。硫素是微藻生长过程中不可或缺的重要元素, 广泛存在于生物体的蛋白质、油脂、碳水化合物等一些代谢产物中[3], 介导叶绿素、谷胱甘肽、辅酶等合成[4], 同时作为含硫蛋白和类囊体膜上硫代异鼠李糖甘油二酯(SQDG)的重要组成元素[5,6], 对维持稳定的光合膜结构, 参与调控光合产能代谢途径有重要的影响。
硫限制或缺乏对微藻生长代谢的影响主要体现在, 细胞生长速率减缓, 含硫氨基酸和蛋白含量降低; 叶绿素含量减少, 类囊体膜结构发生变化, 光合作用能力减弱; 细胞内代谢途径重新调整, 能量更多流向易于储存的油脂进行累积等方面[7,8]。费小雯等[9]报道Heynigia riparia CE14-2在硫素缺乏下细胞生长受阻, 各组分中蛋白、糖和叶绿素等含量均发生不同程度的降低, 胞内油脂出现累积, 光合效率受到影响。Koichi等[10]提出莱茵衣藻(Chlamydomonas reinhardtii)硫素缺乏早期阶段, 光合膜脂SQDG含量减少, 类囊体膜结构发生改变, 导致光系统功能和结构发生变化。Giordano等[11]也证实, 在硫限制条件下杜氏盐藻(Dunaliella salina)光合效率的降低与Rubisco酶蛋白和叶绿素a/b结合蛋白大幅下降相关, 且胞内的碳、氮、硫等代谢途径出现重新调整。Mizuno等[12]研究发现小球藻属(Chlorellaceae spp.)在硫缺乏早期阶段大量累积的淀粉颗粒随后期油滴的变大逐渐减少, 碳和能量转为以油脂的形式进行储存。Takeshita等[13]也提出小球藻(Chlorella viscosa)与普通小球藻(Chlorella vulgaris)在硫缺乏下不仅促进胞内油脂积累, 而且还促进了碳链长度超过C20脂肪酸累积比例的增长。由此可知, 微藻的硫素营养水平影响着细胞油脂积累和生理状态, 从硫素不同营养水平研究微藻的生长、生化组分动态变化和细胞光合生理状态,对于全面了解微藻光合产油代谢具有理论意义。
尖状栅藻(S.acuminatus)是近期分离纯化出的一株淡水产油绿藻, 生长速度快, 油脂累积率高, 能有效的去除废水中氮、磷等营养元素, 具有高度研究价值[14]。本文以尖状栅藻(S.acuminatus)为研究材料, 分别探讨硫加富和硫限制下藻细胞的生长,油脂的累积, 蛋白质、碳水化合物和色素等组份的含量及其变化规律, 以叶绿素荧光参数指示光系统的生理状态, 旨在了解硫素营养对微藻光合生理和代谢的影响, 为进一步探究微藻油脂积累的光合营养生理机制提供基础。
1 材料与方法
1.1 实验材料
尖状栅藻(S.acuminatus)采自暨南大学南湖,由暨南大学水生生物研究中心微藻生物技术与生物能源实验室保藏。
以改良BG-11为基础, 将培养基中MgSO4、ZnSO4和CuSO4分别由MgCl2、ZnCl2和CuCl2代替。实验设置2.0S、1.0S、0.25S(将原改良BG-11含硫量(换算成Na2SO4为43.4 mg)设为对照组, 定为1.0S), 用Na2SO4调节硫素浓度, 1 L无硫BG-11培养基中分别添加86.8、43.4、10.85 mg的Na2SO4(即为2.0S、1.0S、0.25S)。将藻细胞培养至对数生长中期, 3000 r/min低速离心5min。初始接种密度OD750为0.6, 采用Φ3.0 cm×60 cm的柱状光生物反应器培养, 每组设置3个平行, 培养温度为(25±1)℃,光照强度约为300 μmol photons/(m2·s), 通入含1% CO2的压缩空气, 培养周期为18d。
1.2 实验方法
生物量和细胞密度的测定每天取5 mL藻液用预烘干至恒重的0.45 μm微孔滤膜抽滤, 置于105℃烘箱烘至恒重后称重, 计算单位体积藻液的干重(Dry weight, DW)。定时取藻液样品, 利用血球计数板进行细胞密度的测定。
总脂含量的测定及产率的计算总脂测定方法改良自Khozin等[15], 取100 mg冻干藻粉加入2 mL10%二甲基亚砜-甲醇(v鲶v=1鲶9)溶液, 50℃水浴、冰浴分别抽提1.5h后, 离心收集上清液于干燥洁净的玻璃小瓶中, 藻渣加入4 mL乙醚-正己烷溶液 (v鲶v=1鲶1), 再冰浴抽提1.5h, 同样离心收集上清液至上述玻璃小瓶中, 重复上述步骤直至藻渣变白。收集所有抽提液, 加入4 mL蒸馏水静置分相,移取有机相至另一小玻璃瓶, 氮气吹干浓缩, 用乙醚洗涤并转移至预先称重的2 mL塑料离心管(管重记为M1)中, 用氮气吹干至恒重(记为M2)。
总脂含量(冻干藻粉的百分比)=(M2–M1)·100%/冻干藻粉的重量。
单位体积总脂产率[g/(L·d)]=生物量(g/L)×总脂含量(%)/培养天数(d)
总碳水化合物含量的测定参照Dubios等[16]的硫酸-苯酚法, 取10 mg干燥脱脂藻渣, 加入5 mL 0.5 mol/L H2SO4, 于100℃恒温水浴4h。3000 r/min离心5min, 将上清移至50 mL的容量瓶中, 用去离子水洗涤沉淀并离心转移上清液至容量瓶(重复两次), 定容至50 mL。取1 mL提取液, 补水至2 mL, 迅速加入6%苯酚及浓H2SO4摇匀, 冷却后于490 nm下测定吸光值。以葡萄糖为标准物制作标准曲线, 利用标准方程计算总碳水化合物含量。
可溶性蛋白含量的测定用0.5 mol/L NaOH于80℃反复抽提脱脂藻渣, 直至抽提完全。提取液采用lowry法蛋白含量测定试剂盒(上海荔达生物科技有限公司)进行测定。
色素含量的测定每隔24h取藻液1 mL, 3000 r/min低速离心5min后弃上清, 加入10 mL的甲醇, 置于恒温水浴(70℃)避光提取至沉淀变为灰白色, 相同条件离心后保留上清, 采用紫外可见光分光光度计测量其在波长470 nm (A470)、652 nm (A652)、665 nm (A665)、750 nm (A750)的吸光度, 叶绿素及类胡萝卜素(mg/L)含量计算公式参考文献[17]如下:
Chlorophyll a=16.72×(A665–A750)–9.16× (A652–A750)
Chlorophyll b=34.09×(A652–A750)– 15.28×(A665–A750)
Carotenoids=(1000×A470–1.63×Chl.a–104.96× Chl.b)/221
光合放氧速率和暗呼吸速率的测定采用Clark型液相氧电极(Hansatech Oxygraph, 英国)测定单位时间内微藻溶液中溶氧量的变化。取适量新鲜藻液用100 mmol/L的碳酸氢钠(NaHCO3)溶液调至其OD750为0.5, 暗处理30min, 分成2份分别用于干重测定和放氧速率测定。测量之前, 首先对氧电极的饱和氧曲线和零氧曲线的进行校准, 然后对其灵敏度进行标定。测定时, 以LED光源300 μmol photons/(m2·s)的光强照射微藻, 进行光合反应, 测定10min内氧气平均释放速率, 即为光合放氧速率[μmol O2/(mg·DW·min)]; 关闭光源, 暗反应10min,测定藻液中氧气消耗平均速率, 即为暗呼吸速率[μmol O2/(mg·DW·min)]。
叶绿素荧光参数和低温荧光光谱测定参考梁英等[18]测定方法并对其进行改进, 测定仪器为XE-PAM脉冲调制式叶绿素荧光仪(Walz, 德国)。将样品调为同一吸光度(A750=0.5)并暗处理30min,加入四面透光比色皿置于荧光仪中, 打开测量光[光合有效辐射约为8 μmol photons/(m2·s)], 对初始荧光F0进行测量。然后打开光化光[光合有效辐射为368 μmol photons/(m2·s)], 照射5min, 再打开饱和脉冲光激发, 测定藻细胞不同生长时期光系统Ⅱ(PSⅡ)的Yield、ETR、Fv/Fm等光合参数。
采用日立F-4500型荧光分光光度计测定藻细胞在77 K的荧光发射光谱, 激发波长为436 nm, 扫描范围为640—750 nm, 扫描速度为240 nm/min, 狭缝宽度为2 nm。
数据处理采用Origin 8.6对数据进行分析处理, 并用SPSS 13.0软件进行单因素方差分析及相关性分析, P<0.05表示差异显著。
2 结果
2.1 不同硫浓度下尖状栅藻的生长
由图 1可知, 尖状栅藻在培养初期阶段经历一个短暂的延滞期后进入指数期生长, 生物量从培养第3天开始随Na2SO4初始浓度的不同而呈现差异。2.0S实验组的生物量在培养前9天内迅速增加, 随后缓慢进入平台期, 至培养第18天, 生物量达到最大, 为7.47 g/L。显著高于对照组(1.0S组) (P<0.05)。这说明加富硫素营养促进微藻生长, 有利藻细胞的生物量累积。0.25S实验组在培养前3天细胞快速生长, 生长速度在第1至第2天略高于1.0S组, 但差异不显著。随着培养基中硫素被消耗殆尽, 0.25S组藻细胞生长从培养第3天开始受到严重限制, 生物量增加减缓, 至培养第18天, 生物量始终显著低于对照组(1.0S组)(P<0.05), 为4.17 g/L, 且细胞密度也显著低于对照组(P<0.05)。这说明在硫限制条件下尖状栅藻的生长在培养初期受抑制, 藻细胞积累生物量的能力减弱。
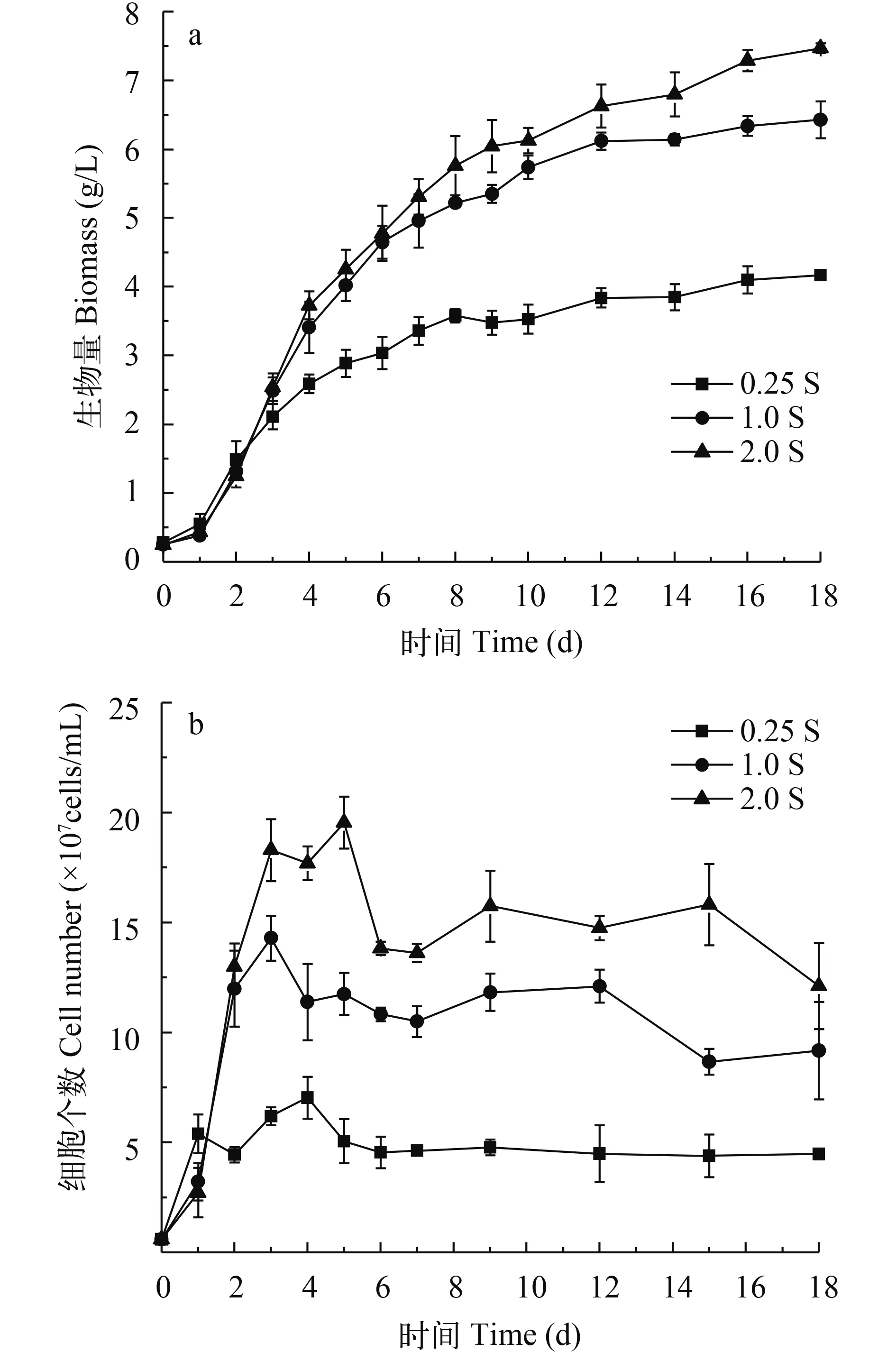
图 1 不同初始硫浓度下尖状栅藻生物量(a)和细胞密度的变化(b)Fig.1 Changes of biomass and cell density of S.acuminatus at different initial Na2SO4concentrations during cultivation
2.2 不同硫浓度下光合色素含量的变化
如图 2所示, 尖状栅藻在不同Na2SO4浓度下的色素含量变化均呈现先显著上升后缓慢下降的趋势, 其含量与初始Na2SO4浓度的大小呈正相关, 初始Na2SO4浓度越高, 色素合成增长越快。在培养前4天, 色素含量迅速增加, 其中2.0S实验组(富硫组)显著高于其他2个实验组(P<0.05)。这说明加富硫素营养有利于尖状栅藻在初期阶段快速合成大量的光合色素, 提高藻细胞捕获光能的效率。在低硫条件下尖状栅藻色素的合成受到显著抑制, 整个培养周期中, 0.25S实验组色素含量始终显著低于对照组(1.0S组)和富硫组(2.0S实验组)(P<0.05), 至培养第18天, 0.25S实验组的叶绿素a、b以及类胡萝卜素的含量分别仅占富硫组的7.92%、8.13%、15.25%。
2.3 不同硫浓度下主要生化组份的变化
在培养初期, 胞内总脂含量较低, 仅占干重的15.95%, 而可溶性蛋白和碳水化合物含量分别占干重38.21%和24.98%。在整个培养周期内, 3个浓度组的藻细胞物质组份总额稳定维持在78%—82% DW, 且均表现为油脂累积持续增加, 碳水化合物和可溶性蛋白含量减少的趋势(图 3)。
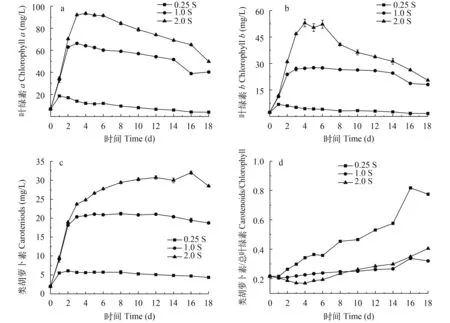
图 2 不同初始硫浓度下尖状栅藻色素含量的变化Fig.2 Changes of pigment content of S.acuminatus at different initial Na2SO4concentrations during cultivation a.Chlorophyll a; b.Chlorophyll b; c.Carotenoids; d.Carotenoids/Chlorophyll
由图 3a、图 3d可知, 0.25S、1.0S、2.0S实验组的总脂含量在整个培养周期内均随时相的推移不断升高。0—3d油脂增长缓慢, 图 3a中2.0S实验组和对照组(1.0S组)在第3天出现略微的下降, 但很快又恢复增长。培养在3—9d总脂含量增长迅速,各浓度组在第9天单位体积油脂产率达到最大, 分别为0.1799、0.2419、0.2025 g/(L·d), 随后出现降低, 导致9—18d总脂含量增长变缓, 至培养第18天,油脂累积量均达到最大, 其中0.25S实验组的油脂含量均显著高于对照组(1.0S)和2.0S实验组(P< 0.05), 分别占干重的55.15%、42.95%、42.85%, 说明低硫条件有利于微藻油脂的累积。
由图 3b可知, 0.25S、1.0S、2.0S实验组的碳水化合物含量在整个培养周期内均呈现先快速上升后缓慢下降的趋势, 均在培养第3天达到最大, 其中0.25S实验组碳水化合物含量最高, 占干重44.37%,显著高于其他2组(P<0.05), 然对照组和2.0S实验组间差异不显著, 分别占干重32.57%、33.07%。这说明在低硫条件下尖状栅藻在培养初期高效促进碳水化合物合成。由图 3c可知, 可溶性蛋白含量的变化在培养周期内随初始Na2SO4浓度的减少呈现梯度降低的趋势。0.25S在培养第3天急剧降低了26.63% DW, 至培养周期结束降至5.57% DW, 显著低于对照组(P<0.05)。这说明在低硫素条件下, 尖状栅藻在培养初期蛋白合成严重受限, 藻细胞通过分解蛋白质中一些含硫多肽或氨基酸来维持生长,所以蛋白含量显著降低。
2.4 不同硫浓度下藻细胞光合参数的变化
从图 4a、b中可以看出, 随培养时间的延长3个实验组的光合速率均呈现先上升后下降的趋势。各浓度组在培养第1天均出现急剧升高的现象,其中以2.0S组的光合速率最大, 为111.48 μmol O2/ (mg DW·min), 分别高出对照组和低硫组(0.25S) 16.06和82.34 μmol O2/(mg DW·min)。在培养的2—10d内迅速降至最低, 对照组和低硫组(0.25S)的光合速率趋近于零, 而2.0S组以一个较低的速率维持正常的光合作用, 在培养周期内, 低硫组(0.25S)和对照组的光合速率始终低于2.0S实验组。暗呼吸速率变化趋势与光合速率变化相似, 前期迅速升高, 在培养第1天达到最大, 随后降至最低,趋于平缓, 以稳定的暗呼吸速率维持藻细胞生命代谢活动。
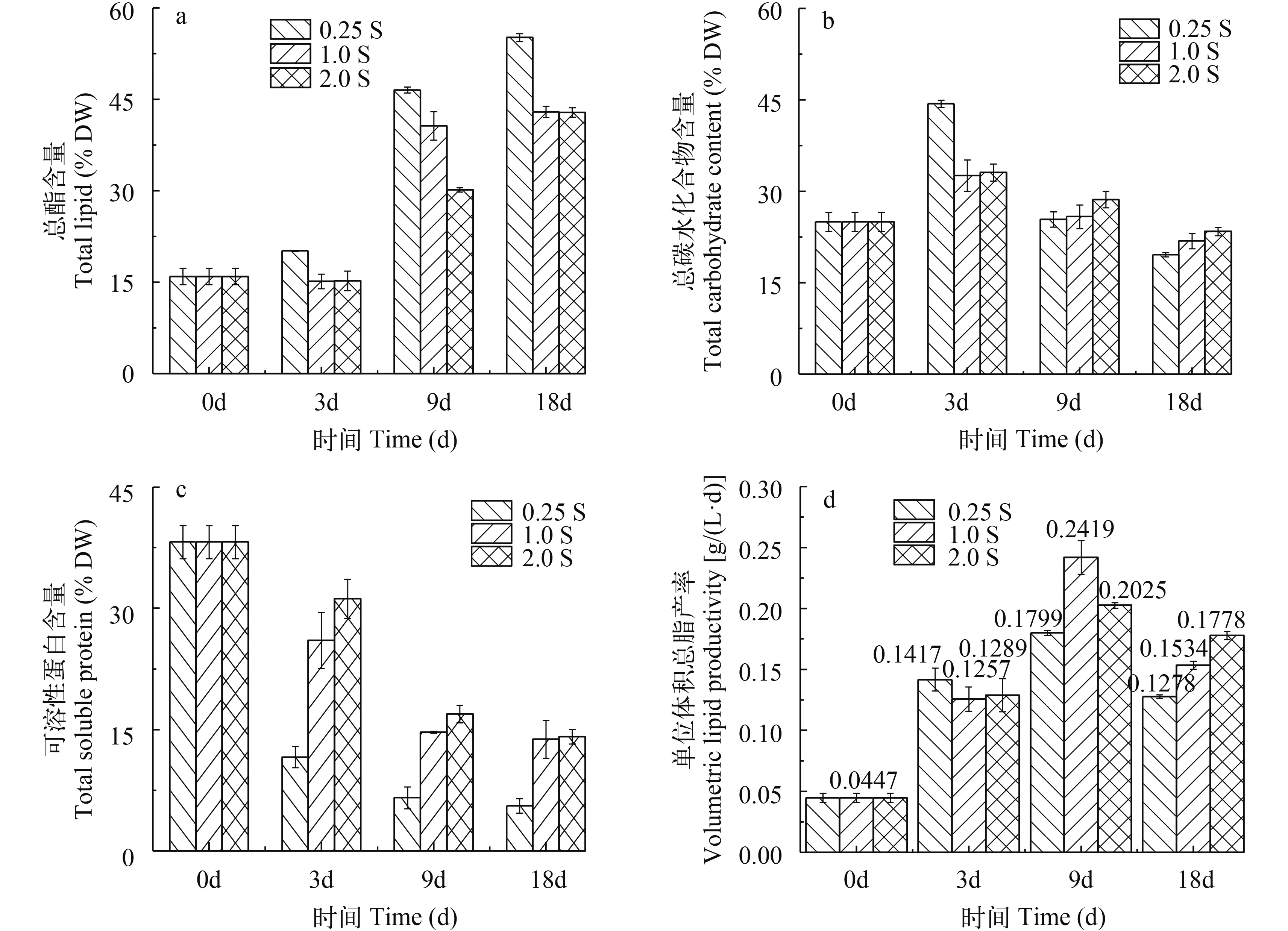
图 3 不同初始硫浓度下尖状栅藻主要生化组分的时相变化及总脂产率Fig.3 Changes of major biochemical components of S.acuminatus during cultivation and lipid productivity at different initial Na2SO4concentrations
叶绿素荧光参数作为衡量细胞光合生理状况的一个标准, 被广泛应用于微藻研究中[19]。从图4c可知, 各浓度组藻细胞的最大光能转换效率Fv/Fm在培养第1天升高, 达到最大, 随后均呈现迅速降低的趋势, 在培养的第2至第8天, 不同初始Na2SO4浓度组之间Fv/Fm值差异显著(P<0.05), 2.0S实验组的Fv/Fm值大于对照组和0.25S组(低硫组)。随培养时间的延长, 对照组和2.0S实验组的Fv/Fm持续降低, 而低硫组(0.25S)的值从培养第8天开始上升。Yield表示光系统Ⅱ(PSⅡ)实际量子产量, 它反映PSⅡ反应中心在光照下的实际光能转化效率, 从图 5d可见, 尖状栅藻Yield在不同初始Na2SO4浓度下的变化均呈现先上升后下降、最后趋于稳定。在培养第1天, Yield值迅速上升, 达到最大值后便显著降低, 2.0S组和对照组在培养第6至第8天趋于平稳, 而0.25S组由于培养初期硫素耗尽,其Yield在第3天降至最低后便达到稳定。培养前6d内, 0.25S组的Yield值相对较小。而第6天后, 低硫组的Yield值出现略微升高, 在培养后期逐渐大于对照组和2.0S组。ETR作为PSⅡ反应中心的电子流通量指标, 表示其电子的传递速率, 从图 5e可知, 不同初始Na2SO4浓度下尖状栅藻的电子传递速率ETR的变化趋势与Yield基本一致, 培养初期快速升高, 随后迅速下降, 最后逐渐稳定的趋势。3个硫浓度组尖状栅藻叶绿素荧光参数的时相变化表明, 藻细胞PSⅡ活性随着培养时间的延长逐渐降低, 其原因可能是硫素的不断消耗导致PSⅡ反应中心间接或直接受损。
2.5 不同硫浓度下77 K低温荧光光谱特征变化
尖状栅藻在不同初始Na2SO4浓度下77 K低温荧光发射光谱在685和714 nm处有2个发射峰, 分别来自PSⅡ外周天线和PSⅠ蛋白复合物。从图 5a、b可知, 随着培养时间的延长, 各荧光发射峰的相对高度均发生变化, 其中2.0S实验组和对照组在第3天均出现F714峰值大于F685峰值的现象。培养至第9天, 两组荧光峰值的变化出现分歧, 2.0S实验组持续维持F714高于F685的状态, 而对照组的F685峰值迅速升高, 出现大于F714的现象, 比2.0S组早一步进入F685高于F714的状态。图 5c中0.25S实验组在整个培养周期内F685峰值均大于F714峰值, 相对荧光强度随培养时间延长呈先增后降的趋势, F714处荧光峰最后逐渐消失。

图 4 不同初始硫浓度下尖状栅藻光合参数的动态变化Fig.4 Changes of photosynthetic parameters of S.acuminatus during cultivation at different initial Na2SO4concentrations
图 5d为77K低温荧光发射峰F714与F685比值变化, 更直观反映了尖状栅藻在3个硫浓度下77 K荧光发射光谱峰随着时间推移的变化情况。2.0S组和对照组的F714/F685变化在培养周期内呈现先升后降的趋势, 在培养第3天达到最大值, 与初始状态相比, 分别升高了1.241、0.384, 随后出现降低, 2.0S组一直维持较高的F714/F685状态。而0.25S组F714/F685变化呈持续下降, 在第6天降至最低后保持平稳。
3 讨论
硫素作为光合生物生长发育过程中继氮、磷、钾后第四位必需的中量营养元素, 其营养水平直接影响光合生物的生长状态和油脂产量, 对于低等的单细胞藻类, 生长代谢过程受硫素营养的影响更为显著。然目前以氮素或磷素等作为营养限制因子进行微藻产油机制研究的报道较多[20—22]。本实验通过设置3个不同初始Na2SO4浓度来研究尖状栅藻的产油生长代谢, 结果显示, 藻细胞在2.0S实验组下生物量累积高, 生长速度快, 细胞密度显著高于对照组和0.25S实验组(P<0.05), 说明加富的硫素营养促进尖状栅藻细胞的快速生长和繁殖。而低硫组(0.25S组)在培养1—2d内出现生物量与细胞分裂速度略高于对照组和2.0S实验组的现象, 可能是尖状栅藻在培养初期便进入硫素胁迫状态, 为应对硫素营养供应不足, 藻细胞产生了一个高效吸收利用SO的应激反应[23], 导致短期内细胞迅速生长。
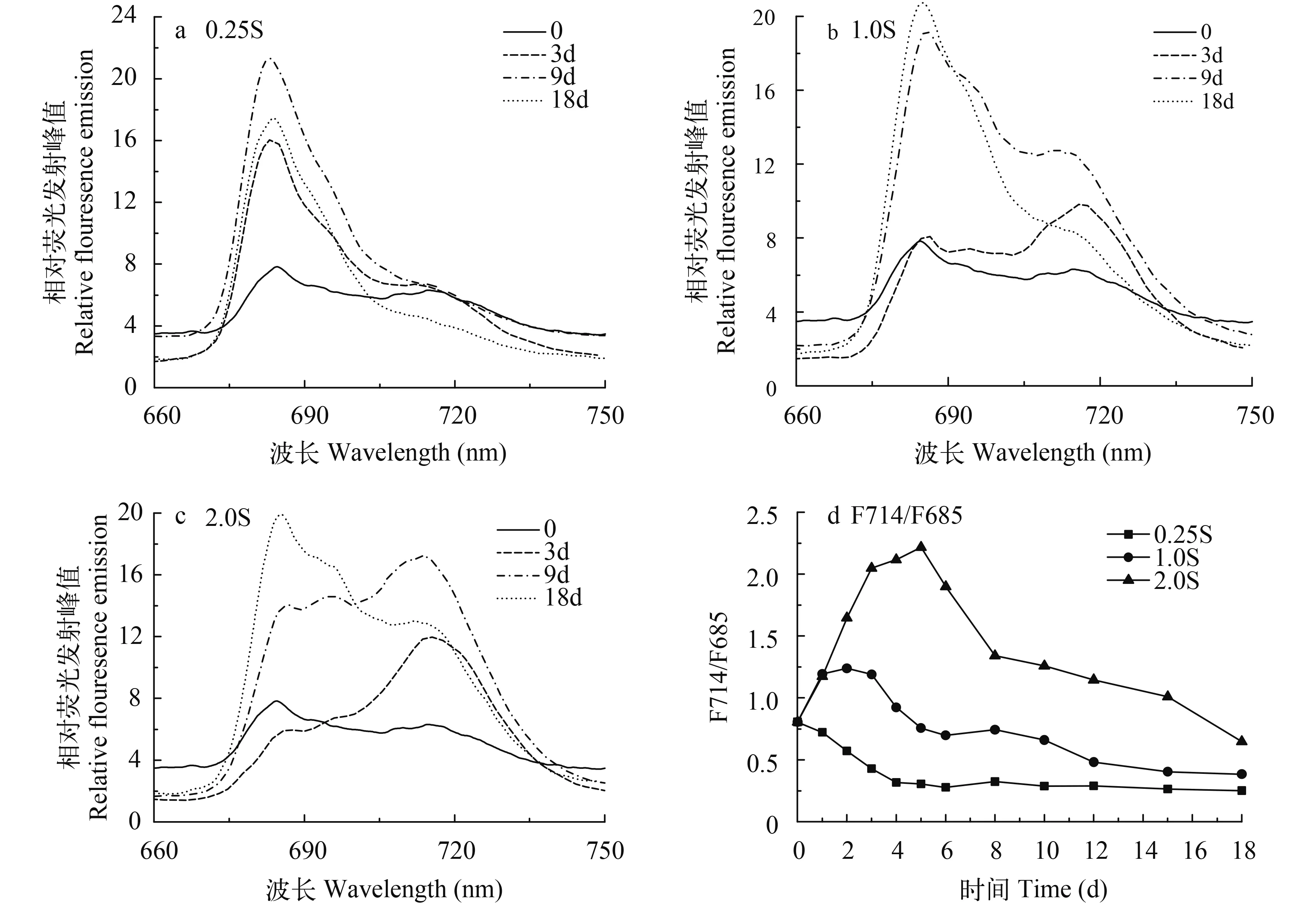
图 5 不同初始Na2SO4浓度下尖状栅藻77 K低温荧光发射光谱和F714与F685比值变化Fig.5 Changes of flouresecence emission spectra and the ratio of F714 to F685 at 77 K of S.Acuminatus during cultivation at different initial Na2SO4concentrations
微藻在营养盐缺乏、高光强等环境胁迫下, 通过改变藻细胞物质组成成分, 来调整自身代谢途径维持正常生命活动, 主要表现为蛋白质和碳水化合物含量降低, 油脂大量积累[24,25], 这与本研究结果一致。3个浓度组尖状栅藻的碳水化合物含量随光合速率升高不断增加, 在培养前3天达到最大, 后期随硫素大量消耗, 藻细胞光合放氧速率和Fv/Fm降低, 碳水化合物合成开始减少。而可溶性蛋白含量在整个培养周期内呈持续降低趋势, 竞争的碳源和能量由最初流向碳水化合物转向油脂合成, 且随油脂含量的大量增加显著降低, 其中低硫水平(0.25S实验组)下降最为显著(图 3)。这与微芒藻(Micractinium pusillum)Y-002在缺硫条件下出现蛋白含量大量减少的报道一致[24], 藻细胞可能通过降解一些非必需蛋白来获取硫素维持生存。低硫组(0.25S)在培养前3天获得最大碳水化合物的累积量的原因: 一方面尖状栅藻细胞核和细胞分裂受抑制, 细胞分裂次数减少, 用于合成细胞分裂间期阶段的RNA、蛋白质等生物大分和DNA复制的能量与碳源, 转向淀粉的合成[26,27]; 另一方面缺硫后分裂的子细胞生物大分子合成虽受阻, 但仍能以正常细胞的光合效率进行光合作用合成大量淀粉, 导致碳水化合物含量迅速增加[8]。而2.0S实验组与対照组在培养初期由于硫素充足, 细胞生长和分裂旺盛,导致蛋白的合成和碳水化合物大量竞争碳源。油脂作为应对营养胁迫和环境压力的一种长期储能方式[28,29], 累积含量在整个培养周期内呈现持续增长, 其中0.25S实验组下尖状栅藻油脂累积量最高,占干重的55.15%, 说明硫素营养限制或缺乏有利于藻细胞油脂积累。这与辜博等[24]报道一致。然就第18天单位体积油脂产率而言, 0.25S实验组显著低于对照组和2.0S实验组(P<0.05), 表明低硫条件虽有利于尖状栅藻油脂积累, 但最终不利于藻细胞生长。
微藻为应对高光、营养胁迫环境, 除通过改变胞内物质组分外, 还产生了内部调整光能吸收机制[30,31], 来保护光合器官。主要体现在: (1)降低叶绿素a和b的含量, 减少光系统对光能的过度捕获而造成的光破坏, 同时提高类胡萝卜素的合成, 减弱胞内氧化活性因子对藻细胞的损伤[32]; (2)均衡调配光能和能量耗散的比例[33,34]。F714/F685的变化与PSⅡ主要外周天线LHCⅡ与PSⅡ核心复合物解离程度相关, 2.0S组和对照组在培养初期F714/F685升高可能是藻细胞为保护PSⅡ避免被高光照射损伤一种短期调控方式, 通过部分LHCⅡ的可逆解离来重新分配激发能, 调节PSⅠ和PSⅡ能量耗散的比例, 维持正常的光合作用。0.25S实验组F714与F685比值持续走低, 表明尖状栅藻在培养初期PSⅡ活性受硫素胁迫和高光的影响, 藻细胞吸收、传递光能的能力减弱, 能量在PSⅡ处以荧光形式大量耗散。叶绿素荧光参数作为光合生物光系统生理状态的重要指证, 反应细胞对光能捕获的能力与效率。尖状栅藻在不同初始Na2SO4浓度下的Fv/Fm、ETR、Yield值的变化均呈先升后降的趋势。研究报道, 在硫素限制下, 蛋白含量骤减, 参与和介导D1蛋白合成周转的含硫氨基酸出现供应不足[35—38], 导致光系统Ⅱ(PSⅡ)反应中心受损, PSⅡ活性降低。Westerman等[39]发现PSⅡ在硫和镁同时缺乏下严重损伤, 最大量子产率(Fv/Fm)和D1蛋白含量出现显著降低。在氮、磷和硫素严重供应不足下同样会导致光合生物PSⅡ实际量子产量(Yield)与最大量子产率(Fv/Fm)显著降低, QA还原状态升高[40]。同时光合电子的传递会因铁-硫蛋白和铁氧还蛋白(Fd)合成减少而受到影响, 电子传递效率ETR降低[5]。但在培养后期, 低硫组(0.25S)叶绿素荧光参数出现略微升高, 可能是衰亡细胞为后续生长的尖状栅藻提供硫源, 促进生长, 亦有可能藻细胞启动其他能量代补偿途径提高光合代谢, 促进电子传递, 促进胞内油脂持续累积。同时, 硫素营养与氮素同化相互影响, 微藻在不同硫素水平条件下其细胞内部营养代谢是如何调控?是否驱动能量代补偿途径等问题尚需进一步研究。
[1]Yang X.Characterization of oil-producing profiles of tropical microalgae and rearch on the affecting factors of lipid accumulation [D].A thesis Submitted to Hainan University in Partial Fulfillment of the Requirement For the Master Degree in Biochemical Engineering, 2013 [杨勋.热带微藻产油性能的评价及油脂积累影响因素研究.海南大学, 硕士毕业论文, 2013]
[2]James B, Joseph E V.Plant Biochemistry (3rd edition) [M].Elsevier, 2012, 428—447
[3]Davidian J C, Kopriva S.Regulation of sulfate uptake and assimilation-the same or not the same [J]? Molecular Plant, 2010, 3(2): 314—325
[4]Li G Q, Zhu Y J, Shen X S.Plant sulphur assimilation pathways and its regulation [J].Plant Physiology Communications, 2005, 41(6): 699—704 [李国强, 朱云集, 沈学善.植物硫素同化途径及其调控.植物生理学通讯, 2005, 41(6): 699—704]
[5]Xu D Q.Photosyntheology (1st edition) [M].Beijing: Science Press.2013, 262—308 [许大全.光合作用学(第一版).北京: 科学出版社.2013, 262—308]
[6]Sato N.Roles of the acidic lipids sulfoquinovosyl diacylglycerol and phosphatidylglycerol in photosynthesis: their specificity and evolution [J].Journal of Plant Research, 2004, 117(6): 495—505
[7]Zhang Z, Shrager J, Jain M, et al.Insights into the survival of Chlamydomonas reinhardtii during sulfur starvation based on microarray analysis of gene expression [J].Eukaryotic Cell, 2004, 3(5): 1331—1348
[8]Šetlík I, Ballin G, Doucha J, et al.Macromolecular syntheses and the course of cell cycle events in the alga Scenedesmus quadricauda under nutrient starvation: Effect of sulphur starvation [J].Biologia Plantarum, 1988, 30(3): 161—169
[9]Fei X W, Cai J J, Deng X D.Effects of Nutrient Elements Deficiency on Lipid Accumulation of Heynigia riparia CE14-2 [J].Journal of Anhui Agricultural Sciences, 2012, 40(34): 16521—16524 [费小雯, 蔡佳佳, 邓晓东.营养限制对Heynigia riparia CEl4-2油脂积累的影响.安徽农业科学, 2012, 40(34): 16521—16524]
[10]Sugimoto K, Midorikawa T, Tsuzuki M, et al.Upregulation of PG synthesis on sulfur-starvation for PS I in Chlamydomonas [J].Biochemical and Biophysical Research Communication, 2008, 369(2): 660—665
[11]Giordano M, Pezzoni V, Hell R.Strategies for the allocation of resources under sulfur limitation in the green alga Dunaliella salin [J].Plant Physiology, 2000, 124(2): 857—864
[12]Mizuno Y, Sato A, Watanabe K, et al.Sequential accumulation of starch and lipid induced by sulfur deficiency in Chlorella and Parachlorella species [J].Bioresource Technology, 2013, 129(2): 150—155
[13]Takeshita T, Ota S, Yamazaki T, et al.Starch and lipid accumulation in eight strains of six Chlorella species under comparatively high light intensity and aeration culture conditions [J].Bioresource Technology, 2014, 158(2): 127—134
[14]Gao B Y, Shen D D, He S S, et al.Integrated the biomass production of oleaginous microalga Scenedesmus acuminatus and dairy wastewater treatment [J].Renewable Energy Resources, 2014, 32(5): 673—679 [高保燕,沈丹丹, 何思思, 等.富油微藻——尖状栅藻生物质生产与奶牛场废水处理相结合的效果研究.可再生能源, 2014, 32(5): 673—679]
[15]Khozin G I, Shrestha P, Cohen Z, et al.Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga Parietochloris incise [J].Biochimica ET Biophysica Acta, 2005, 1738(1): 63—71
[16]Dubois M, Gilles K A, Hamilton J K, et al.Colorimetric method for determination of sugars and related substance [J].Analytical Chemistry, 1956, 28(3): 350—356
[17]Jensen A.Chlorophylls and Carotenoids [M].Handbook of phycological methods.Cambridge: Cambridge University Press.1978, 50—78
[18]Liang Y, Feng L X, Tian C Y, et al.Effects of High Temperature Stress on Chlorophyll Fluorescence Kinetics of Dunaliella salina and Pyramimonas sp.[J].Journal of Fishery Sciences of China, 2007, 14(6): 961—968 [梁英,冯力霞, 田传远, 等.高温胁迫对盐藻和塔胞藻叶绿素荧光动力学的影响.中国水产科学, 2007, 14(6): 961—968]
[19]Kühl M, Glud R N, Borum J, et al.Photosynthetic performance of surface-associated algae below sea ice as measured with a pulse amplitude-modulated (PAM) fluorometer and O2microsensors [J].Marine Ecology Progress Series, 2001, 223: 1—14
[20]Breuer G, Lamers P P, Martens D E, et al.The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains [J].Bioresource Technology, 2012, 124: 217—226
[21]Rodolfi L, Chini Z G, Bassi N, et al.Microalgae for oil: Strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J].Biotechnology and Bioengineering, 2009, 102(1): 100—112
[22]Yao C H, Ai J N, Cao X P, et al.Characterization of cell growth and starch production in the marine green microalga Tetraselmis subcordiformis under extracellular phosphorus-deprived and sequentially phosphorus-replete conditions [J].Applied Microbiology and Biotechnology, 2013, 97(13): 6099—6110
[23]Yildiz F H, Davies J P, Grossman A R.Characterization of sulfate transport in Chlamydomonas reinhardtii during sulfur-limited and sulfur-sufficient growth [J].Plant Physiology, 1994, 104(3): 981—987
[24]Gu B, Fei X W, Hu X W, et al.The Effect of the Restriction of Nutrient Elements to Lipid Accumulation in Micractinium pusillum Y-002 [J].Chinese Journal of Tropical Crops, 2011, 32(5): 789—795 [辜博, 费小雯, 胡新文, 等.营养元素限制对微芒藻Y-002油脂积累的影响.热带作物学报, 2011, 32(5): 789—795]
[25]Khotimchenko S V, Yakovleva I M.Lipid composition of the red alga Tichocarpus crinitus exposed to different levels of photon irradiance [J].Phytochemistry, 2005, 66(1): 73—79
[26]Vitova M, Bisova K, Kawano S, et al.Accumulation of energy reserves in algae: from cell cycles to biotechnological applications [J].Biotechnology Advances, 2015, 33(6): 1204—1218
[27]Hase E, Mihara S, Tamiya H.Role of sulfur in the cell division of Chlorella, with special reference to the sulfur compounds appearing during the process of cell divisionⅡ [J].Plant and Cell Physiology, 1961, 2(1): 9—24
[28]Han F.The mechanisim of microalgae lipid accumulation induced by high-temperature stress and ultrasonic stimulation [D].A Dissertation Submitted to Shandong University in Partial fulfillment of the requirement for the degree of Doctor, 2016 [韩飞.高温胁迫与超声刺激促进微藻油脂积累的过程及机理.山东大学, 2016]
[29]Siaut M, Cuiné S, Cagnon C, et al.Oil accumulation in the model green alga Chlamydomonas reinhardtii: characterization, variability between common laboratory strains and relationship with starch reserves [J].BMC Biotechnology, 2011, 11(1): 7
[30]Croce R, Van A H.Natural strategies for photosynthetic light harvesting [J].Nature Chemical Biology, 2014, 10(7): 492—501
[31]Zhang M.Effects of several ecological factors on the growth, photosynthesis and chloroPhyll fluorescenee of some algae from wujiang river [D].A Thesis Submitted to Southwest University in Partial fulfillment of the requirement for the degree of Master, 2007 [张曼.不同生长条件对乌江适生藻类生长, 光合作用和叶绿素荧光特性的影响.西南大学, 硕士学位论文, 2007]
[32]Liu J H, Xiang W Z, Chen T, et al.Effect of sulphur on the growth and production of astaxanthin by Chlorella zofingiensis in heterotrophic culture [J].Journal of Tropical Oceanography, 2011, 30(1): 101—106 [刘纪化, 向文洲, 陈涛, 等.硫元素对小球藻异养生产虾青素的影响.热带海洋学报, 2011, 30(1): 101—106]
[33]Chen Y, Xu D Q.Two patterns of leaf photosynthetic response to irradiance transition from saturating to limiting one in some plant species [J].New Phytologist, 2006, 169(4): 789—798
[34]Pascal A A, Liu Z, Broess K, et al.Molecular basis of photoprotection and control of photosynthetic light-harvesting [J].Nature, 2005, 436(7047): 134—137
[35]Kim J, Mayfield S P.Protein disulfide isomerase as a regulator of chloroplast translational activation [J].Science, 1997, 278(5345): 1954—1957
[36]He M L.Screening of H2 producing microalgae and physiologial studies on their high H2photoproductive mechanism [D].A Dissertation Submitted to University of Chinese Academy of Sciences in Partial fulfillment of the requirement for the degree of Doctor, 2013 [何梅琳.高效光合产氢藻株的筛选及其产氢机制研究.中国科学院研究生院(海洋研究所), 博士学位论文, 2013]
[37]Wykoff D D, Davies J P, Melis A, et al.The regulation of photosynthetic electron transport during nutrient depriva-tion in Chlamydomonas reinhardtii [J].Plant Physiology, 1998, 117(1): 129—139
[38]Nixon P J, Michoux F, Yu J, et al.Recent advances in understanding the assembly and repair of photosystem II [J].Annals of Botany, 2010, 106(1): 1—16
[39]Westerman S, Stulen I, Suter M, et al.Atmospheric H2S as sulphur source for Brassica oleracea: consequences for the activity of the enzymes of the assimilatory sulphate reduction pathway [J].Plant Physiology and Biochemistry, 2001, 39(5): 425—432
[40]Jacob J, Lawlor D W.In vivo photosynthetic electron transport does not limit photosynthetic capacity in phosphate-deficient sunflower and maize leaves [J].Plant, Cell & Environment, 1993, 16(7): 785—795
EFFECTS OF SULFUR CONCENTRATION ON THE PHOTOSYNTHETIC PHYSIOLOGY AND BIOCHEMICAL COMPOSITION OF SCENEDESMUS ACUMINATUS
WANG Qian-Ya, ZHANG Ying, LI Ai-Fen and ZHANG Cheng-Wu
(Institute of Hydrobiology, Jinan University, Guangzhou 510632, China)
Scenedesmus acuminatus microalgae are capable of accumulating lipids when exposed to different sulfur concentrations and are therefore considered promising organisms for biodiesel production.Using column photobioreactors, the relevance of different sulfur concentration (2.0S, 1.0S, and 0.25S) on the growth and photosynthetic physiology of the algae was investigated.The initial sulfur concentration had a significant effect on the growth of S.acuminatus (P<0.05).A maximum biomass of 7.47 g/L was obtained in the 2.0S group, which was significantly higher than that of the 1.0S and 0.25S groups (6.43 g/L and 4.17 g/L, respectively; P<0.05), indicating that the addition of sulfur-rich nutrients could promote algae growth.The changes in chlorophyll and band total carotenoid content in S.acuminatus positively correlated with the initial sulfur level in the medium.At the beginning of cultivation, rapid accumulation of carbohydrates occurred under low sulfur conditions; the 0.25S group achieved the highest carbohydrate content accounting for 44.37% of the dry weight, which was 14.43% and 13.78% higher than that of the 1.0S and 2.0S groups, respectively.With a decreased carbohydrate and protein content, lipid content increased significantly in the later stages of cultivation.The 0.25S group acquired the maximum lipid content (55.15% of the dry weight), which was significantly higher than that of the other two groups (P<0.05).Meanwhile, the photosynthetic oxygen evolution rate, maximum light energy conversion efficiency of PSⅡ (Fv/Fm), actual light energy conversion efficiency (yield), and the relative electron transfer efficiency (ETR) positively correlated with the initial sulfur concentration in the culture medium; the whole culture period showed a tendency to increase first and then significantly decrease.The results of fluorescence emission spectroscopy at 77 K showed that there was light energy allocation between the two photosynthetic systems at the cultivation prophase.In conclusion, growth, lipid accumulation, and photosynthetic physiology of S.acuminatus were apparently influenced by the sulfur concentration.
Scenedesmus acuminatus; Sulfur Concentration; Lipid accumulation; Photosynthetic physiological parameter
Q948.8
A
1000-3207(2017)04-0904-10
10.7541/2017.113
2016-10-13;
2017-02-18
国家自然科学基金(41176105); 中央高校基本科研业务费专项资金(21614101)资助 [National Natural Science Foundation of China (41176105); Fundamental Research Funds for the Central Universities (21614101)]
王倩雅(1991—), 女, 湖南常德人; 硕士研究生; 研究方向为微藻生理生化与生物技术。E-mail: wangqianya1234@163.com
李爱芬, E-mail: tiger@jnu.edu.cn
