不同链长脂肪酸对斑马鱼的性腺脂肪酸组成、繁殖力与仔鱼成活率的影响
2017-08-16盼周继术吉红于海波赖州文陈
郭 盼周继术吉 红于海波赖州文陈 怡
(1.西北农林科技大学动物科技学院, 杨陵 712100; 2.龙岩新奥生物科技有限公司, 厦门 364000)
不同链长脂肪酸对斑马鱼的性腺脂肪酸组成、繁殖力与仔鱼成活率的影响
郭 盼1周继术1吉 红1于海波1赖州文2陈 怡2
(1.西北农林科技大学动物科技学院, 杨陵 712100; 2.龙岩新奥生物科技有限公司, 厦门 364000)
将体质健壮的4月龄斑马鱼(Danio rerio)亲鱼[雄鱼(0.36±0.05) g/尾, 雌鱼(0.59±0.06) g/尾]雌雄各180尾,随机平均分配在室内斑马鱼循环系统的18个养殖缸中。在斑马鱼基础饲料(对照组)中分别添加7 g/kg n-3HUFA (高不饱和脂肪酸, Highly unsaturated fatty acid)(HUFA组)及10 g/kg MCFA (中链脂肪酸, Medium chain fatty acid)(MCFA组), 制成3组等氮等脂饲料, 饲养90d后, 探究不同链长脂肪酸对斑马鱼的性腺脂肪酸组成、繁殖力和仔鱼成活率的影响。结果表明: (1)3组雌鱼性腺的脂肪酸组成均受到所饲喂饲料脂肪酸组成的影响, 其相关系数均在0.8以上。HUFA组雌鱼性腺中EPA和DHA的相对含量显著高于MCFA组及对照组(P<0.05), 而MCFA组与对照组之间无显著差异; HUFA组油酸的相对含量显著低于MCFA组及对照组(P<0.05), 而MCFA组与对照组之间无显著差异; HUFA组及MCFA组亚麻酸的相对含量与对照组之间均无显著差异, 但MCFA组显著高于HUFA组(P<0.05)。(2)HUFA组及MCFA组雌鱼的成熟系数、绝对繁殖力、体重与体长的相对繁殖力均显著高于对照组(P<0.05), 同时在雌鱼绝对繁殖力、相对繁殖力上, HUFA组显著高于MCFA组(P<0.05)。(3)将对照组雄鱼与各组雌鱼配对繁殖的结果显示, 分别与HUFA组及MCFA组雌鱼配对繁殖后的雌鱼的绝对产卵量、相对产卵量和仔鱼成活率均显著高于与对照组雌鱼的配对, 同时以上指标HUFA组雌鱼均显著高于MCFA组雌鱼(P<0.05)。将对照组雌鱼与各组雄鱼配对繁殖的结果表明, 与HUFA组雄鱼配对后其受精率均显著高于与MCFA组及对照组雄鱼的配对(P<0.05)。综上所述, 试验饲料显著影响斑马鱼雌鱼性腺的脂肪酸组成, HUFA及MCFA均可以促进斑马鱼雌鱼的繁殖性能和仔鱼成活率的提高, 在试验条件下, HUFA的效果更好。
斑马鱼; MCFA; n-3HUFA; 繁殖性能
脂肪酸是一端含有一个羧基的脂肪族碳氢链[1],根据碳链的长度可以分为短链、中链和长链脂肪酸[2], 其碳原子数分别小于8、或由8—12 个碳原子组成、或碳原子数大于12[1]。
高不饱和脂肪酸(Highly unsaturated fatty acids, HUFAs)是一类碳原子数目大于等于20, 双键数目大于等于3的多不饱和脂肪酸, 属于长链脂肪酸, 其中, n-3系列的高不饱和脂肪酸主要是DHA (Docosahexenoic acid, 二十二碳六烯酸)和EPA (Ecosahexenoic acid, 二十碳五烯酸)[3—5]。研究者发现, n-3HUFA是确保鱼类亲代优良繁殖性能的重要营养物质[6,7], 在饲料中添加适量的n-3HUFA可以显著提高花尾胡椒鲷的繁殖性能[7]。Jaya-Ram等[6]的研究表明, 在饲料中添加n-3HUFA可以显著改善斑马鱼雌鱼的繁殖性能, 但n-3HUFA是否能够改善雄鱼的繁殖性能目前尚不清楚。
中链脂肪酸(Medium-chain fatty acids, MCFA)是碳原子数目大于等于8, 但小于等于12的一类饱和脂肪酸[4], 功能特性不同于长链脂肪酸, 其具有体内水解、氧化清除快, 不依赖肉碱转运以及对血浆脂蛋白干扰少等优点, 是较为理想的能源物质[4,8—12]。目前, MCFA在畜牧业中被广泛应用于亲本的培育, 它供能效果好, 可以使亲本更加强健,并能提高子一代的成活率[13,14], 但MCFA在鱼类亲本营养学研究方面, 如其对鱼类的繁殖性能、亲鱼产卵质量及所孵仔鱼质量等方面的影响研究则较为缺乏。
斑马鱼(Danio rerio)属鲤科, 因其繁殖力强, 在亲本培育研究中常作为脊椎动物的试验模型[15,16]。本试验以斑马鱼为实验动物, 在其基础饲料中分别添加n-3HUFA及MCFA, 通过饲喂试验并检测斑马鱼雌鱼性腺脂肪酸组成、繁殖力及仔鱼成活率等指标, 以研究不同链长脂肪酸对淡水养殖鱼类繁殖性能的影响, 为不同链长脂肪酸的繁殖营养作用研究及其实际应用提供参考资料。
1 材料与方法
1.1 试验饲料
据鲤科鱼类半精制的饲料配方[17]及斑马鱼亲鱼的营养需求[18,19], 配制粗蛋白为48%及粗脂肪为10%的等氮等能的基础饲料, 在此基础饲料中分别添加7 g/kg n-3HUFA产品和10 g/kg MCFA。n-3HUFA的添加量参考Sui等[20], MCFA的添加量参考Davis等[21]。
试验用猪油购自陕西省杨陵康乐市场, 亚麻籽油购自长春市花香四季科技有限公司, n-3HUFA产品购自无锡迅达海洋生物制品厂, 其中n-3HUFA的含量为74%, 精炼MCFA油由厦门新奥科技有限公司提供。将原料粉碎过60目筛, 然后将饲料原料按上述饲料配方进行配比, 并遵循“先小剂量, 再大剂量”的原则混合, 同时用小型搅拌机搅拌均匀, 最后使用制粒机制粒, 粒径3 mm, 风干24h后, 于–20℃冰箱保存备用。饲料中的粗蛋白、粗脂肪、灰分及干物质含量分别采用凯氏定氮法、索氏抽提法、马福炉灼烧法及恒温干燥法(105℃)测定。各试验处理组的饲料配方及营养成分见表 1。
1.2 实验鱼
试验用斑马鱼亲鱼为4月龄, 购自中国科学院水生生物研究所斑马鱼研究中心。选取健壮的斑马鱼, 雌雄各180尾[雄鱼(0.36±0.05) g/尾, 雌鱼(0.59±0.06) g/尾], 分为3个组, 每组3个重复, 每个重复20尾鱼, 分别饲喂以上3组试验饲料。
1.3 饲养过程
饲养试验在西北农林科技大学斑马鱼室内循环养殖系统中进行。养殖缸18个, 每个养殖缸水容量为3 L, 养殖期间24h不间断进行水循环。试验期间的光周期为12h光照∶12h黑暗。水温28—30℃, 溶氧6—8 mg/L, 氨态氮0.08—0.10 mg/L, pH为7.5—7.7。饲养试验期间每天投喂2次(09:00, 16:00), 投饲率为2%—3%, 共养殖90d。
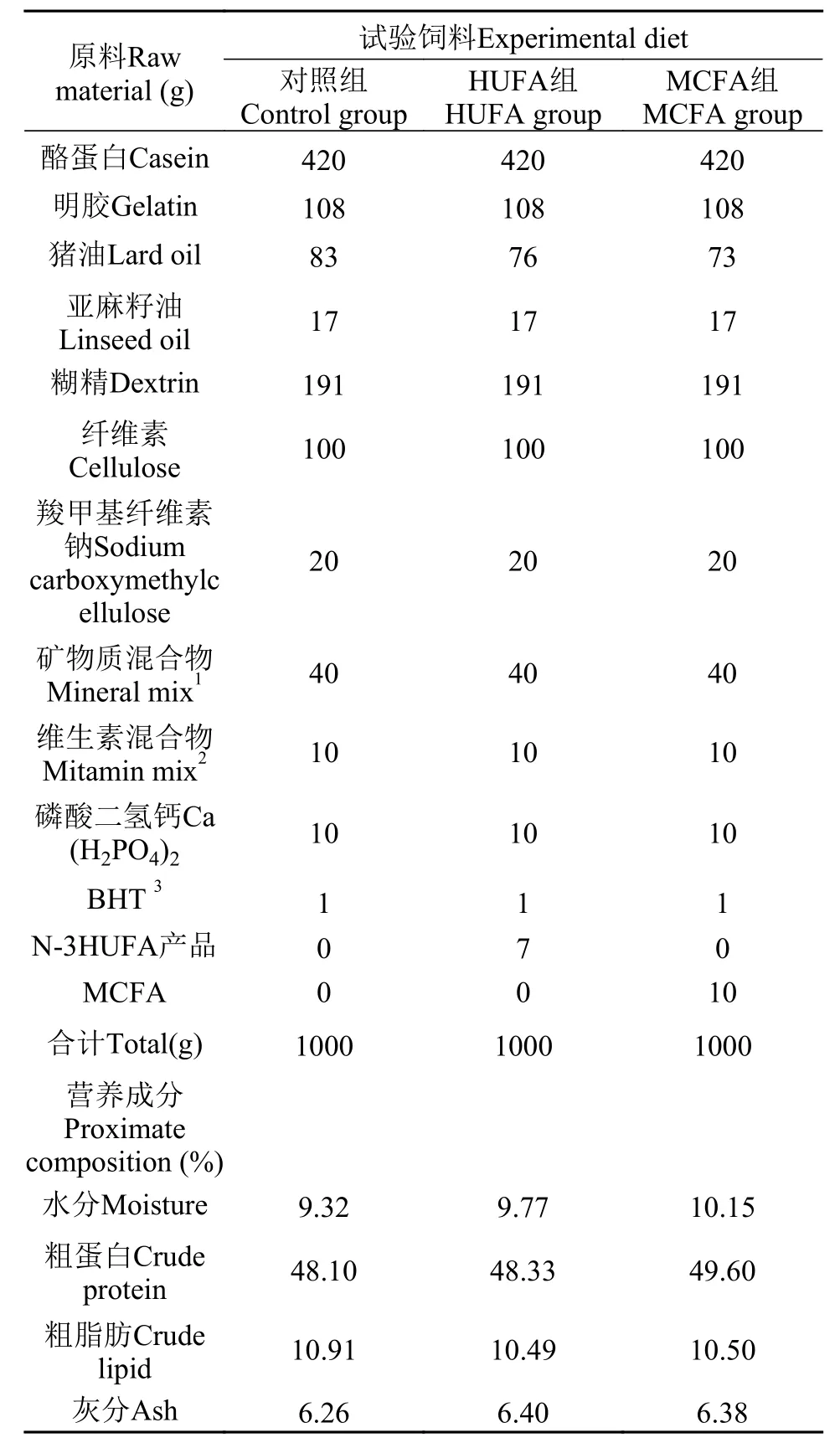
表 1 试验饲料的配方及常规成分(%干物质)Tab.1 Formulation and proximate composition of theexperimental diets (% dry basis)
1.4 采样
在饲养试验结束时, 禁食24h后采样。称取每尾试验鱼体重并测量其体长。每缸随机取鱼6尾,用MS222(0.1 g/L)麻醉后解剖鱼体, 称取鱼体性腺重量, 计算雌鱼卵粒数。将雌鱼性腺于–20℃保存备用以检测性腺脂肪酸组成。
斑马鱼的成熟系数及雌鱼的繁殖力按如下公式进行计算:
成熟系数=性腺重(g)/鱼体重(g)×100%;
绝对繁殖力(粒)=单位重量卵巢的卵粒数(粒/ g)×卵巢质量(g);
体重相对繁殖力(粒/g)=绝对繁殖力(粒)/雌鱼体重(g);
体长相对繁殖力(粒/cm)=绝对繁殖力(粒)/雌鱼体长(cm);
1.5 亲鱼配对繁殖及受精卵样品收集和仔鱼的孵化
将每个养殖缸中余下的12尾斑马鱼亲鱼进行如下配对繁殖: 对照组雌鱼分别与3试验组雄鱼进行配对繁殖, 同时将对照组雄鱼分别与3试验组雌性亲鱼配对繁殖。配对繁殖过程中, 雌雄比例为1∶2。将雌雄配对亲鱼放于专用孵化槽中, 先用隔板将配对繁殖的雌雄鱼隔开, 并覆盖一层软纱布, 过夜后,于试验次日早上取出隔板, 让雌雄亲鱼相互追逐并产卵繁殖。30min后将产卵后的雌雄亲鱼移出, 用清水将所产鱼卵冲洗到孵化杯中, 将孵化杯置于(28±0.5)℃条件下孵化。及时吸出发白的未受精卵。将孵化出膜的仔鱼移入另一养殖杯中并记录孵出仔鱼尾数。对3d内孵出仔鱼的死亡数进行计数。并按以下方法计算亲鱼繁殖情况。
绝对产卵量(粒/尾)=每尾雌鱼实际产卵数量;
相对产卵量(粒/g)=绝对产卵量(粒)/雌鱼体重(g);
受精率(%)=受精卵数/总卵数×100;
孵化率(%)=初孵仔鱼数/受精卵数×100;
仔鱼成活率(%)=孵出仔鱼3 d内存活数/初孵仔鱼数×100;
1.6 饲料及雌鱼性腺脂肪酸组成的测定
取饲料或雌鱼性腺的适量样品, 放入组织捣碎机中搅碎, 用氯仿-甲醇(1鲶1 体积比)提取脂肪, 用正己烷及0.4 mol/L氢氧化钾-甲醇液酯化30min, 然后加水分层。将上层清液用气相色谱法检测脂肪酸组成, 按面积归一化法计算脂肪酸各组分含量。所用气相色谱条件如下: 30 m×0.320 mm×0.25 μm Agilent 19091J-413 色谱柱, 柱箱温度210℃, 检测器温度(FID)300℃, 进样器温度250℃, 载气为高纯氮气, 氮气30 mL/min, 氢气40 mL/min, 空气450 mL/min。脂肪酸组成采用安捷伦7820a气相色谱仪(上海剀台自动化控制设备有限公司, 上海)进行测定。试验饲料的脂肪酸组成见表 2。
1.7 数据处理
试验结果用“平均值±标准差”表示, 采用SPSS 18.0进行单因素方差分析, 并进行Duncan多重比较分析, P<0.05为差异显著。
如图2,有那么以它们为边的平行四边形ABCD的对角线就是该两个向量的和.同时也可以分解为其中,力,速度,加速度等都可理解为向量.向量中的比例:如图3,若则
2 结果
2.1 不同链长脂肪酸对斑马鱼雌鱼性腺脂肪酸组成的影响

表 2 试验饲料的脂肪酸组成(%总脂)Tab.2 Fatty acids composition of diets (% of total lipids)
由表 3可知, 各组雌鱼性腺中均并未检测出中链脂肪酸。HUFA组雌鱼性腺中EPA及DHA的相对含量显著高于对照组及MCFA组 (P<0.05), 而MCFA组与对照组之间无显著差异。HUFA组及MCFA组雌鱼性腺中亚麻酸的相对含量与对照组之间均无显著差异, 但MCFA组则显著高于HUFA组。HUFA组雌鱼性腺中油酸含量显著低于MCFA组及对照组 (P<0.05), 而MCFA组与对照组之间无显著差异。HUFA组的n-3系列脂肪酸、n-3HUFA(DHA和EPA总量)的相对含量及n-3/n-6比值显著高于MCFA组和对照组, 而MCFA组和对照组之间无显著差异。HUFA组n-6系列脂肪酸相对含量显著低于对照组, 但MCFA组与HUFA及对照组之间均无显著差异。饲料与性腺脂肪酸组成的相关系数分别为0.95、0.86及0.94, 表明饲料脂肪酸组成影响了雌鱼性腺的脂肪酸组成。
2.2 不同链长脂肪酸对斑马鱼亲鱼繁殖力的影响
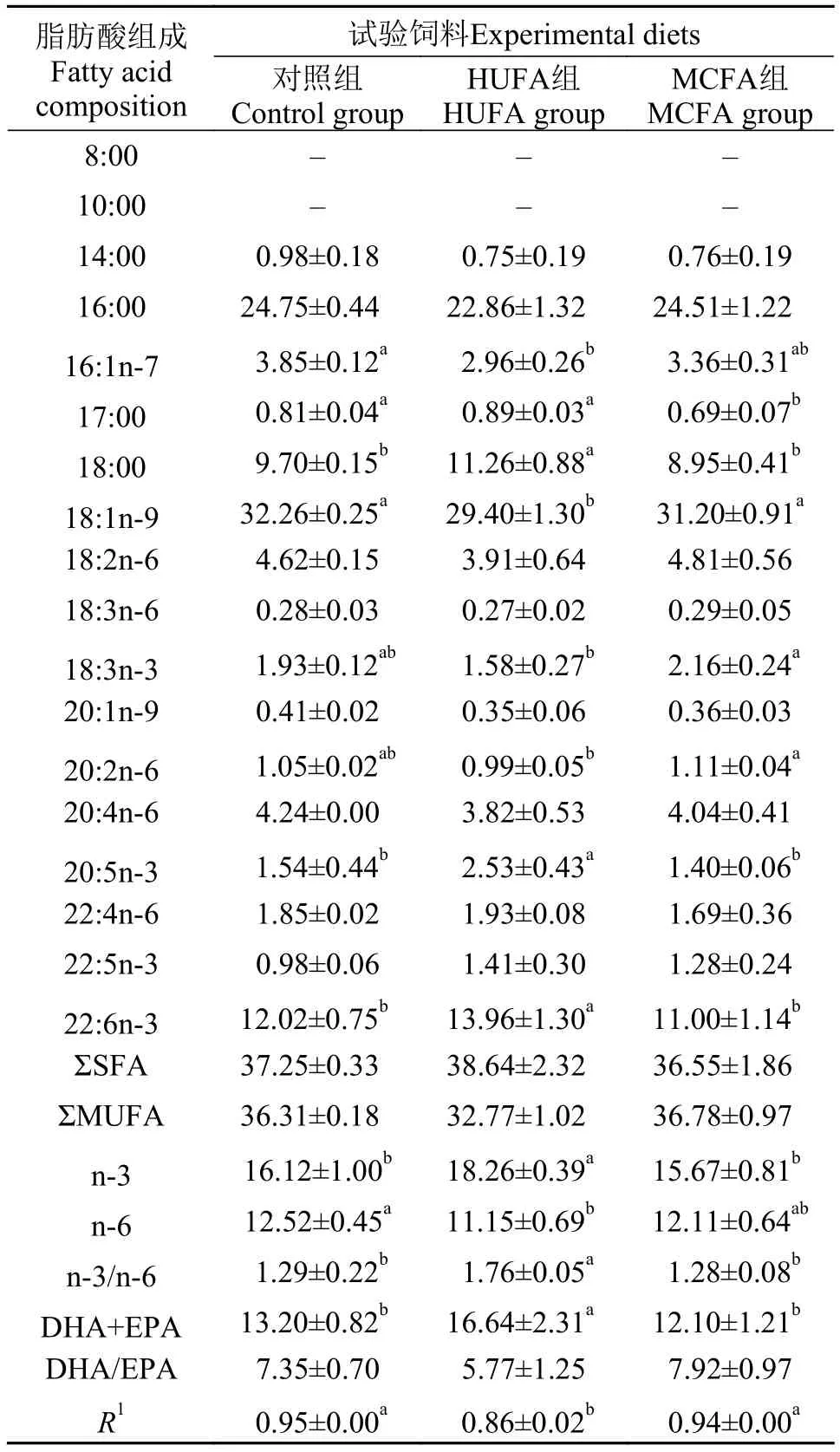
表 3 斑马鱼雌鱼性腺的脂肪酸组成(%总脂)Tab.3 Fatty acids composition in ovaries of female zebra fish (% of total lipids)
由表 4可知, 各组雌鱼的体长、体重及成活率均无显著差异。HUFA组雌鱼的绝对繁殖力、体重相对繁殖力及体长相对繁殖力等指标均显著高于MCFA组, 同时MCFA组显著高于对照组(P<0.05)。HUFA组及MCFA组雌鱼的成熟系数在两组间无显著差异, 但均显著高于对照组(P<0.05)。雄鱼的体长、体重、成熟系数及成活率在各组间均无显著差异(P>0.05)。
2.3 不同链长脂肪酸对斑马鱼产卵情况及仔鱼成活率的影响
由表 5可知, 在对照组雄鱼与各组雌鱼的配对试验中, 各组的孵化率无显著性差异, 但与HUFA组雌鱼及MCFA组雌鱼配对后的总产卵量、每克雌鱼的产卵量和仔鱼成活率均显著高于与对照组雌鱼的配对, 而与MCFA组雌鱼的配对显著低于与HUFA组雌鱼的配对(P<0.05)。
由表 6可知, 在对照组雌鱼与各组雄鱼的配对中, 各配对组的雌鱼绝对产卵量、相对产卵量、孵化率及仔鱼成活率均无显著性差异。对照组雌鱼与HUFA组雄鱼的配对, 其受精率显著高于与对照组雄鱼及与MCFA组雄鱼的配对(P<0.05), 而与MCFA组雄鱼及与对照组雄鱼配对后的受精率无显著差异。
3 讨论
本研究发现, 不同链长脂肪酸对斑马鱼性腺脂肪酸的影响显著, 且基本反映了饲料中脂肪酸组成(如EPA、DHA、n-3/n-6等), 与Jaya-Ram等[6]对斑马鱼和程小飞等[22]对框鳞镜鲤的研究一致。
本研究发现, 虽然MCFA组饲料中油酸的相对含量低于对照组, 但MCFA组和对照组性腺中油酸的相对含量无显著差异, 由于MCFA自身可以迅速氧化供能[10,23], 推测MCFA可能抑止了性腺中油酸的氧化, 从而节约油酸等长链脂肪酸。 Røsjø等[10]研究表明, 饲喂添加MCFA的饲料, 可以抑止大西洋鲑鱼肝脏长链脂肪酸的氧化, 从而导致肝脏长链脂肪酸18:1含量较高。本研究也发现, HUFA组性腺中油酸的相对含量显著低于对照组, 而饲料中HUFA组与对照组油酸含量相近, 说明HUFA能够促进性腺中油酸的β氧化。有研究表明, 饲喂富含DHA和EPA的鱼油, 可以促进大西洋鳕脂肪组织脂肪酸的β氧化供能[24], 在小鼠中也发现n-3HUFA可以增加肝组织中甘油三酯的β氧化[23]。
3.2 不同链长脂肪酸对斑马鱼繁殖力的影响
本研究发现, HUFA组的雌鱼绝对繁殖力、体重相对繁殖力及体长相对繁殖力均显著高于MCFA组及对照组, 同时HUFA组雌鱼的成熟系数显著高于对照组, 而繁殖力是雌鱼所怀的卵粒数量, 包括绝对繁殖力和相对繁殖力[25,26], 成熟系数是评价性腺发育的一个简单又明确的指标[27], 因此从本试验结果可以看出, 饲料中添加n-3HUFA可增加雌鱼怀卵数量, 促进性腺发育, 与以往Chatham等[22]、Annette等[6]、Li等[7]对小神仙鱼、斑马鱼、花尾胡椒鲷等的研究一致。这可能与n-3HUFA具有构成细胞膜组分及为动物提供能量等作用有关[3]。在本研究中, HFUA组性腺中油酸含量显著低于MCFA组。Chatham等[28]的研究结果表明, 1.8% n-3HUFA饲料组和2.9% n-3HUFA饲料组卵中油酸含量的增加可能导致了该亲鱼的繁殖性能的降低。有研究表明, HUFA可以促进脂肪组织的β氧化供能[23,24]。因此,笔者认为, HUFA对繁殖性能的促进作用, 可能与其促进了性腺中油酸的β氧化, 减少了油酸的相对含量, 从而降低了油酸对性腺发育的抑制作用有关。

表 4 斑马鱼亲鱼的成熟度及繁殖力Tab.4 Fecundity and maturity of the zebra fish

表 5 对照组雄鱼与各组雌鱼配对后雌鱼的产卵情况及仔鱼的成活率Tab.5 Spawning and larval survival rate after crossing between male from control and female from all groups
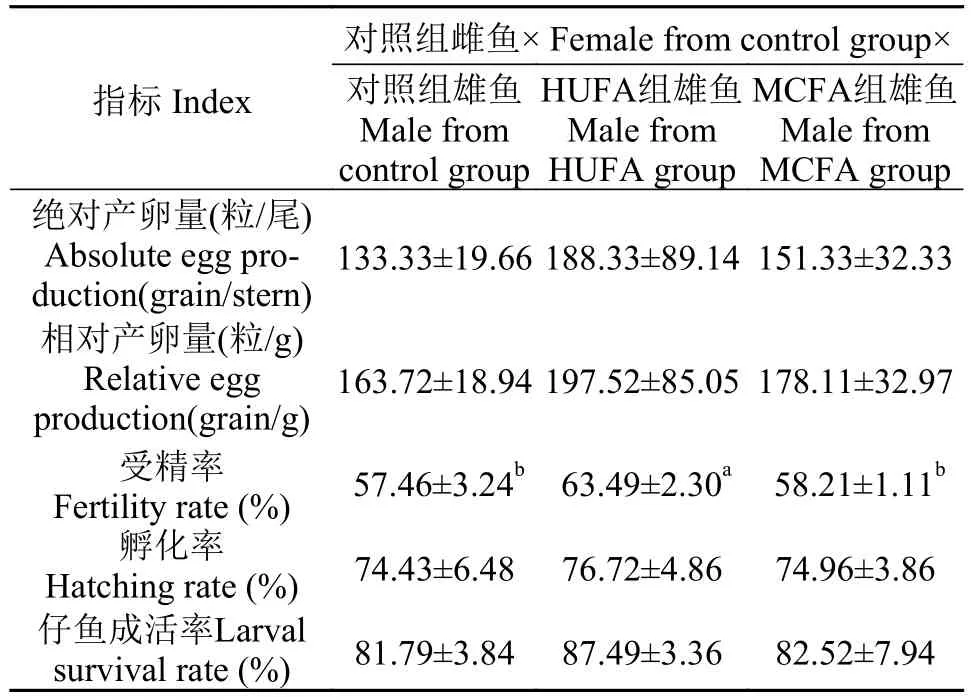
表 6 对照组雌鱼与各组雄鱼配对后雌鱼产卵情况及仔鱼成活率Tab.6 Spawning and larval survival rate after crossing between female from control and male from all groups
目前, 外源添加脂肪酸对鱼类繁殖性能的影响主要集中在HUFA的研究上, 而MCFA对繁殖性能影响的研究还较为缺乏。本研究结果表明, MCFA组的繁殖力与雌鱼的成熟系数均显著高于对照组, 该结果表明, MCFA也是通过增加雌鱼所怀卵的卵粒数及促进性腺发育来改善斑马鱼繁殖性能。在猪的研究中也发现, 母猪饲料中添加椰子油及MCFA, 可增加新生乳猪的成熟度[13]。这可能与作为中链脂肪酸的MCFA, 不仅能够更为迅速地被肠道吸收[10], 而且还可以不经过棕榈酰转移酶的跨膜转运而能直接跨过线粒体膜进行氧化和迅速供能[10,23]有关, 这一快速氧化过程可以为性腺发育提供充足的能量, 从而促进亲体性腺与子代的发育。研究还发现, MCFA也能够通过去甲肾上腺素途径, 促进棕色脂肪组织分解, 减少小鼠的体脂沉积[8], 所以, 在斑马鱼亲鱼中, MCFA也可能促进体内脂质分解, 产生能量, 从而促进性腺发育。但具体机制还需进一步研究。
3.3 不同链长脂肪酸对斑马鱼产卵情况及仔鱼成活率的影响
本研究发现, 对照组雄鱼与各组雌鱼配对繁殖中, 与HUFA组及MCFA组雌鱼配对后雌鱼的绝对产卵量、相对产卵量及仔鱼成活率均显著高于与对照组雌鱼的配对。雌鱼的繁殖性能的评价主要基于每尾雌鱼的总产卵量、每克雌鱼的产卵量及仔鱼的成活率[29], 因此可以看出, HUFA及MCFA的添加可以显著改善斑马鱼雌鱼的繁殖性能。这与以往Mohammad等[5]、Annette等[6]对黄鳍鲷、斑马鱼等的研究一致。本试验中HUFA组的高繁殖性能可能与HUFA组饲料能够为亲鱼补充适量的EPA和DHA有关, EPA是如前列腺素等类二十烷酸的前体, 前列腺素在卵母细胞的最终成熟、排卵等方面具有重要的作用[30], 同时在亲鱼成熟过程中, DHA能够可以被保留或积累, 并在卵和仔鱼发育中发挥重要的作用[30]。
以往的研究表明, 饲料中n-3HUFA是通过影响卵和幼体的脂肪酸组成而影响卵和幼体的质量[7]。本研究也发现, HUFA组中雌鱼性腺的EPA显著高于MCFA组及对照组, 而雌鱼的繁殖性能则是HUFA组显著高于MCFA组及对照组, 表现出性腺中低水平的EPA降低了斑马鱼的繁殖性能, 而EPA是类二十烷酸的前体, 如前列腺素, 其在卵母细胞的最终成熟、排卵等方面具有重要的作用[30]有关。Chatham等[30]采用分别含有1.8%、2.6%和3.9% n-3HUFA的饲料饲喂小神仙鱼雌鱼, 发现性腺中低水平的EPA可能导致了小神仙鱼繁殖性能和产卵质量的下降。因此, 推测外源性HUFA可影响性腺中HUFA水平, 进而调节某些与生殖有关的激素代谢, 从而影响斑马鱼雌鱼的繁殖性能,
目前, 外源脂肪酸对鱼类繁殖性能的影响主要集中在雌鱼的研究上, 而对雄鱼的研究报道较少。本研究结果表明, 在对照组雌鱼与其他组雄鱼的配对繁殖试验中, 与HUFA组雄鱼配对后的受精率显著高于与MCFA组与对照组, 表明添加n-3HUFA也有助于改善雄鱼的繁殖性能, 提高受精率。朱定贵等[31]的研究也表明, 在饲料中添加DHA、ARA (Arachidonic acid)和22:4n-6, 可以提高大刺鳅雄鱼的精子质量。在HUFA组饲料中提供的EPA是前列腺素的前体[30], 前列腺素能够维持雄性器官平滑肌收缩, 与提高了雄性动物繁殖行为有关[32]。因此, 本试验中HUFA组斑马鱼雄鱼对雌鱼有更高的受精率, 可能与HUFA增强了雄鱼的繁殖行为等有关。此外, HUFA组斑马鱼雄鱼对雌鱼有更高的受精率, 也可能与该组饲料有相对较高n-3/n-6脂肪酸比例有关。在猪的研究中发现, 野猪亲本饲料中n-3脂肪酸和n-6脂肪酸的平衡对雄性野猪的繁殖性能非常重要[33], 且较低的n-3脂肪酸和n-6脂肪酸的比例可能增加一些炎症反应的风险[34], 而较高的n-3脂肪酸和n-6脂肪酸的比例则可能促进生长及鼠科后代的发育[35]。因此, 在本试验HUFA组中, 可能是饲料中合适的n-3/n-6脂肪酸比例提高了受精率。但具体机制还需进一步研究。
本研究发现, 在对照组雄鱼与其他组雌鱼的配对繁殖试验中, 对照组雄鱼与HUFA组及MCFA组雌鱼配对后仔鱼的成活率显著高于与对照组雌鱼的配对, 表明亲鱼饲料中添加n-3HUFA或MCFA更能提高斑马鱼仔鱼的成活率。仔稚鱼从内源性营养转变为外源性营养后, 由于能量供应不足, 经常会大量死亡[36]。因此, 本试验中HUFA和MCFA的添加提高仔鱼成活率可能与于MCFA和HUFA有效提高了仔鱼的能量代谢效率, 使其在内外营养转换时更易获取能量有关。在猪的研究中也发现, 外源添加MCFA可以显著增加新生乳猪的成活率, 因此MCFA可以作为一种饲料添加剂来改善幼体的存活率和断奶前的死亡率[14]。在小神仙鱼的研究结果也表明, 在亲鱼成熟过程中, DHA可以被保留或积累, 并在卵和仔鱼发育中发挥重要的作用[28]。
4 结论
试验饲料显著影响斑马鱼雌鱼性腺的脂肪酸组成, MCFA和n-3HUFA均可以促进斑马鱼雌鱼的繁殖性能和仔鱼成活率的提高, 在本试验条件下, n-3HUFA的效果更佳。
致谢:
感谢西北农林科技大学水产动物营养与饲料研究室全体成员、2012级本科生郑玉珠和2014级本科生霍丽坤、刘萍、郭倩、徐佳婉等同学的大力协助。
[1]Zhang X, Yang M, Song F, et al.Ntimicrobial activity of selected fatty acids and their derivatives [J].Journal of Zhejiang University (Agriculture & Life Sciences), 2013, 39(2): 155—160 [张希, 杨明, 宋飞, 等.脂肪酸及其衍生物的抑菌活性.浙江大学学报: 农业与生命科学版, 2013, 39(2): 155—160]
[2]Tang C H, Xu J X, Peng Z Y.Recent study on nutrition and function of fatty acids [J].China Oils and Fats, 2000, 25(6): 20—23 [唐传核, 徐建祥, 彭志英.脂肪酸营养与功能的最新研究.中国油脂, 2000, 25(6): 20—23]
[3]Ji H, Tian J J.Research progresses of the nutrition effects of highly unsaturated fatty acid (HUFAs) in the freshwa-ter fish [J].Journal of Fisheries of China, 2014, 38(9): 1650—1665 [吉红, 田晶晶.高不饱和脂肪酸(HUFAs)在淡水鱼类中的营养作用研究进展.水产学报, 2014, 38(9): 1650—1665]
[4]Dong Y M, Li Y, Ning H, et al.High dietary intake of medium-chain fatty acids during pregnancy in rats prevents later-life obesity in their offspring [J].Journal of Nutritional Biochemistry, 2010, 22(8): 791—797
[5]Gao J, Li Y, Ye W Z, et al.The growth performances and the fatty acid compositions of loach Misgurnus anguillicaudatus fry fed with different lipid sources [J].Acta Hydrobiologica Sinica, 2016, 40(1): 1—9 [高坚, 李洋, 叶伟钊, 等.不同脂肪源对泥鳅稚鱼生长性能及脂肪酸组成的影响.水生生物学报, 2016, 40(1): 1—9]
[6]Jaya-Ram A, Kuah M K, Lim P S, et al.Influence of dietary HUFA levels on reproductive performance, tissue fatty acid profile and desaturase and elongase mRNAs expression in female zebrafish Danio rerio [J].Aquaculture, 2008, 277(3): 275—281
[7]Li Y Y, Chen W Z, Sun Z W, et al.Effects of n -3 HUFA content in broodstock diet on spawning performance and fatty acid composition of eggs and larvae in Plectorhynchus cinctus [J].Aquaculture, 2005, 245(s 1-4): 263—272
[8]Zhang Y, Qing X U, Liu Y H, et al.Medium-chain triglyceride activated brown adipose tissue and induced reduction of fat mass in C57BL/6J mice fed high-fat diet [J].Biomedical and Environmental Sciences, 2015, 28(2): 97—104
[9]Hong S M, Hwang J H, Kim I H.Effect of medium-chain triglyceride (MCT) on growth performance, nutrient digestibility, blood characteristics in weanling pigs [J].Asian Australasian Journal of Animal Sciences, 2012, 25(7): 1003—1008
[10]Røsjø C, Nordrum S, Olli J J, et al.Lipid digestibility and metabolism in Atlantic salmon (Salmo salar) fed medium-chain triglycerides [J].Aquaculture, 2000, 190: 65—76
[11]Liu Y H, Yong Z, Qing X U, et al.Increased norepinephrine by medium-chain triglyceride attributable to lipolysis in white and brown adipose tissue of C57BL/6J mice [J].Bioscience Biotechnology & Biochemistry, 2012, 76(6): 1213—1218
[12]Alexandre C L, Mélanie F, Jennifer T M, et al.Stimulation of mild, sustained ketonemia by medium-chain triacylglycerols in healthy humans: estimated potential contribution to brain energy metabolism [J].Nutrition, 2013, 29(4): 635—640
[13]Jean K B, Chiang S H.Increased survival of neonatal pigs by supplementing medium-chain triglycerides in lategestating sow diets [J].Animal Feed Science and Technology, 1999, 76(3): 241—250
[14]Azain M J.Effects of adding medium-chain triglycerides to sow diets during late gestation and early lactation on litter performance [J].Journal of Animal Science, 1993, 71(11): 3011—3019
[15]Carvalho A P, Araújo L, Santos M M.Rearing zebrafish (Danio rerio) larvae without live food: evaluation of a commercial, a practical and a purified starter diet on larval performance [J].Aquaculture Research, 2006, 37(11): 1107—1111
[16]Ribas L, Piferrer F.The zebrafish (Danio rerio) as a model organism, with emphasis on applications for finfish aquaculture research [J].Reviews in Aquaculture, 2013, 5(4): 209—240
[17]Lovell T.Nutrition and Feeding of Fish [M].New York: Van Nostrand Reinhold.1989
[18]Williams S.Official methods of the association of official analytical chemists [M].Arlington: Association of Official Analytical Chemists.1984
[19]Meinelt B T, Schulz C, Wirth M, et al.Dietary fatty acid composition influences the fertilization rate of zebrafish (Danio rerio Hamilton-Buchanan) [J].Journal of Applied Ichthyology, 1999, 15(1): 19—23
[20]Sui L Y, Sun H X, Wu X G, et al.Effect of dietary HUFA on tissue fatty acid composition and reproductive performance of Chinese mitten crab Eriocheir sinensis, (H.Milne-Edwards) broodstock [J].Aquaculture International, 2011, 19(2): 269—282
[21]Davis D A, Lazo J P, Arnold C R.Response of juvenile red drum (Sciaenops ocellatus) to practical diets supplemented with medium chain triglycerides [J].Fish Physiology & Biochemistry, 1999, 21(3): 235—248
[22]Cheng X F, Tian J J, Ji H, et al.Effects of different lipid sources in the silkworm pupa-based diet for mirror carp (Cyprinus carpio var.specularis) on growth performance, body composition and health status [J].Acta Hydrobiologica Sinica, 2013, 37(4): 656—668 [程小飞, 田晶晶, 吉红, 等.蚕蛹基础日粮中添加不同脂肪源对框鳞镜鲤生长、体成分及健康状况的影响.水生生物学报, 2013, 37(4): 656—668]
[23]Yoshinaga K, Sasaki K, Watanabe H, et al.Differential effects of triacylglycerol positional isomers containing n-3 series highly unsaturated fatty acids on lipid metabolism in C57BL/6J mice [J].Journal of Nutritional Biochemistry, 2015, 26(1): 57—63
[24]Marijana Todorčević, Marte A.Kjær, Nataša Djaković, et al.N-3 HUFAs affect fat deposition, susceptibility to oxidative stress, and apoptosis in Atlantic salmon visceral adipose tissue [J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2008, 152(2): 135—143
[25]Shi L N, Zhang Q, Wu X D, et al.Individual fertility of the Silurus lanzhouensis [J].Journal of Gansu Agricultural University, 2008, 43(1): 67—70 [史丽娜, 张奇, 吴旭东, 等.兰州鲇个体繁殖力的研究.甘肃农业大学学报, 2008, 43(1): 67—70]
[26]Koslow J A.Fecundity and its variability in orange roughy: effects of population density condition, egg size and senescence [J].Journal of Fish Biology, 1995, 47(6): 1063—1080
[27]Hu X Q, Li W H, Tian F, et al.Study on gonadal developmental toxicity of dibutyl phthalate in male zebrafish of F1 generation [J].Journal of Hygiene Research, 2010,39(2): 231—234 [胡晓晴, 李卫华, 田芳, 等.邻苯二甲酸二丁酯对F1代雄性斑马鱼性腺发育影响的研究.卫生研究, 2010, 39(2): 231—234]
[28]Callan C K, Laidley C W, Kling L J, et al.The effects of dietary HUFA level on flame angelfish (Centropyge loriculus) spawning, egg quality and early larval characteristics [J].Aquaculture Research, 2014, 45(7): 1176—1186
[29]Roo J, Fernández-Palacios H, Schuchardt D, et al.Influence of hormonal induction and broodstock feeding on longfin yellowtail Seriola rivoliana maturation, spawning quality and egg biochemical composition [J].Aquaculture Nutrition, 2015, 21(5): 614—624
[30]Røjbek M C, Støttrup J G, Jacobsen C, et al.Effects of dietary fatty acids on production and quality of eggs and larvae of Atlantic cod (Gadus morhua L.) [J].Aquaculture Nutrition, 2014, 20(6): 654—666
[31]Zhu D G.Study on the fatty acid of the wild male and female Mastacembelus armatus during breeding season [J].Chinese Agricultural Science Bulletin, 2012, 28(2): 65—68 [朱定贵.生殖季节野生大刺鳅雌雄鱼脂肪酸组成研究.中国农学通报, 2012, 28(2): 65—68]
[32]Ye G C.Prostaglandins and male reproductive physiology [J].Progress in Physiological Sciences, 1983, 1: 16 [叶干才.前列腺素与雄性生殖生理.生理科学进展, 1983, 1: 16]
[33]Lin Y, Cheng X, Mao J, et al.Effects of different dietary n-6/n-3 polyunsaturated fatty acid ratios on boar reproduction [J].Lipids in Health & Disease, 2016, 15(1): 1—10
[34]Korotkova M, Gabrielsson B G, Holmäng A, et al.Gender-related long-term effects in adult rats by perinatal dietary ratio of n-6/n-3 fatty acids [J].Ajp Regulatory Integrative & Comparative Physiology, 2005, 288(3): 575—579
[35]Kiecolt-Glaser J K, Belury M A, Porter K, et al.Depressive symptoms, omega-6: omega-3 fatty acids,and inflammationin older adults [J].Psychosomatic Medicine, 2007, 69(3): 217—224
[36]Gong G, Xue M, Wang J, et al.Nutrition requirement and nutritional regulation of growth and developmentfor fish larvae [J].Chinese Journal of Animal Nutrition, 2014, 26(4): 843—851 [宫官, 薛敏, 王嘉, 等.仔稚鱼营养需要及生长发育的营养调控.动物营养学报, 2014, 26(4): 843—851]
INFLUENCE OF FATTY ACIDS WITH DIFFERENT CHAIN LENGTH ON FATTY ACID COMPOSITION OF OVARIES, FECUNDITY AND SURVIVAL RATE OF LARVAE IN ZEBRAFISH (DANIO RERIO)
GUO Pan1, ZHOU Ji-Shu1, JI Hong1, YU Hai-Bo1, LAI Zhou-Wen2and CHEN Yi2
(1.College of Animal Science and Technology, Northwest A&F University, Yangling 712100, China; 2.New Austrian Biotechnology Co., Ltd., Xiamen 364000, China)
To study the effects of fatty acids on zebrafish (Danio rerio), three diets with isonitrogenous and isolipidic nutrients of basal diet (control group), 7 g/kg n-3HUFA (Highly unsaturated fatty acid) (HUFA group) and 10 g/kg MCFA (Medium chain fatty acid) (MCFA group) were formulated to fed a total of 360 healthy four months old parent zebrafish including 180 male (0.59±0.06) g and 180 female (0.36±0.05) g fish that were randomly divided into three groups (triplicate per group) for a 90 days trial.The fatty acid composition of gonad, fecundity and larvae survival rate were used to assess the effects of fatty acids.The results indicated dietary fatty acids were effectively incorporated into ovaries of female fish with high coefficients that were all more than 0.8.EPA and DHA content in ovary tissue of HUFA group were higher than those in MCFA group and control group (P<0.05), and there was no significant difference between MCFA group and control group.Oleic acid was significantly lower in HUFA group than that of MCFA and control groups (P<0.05), and there was no significant difference between MCFA group and control group.Linolenic acid content in HUFA group was higher than that in MCFA group (P<0.05), and linolenic acid content in the two groups were higher than that of control group.Gonadosomatic index, absolute fecundity, relative fecundity of weight and body length in HUFA group and MCFA group were significantly higher than those of control group (P<0.05) and the fecundity in HUFA group was significantly higher than that in MCFA group (P<0.05).For the mating experiment using female fish fed with different diet, absolute egg production, relative egg production rate of female fish and survival rate of larvae in HUFA group were significantly higher than that of MCFA group, and these two groups were significantly higher than control group (P<0.05).For the mating experiment using male fish fed with different diets, fertility rate in HUFA group was significantly higher than that in MCFA and control groups (P<0.05).The present result showed that the fatty acid composition in diets regulated fatty acids composition in ovaries of female fish, the reproduction performance of female fish and the survival ratio of the larvae with the better beneficial effects for HUFA compared with MCFA.
Zebrafish; MCFA; N-3HUFA; Reproduction performance
S965.1
A
1000-3207(2017)04-0766-08
10.7541/2017.95
2016-07-26;
2016-09-05
陕西省科技统筹(2015KTTSNY01-05); 龙岩新奥生物科技有限公司课题(K4030216051)资助 [Supported by the Shaanxi Province Science and Technology Overall Plan (2015KTTSNY01-05); the New Austrian Biotechnology Co., Ltd., Longyan Xiamen, China (K4030216051)]
郭盼(1990—), 女, 河南南阳人; 硕士研究生; 研究方向为水产动物营养与饲料。E-mail: 1028796797@qq.com
吉红(1967—), 男, 河南灵宝人; 博士, 教授; 博士生导师; 研究方向为水产动物营养与饲料。E-mail: jihong@nwsuaf.edu.cn
