草鱼TRIM32基因克隆表达及功能研究
2017-08-16贾路路曾令兵王方彭俊杰王业大周勇刘学芹
贾路路曾令兵王 方彭俊杰王业大周 勇刘学芹
(1.华中农业大学水产学院水生动物医学系, 武汉 430070; 2.中国水产科学研究院长江水产研究所, 武汉 430070; 3.淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 4.池塘健康养殖湖北省工程实验室, 武汉 430070)
草鱼TRIM32基因克隆表达及功能研究
贾路路1,2,3,4曾令兵2王 方1,3,4彭俊杰1,3,4王业大1,3,4周 勇2刘学芹1,3,4
(1.华中农业大学水产学院水生动物医学系, 武汉 430070; 2.中国水产科学研究院长江水产研究所, 武汉 430070; 3.淡水水产健康养殖湖北省协同创新中心, 武汉 430070; 4.池塘健康养殖湖北省工程实验室, 武汉 430070)
TRIM (Tripartite-motif protein) 家族是机体先天性免疫的重要成员, 参与细胞增殖分化、细胞凋亡、肿瘤抑制、抗病毒等过程。为了进一步探究TRIM蛋白在鱼类免疫中的作用, 实验利用PCR方法克隆了草鱼TRIM32基因的编码区全长, 共1980 bp, 编码660个氨基酸。草鱼TRIM32具有TRIM家族典型的3个结构域, 与斑马鱼TRIM32的核苷酸序列同源性较高, 遗传进化分析也聚为一支。间接免疫荧光、Western-blotting检测结果显示草鱼TRIM32在EPC细胞中成功表达, 主要以点状分布在细胞质中, 细胞核中表达量较少; 组织分布分析表明TRIM32在被检测的11个组织中均有表达, 其中在头肾组织中的表达量明显高于其他组织; 不同胚胎发育时期的表达分析进一步表明, TRIM32在受精卵时期、卵裂期和囊胚期的表达量显著高于其他时期(P<0.05), 随后表达量下降, 直到出膜后表达量再次显著性升高。此外, 双荧光素酶检测系统显示TRIM32能够激活NF-κB信号通路, 诱导下游的炎症反应。结果显示, 草鱼TRIM32广泛分布于鱼体内, 并参与机体的天然免疫反应, 对于抵抗病原体的入侵具有重要作用。
TRIM32; 克隆; 真核表达; NF-κB
TRIM (Tripartite-motif protein)家族蛋白, 也称为RBCC家族蛋白, 从N端到C端依次是RING结构域、B-box结构域、Coiled-coil结构域, 其在细胞的增殖、分化、肿瘤的抑制、病毒的抑制等方面发挥了重要的调控作用[1,2]。在哺乳动物中TRIM家族的部分成员, 例如TRIM25、TRIM5α等, 在病毒感染宿主细胞的过程中可以起到E3泛素连接酶的作用, 从而调控机体的抗病毒天然免疫反应[3—6]。
在哺乳动物中TRIM32的功能研究较多, TRIM32 RING结构域具有泛素连接酶活性, 能够促进下游靶蛋白发生泛素化修饰, 从而激活NF-κB信号通路; TRIM32还可以抑制病毒在宿主细胞内的表达, 促进病毒粒子的释放[7—10]。此外, TRIM32 羧基末端含有6个NHL重复结构域(NCL-1、HT2A和LIN-41), 参与蛋白/蛋白相互作用[11]。在皮肤癌变模型小鼠以及UVB辐射诱发小鼠皮肤癌变的致癌性研究过程中发现, TRIM32的表达有显著性升高,同时研究还发现TRIM32具有抗凋亡活性[12,13]。目前对于TRIM家族在鱼类中的功能研究相对较少,主要集中在TRIM家族在鱼类先天性免疫中的重要作用[14]。有研究表明鱼类中TRIM家族同哺乳动物具有相似的功能, 在病毒刺激后鱼体中TRIM家族的表达量上升, 同时也证实TRIM家族参与鱼体的抗病毒天然免疫反应并发挥重要作用[15,16]。
本研究克隆表达了草鱼 (Ctenopharyngodon idellus)TRIM32, 分析其在不同组织及不同胚胎发育时期的表达丰度, 并检测对NF-κB信号通路的影响, 为研究草鱼TRIM32在天然免疫中的作用及机制提供依据。
1 材料与方法
1.1 材料
质粒、菌株及细胞组织载体质粒pcDNA 4.0和EPC细胞均由本实验室保存, E.coli.DH5α感受态细胞购自TaKaRa公司, 草鱼购自华中农业大学菜市场。
工具酶及化学试剂限制酶、T4 DNA连接酶、反转录试剂盒均购自大连宝生物工程有限公司, 质粒DNA小提试剂盒购自Omega公司, HRPDAB底物显色试剂盒购自武汉博士德生物工程有限公司, 转染试剂lipo2000购自Promega公司, 鼠源抗His标签抗体购自Sigma公司, HRP标记的羊抗鼠荧光二抗购自美国Invitrogen公司, pNF-κB-Luc购自Agilent Technologies公司、pRL-TK购自Promega公司, M199培养基购自Hyclone公司, 新生胎牛血清购自Gibco公司。
1.2 引物的设计
根据NCBI鲤TRIM32编码区全长序列(序列号: emb|LN591166.1|), 用Primer5.0软件设计扩增引物,上游引物为F: 5′-ATGGCCACACCAACATCCC TA-3′, 下游引物为R: 5′-TTAACATGTAGAGGA ACGTCTCT-3′。
设计真核表达引物, 上游引物加入BamHⅠ酶切位点, 下游引物加入XbaⅠ酶切位点, 上游引物为F1: 5′-AAAGGATCCATGGCCACACCAACATC CCTA-3′, 下游引物为R1: 5′-AAATCTAGAACAT GTAGAGGAACGTCTCT-3′, 下划线部分为限制性内切酶位点。
设计荧光定量特异性引物, 上游引物RT-F: 5′-TGCCTTTGCCACCTCCTTG-3′, 下游引物RT-R: 5′-TCTTCTTCATTGTTACTCCCTTCC-3′。
以上引物均由武汉擎科新业生物技术有限公司合成。
1.3 TRIM32基因克隆
试验草鱼在实验室暂养1周后, 冰上解剖取脾脏组织50—100 mg于1 mL Trizol试剂中, 按照Trizol使用说明提取总RNA, 以其反转录获取的cDNA为模板, 通过PCR扩增TRIM32基因。PCR扩增程序为: 95℃预变性5min; 95℃变性30s, 58℃退火30s, 72℃延伸2min, 共35个循环; 72℃延伸10min。PCR反应产物用1%琼脂糖凝胶电泳鉴定并纯化回收目的片段, 将回收产物连接到克隆载体pMD19-T(TaKaRa公司)得到重组质粒pMD19-TTRIM32, 将其转化到E.coli.DH5α感受态细胞(TaKaRa公司)。经Ampicillin抗性筛选, 挑取阳性菌落, 扩大培养后进行菌液PCR鉴定, 并由武汉擎科新业生物技术有限公司测序。
1.4 TRIM32序列分析及系统进化树分析
将测序所得核苷酸序列及相应的氨基酸序列用BLAST程序比对分析, 用CLUSTAL软件对不同物种TRIM32各结构域进行比对分析, 系统进化树的构建使用MEGA6.06软件进行对比分析。
1.5 TRIM32真核表达载体的构建与鉴定
提取鉴定正确的重组质粒pMD19-T-TRIM32,经BamHⅠ和XbaⅠ双酶切后胶回收, 以摩尔比3鲶1连接到经相同双酶切的质粒pcDNA4.0。转化至E.coli.DH5α感受态细胞, Ampicillin抗性筛选, 挑取阳性克隆培养并进行菌落PCR鉴定, 所构建的重组表达载体初步命名为pcDNA4.0-TRIM32, 并送至武汉擎科测序公司进行序列测定。
1.6 免疫印迹鉴定TRIM32基因的表达
转染36h后收集细胞, 用预冷的细胞裂解液裂解细胞, 冰上放置15min; 将细胞裂解液4℃ 12000 r/min离心15min, 上清为获取的细胞总蛋白; 不同处理样品进行SDS-PAGE凝胶电泳; 电泳后, 12V电压过夜转移蛋白至PVDF膜; 用封闭液(含1% BSA的TBST)在室温下封闭1h; 加入一抗鼠源抗His标签抗体和HRP-羊抗鼠二抗后, 将PVDF膜放入化学发光底物A和B液的等量混合液中进行避光显色, 用化学发光成像系统进行照相。
1.7 TRIM32蛋白在EPC细胞中的定位
用转染试剂lipo 2000将重组质粒pcDNA4.0-TRIM32转染至EPC细胞。具体操作步骤参照试剂盒说明书进行。转染质粒用量为0.8 μg, 转染4h后更换细胞培养液, 36h后用PBS洗涤细胞3次, 每次5min。100%甲醇室温固定10min, PBS洗涤3次, 每次5min。用封闭液(含1% BSA的PBS)封闭30min, PBS洗涤3次, 每次5min。加入封闭液稀释的鼠源一抗(抗His标签), 孵育1—2h, PBS洗涤3次, 每次5min。加入封闭液稀释的羊抗鼠二抗, 孵育45min, PBS洗涤3次, 每次5min。加入适量PBS, 防止干样。在倒置荧光显微镜下观察转染细胞的荧光并拍照。
1.8 草鱼TRIM32在不同组织及不同胚胎发育时期的表达
试验草鱼为1龄草鱼, 鱼体全长20—25 cm, 体重350—400 g。试验鱼体在实验室暂养1周后, 于冰上解剖取肌肉、脑、眼、鳃、心、肝、肾、头肾、脾、皮肤、肠道各50—100 mg于1 mL Trizol试剂中, 分别取3组作为3个平行。按照Trizol使用说明提取总RNA反转录成cDNA, 用实时荧光定量PCR检测TRIM32在不同组织的相对表达量。试验鱼卵在受精后于28℃水温中进行孵化, 在光学显微镜下观察受精卵胚胎发育情况, 并在受精卵、卵裂期、囊胚期、原肠期、神经胚期、眼囊期、心跳期各取3粒受精卵于1 mL Trizol试剂中(重复3个平行), 在出膜期、出膜后1d、出膜后2d、出膜后3d、出膜后4d、出膜后5d取3尾鱼苗于1 mL Trizol试剂中(重复3个平行), 按照Trizol使用说明提取总RNA反转录成cDNA, 用实时荧光定量PCR检测TRIM32在不同胚胎发育时期的相对表达量。在此次试验中受精卵时期为受精后3min, 卵裂期为受精后1h, 囊胚期为受精后2.5h, 原肠期为受精后10h, 神经胚期为受精后12h, 眼囊期为受精后14.5h, 尾鳍期为受精后18.5h, 心跳期为受精后19.5h, 出膜期为受精后22h。实时荧光定量PCR 20 μL反应体系: cDNA模板2 μL, 上游引物RT-F 0.8 μL, 下游引物RT-R 0.8 μL, SYBR green Real-time PCR master mix 10 μL, 加水至20 μL。PCR扩增程序: 95℃3min; 95℃ 10s, 58℃ 30s, 40个循环; 72℃延伸10min。
1.9 双荧光素酶报告实验检测草鱼TRIM32对NF-κB活性的影响
双荧光素酶活性测定按照Promega公司提供的分析系统说明书进行。除去细胞培养基, PBS冲洗细胞, 加入Passive Lysis Buffer(PLB)细胞裂解液100 μL, 室温轻缓晃动培养板15min后再吹打细胞,收集细胞裂解液, 通过生物化学发光分析仪(德国Berthold公司) 进行双荧光素酶活性测定。以萤火虫荧光素酶的活性与海肾荧光素酶活性的比值表示被检测的质粒在转染细胞后所测得的荧光素酶的相对活性。
1.10 统计学分析
所有的实验至少重复3次。数据以平均值±标准偏差的形式表示, 采用Welch校正的非配对t检验。P≥0.05认为无显著性差异; P<0.05认为差异显著, 用“*”表示; P<0.01认为差异非常显著, 用“**”表示。
2 结果
2.1 TRIM32基因克隆
从草鱼脾脏组织中提取总RNA, 以反转录获取的cDNA为模板, 扩增TRIM32 CDS区全长。经琼脂糖凝胶电泳检测, 结果显示均在大约2000 bp位置检测到特异性目的条带(图 1)。将扩增片段纯化回收连接到克隆载体pMD19-T得到重组质粒pMD19-TTRIM32, 经测序草鱼TRIM32 CDS区全长为1980 bp。
2.2 TRIM32序列分析
草鱼TRIM32同其他物种的核苷酸序列比对结果表明, 草鱼TRIM32与斑马鱼(Danio rerio)和鲤(Cyprinus carpio)具有很高的同源性, 分别为87%和90%, 而与人类(Homo sapiens)和小鼠(Mus musculus)的同源性相对较低, 只有71%和73%。同时氨基酸结构域对比分析表明草鱼TRIM32具有典型的RING结构域、B-BOX结构域以及SPRY结构域等保守结构域(图 2)。
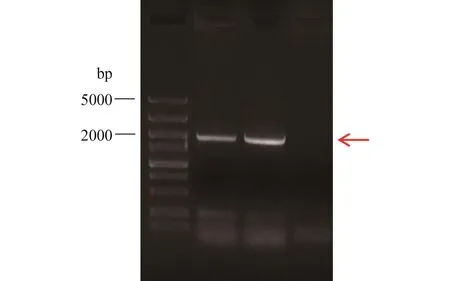
图 1 TRIM32 PCR产物Fig.1 PCR product of TRIM32
2.3 TRIM32系统进化树分析
通过草鱼与其他物种的TRIM32构建系统进化树来进行拓扑结构分析(图 3), 结果表明草鱼TRIM32与斑马鱼和墨西哥脂鲤(Astyanax mexicanus)的亲缘关系较近, 遗传进化分析聚为一支, 与爬行类的扬子鳄(Alligator sinensis)和哺乳类的人、小白鼠的遗传距离较远。
2.4 TRIM32真核表达产物免疫印迹检测
构建重组质粒pcDNA4.0-TRIM32并转染至EPC细胞, 经Western-blotting分析检测TRIM32的表达情况, 结果显示在约75 kD处有特异性条带, 且与目的蛋白理论大小一致, 而空载体pcDNA4.0转染组无特异性条带, 证明目的蛋白在EPC细胞中得到表达(图 4)。
2.5 TRIM32蛋白在EPC细胞中的定位
将重组质粒pcDNA4.0-TRIM32转染至EPC细胞, 36h后进行间接免疫荧光试验检测, 同时以空载体pcDNA4.0转染EPC细胞作为对照。结果显示: 在pcDNA4.0-TRIM32转染组中有明显的绿色荧光, 表明TRIM32蛋白主要以点状分布在细胞质中, 细胞核中表达量较少(图 5)。
2.6 草鱼TRIM32在不同组织及不同胚胎发育时期的表达分析
采用实时荧光定量PCR对TRIM32基因在草鱼不同组织的表达进行分析, 结果表明TRIM32在草鱼的组织中广泛表达, 而在头肾组织中TRIM32的表达水平最高, 脾脏与脑组织次之, 肌肉组织中表达量最少(图 6)。

图 2 草鱼TRIM32蛋白与其他物种序列比对Fig.2 Grass carp(C.idellus)TRIM32 amino acids sequence
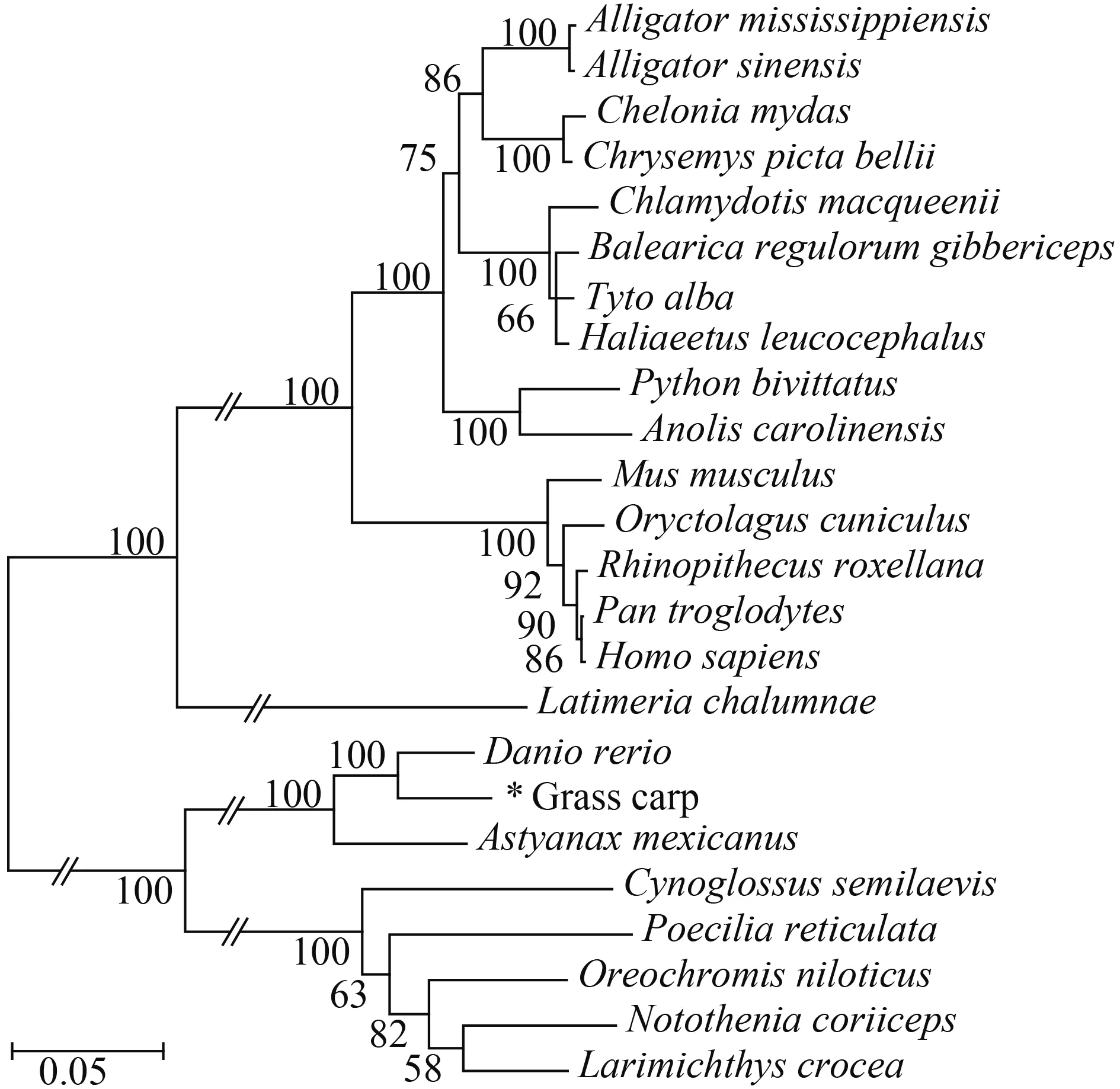
图 3 草鱼与其他物种TRIM32的进化树分析Fig.3 The phylogenetic tree of TRIM32 from grass carp (C.idellus) and other species

图 4 Western blotting检测TRIM32在EPC细胞中的表达Fig.4 Western blotting of TRIM32 in EPC cells
对草鱼不同胚胎发育时期TRIM32的表达量进行了分析, 结果表明TRIM32在整个胚胎发育时期均有表达, 而在受精卵时期、卵裂期和囊胚期的表达量显著高于其他时期, 随后表达量下降, 直到出膜后表达量再次显著升高(图 7)。
2.7 草鱼TRIM32激活转录因子NF-κB
将pcDNA4.0-TRIM32质粒、pNF-κB-Luc质粒和pRL-TK质粒共转染EPC细胞, 48h后, 用双荧光素酶报告系统检测, 结果显示: 转染草鱼TRIM32报告基因组活性是对照组的1.66倍(图 8), 说明草鱼TRIM32能够激活NF-κB的活性。
3 讨论
3.1 草鱼TRIM32的克隆及生物信息学分析
本研究成功克隆了草鱼TRIM32基因的编码区全长, 核苷酸序列比对分析表明与斑马鱼、鲤具有很高的同源性, 分别为87%和90%, 同时与人类、小鼠也具有较高的相似性。蛋白预测分析表明, TRIM32含有一个RING结构域、一个B-box结构域和一个SPRY结构域。从鱼类到人类的演化过程中,重要功能区域RING结构域较为保守, 说明该基因在脊椎动物的生命活动中起到不可替代的重要作用[17]。这与之前的一些研究结果相似, 如人类与斑马鱼TRIM家族的基因同源性比较及进化分析表明,该TRIM家族基因的进化与物种进化相一致[18]。这说明了该结构域在进化中的保守性及生理功能的重要性。此外, 草鱼TRIM32主要以点状分布在细胞质中, 细胞核中表达量较少, 这一现象与哺乳动物中的报道一致[6]。
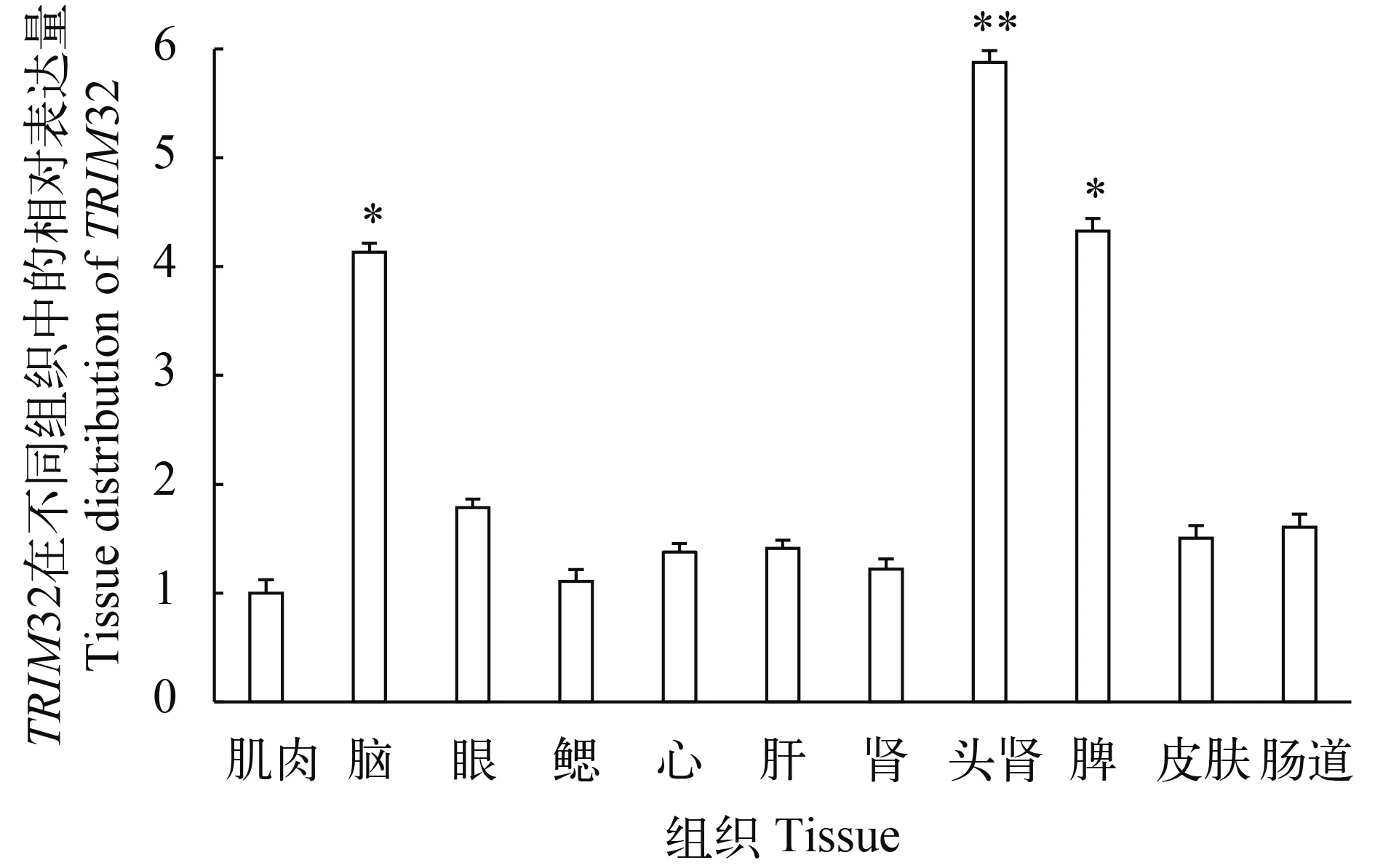
图 6 草鱼TRIM32基因在不同组织中的表达Fig.6 The relative mRNA level of TRIM32 in different tissues

图 7 草鱼TRIM32基因在不同发育时期胚胎中的表达Fig.7 Expression profile of TRIM32 during different early embryonic development stages
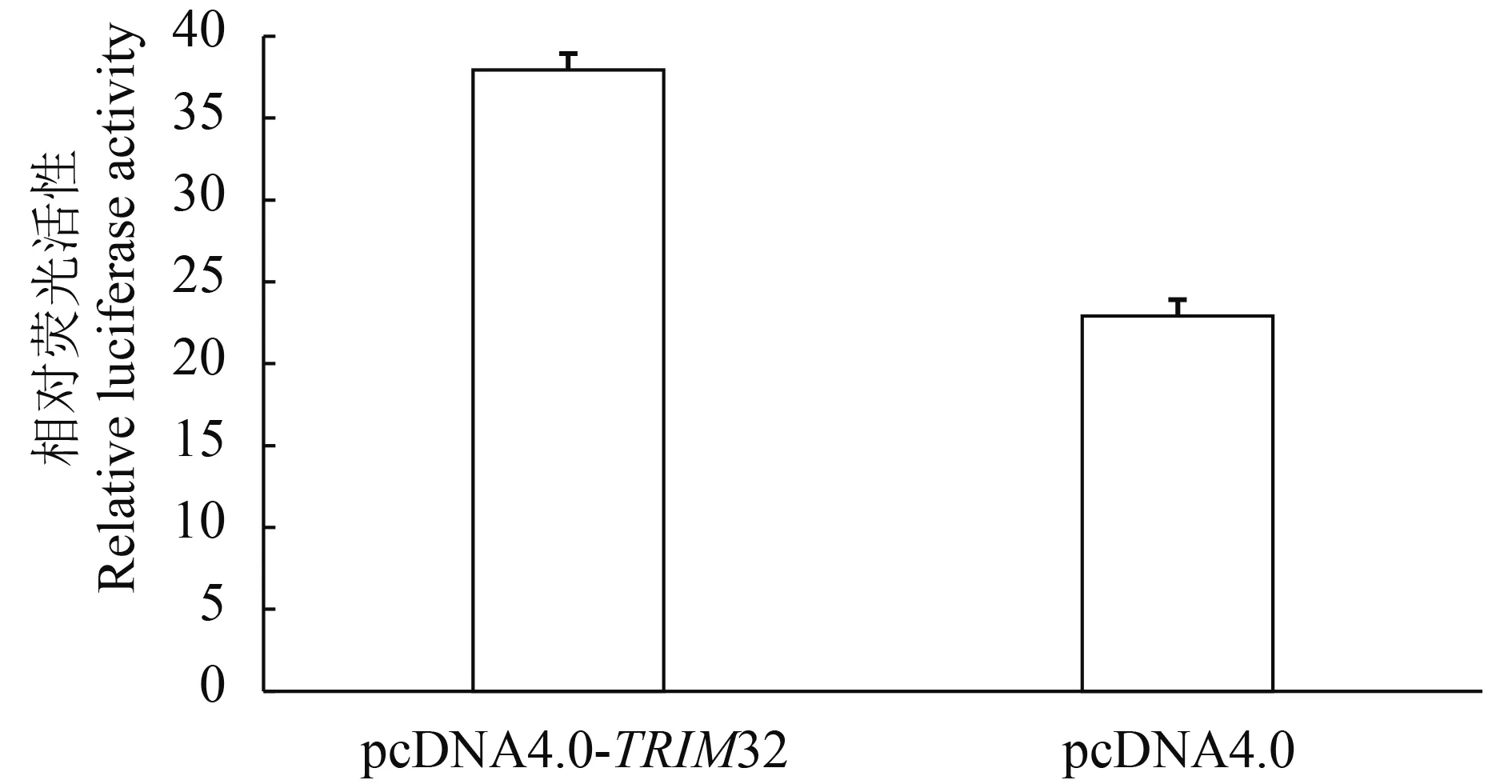
图 8 TRIM32激活NF-kB的相对荧光活性Fig.8 Induction of NF-kB relative luciferase activity by TRIM32 protein
3.2 草鱼TRIM32的表达分析
TRIM32在草鱼的组织中广泛分布, 在头肾组织中的表达水平明显高于其他组织, 表明该蛋白可能与机体的免疫功能相关。草鱼在不同胚胎发育时期TRIM32的表达情况显示, 该蛋白在整个胚胎发育时期均有表达, 在受精卵时期、卵裂期和囊胚期的表达量显著高于其他时期, 随后表达量下降,直到出膜后表达量再次显著性升高。因此推测胚胎在出膜之前, 由于卵膜的保护作用, 或许不需要功能性的防御系统[19]。TRIM32在胚胎发育早期表达水平较高, 随着发育的进行, 在原肠胚期下降到最低水平直到心跳期都一直保持着较低水平。这说明TRIM32在早期的高表达主要与受精卵中母性遗传物质存在较多有关[20]。TRIM32在出膜期表达量又显著性升高, 并在出膜后一直保持着相对较高水平, 表明在胚胎发育早期抵抗病原体感染方面可能发挥着重要作用。
3.3 草鱼TRIM32的功能探究
草鱼TRIM32在EPC细胞中过表达后, 通过双荧光素酶系统检测显示, 转染草鱼TRIM32报告基因活性是对照组的1.66倍。这说明草鱼TRIM32的功能和哺乳动物TRIM32的功能类似, 能够激活NF-κB信号通路, 诱导下游的炎症反应[21,22]。草鱼TRIM32诱导的数量级低于TRIM32在哺乳动物细胞中过表达的数量级, Zhang等[23]在293细胞中TRIM32对NF-κB的诱导是对照组的9倍。在鱼类研究中也有类似的报道, CgsMyD88在大鲵肌肉细胞(GSM)中的报告基因活性是对照组的1.88倍[24],明显低于大西洋鲑鱼MyD88在293细胞中的数量级[25],猜测可能由于NF-κB启动子的来源不同导致。此外, 在本实验中荧光的活性低于在哺乳动物细胞中的活性, 可能是由于鱼类细胞的转染效率低于哺乳动物, 使得TRIM32的表达量较低, 从而导致数量级较低。
综上所述, 本研究成功克隆了草鱼TRIM32编码区全长, 该序列含有TRIM家族特有的结构特征。TRIM32的组织表达结果显示TRIM32在头肾组织中的表达量显著高于其他组织; 不同胚胎发育时期的表达分析进一步表明, TRIM32在受精卵时期、卵裂期和囊胚期的表达量显著高于其他时期,随后表达量下降, 直到出膜后表达量再次显著性升高。此外, 通过双荧光素酶检测系统显示TRIM32能够激活NF-κB信号通路, 诱导下游的炎症反应,说明草鱼TRIM32在天然免疫中扮演着重要角色,但其具体机制还需进一步探究。
[1]Reymond A, Meroni G, Fantozzi A, et al.The tripartite motif family identifies cell compartments [J].EMBO Journal, 2001, 20(9): 2140—2151
[2]McNab F W, Rajsbaum R, Stoye J P, et al.Tripartite-motif proteins and innate immune regulation [J].Current Opinion in Immunology, 2011, 23(1): 46—56
[3]Kawai T, Akira S.Regulation of innate immune signalling pathways by the tripartite motif (TRIM) family proteins [J].EMBO Molecular Medicine, 2011, 3(9): 513—527
[4]Song B.TRIM5alpha [J].Current Topics in Microbiology and Immunology, 2009, 339: 47—66
[5]Brass A L, Dykxhoorn D M, Benita Y, et al.Identification of host proteins required for HIV infection through a functional genomic screen [J].Science, 2008, 319(5865): 921—926
[6]Albor A, El-Hizawi S, Horn E J, et al.The interaction of Piasy with Trim32, an E3-ubiquitin ligase mutated in limb-girdle muscular dystrophy type 2H, promotes Piasy degradation and regulates UVB-induced keratinocyte apoptosis through NFkappaB [J].The Journal of Biological Chemistry, 2006, 281(35): 25850—25866
[7]Rahm N, Telenti A.The role of tripartite motif family members in mediating susceptibility to HIV-1 infection [J].Current Opinion in HIV and AIDS, 2012, 7(2): 180—186
[8]Ozato K, Shin D M, Chang T H, et al.TRIM family proteins and their emerging roles in innate immunity [J].Nature Reviews.Immunology, 2008, 8(11): 849—860
[9]Uchil P D, Quinlan B D, Chan W T, et al.TRIM E3 ligases interfere with early and late stages of the retroviral life cycle [J].PLoS Pathogens, 2008, 5(2): 1—13
[10]Uchil P D, Hinz A, Siegel S, et al.TRIM protein-mediated regulation of inflammatory and innate immune signaling and its association with antiretroviral activity [J].Journal of Virology, 2013, 87(1): 257—272
[11]Slack F J, Ruvkun G.A novel repeat domain that is often associated with RING finger and B-box motifs [J].Trends in Biochemical Sciences (Regular Edition), 1998, 23(12): 474
[12]Frosk P, Weiler T, Nylen E, et al.Limb-girdle muscular dystrophy type 2H associated with mutation in TRIM32, a putative e3-ubiquitin–ligase gene [J].American Journal of Human Genetics, 2002, 70(3): 663—672
[13]Chiang A P, Beck J S, Yen H J, et al.Homozygosity mapping with SNP arrays identifies TRIM32, an E3 ubiquitin ligase, as a Bardet-Biedl syndrome gene (BBS11) [J].Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(16): 6287—6292
[14]Aa L V, Levraud J P, Yahmi M, et al.A large new subset of TRIM genes highly diversified by duplication and positive selection in teleost fish [J].BMC Biology, 2009, 7(1): 1—23
[15]Aa L V, Jouneau L, Laplantine E, et al.FinTRIMs, fish virus-inducible proteins with E3 ubiquitin ligase activity [J].Developmental & Comparative Immunology, 2012, 36(36): 433—441
[16]Wei W, Huang Y, Yu Y, et al.Fish TRIM39 regulates cell cycle progression and exerts its antiviral function against iridovirus and nodavirus [J].Fish & Shellfish Immunology, 2016, 50: 1—10
[17]Fu B S, Wang L Y, Ding H, et al.TRIM32 senses and restricts influenza a virus by ubiquitination of PB1 polymerase [J].PLoS Pathogens, 2015, 11(6): 1—23
[18]Boudinot, Van D A, Lieke M, et al.Origin and evolution of TRIM proteins: new Insights from the complete TRIM repertoire of zebrafish an pufferfish [J].PloS One, 2011, 6(7): 1—18
[19]Yang A, Zhou Z, Dong Y, et al.Expression of immunerelated genes in embryos and larvae of sea cucumber Apostichopus japonicas [J].Fish & Shellfish Immunology, 2010, 29(5): 839—845
[20]Ma K Y, Liu Z Q, Lina J Y, et al.Molecular characterization of a novelovary-specific gene fem-1 homolog from the oriental river prawn, Macrobrachium nipponense [J].Gene, 2016, 575(2): 244—252
[21]Ruelas D S, Chan J K, Oh E, et al.MicroRNA-155 reinforces HIV latency [J].Journal of Biological Chemistry, 2015, 290(22): 13736—13748
[22]Locke M, Tinsley C L, Benson M A, et al.TRIM32 is an E3 ubiquitin ligase for dysbindin.Hum [J].Molecular Genetics and Genomics, 2009, 18(13): 2344—2358
[23]Zhang J, Hu M M, Wang Y Y, et al.TRIM32 protein modulates type I interferon induction and cellular antiviral response by targeting MITA/STING protein for K63-linked ubiquitination [J].Journal of Biological Chemistry, 2012, 287(34): 28646—28655
[24]Huang L, Fan Y, Yong Z, et al.Cloning, sequence analysis and expression profiles of Toll-like receptor 7 from Chinese giant salamander Andrias davidianus [J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology, 2015, 184: 52—57
[25]Skjaeveland I, Iliev D B, Strandskog G, et al.Identification and characterization of TLR8 and MyD88 homologs in Atlantic salmon (Salmo salar) [J].Developmental & Comparative Immunology, 2009, 33(9): 1011—1017
THE PRELIMINARY STUDY ON CLONING, EXPRESSION PROFILES AND FUNCTION OF GRASS CARP (CTENOPHARYNGODON IDELLUS) TRIM32
JIA Lu-Lu1,2,3,4, ZENG Ling-Bing2, WANG Fang1,3,4, PENG Jun-Jie1,3,4, WANG Ye-Da1,3,4, ZHOU Yong2and LIU Xue-Qin1,3,4
(1.Department of Aquatic Animal Medicine, College of Fisheries, Huazhong Agricultural University, Wuhan 430070, China; 2.Chinese Academy of Fishery Sciences, Yangtze River Fisheries Research Institute, Wuhan 430070, China; 3.Freshwater Aquaculture Collaborative Innovation Center of Hubei Province, Wuhan 430070, China; 4.Hubei Provincial Engineering Laboratory for Pond Aquaculture, Wuhan 430070, China)
The TRIM family, an important member in natural immune system, regulates cell proliferation, differentiation, apoptosis, tumor suppression, antiviral activity and other processes.The TRIM32 full-length sequence of grass carp (Ctenopharyngodon idellus) was cloned by using PCR method.It was 1980 bp in length encoding 660 amino acids.The TRIM32 protein has three typical structural features of the TRIM family.Sequence analysis indicated that TRIM32 of grass carp shared the highest identity with zebrafish, which belongs to the same branch on the phylogenetic trees.Immunofluorescence and Western-blotting showed that TRIM32 successfully expressed in cytoplasmic speckles of EPC cells.Tssue distribution analysis showed that TRIM32 was widely expressed, especially in the renal tissue.TRIM32 was significantly higher in zygote period, cleavage and blastula stage than that of the other stages during different stages of embryonic development, and then decreased until hatching in which it increased significantly.In addition, grass carp TRIM32 can activate the nuclear factor NF-κB based on dual luciferase assay and induce inflammation.
TRIM32; Cloning; Eukaryotic expression; NF-κB
Q344+.1
A
1000-3207(2017)04-0741-07
10.7541/2017.92
2016-07-07;
2016-11-07
湖北省科技支撑计划项目(2015BBA234)资助 [Supported by the Science & Technology Supporting Program from Hubei Province (2015BBA234)]
贾路路(1991—), 女, 河南濮阳人; 硕士; 主要从事鱼类疾病学研究。E-mail: 15527985398@163.com
刘学芹, 女, 山东烟台人; 博士, 教授, 硕士生导师; 主要从事水产病毒致病机理与综合防控研究。E-mail: xueqinliu@mail.hzau.edu.cn
