椎管内原发黑色素瘤2例并临床分析
2017-08-16陈大伟
陈 凡,李 琮,郭 振,陈大伟△
(吉林大学白求恩第一医院:1.神经肿瘤外科;2.肾病内科;3.心内科,长春 130021)
·短篇及病例报道· doi:10.3969/j.issn.1671-8348.2017.19.047
椎管内原发黑色素瘤2例并临床分析
陈 凡1,李 琮2,郭 振3,陈大伟1△
(吉林大学白求恩第一医院:1.神经肿瘤外科;2.肾病内科;3.心内科,长春 130021)
颅内原发性黑色素瘤(primary melanocytic neoplasms,PMN)起源于软脑膜黑色素细胞,临床少见,占颅内肿瘤的0.07%~0.17%[1],而原发于椎管内的黑色素瘤(ISPMN)则更为罕见,多位于髓外硬膜下或硬脊膜内外脊神经根附近,神经根痛常为首发症状。ISPMN的影像学表现多样,容易误诊,尤其易误诊为神经源性鞘瘤。此外,ISPMN整体恶性程度高,术后易复发,放、化疗敏感性欠佳,治疗效果差,并且以恶性多见,总体愈后较差。本文总结2例就诊于本院神经肿瘤外科的ISPMN患者的临床资料,现报道如下。
1 病例资料
1.1 患者1 男,35岁,右利手。主因发现椎管内占位2年伴左下肢胀痛3个月入院。患者2年前因腰椎间盘突出在当地医院行腰椎内固定术,术中发现椎管内占位,因当地医院条件限制未行肿物切除。体检:全身皮肤黏膜无黑色素痣及色素沉着,神清语利,双下肢肌力Ⅴ级,肌张力正常,左下肢及左侧臀部胀痛感存在,左小腿外侧感觉减退,生理反射存在,病理反射未引出。腰椎磁共振成像(MRI)平扫+增强(图1A、B)示:腰4~5(L4~L5)椎体内固定术后改变,L4~L5平面椎管及左侧椎间孔占位,考虑神经鞘瘤,腰3~4(L3~L4)/腰5~骶1(L5~S1)椎间盘轻度突出。术前诊断:L5神经鞘瘤。治疗经过:全身麻醉下右侧卧位进行手术,术中见部分瘤体侵袭硬脊膜、椎骨,纵行切开硬脊膜,见肿瘤发自神经根,灰白、质韧,血供丰富,大小约3.5 cm×3.0 cm×3.0 cm,显微镜下分块切除肿瘤。病理组织学:苏木精-伊红(HE)染色示细胞质呈嗜酸性,细胞较大,类圆形或多边形,细胞质丰富,瘤细胞巢状分布(图1C)。免疫组织化学:胶质纤维酸性蛋白(GFAP)(-),S-100(+),细胞角蛋白(CK)(-),上皮细胞膜抗原(EMA)(-),抗黑色素瘤特异性抗体(HMB45)(-),孕激素受体(PR)(-),嗜铬素蛋白-A(CgA)(-),突触素(Syn)(-),Ki-67(+<5%)。病理诊断:黑色素瘤。术后正电子发射计算机体层摄影(PET)-CT证实肿瘤全切(图1D)。患者术后胀痛感消失,左侧拇指麻木感存在,未出现大小便失禁等相关并发症。给予对症治疗,左侧拇指麻木感9 d后消失。患者住院15 d出院,未行放化疗,随访10个月,现患者正常工作生活。
1.2 患者2 男,59岁,右利手。主因自觉剑突水平以下痛温觉减退1年,行走不稳1个月入院。患者1年前出现剑突平面以下痛温觉减退,未予治疗,1个月前无明显诱因出现行走不稳。体检:神清语明,全身皮肤黏膜无色素沉着、无黑色素痣,胸4(T4)平面以下浅感觉减退,双侧腹壁反射减弱,左下肢肌力Ⅳ级,右下肢肌力Ⅲ级,肌张力正常,右侧跟膝胫实验(+),其余检查未见明显异常。胸椎MRI(图2A):T4椎体水平椎管内髓外可见0.6 cm×2.7 cm×1.3 cm椭圆形异常信号,T1、T2及压脂像均呈低信号,相应节段脊髓受压变形,注射钆对比剂后病灶强化不均匀。术前诊断:T4水平椎管内占位性病变。治疗经过:全身麻醉下手术,采取后入路,咬除T4棘突后见硬脊膜膨隆,纵行切开硬脊膜,未见脊髓搏动,可见肿瘤与右侧神经根及脊髓背侧粘连,质韧,灰黑色,包膜完整,血供较丰富,T4水平脊髓受压变薄,电生理监护下行肿瘤切除,显微镜下分离肿瘤与周边组织,完整切除肿瘤,数分钟后脊髓搏动恢复。病理组织学(图2B):HE染色显示肿瘤细胞无明显色素颗粒,胞质呈嗜酸性,核分裂象明显,可见中间级肿瘤细胞。免疫组织化学:GFAP(-),S-100(+),CK(-),EMA(-),HMB45(-),PR(-),Syn(-),Ki-67(+<5%)。病理诊断:椎管内中间级别黑色素细胞瘤,世界卫生组织(WHO)分级Ⅱ级伴坏死。患者术后T4平面以下浅感觉障碍及双下肢肢力明显改善,术后3 d复查胸椎MRI显示(图2C):肿瘤消失。患者术后14 d出院,未行放化疗,随访1年未见复发。

A:术前MRI平扫T1WI;B:术前MRI增强;C:病理组织学(HE染色,×400);D:术后复查PET-CT显示肿瘤全切
图1 患者1影像学与组织病理学检测图
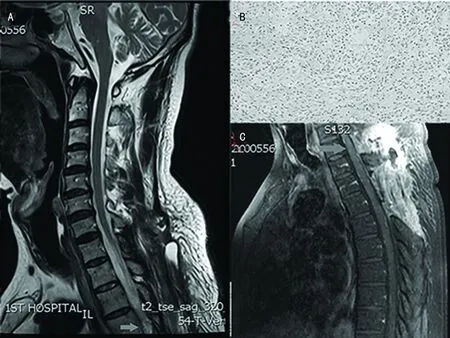
A:术前MRI平扫T2WI;B:病理组织学(HE染色,×200);C:术后复查胸椎MRI显示肿瘤全切
图2 患者2影像学与组织病理学检测图
3 讨 论
ISPMN是一种罕见的中枢神经系统肿瘤,常起源于软脑膜黑色素细胞,呈孤立性色素性病变,50岁左右高发,无明显性别差异,胸段最常见,颈段次之,腰段罕见[2]。2007年WHO将ISPMN定义为一组起源于软脑脊膜的良性或恶性肿瘤,目前尚不能确定其准确的细胞起源,可能来源于软脑膜的黑色素细胞或者先天性神经外胚层的缺失[2]。有学者提出中枢神经系统(CNS)原发和转移黑色素瘤的诊断标准:黑色素仅存在CNS而皮肤黏膜无相关病变为原发,CNS黑色素瘤同时皮肤黏膜存在相关病变为转移[3-4]。另有研究者提出诊断ISPMN的条件:(1)没有CNS以外的恶性黑色素瘤;(2)病变经病理证实[5]。
MRI是诊断CNS肿瘤的首选方法[6],但并不能将黑色素细胞肿瘤与其他椎管内肿瘤更好地区分。黑色素细胞肿瘤中的黑色素颗粒是一种顺磁性物质,它能够缩短T1、T2弛豫时间,由此可见黑素色素瘤一般在T1像为高信号、T2像为低信号,但临床上常遇到瘤卒中等情况,肿瘤缺乏典型核磁表现[2,7]。根据黑色素瘤内黑色素的含量不同,将磁共振(MR)表现分为4型:(1)黑色素型,表现为T1像高信号,T2像低信号;(2)非色素型,T1像为低或高信号,T2WI为高或等信号;(3)混合型,与黑色素型与非色素型均不同的混合特征;(4)出血型,仅有血肿特征。MRI上黑色素瘤的T1信号强度随黑色素水平的增加而增加,而黑色素颗粒对T2弛豫时间的缩短是相对缩短,T2的信号强度与黑色素水平关系不甚密切,但当肿瘤较小时,T2较为敏感,瘤内出血可改变影像特点,而且血液对影像特点的影响要大于黑色素[8]。任爱军等[9]认为,出血会严重影响MR诊断,血液中的去氧血红蛋白等物质具有顺磁性,可掩盖肿瘤对T1、T2弛豫时间的影响,仅表现为不同出血时期的MR特点。Isiklar等[10]研究表明,临床上仅有25%左右的患者具有典型影像学表现,当肿瘤中黑色素细胞含量超过10%才会出现黑色素细胞肿瘤的典型影像表现。因此,单纯依靠MRI诊断,容易造成误诊。
ISPMN较罕见,需要免疫组织化学和电子显微镜确诊[11]。大多数黑色素细胞病变显示黑色素分布在肿瘤细胞、肿瘤间质和肿瘤巨噬细胞的细胞质。恶性黑色素瘤镜下示:肿瘤细胞多形性显著,大小形态不一,有极性突起及黏着带,排列成片状和松散的巢状,或沿血管周围延伸,侵犯基底膜层;细胞核大、不规则形、染色质粗,核仁不明显,呈双核或多核,异常核分裂象多见;黑色素颗粒充满细胞质,黑色素小体和前黑色素小体共存。CNS黑色素瘤可以根据有丝分裂活动分为中间级黑色素细胞肿瘤和恶性黑色素细胞肿瘤。恶性黑色素瘤更多为多形性,有更多的未分化的细胞核,细胞密度高,凝固性坏死多见。色素性病变(即黑色素瘤、恶性黑色素瘤和黑素细胞增生症)的免疫组织化学分布相似,即HMB-45、Melan-A、S-100蛋白和波形蛋白阳性。有研究认为,核的大小是鉴别良恶性黑色素细胞病变的一种依据[12-13]。
同其他CNS肿瘤一样,手术治疗是ISPMN的首选治疗方法[14],但由于肿瘤具有沿蛛网膜下腔和血管神经间隙蔓延、侵袭的特点,很难做到全切除,因此术后应辅助其他治疗措施[15-17]。在保全神经功能的前提下,尽可能彻底地切除肿瘤以防止术后复发及恶变,手术可在神经电生理检测下进行。对于与脊髓粘连紧密者,无需强行剥离,以免出现严重后果,术后可给予放疗。但放疗对于CNS黑色素细胞肿瘤的治疗效果仍有争议,尽管手术+放疗对减少肿瘤局部复发及减轻神经功能缺损优于单纯手术,但对患者的整体生存期并没有显著影响[16,18]。一项纳入686例脑转移性黑色素瘤的研究显示,单纯手术组与手术+放疗组的整体生存期分别为8.7、8.9个月,两组比较差异无统计学意义(P>0.05)[15]。然而,大多数学者认为,对于多发病变不适合手术的患者,放疗仍可作为一种姑息治疗措施[18]。化疗作为转移性黑色素瘤的辅助治疗措施显示了一定的作用。有研究者指出,当肿瘤侵袭脑组织1~2 mm,血脑屏障会被破坏,可增加化疗药物的通透性[18]。长期以来,最常用的化疗药物为氮烯咪胺,但由于其难以透过血脑屏障,效果较差。近年来,替莫唑胺、福莫司汀在多项临床试验中显示出明显的抗黑色素瘤活性,并且由于其较好的血脑屏障通透性,临床应用较广泛[15-16,18]。
综上所述,ISPMN是一种罕见的CNS肿瘤,预后较恶性黑色素瘤好,综合文献笔者认为应在保全神经功能的前提下尽可能全切,对于年老、体质较差者,可在活检明确病理后行放化疗。
[1]Brat DJ,Giannini C,Scheichauer BW,et al.Primary melanocytic neoplasms of the central nervous systems[J].Am J Surg Pathol,1999,23(7):745-754.
[2]Kim MS,Yoon DH,Shin DA.Primary spinal cord melanoma[J].J Korean Neurosurg Soc,2010,48(2):157-161.
[3]李永,王硕,赵继宗.中枢神经系统黑色素瘤15例临床分析[J].中华医学杂志,2004,84(2):134-137.
[4]Greco Crasto S,Soffietti R,Bradac GB,et al.Primitive cerebral melanoma:ease report and review of the literature[J].Surg Neurol,2001,55(3):163-168.
[5]Salame K,Merimsky O,Yosipov J,et al.Primary intramedullary spinal melanoma:diagnostic and treatment problems[J].J Neumoncol,1998,36(2):79-83.
[6]Kwon SC,Rhim SC,Lee DH,et al.Primary malignant melanoma of the cervical spinal nerve root[J].Yonsei Med J,2004,45(2):345-348.
[7]Farrokh D,Fransen P,Faverly D.MR findings of a primary intramedullary malignant melanoma:case report and literature review[J].Am J Neuroradiol,2001,22(10):1864-1866.
[8]Doglietto F,Colosimo C,Lauriola L,et al.Intracranial melanocytic meningeal tumours and melanosis oculi:case report and literature review[J].BMC Cancer,2012,12:220.
[9]任爱军,王亚明,郭勇.椎管内原发性黑色素细胞肿瘤的MRI诊断[J].中华放射学杂志,2008,42(12):1249-1252.
[10]Isiklar I,Leeds NE,Fuller GN,et al.Intracranial metastatic melanoma:correlation between MR imaging characteristics and melanin content.[J].AJR Am J Roentgenol,1995,165(6):1503-1512.
[11]Ma J,Zhang Z,Li S,et al.Intracranial amelanotic melanoma:a case report with literature review[J].World J Surg Oncol,2015,13:182.
[12]Li LX,Crotty KA,Scolyer RA,et al.Use of multiple cytometric markers improves discrimination between benign and malignant melanocytic lesions:a study of DNA microdensitometry,karyometry,argyrophilic staining of nucleolar organizer regions and MIB1-Ki67 immunoreactivity[J].Melanoma Res,2003,13(6):581-586.
[13]Miedema J,Marron JS,Niethammer M,et al.Image and statistical analysis of melanocytic histology[J].Histopathology,2012,61(3):436-444.
[14]Francois P,Lioret E,Jan M.Primary spinal melanoma:case report[J].Br J Neurosurg,1998,12(2):179-182.
[15]Flanigan JC,Jilaveanu LB,Chiang VL,et al.Advances in therapy for melanoma brain metastases[J].Clin Dermatol,2013,31(3):264-281.
[16]Ly D,Bagshaw HP,Anker CJ,et al.Local control after stereotactic radiosurgery for brain metastases in patients with melanoma with and without BRAF mutation and treatment[J].J Neurosurg,2015,123(2):395-401.
[17]Wang J,Guo ZZ,Wang YJ,et al.Microsurgery for the treatment of primary malignant intracranial melanoma:a surgical series and literature review[J].Eur J Surg Oncol,2014,40(9):1062-1071.
陈凡(1993-),在读硕士,主要从事脑及脊髓肿瘤方面的研究。△
,E-mail:cdw2006@.Tom.com。
R739.4
C
1671-8348(2017)19-2734-03
2017-02-11
2017-04-08)
