多西他赛或伊立替康联合奥沙利铂及替吉奥治疗晚期胃癌的临床疗效及安全性分析
2017-08-16谢文健
谢文健,闵 江,钱 昆,张 伟
(重庆医科大学附属第一医院胃肠外科,重庆 400016)
多西他赛或伊立替康联合奥沙利铂及替吉奥治疗晚期胃癌的临床疗效及安全性分析
谢文健,闵 江,钱 昆,张 伟△
(重庆医科大学附属第一医院胃肠外科,重庆 400016)
目的 观察多西他赛(TXT)或伊立替康(CPT-11)联合奥沙利铂(L-OHP)及替吉奥治疗晚期胃癌的临床疗效与安全性。方法 收集2010年1月1日至2016年3月1日该院胃肠外科收治的符合入组条件的62例ⅢB~Ⅳ晚期胃癌患者,将其分为TXT联合L-OHP及替吉奥组(改良DCF组,33例)和CPT-11联合L-OHP及替吉奥组(改良ICF组,29例),所有患者完成1个周期及以上的化疗,直至疾病出现进展或出现不可耐受的不良反应。化疗结束后,对两组患者的疗效、不良反应,以及新辅助化疗后再行手术治疗的效果进行对比分析。结果 改良DCF组的客观缓解率(ORR)为60.6%,高于改良ICF组的51.7%,但两组近期疗效比较,差异无统计学意义(Z=-0.837,P=0.403);两组胃肠道反应、骨髓抑制、神经毒性、脱发和肝功能异常等主要不良反应的发生率比较,差异均无统计学意义(P>0.05)。改良DCF组与改良ICF组新辅助化疗后再行手术治疗的根治性切除率分别为66.7%、62.1%,差异无统计学意义(χ2=0.143,P=0.706);术后主要并发症为吻合口瘘、吻合口梗阻、腹腔感染、肺部感染、切口感染、胃动力障碍等,两组并发症的发生率比较,差异无统计学意义(P>0.05)。两组化疗后生活质量比较,差异无统计学意义(χ2=1.572,P=0.456)。结论 TXT联合L-OHP及替吉奥与CPT-11联合L-OHP及替吉奥治疗晚期胃癌的疗效相近,可缩小瘤体,提高根治性切除率,不良反应大致相同,均可耐受,值得临床进一步研究与应用。
胃肿瘤,晚期;多西他赛;伊立替康;奥沙利铂;替吉奥;新辅助化疗;治疗效果
University,Chongqing400016,China)
近年来,胃癌仍然是我国恶性肿瘤发病率和病死率最高的肿瘤之一。世界卫生组织公布的报告显示,全球胃癌发病率为13.9/10万,居恶性肿瘤第2位,在我国每年新增胃癌患者40万,占世界总新增患者数的40%以上[1]。虽然胃癌的发病率与病死率在许多国家已呈下降趋势,但是由于胃癌早期无明显症状,当出现显著症状时,病情往往发展至较晚期,约60%患者确诊时即为局部晚期或已发生远处转移,失去手术机会,患者5年生存率不超过40%[2]。目前在胃癌的综合治疗方案中手术切除仍占主导地位,但是手术切除后仍有约60%的复发率。多项研究表明,晚期胃癌患者进行化疗能够缓解症状、获得生存益处[3]。因此,开展相关的临床化疗研究对进一步提高化疗的反应率,降低不良反应发生率,提高手术切除率及延长患者生存期具有重要意义。基于此,笔者回顾性分析2010-2016年于本科室使用多西他赛(TXT)联合奥沙利铂(L-OHP)和替吉奥(改良DCF方案),以及伊立替康(CPT-11)联合L-OHP和替吉奥(改良ICF方案)治疗的共62例晚期胃癌患者,比较两种方案的疗效、不良反应、手术切除率及并发症,现报道如下。
1 资料与方法
1.1 一般资料 选取2010年1月1日至2016年3月1日本院胃肠外科收治的62例ⅢB~Ⅳ晚期胃癌患者,本研究通过本院伦理委员会批准。纳入标准:(1)经胃镜和(或)腹腔镜取得病理组织证实为胃癌,经胸腹部CT检查确定临床分期为胃癌ⅢB~Ⅳ期;(2)治疗前均有可测量病灶,转移部位包括肝、腹腔淋巴结、肺、骨、肾等;(3)不能手术或拒绝手术且为初次进行化疗;(4)血常规、生化指标、心电图等检查在正常范围内,无化疗禁忌证;(5)治疗前卡氏行为状态(KPS)评分大于或等于70 分, 预计生存时间大于4个月;(6)治疗前签订知情同意书。将62例患者按照采取的不同化疗方案分为两组:改良DCF组33例,改良ICF组29例。两组患者一般临床资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。
1.2 方法
1.2.1 治疗方法 改良DCF组:TXT 75 mg/m2,静脉滴注,第1天;L-OHP 75 mg/m2,静脉滴注,第2天;替吉奥40 mg/m2,口服,每日2次,第3~23天。改良ICF组:CPT-11 75 mg/m2,静脉滴注,第1天;L-OHP 75 mg/m2,静脉滴注,第2天;替吉奥40 mg/m2,口服,每日2次,第3~23天。每30天重复。用药前严格按照患者的体表面积计算各化疗药物剂量,对于高龄或体弱患者在30%的范围内减少药物用量。每次化疗前、后分别常规给予盐酸托烷司琼止吐和10 mg地塞米松预防过敏,同时给予抑酸护胃、保肝及水化辅助治疗。对于出现白细胞下降患者常规给予重组人粒细胞刺激因子治疗;对于大于或等于Ⅱ度消化道反应患者给予止吐、止泻、输液等对症支持治疗;出现神经毒性,予以大量维生素及营养神经对症治疗。对于疗效评价为疾病进展(PD)的患者,之后根据其意愿接受二、三线方案化疗或支持治疗,对化疗后病情得到缓解的患者给予根治性手术治疗或姑息性手术治疗。
1.2.2 疗效及不良反应评价 每周期化疗前和化疗后进行三大常规、肝肾功能、癌谱、心电图及胸腹部CT检查,进而行疗效与不良反应评估。临床疗效判定根据美国临床肿瘤学会2000年公布的实体瘤疗效评价标准(RECIST):完全缓解(CR),全部病灶消失,并持续4周以上;部分缓解(PR),肿瘤2个最大的相互垂直的直径乘积缩小大于50%,并持续4周以上,无新病灶出现;疾病稳定(SD),肿瘤2个最大的相互垂直的直径乘积缩小小于50%,增大小于25%,并持续4周以上,无新病灶出现;疾病进展(PD),肿瘤2个最大的相互垂直的直径乘积增大大于25%或者有新病灶出现[4]。客观缓解率(ORR)为CR+PR患者所占百分比;疾病控制率(DCR) 为CR+PR+SD患者所占百分比。每例患者随访时间从第1次化疗开始到化疗周期结束、肿瘤出现进展、患者失访或死亡,随访截止时间为2016年6月31日。不良反应根据美国国家癌症研究所(NCI)2009年通用毒性评价标准(CTC)4.0版进行分级,分为0~Ⅳ级[5]。生活质量参照Kamofsky评分(KPS)标准判定:治疗后评分较治疗前增加大于或等于10分者判为提高,评分增减小于10分者判为稳定,评分减少大于10分者为减退。生活质量包括行为状态评分、体质量、患者的主观感受及治疗前后食欲变化。化疗后手术情况主要评价手术切除率及其相应并发症发生情况。
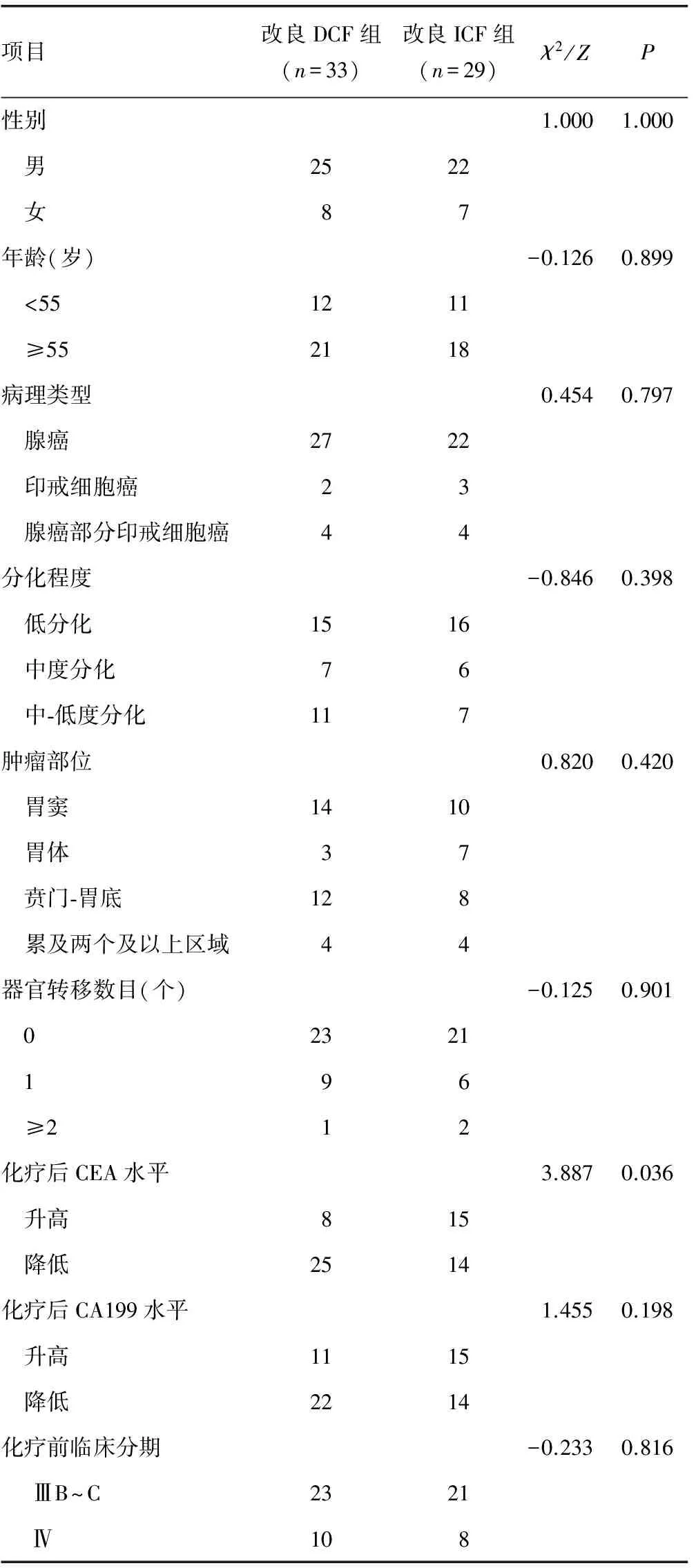
表1 两组一般临床资料比较(n)
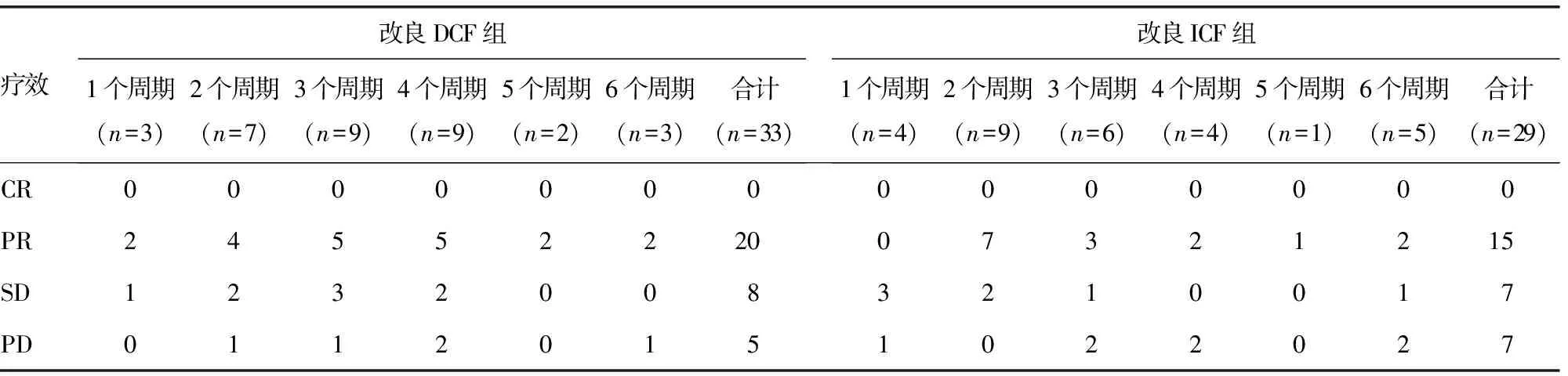
表2 两组化疗疗效比较(n)
1.3 统计学处理 采用SPSS 22.0统计软件进行统计分析,患者一般资料、疗效、不良反应及新辅助化疗后手术切除率和手术后并发症发生率等计数资料的比较采用χ2检验,等级资料比较采用秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组临床疗效比较 62例晚期胃癌患者均接受1~6个周期的化疗。改良DCF组共行108个周期化疗,平均3.27个周期;改良ICF组共行91个周期化疗,平均3.14个周期。每例患者化疗后疗效均可评价,两组均无疗效为CR的患者,改良DCF组中PR 20例(60.6%),SD 8例(24.2%),PD 5例(15.2%),ORR为60.6%(20/33);改良ICF组中PR 15例(51.7%),SD 7例(24.1%),PD 7例(24.1%),ORR为51.7%(15/29)。改良DCF组ORR较改良ICF组高,但两组近期疗效比较,差异无统计学意义(Z=-0.837,P=0.403),见表2。改良ICF方案化疗前CT图像见图1A,可见肿瘤位于胃体小弯侧,浆膜面毛糙,周围可见肿大淋巴结;同一患者接受改良ICF方案化疗2个周期后CT图像见图1B,可见肿瘤较前明显缩小。

A:化疗前CT图像;B:化疗2个周期后CT图像
图1 改良ICF方案化疗前后CT图像
2.2 两组不良反应发生情况比较 接受两种化疗方案治疗的晚期胃癌患者均出现了不同程度的骨髓抑制,恶心、呕吐、腹泻等消化道不良反应,以及肝功能异常、神经毒性、脱发和皮肤过敏等化疗相关不良反应,经积极对症支持治疗后均得到不同程度的缓解,62例患者化疗后不良反应均可评价,两组无1例患者在化疗周期内因不良反应而终止化疗或死亡。两组患者化疗相关不良反应发生率比较,差异均无统计学意义(P>0.05),见表3。
2.3 两组新辅助化疗后手术切除情况比较 两组患者化疗后均可重新评估,对于病情得到缓解的患者根据具体情况给予根治性手术治疗或姑息性手术治疗。改良DCF组新辅助化疗后行根治术22例(66.7%),行姑息性手术4例(12.1%),7例(21.2%)未行手术;改良ICF组新辅助化疗后行根治术为18例(62.1%),行姑息性手术2例(6.9%),9例(31.0%)未行手术。两组新辅助化疗后手术根治性切除率比较,差异无统计学意义(χ2=0.143,P=0.706)。
2.4 两组手术并发症发生情况比较 两组患者手术后主要并发症为吻合口瘘、吻合口梗阻、腹腔感染、肺部感染、切口感染、尿路感染、胃动力障碍、肠梗阻、实质性脏器功能障碍等;两组患者手术并发症发生率比较,差异无统计学意义(P>0.05),见表4。
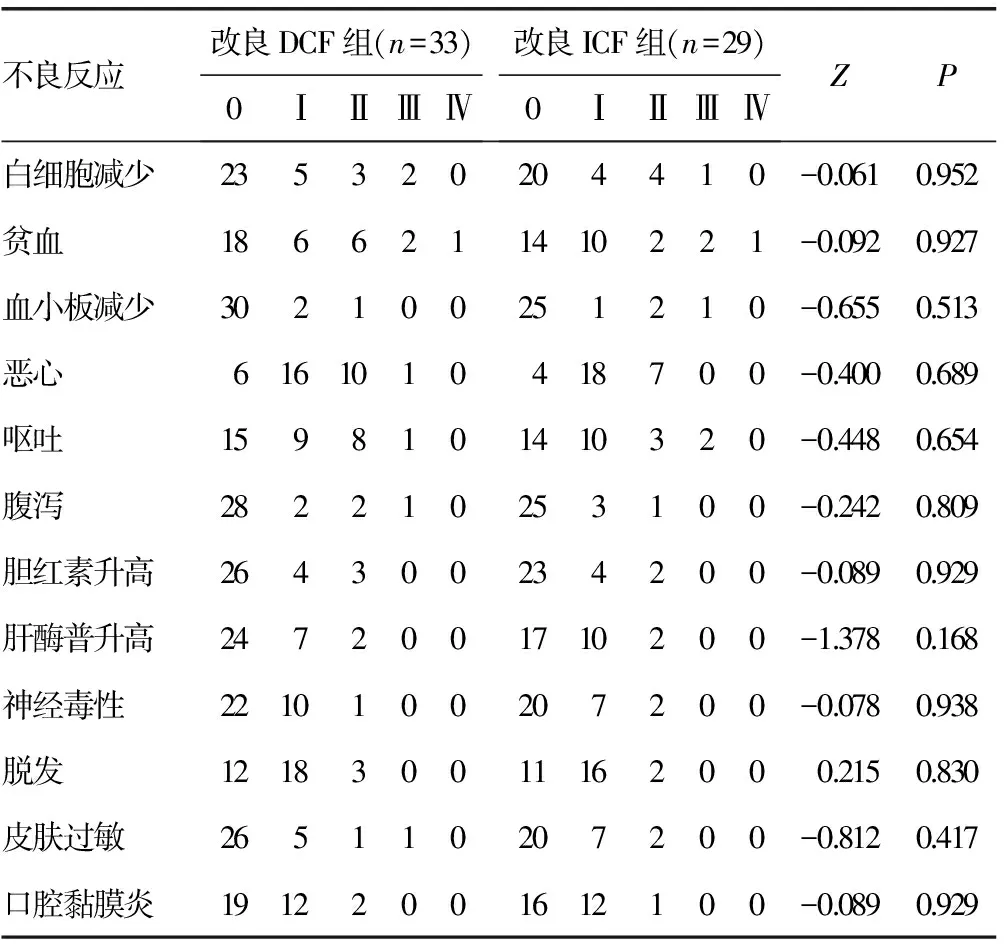
表3 两组化疗后不良反应比较(n)

表4 两组手术后并发症比较(n)
2.5 两组生活质量比较 两组患者化疗后进行比较,改良DCF组生活质量提高23例、稳定3例、减退7例,改良ICF组生活质量提高16例、稳定5例、减退8例;两组生活质量比较,差异无统计学意义(χ2=1.572,P=0.456)。
3 讨 论
目前在我国,胃癌发病率仍居各种恶性肿瘤前列,因其临床表现的特殊性,早期症状不典型,大部分患者确诊时已是局部晚期或已经发生远处转移,失去手术机会。对于晚期胃癌的治疗,目前提倡以综合治疗为主,包括手术切除、化疗、放疗及分子靶向药物治疗等,但总体的治疗效果至今尚不满意,其复发率高,预后极差。因此,有必要要求临床医生探索对晚期胃癌的新辅助化疗研究,这对进一步提高化疗的反应率、降低不良反应发生率、缩小瘤体、降低胃癌的分期、提高手术切除率及延长患者生存期至关重要。近年来,晚期胃癌的化疗仍无“金标准”方案,对晚期胃癌化疗疗效得到肯定的药物包括氟尿嘧啶类、铂类、紫杉烷类、丝裂霉素等,但是临床实践证明这些药物单药化疗的有效率低,疗效并不理想。随着新一代抗肿瘤药物TXT、CPT-11、替吉奥、曲妥珠单抗、雷莫芦单抗的问世,新的联合化疗方案不断出现、改进,晚期胃癌的化疗效果得到了一定改善。
本研究选择目前临床上对晚期胃癌患者化疗效果和耐受性较好的两种多药联合方案(改良DCF方案与改良ICF方案)。TXT属于半合成紫杉烷类抗肿瘤药,其作用机制是加强微管蛋白聚合作用和抑制微管解聚作用,导致形成稳定的非功能性微管束,从而破坏肿瘤细胞的有丝分裂,是细胞周期M期特异性药物,其微管作用及作用时间较紫杉醇更优,多项临床研究已显示该药治疗胃癌有效[6-7]。因此,TXT常作为许多化疗方案的联合药物之一。CPT-11为DNA拓扑异构酶Ⅰ抑制剂,与其形成的复合物结合,从而阻止DNA复制并抑制RNA合成,为细胞周期S期特异性药物。一项Ⅰ期随机临床研究将CPT-11和单用最佳支持治疗作为二线治疗进行比较,结果显示CPT-11较最佳支持治疗能明显延长总生存期(OS)[8]。L-OHP为新型铂类抗癌药物,通过产生水化衍生物作用于DNA,形成链内、链间交联,从而抑制DNA的合成。研究表明,相较于顺铂及卡铂,L-OHP与DNA结合的速率更快,具有广谱的体外细胞毒性及体内抗肿瘤活性,对晚期胃癌患者的耐受性较好,在临床更易实施[9]。Kim等[10]、Montagnani等[11]研究结果表明,含L-OHP的方案其疗效不低于含顺铂的方案,L-OHP可以在治疗中取代顺铂。替吉奥胶囊是新型的治疗中晚期胃肠道肿瘤的一线药物,由替加氟(FT)、吉美嘧啶(CDHP)和奥替拉西钾组成。FT的作用与氟尿嘧啶相同,在体内能干扰和拮抗DNA、RNA及蛋白质的合成;CDHP能阻止氟尿嘧啶活化物降解,增强抗癌作用;奥替拉西钾能保护胃肠道黏膜,减少消化道反应。临床研究结果表明,替吉奥胶囊已在胃癌综合治疗中显示出较好的疗效,其有效率可达20.0%~56.5%,并具有口服方便、不良反应发生率相对较低、患者耐受性良等优点[12-13]。已有多项Ⅱ期临床试验证实了紫杉醇联合顺铂(或L-OHP)、氟尿嘧啶(或替吉奥胶囊)的组合方案(DCF方案或改良DCF方案)的疗效及安全性[14-15]。DCF方案已被美国食品药品监督管理局(FDA)批准用于一线治疗晚期胃癌,但是不良反应发生率较高。目前临床上晚期胃癌患者应用显示,改良DCF方案与DCF方案比较,其临床疗效相似,但是改良DCF方案的不良反应明显比DCF方案更小,患者的耐受性更好,临床易于实施[16]。改良DCF方案已被美国综合肿瘤网络中心(NCCN)指南纳入晚期胃癌的一线治疗。近年来,含有CPT-11的改良ICF方案在晚期胃癌的治疗中也逐渐被接受,其临床疗效亦取得了一定进展,但在晚期胃癌治疗中尚缺乏大宗的Ⅱ或Ⅲ期临床研究。基于此,笔者对比研究了改良DCF化疗方案与改良ICF化疗方案,以探讨两种方案在近期疗效的区别及不良反应的强弱。本研究结果显示,两种方案治疗晚期胃癌的疗效相当,改良DCF方案与改良ICF方案的ORR分别为60.6%和51.7%;两种方案的主要不良反应为骨髓抑制、消化道不良反应、神经毒性、脱发和肝功能异常等,多为Ⅰ/Ⅱ度,但差异无统计学意义(P>0.05);大多数患者在新辅助化疗后生活质量提高,身体状况得到相应的改善,为根治性手术创造了条件;改良DCF组与改良ICF组新辅助化疗后再行手术治疗的根治性切除率分别为66.7%和62.1%,差异无统计学意义(P>0.05);两组术后吻合口瘘、吻合口梗阻、腹腔感染、肺部感染、切口感染、胃动力障碍等主要并发症的发生率比较,差异无统计学意义(P>0.05)。本研究中无1例化疗相关性死亡。
综上所述,改良DCF方案和改良ICF方案在治疗晚期胃癌的临床疗效相近,不良反应经积极对症处理均可耐受,两种化疗方案对治疗晚期胃癌是一种安全且有效的治疗策略,可以提高肿瘤切除率和根治率,值得临床进一步推广应用。改良ICF方案有望成为晚期胃癌的一线治疗方案,可根据患者体质及耐受程度合理选用。但由于本研究样本量较小,且纳入的患者病期偏晚,研究结果还有待进一步论证。
[1]Kamangar F,Dores GM,Anderson WR.Patterns of cancer incidence,mortality,and prevalence across five continents:defining priorities to reduce cancer disparities in different geographic regions of the world[J].J Clin Oncol,2006,24(14):2137-2150.
[2]Ajani JA.Evolving chemotherapy for advanced gastric cancer[J].Oncologist,2005,10(Suppl 3):49-58.
[3]王镇南,余忠华,周和超,等.紫杉醇联合5一氟尿嘧啶及亚叶酸钙治疗29例晚期胃癌[J].广东医学,2011,32(13):1760-1761.
[4]Therasse P,Arbuck SG,Eisenhauer EA,et al.New guidelines to evaluate the response to treatment in solid tumors[J].J Natl Cancer Inst,2000,92(3):205-216.
[5]National Institutes of Health.Common terminology criteria for adverse events (CTCAE) Version 4.0[EB/OL].(2010-06-14)[2017-01-18].https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf.
[6]Ajani JA,Moiseyenko VM,Tjulandin S,et al.Clinical benefit with docetaxel plus fluorouracil and cisplatin compared with cisplatin and fluorouracil in a phase Ⅲ trial of advanced gastric or gastroesophageal cancer adenocarcinoma:the V-325 study group[J].J Clin Oncol,2007,25(22):3205-3209.
[7]Ajani JA.Optimizing docetaxel chemotherapy in patients with cancer of the gastric and gastroesophageal junction:evolution of the docetaxel,cisplatin,and 5-fluorouracil regimen[J].Cancer,2008,113(5):945-955.
[8]Thuss-Patience PC,Kretzschmar A,Bichev D,et al.Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer-a randomised phase Ⅲ study of the Arbeitsgemeinschaft Internistische Onkologie (AIO)[J].Eur J Cancer,2011,47(15):2306-2314.
[9]谢瑞莲,王茂源,施华球,等.改良DCF和FOLFOX4方案治疗晚期胃癌的临床对比研究[J].吉林医学,2013,34(14):2686-2688.
[10]Kim YS,Sym SJ,Park SH,et al.A randomized phase Ⅱ study of weekly docetaxel/cisplatin vesus weekly docetaxel/oxaliplatin as first-line therapy for patients with advanced gastric cancer [J].Cancer Chemother Pharmacol,2014,73(1):163-169.
[11]Montagnani F,Turrisi G,Marinozzi C,et al.Effectiveness and safety of oxaliplatin compared to cisplatin for advanced,unresectable gastric cancer:a systematic review and meta-analysis[J].Gastric Cancer,2011,14(1):50-55.
[12]Terazawa T,Iwasa S,Takashima A,et al.Impact of adding cisplatin to S-1 in elderly patients with advanced gastric cancer[J].J Cancer Res Lin Oncol,2013,139(12):2111-2116.
[13]杨林,宋岩,秦琼,等.替吉奥联合奥沙利铂一线治疗晚期胃癌的疗效和安全性[J].肿瘤防治研究,2013,40(7):688-692.
[14]Hwang J,Cho SH,Shim HJ,et al.Phase Ⅱ study of paclitaxel,cisplatin,and 5-fiuorouracil combination chemotherapy in patients with advanced gastric cancer[J].J Korean Med Sci,2008,23(4):586-591.
[15]Kang GH,Kim GS,Lee HR,et al.Phase Ⅱ grial of paclitaxel,5-fluorouracil (5-FU) and cisplatin in patients with metastatic or recurrent gastric cancer[J].Cancer Res Treat,2008,40(3):106-110.
[16]陈奕贵,杨建伟,蔡雄超.改良DCF方案治疗27例晚期胃癌的临床观察[J].临床肿瘤学杂志,2010,15(1):55-59.
Analysis of clinical efficacy and safety of docetaxel or irinotecan combined with oxaliplatin and S-1 in the treatment of advanced gastric cancer
XieWenjian,MinJiang,QianKun,ZhangWei△
(DepartmentofGastrointestinalSurgery,theFirstAffiliatedHospitalofChongqingMedical
Objective To observe the clinical efficiency and safety of docetaxel(TXT) or irinotecan(CPT-11) combined with oxaliplatin(L-OHP) and S-1 in the treatment of advanced gastric cancer.Methods Totally 62 cases of patients with stage ⅢB-Ⅳ advanced gastric cancer in the Department of Gastrointestinal Surgery of our hospital were collected from 1st January 2010 to 1st March 2016,and were divided into two groups:TXT combined with L-OHP and S-1 group (modified DCF group,33 patients) and CPT-11 combined with L-OHP and S-1 group (modified ICF group,29 patients).All patients in the two groups were completed at least 1 cycle of chemotherapy until disease progression or intolerable toxicity.At the end of chemotherapy,the curative effects,untoward reactions and effects of surgery after neoadjuvant chemotherapy treatment were compared and analyzed.Results The objective response rate (ORR) in the modified DCF group(60.6%) was higher than that in the modified ICF group (51.7%),while no statistically significant difference was found in short-term effects between the two groups (Z=-0.837,P=0.403).There was no statistically significant difference in the incidences of main untoward reactions,including gastrointestinal reaction,myelosuppression,neurotoxicity,alopecia and liver function abnormal,between the two groups (P>0.05).The radical resection rate of the modified DCF group and the modified ICF group after neoadjuvant chemotherapy was 66.7% and 62.1% respectively,the difference between the two groups was not statistically significant (χ2=0.143,P=0.706).After neoadjuvant chemotherapy,the main postoperative complications were anastomotic leakage,anastomotic obstruction,abdominal infection,pulmonary infection,incision infection and gastric motility disorder,and no statistically significant difference was found in the incidence of postoperative complications between the two groups (P>0.05).The was no statistically significant difference in quality of life after chemotherapy between the two groups (P>0.05).Conclusion TXT or CPT-11 combined with L-OHP and S-1 has similar efficacy in the treatment of advanced gastric cancer,which could reduce tumour size,improve radical resection rate.Furthermore,untoward reactions of the two neoadjuvant chemotherapy protocols are almost the same,and can be tolerated.It is worthy of further research and application.
stomach neoplasms,advanced;docetaxel;irinotecan;oxaliplatin;S-1;neoadjuvant chemotherapy;treatment outcome
谢文健(1989-),住院医师,在读硕士,主要从事胃肠道肿瘤方面的研究。△
,E-mail:cyzhangwei@hotmail.com。
��·临床研究
10.3969/j.issn.1671-8348.2017.19.016
R735.2
A
1671-8348(2017)19-2644-05
2016-11-18
2017-02-06)
