癌在多形性腺瘤中1例报告并文献复习
2017-08-12张建东温霆宇
肖 海,张建东,温霆宇
(1.赣南医学院第一附属医院病理科/病理学教研室,江西赣州 341000;2.赣南医学院基础医学院,江西赣州 341000)
·短篇及病例报道·
癌在多形性腺瘤中1例报告并文献复习
肖 海1,2,张建东2,温霆宇2
(1.赣南医学院第一附属医院病理科/病理学教研室,江西赣州 341000;2.赣南医学院基础医学院,江西赣州 341000)
癌在多形性腺瘤中(carcinoma ex pleomorphic adenoma,CXPA)是涎腺恶性多形性腺瘤(pleomorphic adenoma,PA)中最常见的一种类型,占涎腺恶性肿瘤的5%~15%。该病国内报道较少,其病因、发病机制尚不完全清楚。为提高对该病的认识,现将本院近期诊治的1例颜面部CXPA患者的临床资料结合国内外文献报道如下。
1 临床资料
患者男,57岁,因发现左颜面部包块超过30年,疼痛、发胀超过1个月,于2015年7月15日入院。患者约30年前发现左颜面部长一肿块,约拇指大小,无明显压痛,无发热等。到本院行手术切除后,病理诊断为PA。30年来患者左侧颜面部再次出现肿物并逐渐增大,未予重视,就诊前约1个月自觉包块疼痛、发胀。当地医院CT检查示:左侧颌面部多发占位,考虑良性肿瘤可能。患者再次就诊本院门诊,行肿物细胞学穿刺诊断为PA。体格检查:左侧颜面部见一巨大突出肿物,大小约25 cm×15 cm×10 cm,上至颞部头皮,下至上颈部,前至外眦及口角,后至左耳耳屏。质地较硬,边界尚清楚,无活动,局部皮肤张力增大,无明显压痛及局部皮肤温度升高。2015年7月19日在全身麻醉下行左侧颜面部肿物切除术,术中见肿物边界尚清,呈分叶状,包膜完整,面神经峡支与肿瘤黏连,肿瘤与腮腺组织分界不清,术中保留面神经主干及分支,切除肿物及部分腮腺组织。病理检查:(1)大体观,灰白灰红色结节状肿物3个,体积分别为17.0 cm×12.0 cm×6.5 cm、5.5 cm×5.0 cm×4.5 cm和1.5 cm×1.5 cm×1.2 cm,其中体积较大者表面附皮肤,面积14.0 cm×7.5 cm。肿块切面呈灰白色,部分区域呈暗红色,可见黏液及囊性变,质实,稍脆(图1A)。(2)镜下观,肿瘤组织大部分区域为PA的组织学表现(图1B),由上皮细胞、肌上皮细胞、黏液及软骨成分构成,上皮细胞排列成腺管状、实性、条索状或散在分布,部分腺腔内有嗜酸性分泌物,腔面细胞低柱状、低立方或扁平状,外周有细胞质透明的肌上皮细胞;恶性区域肿瘤组织呈浸润性生长,肿瘤细胞增生活跃,呈巢团状、腺样结构或散在分布,细胞体积增大,可见细胞质内黏液,细胞异型性明显,可见核分裂象,癌组织未突破包膜(图1C、D)。免疫组织化学:肿瘤细胞角蛋白(CK)、CK7阳性(图2A、B),ki-67阳性指数约50%(图2C),胶质纤维酸性蛋白(GFAP)(图2D)、S-100、P63阴性。病理诊断:左颜面部CXPA。患者术后恢复良好,未行放疗和化疗。随访10个月未见复发和转移。

A:大体标本;B:PA组织学表现(苏木精-伊红,×100);C:癌组织浸润性生长,未突破包膜(苏木精-伊红,×100);D:癌细胞异型明显,细胞质内含黏液,核深染(苏木精-伊红,×400)
图1 病理检查
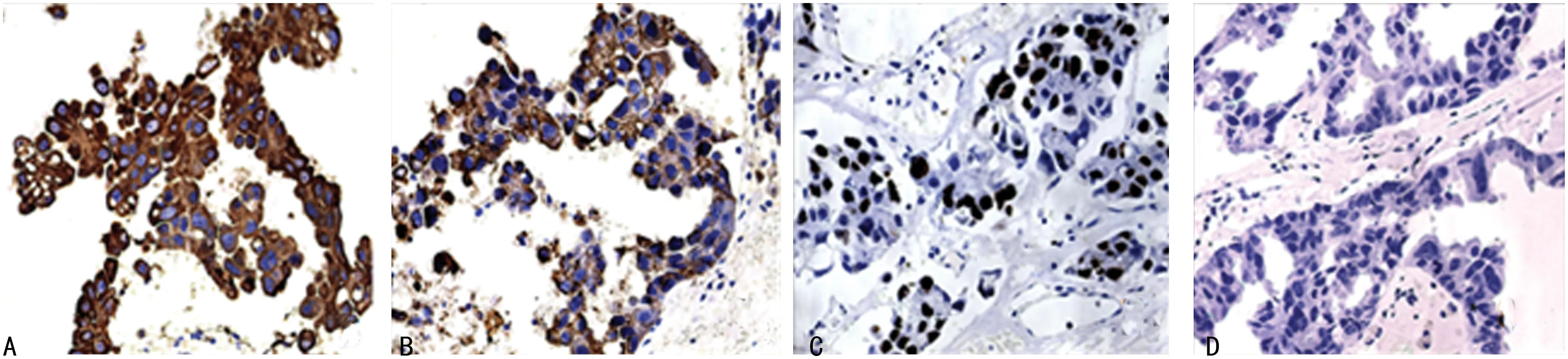
A:癌细胞CK阳性(EnVision法,×400);B:癌细胞CK7阳性(EnVision法,×400);C:ki-67阳性指数约50%(EnVision法,×400);D:癌细胞GFAP阴性(EnVision法,×400)
图2 免疫组织化学检查
2 讨 论
2.1 临床特征 PA又称混合瘤(mixed tumor),是涎腺肿瘤中最常见的类型,约占全部涎腺上皮性肿瘤的50%以上。恶性PA是由良性PA恶变而来,约占涎腺肿瘤的3.6%,占涎腺恶性肿瘤的12%。世界卫生组织将恶性PA分为CXPA、癌肉瘤和转移性PA 3类,其中以CXPA最为常见,占涎腺恶性肿瘤的5%~15%[1]。CXPA是指上皮性恶性肿瘤成分发生在原发或复发的PA中[2]。CXPA的病因和发病机制尚不清楚,可能是PA长期发展过程中导致遗传学不稳定所致,常见染色体5'(q22-23,q32-33)缺失和t(10;12)(p15,q14-15)伴12qHMGIC断裂和标志染色体10的全部基因转位,导致HMGIC和MDM2基因的片段缺血或扩增。另外,8q12基因重排也较常见[3]。CXPA最常发生于腮腺,其次为舌下腺、颌下腺、软腭等部位,发生在涎腺以外者少见。患者多为中老年,男性多于女性,病程长,往往可达数年(20~30年)。临床上多表现为无痛性逐渐增大的肿块,质地中等或较硬。长期存在的肿块在短时间内出现迅速增大时应怀疑PA恶变的可能,如肿瘤浸润神经和周围组织,患者可伴有疼痛、面神经麻痹症状和破溃出血。本文报道的1例患者有PA的手术史,术后复发,病程长达30余年,近来肿块迅速增大伴有疼痛的临床症状,符合多形性腺瘤复发后恶变。
2.2 病理学特征 肿瘤体积通常较大,直径多在5 cm以上,形态不规则,呈结节状或分叶状,部分有包膜或包膜不完整。切面良性部分呈灰白色,质地较实,恶性部分呈鱼肉状,质软,常见出血、坏死等。镜下可见PA结构中含有数量不等的恶性成分,最常见的组织类型是低分化腺癌(涎腺导管细胞癌或非特异性腺癌)和未分化癌,其他类型如腺样囊性癌、黏液表皮样癌、鳞状细胞癌、多形性低度恶性腺癌较少见。根据肿瘤侵犯程度,CXPA分为非侵袭性(恶性成分局限于肿瘤包膜内)、微侵袭性(恶性成分侵入包膜外小于或等于1.5 mm)和侵袭性(恶性成分侵入邻近组织的深度大于1.5 mm)[4]。本例患者肿瘤中有典型的PA区域,恶性区域肿瘤细胞异型明显,伴有坏死和钙化,但恶性成分仍位于包膜内,属于非侵袭性的包膜内癌。
2.3 影像学特征 超声检查能清晰、无创地显示肿块的位置、大小、形态、边界、内部回声及血流情况,可以为临床提供重要信息[5]。通过彩超观察肿瘤血流分布情况在良、恶性肿瘤的鉴别中具有重要的临床意义。CT扫描涎腺CXPA多表现为类圆形或不规则软组织肿块,边缘光滑,增强后病变不均匀强化或不强化。肿块密度多不均匀,内部可出现液化、坏死、囊性变、钙化等[6-7]。CT上鉴别涎腺PA和恶性PA有一定困难。边界不清、侵犯和破坏周围组织是诊断恶性PA的重要依据。也有研究认为,肿瘤组织中出现钙化是PA向恶性转变的一个特征[8-9]。CXPA磁共振成像(MRI)检查多表现为形态不规则,边界不清的肿块影,包膜常不完整或无包膜,周围组织浸润,在T1WI及 T2WI均呈低信号,多数为快速而不均匀强化,但PA由于其组织学上由多种结构构成,也可表现为不均匀强化的特点,因此MRI在鉴别时也存在较大的困难。
2.4 诊断和鉴别诊断 CXPA的确诊需要依靠病理组织学检查。病理学诊断CXPA必须有现存良性肿瘤的组织学证据或在同一肿瘤中见到良恶性成分共存才能确诊,因此对肿瘤充分取材十分必要[4]。提示癌变的可能组织学表现有大片玻璃样变性、灶性出血、坏死、钙化、间质骨化、浸润性生长等。CXPA与PA的鉴别要严格掌握恶性标准,如在良性PA的背景中出现肯定的恶性成分,10个高倍视野出现2个以上核分裂象,间质肉瘤样变及浸润性生长等均提示恶性[10]。另外,区别微侵袭性和侵袭性癌对PA的预后有重要的意义,也是是否需要给予颈部淋巴结清扫和辅助性放疗的依据。肿瘤生长过程中引起的周围组织反应,从而形成的纤维性包裹,并不是一个真性的组织被膜。
2.5 治疗和预后 局部广泛切除和周围淋巴结清扫是CXPA的主要治疗手段。对肿瘤伴有广泛浸润者往往需要进行辅助性放疗。如果为低度恶性和(或)微侵袭性恶性多形性腺瘤,在确保彻底切除肿瘤的情况下,可以不进行辅助性放化疗[11]。CXPA的预后与肿瘤的大小、分化程度、是否有包膜侵犯、癌变的组织学类型等有关。包膜内癌或侵及包膜外小于1.5 mm者,手术切除预后良好;恶性成分侵及包膜外组织大于1.5 mm者,恶性程度高,伴有淋巴结转移者预后不佳[12]。肿瘤体积越大、分化程度越低预后越差。远处转移主要发生在肺、骨、腹部和中枢神经系统等部位。本例腮腺CXPA属于包膜内型,预后较好,随访10个月,未见复发和转移。
[1]Antony J,Gopalan V,Smith RA,et al.Carcinoma ex pleomorphic adenoma:a comprehensive review of clinical,pathological and molecular data[J].Head Neck Pathol,2012,6(1):1-9.
[2]陈超,王佳峰,赵坚强,等.颌下腺癌在多形性腺瘤中预后因素分析[J].肿瘤学杂志,2013,19(6):461-465.
[3]Barnes L,Eveson JW,Reichart P,et al.刘红刚,高岩.译.世界卫生组织肿瘤分类:头颈部肿瘤病理学和遗传学[M].北京:人民卫生出版社,2006:282-284.
[4]江瑞康,王玉玲,刘培成.泪腺非侵袭性癌在多形性腺瘤中1例[J].临床与实验病理学杂志,2014,30(8):947-949.
[5]王敏,崔可飞,于小芳.腮腺癌在多形性腺瘤中超声表现1例[J].临床超声医学杂志,2014,16(11):791-791.
[6]Lingam RK,Daghir AA,Nigar E,et al.Pleomorphic adenoma(benign mixed tumour) of the salivary glands:its diverse clinical,radiological,and histopathological presentation[J].Br J Oral Maxillofac Surg,2011,49(1):14-20.
[7]Lee Y,Wong KT,King AD,et al.Imaging of salivary gland tumours[J].Eur J Radiol,2008,66(3):419-436.
[8]Honda T,Yamamoto Y,Isago T,et al.Giant pleomorphic adenoma of the parotid gland with malignant transformation[J].Ann Plast Surg,2005,55(5):524-527.
[9]陈倩倩,王平仲,余强.下颌下腺多形性腺瘤和恶性多形性腺瘤的CT表现对比[J].中国医学计算机成像杂志,2013,19(2):120-123.
[10]郑舟军,孙蕾娜,潘毅,等.涎腺组织外恶性多形性腺瘤4例临床病理分析[J].中国肿瘤临床,2007,34(18):1065-1066.
[11]Sun G,Yang X,Tang E,et al.The treatment of sublingual gland tumours[J].Int J Oral Maxillofac Surg,2010,39(9):863-868.
[12]Weis E,Rootman J,Joly TJ,et al.Epithelial lacrimal ghnd gulnolx:pathologic clarification and current understanding[J].Arch Ophthahnol,2009,127(8):1016-1028.
肖海(1977—),副教授,硕士,主要从事肿瘤病理方面的研究。
10.3969/j.issn.1671-8348.2017.21.048
R739.8
C
1671-8348(2017)21-3021-03
2017-02-08
2017-04-13)
