阿奇霉素通过TRAF6/NF-κB/VEGF信号通路抑制哮喘大鼠气道平滑肌细胞增殖
2017-08-12李小莉郭纪元郭省香
李小莉,王 威,郭纪元,郭省香
(1.西安市第三医院儿科 710018;2.西安市儿童医院儿科 710002)
阿奇霉素通过TRAF6/NF-κB/VEGF信号通路抑制哮喘大鼠气道平滑肌细胞增殖
李小莉1,王 威1,郭纪元2,郭省香1
(1.西安市第三医院儿科 710018;2.西安市儿童医院儿科 710002)
目的 探讨阿奇霉素(AZM)抑制哮喘大鼠气道平滑肌细胞(ASMCs)增殖的作用机制。方法 30只SD大鼠分为对照组、哮喘模型组、AZM组。以卵蛋白(OVA)致敏、激发制备哮喘模型,用医学图像分析系统测定各组大鼠肺组织气道相关参数;组织贴块法分离培养原代ASMCs,并向AZM组ASMCs中分别转染血管内皮生长因子(VEGF)过表达载体或肿瘤坏死因子受体相关因子6(TRAF6)过表达载体。蛋白质印迹法测定VEGF、核因子κB(NF-κB)p65和TRAF6蛋白表达水平;CCK-8试剂盒检测ASMCs的增殖情况。结果 AZM明显抑制哮喘大鼠总管壁厚度、内壁厚度、平滑肌厚度的增加(P<0.05),也明显抑制哮喘模型组ASMCs的增殖(P<0.05)。AZM明显抑制哮喘诱导的NF-κB p65和VEGF蛋白表达的增加(P<0.05);过表达VEGF明显减弱AZM对ASMCs增殖的抑制效应(P<0.05)。AZM明显抑制哮喘诱导的TRAF6的高表达(P<0.05);过表达TRAF6明显减弱AZM对NF-κB p65和VEGF蛋白表达及ASMCs增殖的抑制作用(P<0.05)。结论 AZM能够抑制哮喘大鼠ASMCs的增殖,其部分机制可能是通过抑制TRAF6/NF-κB/VEGF信号通路而实现的。
阿奇霉素;哮喘;气道平滑肌细胞;TRAF6;NF-κB;血管内皮生长因子
哮喘是一种常见的气道慢性炎症性疾病,目前全球约有3亿哮喘患者[1]。气道重塑是哮喘的重要病理特征,其最显著的特点是气道平滑肌细胞(airway smooth muscle cells,ASMCs)增殖。哮喘患者ASMCs的大量增殖可促使气道收缩力增加,管壁增厚,导致明显的气道狭窄及气道高反应性[2]。研究表明,阿奇霉素(Azithromycin,AZM)可抑制ASMCs增殖[3],改善哮喘症状,然而其分子机制尚未完全阐明。血管内皮生长因子(VEGF)在哮喘患者和哮喘模型肺组织和血清中均表达上调[4],且与ASMCs的增殖密切相关[5]。在过敏性鼻炎的外周血中存在肿瘤坏死因子受体相关因子6(tumor necrosis receptor-associated factor 6,TRAF6)的高表达[6],且干扰TRAF6的表达能够抑制血管平滑肌细胞的增殖[7]。生物信息学研究表明,TRAF6可能与支气管哮喘有关[8]。TRAF6过表达可以诱导核因子κB(NF-κB)信号通路的激活[9],而NF-κB能诱导VEGF的表达[10],并抑制哮喘模型中NF-κB的激活和VEGF的表达,缓解哮喘炎症[11-12]。既往研究表明,AZM可以影响TRAF6、NF-κB和VEGF的表达[13-14]。因此,推测TRAF6、NF-κB和VEGF有可能参与了AZM对ASMCs增殖的抑制过程。本研究分析了AZM处理后哮喘大鼠模型肺组织及其ASMCs中NF-κB p65、VEGF和TRAF6的表达变化及其对ASMCs增殖的影响,从而探讨AZM抑制哮喘ASMCs增殖的可能机制。
1 材料与方法
1.1 实验动物及主要试剂 清洁级雄性SD大鼠30只,4~6周龄,体质量100~200 g,购自第四军医大学实验动物中心,所有动物实验遵守《实验动物管理条例》,符合动物伦理学标准;AZM(西安利君制药有限公司);鸡卵清蛋白(ovalbumin,OVA)、氢氧化铝粉[Al(OH)3]和CCK-8试剂盒(美国Sigma公司);PCR扩增试剂盒、pcDNA3.1-GFP载体、LipofectamineTM2000转染试剂(美国Invitrogen公司);DMEM培养基、胎牛血清(美国Gibco公司);RIPA裂解液、二喹啉甲酸(BCA)蛋白定量试剂盒和电化学发光(ECL)试剂(上海碧云天公司);聚偏氟乙烯(PVDF)膜(美国Millipore公司);兔抗大鼠NF-κB P65多克隆抗体、兔抗大鼠VEGF多克隆抗体、兔抗大鼠TRAF6单克隆抗体、小鼠抗大鼠β-actin单克隆抗体、辣根过氧化物酶标记的山羊抗兔、兔抗小鼠IgG (英国Abacm公司)。
1.2 方法
1.2.1 动物分组及哮喘模型的建立 将30只SD大鼠分为3组(n=10):对照组、哮喘模型组和AZM组。哮喘模型组和AZM组小鼠,在第1、8天腹腔注射1 mL 含10 mg OVA和100 mg Al(OH)3的生理盐水溶液致敏,第15 天开始给予2% OVA生理盐水溶液雾化吸入以激发气道,每次20 min,每日1次,共持续4周。其中AZM组,从第15天开始于雾化激发前30 min给予AZM(50 mg/kg)腹腔注射。对照组小鼠在致敏与激发时均以生理盐水代替OVA。各组大鼠均于末次雾化激发24 h后处死,迅速取下肺组织,部分肺组织以4%多聚甲醛固定后制成病理切片,部分肺组织用于ASMCs分离,剩余肺组织以液氮冻存待检。同时,分离出哮喘大鼠致敏血清,-20 ℃保存备用。
1.2.2 气道相关参数的测定 取肺组织病理切片,选取完整不含软骨的支气管横截面,用医学图像分析软件Image-Pro Plus 6.0测定肺组织支气管基底膜周径(basement membrane perimeter,Pbm)、支气管壁总面积(total bronchial wall area,WAt)、气道内壁面积(inner way area,WAi)和平滑肌面积(smooth muscle area,WAm),并用Pbm将测量值标准化,分别代表总管壁厚度(WAt/Pbm)、内壁厚度(WAi/Pbm)和平滑肌厚度(WAm/Pbm)。
1.2.3 大鼠ASMCs的培养及细胞增殖测定 按照文献[15]方法,无菌条件下迅速分离各组大鼠的气道平滑肌组织,应用组织贴块法,于37 ℃、5% CO2环境下培养原代ASMCs,胰酶消化传代。取4~6代各组ASMCs,分别制成浓度为5×104/mL的细胞悬液,按每孔200 μL接种于96孔板,37 ℃、5% CO2培养24 h,换成无血清的DMEM培养液继续培养24 h,使细胞同步于G0期,然后向对照组ASMCs中加入含10%胎牛血清的培养液,向哮喘模型组ASMCs中加入含致敏大鼠血清的培养液,向AZM组ASMCs中同时加入含致敏大鼠血清和不同终浓度的AZM(3×10-6、6×10-6、1×10-5mol/L)的培养液,37 ℃、5% CO2培养48 h 后,每孔加10 μL CCK-8检测液,继续培养2 h后,酶联免疫检测仪检测450 nm处各孔测定吸光度(A)值。
1.2.4 TRAF6和VEGF过表达载体的构建及转染 根据Gen Bank中TRAF6和VEGF基因序列,采用软件Oligo 6设计相应引物,用PCR方法扩增获得目的基因。将测序正确的TRAF6或VEGF序列克隆到pcDNA3.1-GFP载体中,构建pcDNA3.1-TRAF6-GFP或pcDNA3.1-VEGF-GFP过表达载体[16]。采用lipofectamineTM2000向AZM组ASMCs中分别转染pcDNA3.1-TRAF6-GFP过表达载体(TRAF6)或pcDNA3.1-VEGF-GFP过表达载体(VEGF),以空质粒pcDNA3.1-GFP作为对照(载体对照组)。转染细胞在37 ℃、5% CO2条件下培养48 h后,蛋白质印迹法(Western blotting)检测蛋白表达情况,CCK-8试剂盒检测ASMCs增殖情况。
1.2.5 Western blotting检测 用RIPA裂解液分别裂解适量各组大鼠肺组织及ASMCs,离心提取总蛋白,BCA试剂盒测定蛋白水平。取20 μg总蛋白行10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移至PVDF膜,5%脱脂奶粉封闭1 h,然后分别加入兔抗大鼠TRAF6单克隆抗体、兔抗大鼠NF-κB P65多克隆抗体、兔抗大鼠VEGF多克隆抗体或小鼠抗大鼠β-actin单克隆抗体,4 ℃孵育过夜,漂洗后分别加入辣根过氧化物酶标记的山羊抗兔、兔抗小鼠IgG,室温孵育1 h,洗膜后加入ECL发光试剂显影扫描。以β-actin作为内参,用Image j软件对条带进行分析。

2 结 果
2.1 AZM抑制哮喘大鼠气道重塑及ASMCs增殖 大鼠肺组织切片气道参数检测显示,哮喘模型组气道WAt/Pbm、WAi/Pbm、WAm/Pbm均明显高于对照组(P<0.05);AZM组气道WAt/Pbm、WAi/Pbm、WAm/Pbm均明显低于哮喘模型组(P<0.05),见表1。CCK-8检测各组大鼠ASMCs增殖的变化,结果显示:与对照组相比,哮喘模型组ASMCs增殖明显增加(P<0.05);与哮喘模型组相比,AZM组ASMCs增殖明显减少(P<0.05),且具有一定的剂量依赖性,见图1。
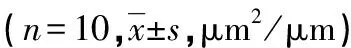
表1 各组大鼠气道WAt/Pbm、WAi/Pbm及WAm/Pbm比较
*:P<0.05,与对照组比较;#:P<0.05,与哮喘模型组比较
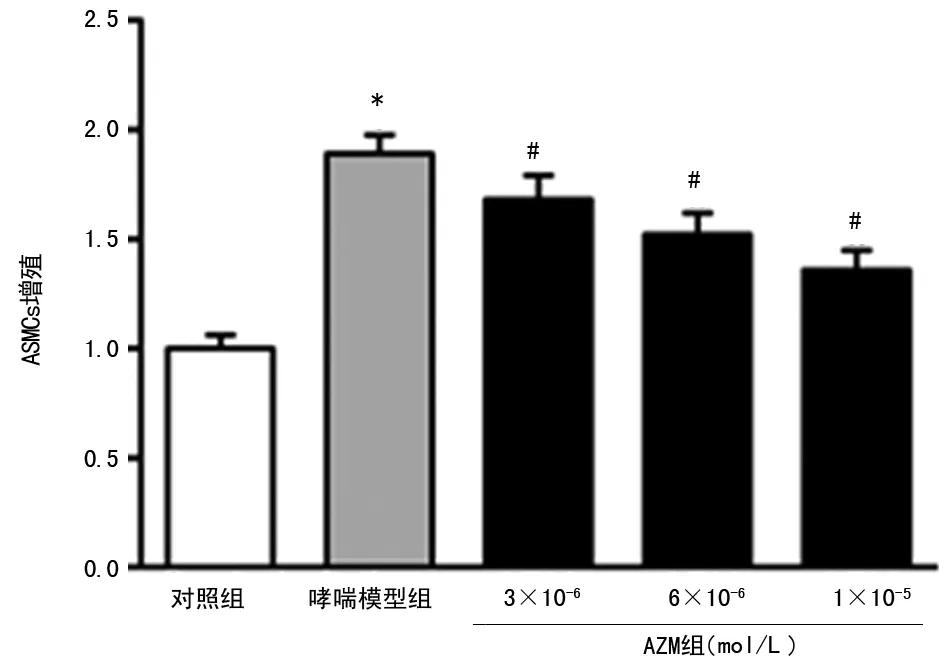
*:P<0.05,与对照组比较;#:P<0.05,与哮喘模型组比较
图1 AZM对大鼠ASMCs增殖的影响
2.2 AZM抑制哮喘大鼠NF-κB p65和VEGF蛋白的表达 Western blotting检测显示:与对照组相比,哮喘模型组大鼠肺组织及其ASMCs中NF-κB p65和VEGF蛋白表达均明显增加(P<0.05),见图2A、B;与哮喘模型组相比,AZM组大鼠肺组织及其ASMCs中NF-κB p65和VEGF蛋白表达均明显减少(P<0.05),见图2A、B。且NF-κB p65和VEGF蛋白在ASMCs中的表达呈AZM剂量依赖性,见图2B。
2.3 过表达VEGF减弱AZM对ASMCs增殖的抑制作用 Western blotting检测显示:与对照组相比,AZM+VEGF过表达组VEGF蛋白水平明显增加(P<0.05),见图3A。CCK-8检测显示:与AZM组相比,VEGF过表达后AZM对ASMCs增殖的抑制效应明显减少(P<0.05),见图3B。
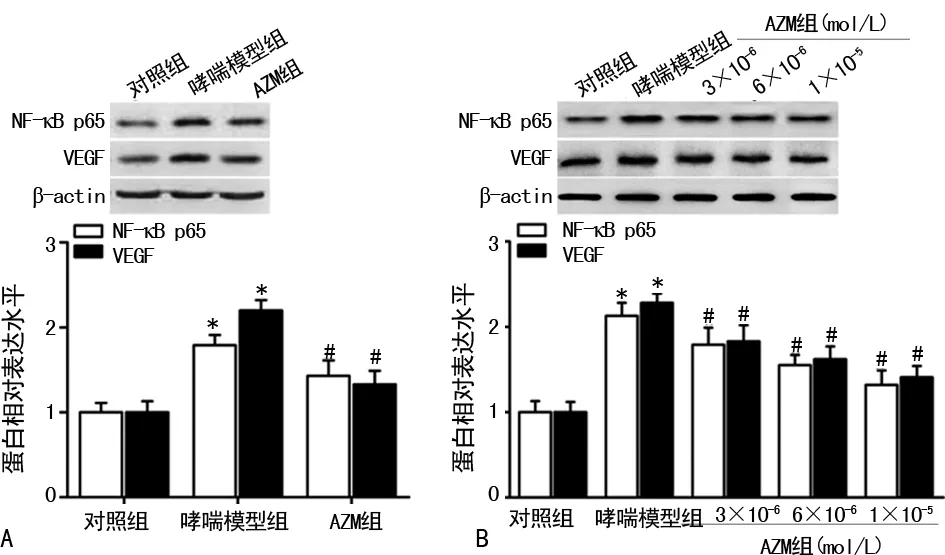
A:肺组织;B:ASMCs;*:P<0.05,与对照组比较;#:P<0.05,与哮喘模型组比较
图2 各组大鼠肺组织及ASMCs中NF-κB p65和VEGF蛋白的表达
2.4 过表达TRAF6减弱AZM对NF-κB p65和VEGF蛋白表达及ASMCs增殖的抑制作用 Western blotting检测显示:与对照组相比,哮喘模型组ASMCs中TRAF6蛋白表达明显增加(P<0.05);与哮喘模型组相比,AZM组TRAF6蛋白表达明显减少(P<0.05);与AZM组相比,TRAF6过表达后AZM对TRAF6、VEGF和NF-κB p65蛋白表达的抑制效应明显减少(P<0.05),见图4A。CCK-8检测显示:与AZM组相比,TRAF6过表达后AZM对ASMCs增殖的抑制效应明显减少(P<0.05),见图4B。

A:VEGF蛋白在AZM组ASMCs中的过表达;B:各组ASMCs的增殖;*:P<0.05,与对照组比较;#:P<0.05,与哮喘模型组比较;△:P<0.05,与AZM组比较
图3 VEGF过表达及其对ASMCs增殖的影响
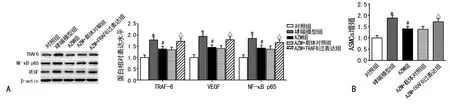
A:TRAF6、VEGF和NF-κB p65蛋白在各组ASMCs的表达;B:各组ASMCs的增殖;*:P<0.05,与对照组比较;#:P<0.05,与哮喘模型组比较;△:P<0.05,与AZM组比较
图4 TRAF6过表达及其对NF-κB p65和VEGF蛋白表达及ASMCs增殖的影响
3 讨 论
ASMCs过度增殖是支气管哮喘气道重塑的一个重要因素,也是许多趋化因子、细胞炎性因子的重要来源。增殖的ASMCs能够导致气道管壁增厚、气道狭窄,加重哮喘气道炎症,引起气道高反应性。因此,抑制ASMCs的增殖对哮喘及气道重塑的逆转和预防有着重要意义。本研究发现,哮喘模型大鼠气道WAt/Pbm、WAi/Pbm和WAm/Pbm较正常大鼠均明显增加,哮喘模型组ASMCs增殖也明显增加,而AZM处理后,气道WAt/Pbm、WAi/Pbm和WAm/Pbm均明显减少,ASMCs增殖也明显减少,证实AZM能够抑制ASMCs增殖,减缓气道重塑,与以往的报道一致[3,17]。
有研究显示,哮喘大鼠ASMCs的增殖与VEGF mRNA及蛋白表达水平呈正相关[5];VEGF的表达也与NF-κB信号通路密切相关[10],且研究表明NF-κB活化也参与哮喘ASMCs的增殖[18]。因此,本研究分析了NF-κB/VEGF通路在AZM抑制哮喘ASMCs增殖中的作用,结果表明哮喘大鼠肺组织及ASMCs中NF-κB p65和VEGF蛋白表达水平较正常大鼠均明显增加,证实NF-κB/VEGF信号通路参与了哮喘过程。AZM处理后,NF-κB p65和VEGF蛋白表达水平均明显减少,这与郭彩霞[19]报道的AZM能够抑干预慢性阻塞性肺病中NF-κB通路的激活一致。同时,VEGF的过表达能够显著减弱AZM对ASMCs增殖的抑制效应,表明AZM可能部分通过抑制NF-κB/VEGF信号通路抑制哮喘大鼠ASMCs的增殖。
TRAF6是NF-κB信号通路的重要调节因子,且TRAF6与VEGF的表达存在相关性[20]。AZM能够减少破骨细胞中TRAF6 mRNA的表达[13],提示AZM可能通过TRAF6调控NF-κB/VEGF信号通路参与哮喘进程。因此,本研究分析了TRAF6在AZM抑制哮喘ASMCS中的作用,结果显示哮喘模型组ASMCs中TRAF6蛋白表达较对照组明显增加,这与Riba等[8]报道的TRAF6高表达与支气管哮喘发作相关一致[8]。AZM处理后,TRAF6蛋白表达水平明显减少。同时,TRAF6过表达能减弱AZM对VEGF和NF-κB p65蛋白表达的抑制效应,也能逆转AZM对ASMCs增殖的抑制效应,表明AZM对哮喘大鼠ASMCs增殖的抑制作用可能部分是通过阻断TRAF6/NF-κB/VEGF信号通路而实现的,这可能也是AZM延缓哮喘气道重塑的重要机制之一。
综上所述,AZM能够抑制哮喘大鼠ASMCs的增殖,其部分机制可能是通过抑制TRAF6/NF-κB/VEGF信号通路而实现的。
[1]Normansell R,Kew KM,Mansour G.Different oral corticosteroid regimens for acute asthma[J].Cochrane Database Syst Rev,2016(5):CD011801.
[2]潘亦林,朱燕亭,李满祥.支气管哮喘气道重塑的研究进展[J/CD].中华肺部疾病杂志(电子版),2015,8(6):97-100.
[3]尹娟,戴元荣,徐慧,等.阿奇霉素对哮喘大鼠气道平滑肌细胞生长的影响[J].浙江医学,2010,32(5):685-687.
[4]Smith R.Is VEGF a potential therapeutic target in asthma? [J].Pneumologia,2014,63(4):194,197-199.
[5]邹晖,徐永健,张珍祥.血管内皮生长因子及其受体2与哮喘模型大鼠气道平滑肌细胞增殖关系的研究[J].中国组织化学与细胞化学杂志,2010,19(4):321-326.
[6]Luo X,Hong H,Tang J,et al.Increased expression of miR-146a in children with allergic rhinitis after allergen-specific immunotherapy[J].Allergy Asthma Immunol Res,2016,8(2):132-140.
[7]Dong LH,Li L,Song Y,et al.TRAF6-mediated SM22α K21 ubiquitination promotes G6PD activation and NADPH production,contributing to GSH homeostasis and VSMC survival in vitro and in vivo[J].Circ Res,2015,117(8):684-694.
[8]Riba M,Garcia Manteiga JM,Bošnjak B,et al.Revealing the acute asthma ignorome:characterization and validation of uninvestigated gene networks[J].Sci Rep,2016,6:24647.
[9]Qiu H,Huang F,Xiao H,et al.TRIM22 inhibits the TRAF6-stimulated NF-kappaB pathway by targeting TAB2 for degradation[J].Virol Sin,2013,28(4):209-215.
[10]Zhu T,Wang DX,Zhang W,et al.Andrographolide protects against LPS-induced acute lung injury by inactivation of NF-κB[J].PLos One,2013,8(2):e56407.
[11]Huang CQ,Li W,Wu B,et al.Pheretima aspergillum decoction suppresses inflammation and relieves asthma in a mouse model of bronchial asthma by NF-κB inhibition[J].J Ethnopharmacol,2016,189:22-30.
[12]Zha WJ,Su M,Huang M,et al.Administration of pigment epithelium-derived factor inhibits airway inflammation and remodeling in chronic OVA-induced mice via VEGF suppression[J].Allergy Asthma Immunol Res,2016,8(2):161-169.
[13]Gannon SC,Cantley MD,Haynes DR,et al.Azithromycin suppresses human osteoclast formation and activity in vitro[J].J Cell Physiol,2013,228(5):1098-1107.
[14]Wan YF,Huang ZH,Jing K,et al.Azithromycin attenuates pulmonary inflammation and emphysema in smoking-induced COPD model in rats[J].Respir Care,2015,60(1):128-134.
[15]Zhao L,Wu J,Zhang X,et al.The effect of Shenmai injection on the proliferation of rat airway smooth muscle cells in asthma and underlying mechanism[J].BMC Complement Altern Med,2013,13:221.
[16]郑湘榕,张珊珊,杨于嘉,等.内皮细胞特异性表达血管内皮生长因子基因载体的构建及表达特性验证[J].中国现代医学杂志,2010,20(21):3205-3209.
[17]郭敏,郭悦鹏.阿奇霉素对哮喘大鼠气道重塑的影响 [J].新乡医学院学报,2013,30(5):364-367.
[18]韦江红,莫碧文,黄剑伟.TLR4/NF-κB对哮喘大鼠气道平滑肌细胞增殖、凋亡的影响 [J].中国现代医学杂志,2011,21(25):3110-3115.
[19]郭彩霞.阿奇霉素经TLR-4/NF-κB信号通路干预COPD大鼠炎症的机制研究 [J].重庆医学,2016,45(12):1612-1615.
[20]Bruneau S,Datta D,Flaxenburg JA,et al.TRAF6 inhibits proangiogenic signals in endothelial cells and regulates the expression of vascular endothelial growth factor[J].Biochem Biophys Res Commun,2012,419(1):66-71.
Azithromycin inhibits proliferation of rat airway smooth muscle cells though TRAF6/NF-κB/VEGF signaling pathway
LiXiaoli1,WangWei1,GuoJiyuan2,GuoShengxiang1
(1.DepartmentofPediatrics,Xi′anMunicipalThirdHospital,Xi′an,Shaanxi710018,China;2.DepartmentofPediatrics,Xi′anMunicipalChildren′sHospital,Xi′an,Shaanxi710002,China)
Objective To explore the mechanism of azithromycin (AZM) for inhibiting the proliferation of rat airway smooth muscle cells (ASMCs).Methods Thirty Sprague-Dawley (SD) rats were divided into the control group,asthma model group and AZM group.The rat model of asthma was established by ovalbumin (OVA) sensitization and stimulation in vitro.The airway related parameters of rat lung tissue were determined by using the medical image analysis system.Primary passage ASMCs were isolated and cultured using the tissue-sticking method,and the vascular endothelial growth factor (VEGF) overexpression vector or tumor necrosis factor receptor-associated factor 6 (TRAF6) overexpression vector was transfected into ASMCs in the AZM group.The protein levels of VEGF,NF-κB p65 and TRAF6 were detected by Western blotting,and the proliferation of ASMCs was evaluated by CCK-8 kit.Results AZM significantly inhibited the increase of thickness of total airway wall,thickness of inner airway wall and thickness of airway smooth muscle layer in asthma rats (P<0.05),also significantly inhibited the proliferation of ASMCs in the asthma model group (P<0.05).AZM significantly inhibited the protein expression of VEGF and NF-κB p65 induced by asthma (P<0.05),and the overexpression of VEGF significantly reduced the inhibiting effects of AZM on proliferation of ASMCs (P<0.05).AZM significantly inhibited the high expression of TRAF6 induced by asthma (P<0.05),and the overexpression of TRAF6 significantly reduced the inhibiting effects of AZM on expression of VEGF and NF-κB p65 as well as proliferation of ASMCs (P<0.05).Conclusion AZM can suppress the proliferation of ASMCs,its partial mechanism may be realized through inhibiting TRAF6/NF-κB/VEGF signaling pathway.
azithromycin;asthma;airway smooth muscle cell;TRAF6;NF-κB;vascular endothelial growth factor
李小莉(1979-),副主任医师,本科,主要从事小儿内科方面的研究。
10.3969/j.issn.1671-8348.2017.21.006
R562.2+5
A
1671-8348(2017)21-2898-04
2017-02-05
2017-04-10)
