下调PI3K/Akt信号通路对抑制喉癌细胞生长的影响*
2017-08-12王慧敏余文发卢振民
王慧敏,余文发,周 航,卢振民
(新乡医学院第一附属医院耳鼻咽喉科,河南卫辉 453100)
下调PI3K/Akt信号通路对抑制喉癌细胞生长的影响*
王慧敏,余文发,周 航,卢振民△
(新乡医学院第一附属医院耳鼻咽喉科,河南卫辉 453100)
目的 探讨钾通道阻断剂四乙胺(TEA)通过磷脂酰肌醇3激酶(PI3K)/丝氨酸苏氨酸蛋白激酶(Akt)信号通路对人喉癌上皮细胞(Hep-2)增殖与凋亡的影响。方法 将TEA作用于Hep-2,用噻唑蓝(MTT)法测定Hep-2细胞活性,计算出TEA对Hep-2的增殖抑制率;采用Hoechest33258染色检测细胞凋亡,用流式细胞仪(FCM)法测定Hep-2凋亡率。结果 5、10、20 mmol/L TEA接种后,Hep-2细胞增殖抑制率分别达到12.573%、31.385%和56.132%,Hep-2作用96 h后细胞凋亡率分别为(41.64±2.67)%、(58.76±4.32)%和(72.65±6.54)%,TEA处理组抑制率和凋亡率都高于未用TEA处理的对照组,差异均有统计学意义(P<0.05)。结论 TEA可抑制Hep-2的增殖及体内生长,促进Hep-2的凋亡。
钾通道阻滞剂;喉肿瘤;上皮细胞;PI3K-Akt;细胞凋亡
University,Weihui,Henan453100,China)
喉癌是一种常见的恶性肿瘤,发病率占全身肿瘤的1%~5%,其病因尚不十分清楚,症状因癌肿部位而存在较大差别[1]。探索喉细胞癌发生、发展的病理生理机制,寻找有效的治疗方法是肿瘤外科和耳鼻喉科的一个研究热点。外离子环境是细胞依赖生存的条件,喉癌细胞上存在着多种类型的钾离子通道,调节磷脂酰肌醇3激酶(PI3K)/丝氨酸苏氨酸蛋白激酶(Akt)信号通路对咽喉肿瘤细胞的增殖和凋亡有着非常重要的作用[2]。为了探讨钾通道在喉癌细胞增殖中的作用和机制,寻找喉癌治疗的新靶点。笔者以体外培养的人喉癌上皮细胞(human larynx carcinoma epithelial cell,Hep-2)为研究对象,观察钾通道阻滞剂四乙胺(tetra ethyl ammonium,TEA)对Hep-2细胞增殖和凋亡的影响。
1 材料与方法
1.1 材料
1.1.1 细胞来源 Hep-2细胞株购自中国科学院上海细胞库。
1.1.2 药品与试剂 胎牛血清(FBS)购自杭州四季清公司;TEA、Hoechest33258荧光染料、噻唑蓝(MTT)、二甲亚砜(DMSO)、胰蛋白酶均购自美国Sigma公司;流式试剂盒购自北京中杉金桥生物技术有限公司。其他试剂均为国产分析醇。
1.1.3 仪器 Olympus-LX70倒置显微镜(西安测维光电技术有限公司);HEAR-cell150培养箱(上海森信实验仪器有限公司);ZEISS-imager Al荧光显微镜(西安测维光电技术有限公司);AT-858酶标仪(上海优浦科学仪器有限公司生产);BD-FACSCalibur流式细胞仪(FCM)。
1.2 方法
1.2.1 细胞株培养 在37 ℃、5% CO2饱和湿度的培养箱中,将所购HEP-2细胞株单层接种在含10% FBS的DMEM培养基中(每100毫升含1万U的庆大霉素)生长,同时以0.25%胰蛋白酶消化传代。
1.2.2 细胞生长抑制实验 采用MTT法,取2×104/mL、生长状态良好的Hep-2细胞,预培养12 h,细胞贴壁后,设对照组(不给予TEA处理)和不同TEA水平处理组(TEA 1、5、10、20 mmol/L),分别接种于4块96孔平底培养板中,每孔100 μL细胞,在37 ℃、体积分数为5%CO2的培养箱中继续培养24、48、72、96 h,然后弃上清液,每孔加入5 g/L MTT溶液10 μL,37 ℃作用4 h后,每孔再加入100 μL DMSO,震荡10 min摇匀,酶标仪(λ=490 nm)测吸光度(A)值。整个实验在同样条件下重复3次,计算药物作用后细胞的体外生长抑制率,细胞抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。随后以时间为横轴,细胞抑制率为纵轴绘制Hep-2的生长抑制率曲线。
1.2.3 细胞凋亡检测 分别收集被不同TEA水平处理96 h后的Hep-2细胞,用磷酸盐缓冲液(PBS)洗涤2次(1 000 r/min,5 min),收集5×105个细胞,加入500 μL的缓冲液悬浮细胞;取0.1 μL细胞悬液涂于盖玻片上,用新鲜配制1∶3混合的乙酸/甲醇固定液固定10 min,蒸馏水漂洗后,加入8 mg/L Hoechst 33258荧光染色液染色20 min,用双蒸水洗3次,自然晾干后封片,荧光显微镜下观察细胞形态。凋亡细胞呈染色质高度凝聚、边集,细胞核裂解为碎块,凋亡小体形成。室温下避光反应5~15 min,在FCM上用激发波长Ex=488 nm,发射波长Em=530 nm测试细胞凋亡周期,并计算细胞凋亡率,凋亡率(%)=[实验组凋亡率(%)-对照组凋亡率(%)]/[1-对照组凋亡率(%)]。

2 结 果
2.1 TEA对Hep-2细胞增殖的抑制效应 MTT实验结果显示,对照组A值为0.850±0.015,抑制率为0。接种TEA后(不同TEA水平的处理组),A值和增殖抑制率随药物水平变化而相应变化,TEA为1 mmol/L时,A值和增殖抑制率与对照组很接近;当TEA≥5 mmol/L时,对Hep-2细胞的增殖抑制率明显高于对照组(P<0.05),且TEA水平与A值成反比,与增殖抑制率成正比,见表1。处理组4个不同水平TEA培养后,Hep-2细胞的生长抑制率随着反应时间延长而增高,且TEA水平越高,增幅越大,Hep-2的生长抑制率曲线见图1。
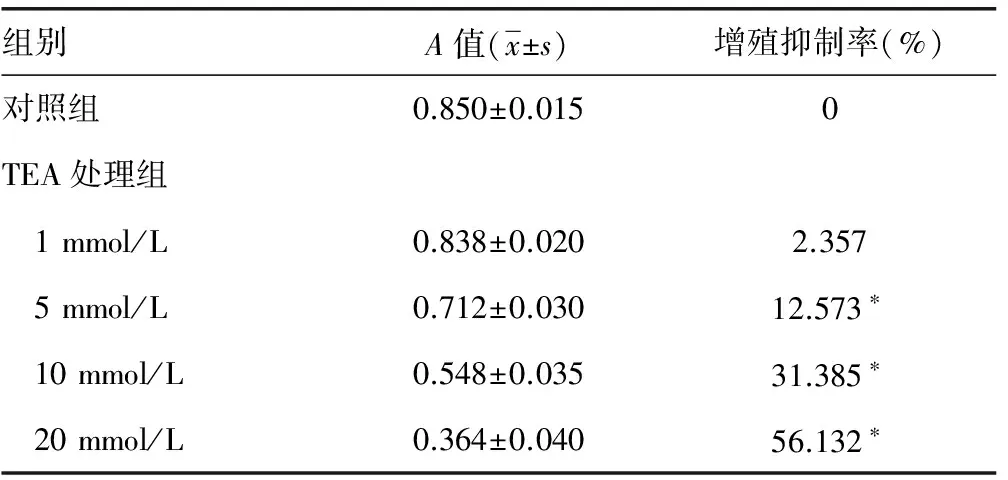
表1 48 h后TEA对Hep-2细胞增殖抑制作用的影响
*:P<0.01,与对照组比较
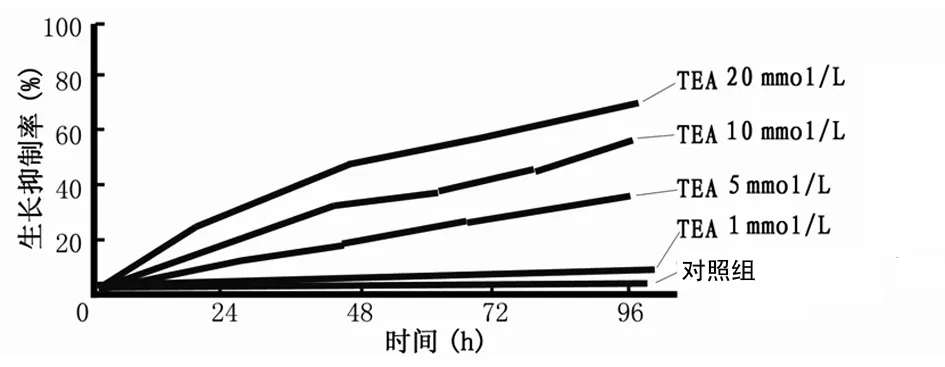
图1 TEA对Hep-2细胞的生长抑制率曲线
2.2 TEA对Hep-2细胞凋亡及周期分布的影响 通过光学显微镜下观察Hep-2的形态,结果显示:对照组细胞形态良好、细胞膜完整、细胞核大圆、核仁色深,清晰可见,而TEA处理组的Hep-2细胞除很少部分继续贴壁外,大部分已死亡、脱落,且贴壁细胞也出现圆缩、脱落等凋亡趋势。Hoechst33258荧光染色观察显示,对照组细胞膜完整,细胞质丰富饱满,细胞核呈现均匀一致的蓝色荧光;TEA处理组亮蓝色的细胞核质浓缩、密度增加,核聚集并破裂成大小不等的碎片,呈典型的凋亡形态。FCM检测Hep-2细胞凋亡率比较,见表2。
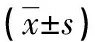
表2 不同水平的TEA作用96 h后Hep-2细胞周期分布及凋亡率
*:P<0.05:#:P<0.01,与对照组比较
3 讨 论
大部分喉癌都属于鳞癌,目前临床上对喉癌的治疗方式早期主要以放疗为主,晚期多采取手术加化疗的方式[3]。随着对人喉癌Hep-2细胞的生物学特性和分子机制研究的不断深入,利用生物分子学原理,通过阻隔通道、下调环境去抑制癌细胞生长,诱导癌细胞凋亡进行抗肿瘤治疗也开始应用到咽喉癌防治中,且成为喉癌防治的新策略[4]。众多研究发现,PI3Ks信号参与了肿瘤细胞的增殖、分化、调节和凋亡,与其下游分子Akt所组成的信号通路与人类肿瘤的发生、发展、迁移、黏附、肿瘤血管生成及细胞外基质的降解等都有密切的相关性,以PI3K/Akt信号通路关键分子为靶点,发展小分子药物有效抑制该通路的高活性的恶性肿瘤治疗策略也在积极探索中[5-6]。
近年有研究发现,钾离子通道在肿瘤细胞的增殖和凋亡中发挥重要作用,不同肿瘤细胞膜存在多种钾离子通道,并调控肿瘤细胞生长[7]。如果加入钾离子通道阻断剂,可控制肿瘤细胞的通透性、氧耗、核碎,继而促使癌细胞体积缩小,生理形态发生改变。同时通过P53蛋白残基磷酸化,下调PI3K/Akt通路活性,抑制肿瘤细胞的生长,减少癌细胞增殖、转移,促进癌细胞凋亡[8]。为了探讨钾离子通道通过下调PI3K/Akt信号通路对人喉癌上皮细胞的生长抑制作用,本研究以人喉癌上皮细胞Hep-2为研究对象,选择钾通道阻滞剂TEA作为工具药物,观察PI3K/Akt通路对喉癌上皮细胞细胞黏附、运动和增殖侵袭的影响。MTT法实验结果表明,接种48 h后,TEA处理组中TEA水平在5、10、20 mmol/L时,对Hep-2细胞增殖抑制率分别达到12.573%、31.385%和56.132%。与对照组比较,差异有统计学意义(P<0.05),说明TEA对Hep-2细胞有明显的抑制作用。
采用Hoechst33258荧光染色法和FCM检测细胞凋亡,显微镜观察发现,药物水平的增加和作用时间的延长与生长抑制率成正比,即TEA体外抗人喉癌Hep-2细胞的作用具有明显的量效关系和时效关系。通过FCM检测,可以看出S期细胞明显减少,细胞被阻滞于G0/G1期。喉癌细胞具有多种抑制凋亡、延长存活的机制,TEA处理有助于下调P13K/Akt信号通路[9],通过TEA对Akt进行磷酸化,继而对Hep-2形成细胞周期阻滞,使G1期细胞不能正常通过细胞周期点进入S期而发生G0/G1期阻滞,这正是一种显性负效应[10]。TEA抑制P13K/Akt信号通路活性,干扰喉癌细胞的正常周期,阻断DNA合成,直接抑制喉癌细胞增殖和生长,诱导喉癌细胞凋亡[11-12]。为恶性肿瘤的治疗探寻了新的途径与思路。
综上所述,P13K/Akt信号通路与喉癌细胞的生长和转移潜能有直接关系[13]。通道阻滞剂TEA下调P13K/Akt信号通路,对人喉癌Hep-2细胞增殖有重要抑制作用,可进一步促进Hep-2细胞凋亡,这一观察结果具有分子生物学的理论意义[14]。当然,要全面应用到临床还需要进一步探索。
[1]杨智英,谭超超,杨治平,等.维甲酸对肝癌细胞HtPG2糖基化磷脂酰肌醇特异性磷脂酶D表达及细胞生物学特性的影响[J].生命科学研究,2012,16(1):42-47.
[2]宋岩,刘秀萍,白伟良,等.LY294002联合顺铂阻断PI3K-Akt通路诱导喉癌Hep-2细胞凋亡研究[J].实用肿瘤杂志,2013,28(2):132-134.
[3]李豫江,张伟,赵磊.来氟米特通过PI3K/Akt/mTOR信号通路诱导大鼠系膜细胞凋亡的作用[J].重庆医学,2016,45(8):1022-1025.
[4]魏蕾,江黎珠,于超,等.下调FoxM1表达对人喉癌Hep-2细胞顺铂敏感性的影响[J].第三军医大学学报,2015,37(16):1603-1608.
[5]Georgakis GV,Younes A.From Rapa Nui to rapamycin:targeting PI3K/Akt/mTOR for cancer therapy[J].Expert Rev Anticancer Ther,2006,6(1):131-140.
[6]江红轲.游泳训练通过激活P13K-Akt信号通路抑制2型糖尿病引起的心肌细胞凋亡[J].湖南师范大学自然科学学报,2012,35(3):71-77.
[7]权悦,马莹,周峰,等.多糖偶联细胞毒性药物治疗恶性肿瘤的研究进展[J].癌变·畸变·突变,2016,28(1):77-80.
[8]谭超超,唐建华,卢永娟,等.糖基化磷脂酰肌醇磷脂酶D与动脉粥样硬化关系的研究[J].中华老年医学杂志,2012,31(11):954-958.
[9]祝冰晶,王宇亮,罗虎,等.CA916798基因通过PI3K/AKT通路参与肺癌顺铂耐药[J].第三军医大学学报,2013,35(7):618-621.
[10]张萌,彭利,乔治斌,等.PI3K/Akt信号通路抑制剂对人肝癌HepG2细胞的体外抑制作用及其机制[J].世界华人消化杂志,2013,21(23):2250-2257.
[11]余文发,赵玉林,王萍,等.siRNA沉默C-erbB-2基因对人喉癌Hep-2细胞PI3K/Akt信号通路的影响[J].临床耳鼻咽喉头颈外科杂志,2014,28(12):894-897.
[12]Levine DA,Bogomolniy F,Yee CJ,et al.Frequent mutation of the PIK3CA gene in ovarian and breast cancers[J].Clin Cancer Res,2005,11(8):2875-2878.
[13]杨智英,谭超超,杨治平,等.GPI-PLD通过下调PI3K-Akt信号通路活性抑制肝癌细胞的生长[J].中南大学学报(医学版),2014,39(9):873-878.
[14]Wang M,Vogel I,Kalthoff H.Correlation between metastatic potential and variants from colorectal tumor cell line HT-29[J].World J Gastroenterol,2003,9(11):2627-2631.
Effects of down-regulation of PI3K/Akt signaling pathway on growth of laryngeal cancer cells*
WangHuimin,YuWenfa,ZhouHang,LuZhenmin△
(DepartmentofOtorhinolaryngology,FirstAffiliatedHospitalofXinxiangMedical
Objective To investigate the effect of potassium channel blocker tetraethtylamine (TEA) on the proliferation and apoptosis of human laryngeal carcinoma cells (Hep-2) through the PI3K/Akt signaling pathway.Methods TEA acted on HEp-2.The methyl thiazolyl blue (MTT) method was used to determine the Hep-2 cell activity and the proliferation inhibition rate of TEA on Hep-2 was calculated;the Hoechest33258 staining was used to detect cell apoptosis,and the Hep-2 apoptosis rate was detected by flow cytometry (FCM) assay.Results After inoculation by 5,10,20 mmol/L TEA,the Hep-2 cell proliferation inhibition rate reached 12.573%,31.385% and 56.132%,respectively.After 96 h Hep-2 cell action,the cellular apoptosis rates were (41.64±2.67)%,(58.76±4.32)% and (72.65±6.54)% respectively,the inhibition rate and apoptosis rate in the TEA treating group were significantly higher than those in the non-TEA treating group,the differences were statistically significant (P<0.05).Conclusion TEA can inhibit the proliferation and in vivo growth of human laryngeal carcinoma cells and promotes the apoptosis of laryngeal cancer cells.
potassium channel blockers;laryngeal neoplasms;epithelial cells;PI3K/Akt;apoptosis
10.3969/j.issn.1671-8348.2017.21.004
河南省重点科技攻关项目(152102310355)。 作者简介:王慧敏(1981-),主治医师,硕士,主要从事耳鼻咽喉临床方面的研究。
R739.65;R730.53
A
1671-8348(2017)21-2892-03
2017-02-07
2017-04-12)
△通信作者,E-mail:wmhw741@sina.com。
