急性脑梗死患者AngⅡ及免疫指标IL-6、IgG、C3的变化研究
2017-08-11陈孝伟刘颖朱晓暾陶伟
陈孝伟,刘颖,朱晓暾,陶伟
·临床研究·
急性脑梗死患者AngⅡ及免疫指标IL-6、IgG、C3的变化研究
陈孝伟,刘颖,朱晓暾,陶伟
目的:探讨急性脑梗死患者血管紧张素Ⅱ(AngⅡ)及免疫指标IL-6、IgG、C3的变化与相互关系。方法:选择急性脑梗死患者46例为病例组,选择同时期健康体检者46例为对照组。检测并且比较2组血压、神经内分泌指标(AngⅡ)及免疫指标IL-6、1gG、C3水平。结果:病例组入院时平均舒张压及收缩压较对照组体检时显著升高(P<0.05)。病例组入院时IL-6、IgG及AngⅡ较对照组显著升高(P<0.05),而C3显著降低(P<0.05);病例组IL-6及C3在入院第3天及第7天较入院时均显著升高(P<0.05),入院第7天较入院第3天均显著降低(P<0.05);病例组IgG与AngⅡ在发病后均逐渐降低,但不同时点差异无统计学意义(P>0.05)。病例组发病后不同时点的IL-6、IgG、C3及AngⅡ水平无相关性(P>0.05)。结论:急性脑梗死患者出现AngⅡ及免疫指标的改变,随着病程进展出现不同趋势的变化。
脑梗死;血管紧张素Ⅱ;免疫;临床研究
脑梗死又称缺血性脑卒中,是局部脑组织因血液循环障碍而引起缺血、缺氧,继而脑软化或液化性坏死。其主要发病因素是血栓形成及动脉粥样硬化致脑动脉管腔狭窄。研究表明,脑梗死是成年人致残的主要因素,且有逐渐增长的趋势。脑梗死后的神经内分泌及免疫反应是缺血区及周围区神经元损伤的重要机制之一。因此,本研究通过检测急性脑梗死患者血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)及免疫指标IL-6、IgG、C3的变化,以探讨其变化规律及相互关系。
1 资料与方法
1.1 一般资料
选择2014年5月至2016年4月在聊城市第二人民医院神经内科住院治疗的急性脑梗死患者46例为病例组。入选标准:①符合脑梗死诊断标准,经头颅CT或MRI确诊,梗死体积<20 mL,除外脑干梗死且神志清楚;②除外3个月内脑卒中病史,1个月内有化疗、手术、放疗等特殊治疗史,半个月内有炎性反应病史或者入院后采血期院内感染者;③除外严重心、肝、肾、肺等重要脏器疾病,自身免疫性疾病,血液疾病,内分泌疾病,良恶性肿瘤,及血栓性疾病者;④临床资料完整。病例组中,男30例,女16例;年龄31~76岁,平均(52.38±8.56)岁;发病时间3~12 h,平均(6.42±1.22)h。选择同时期在聊城市第二人民医院体检中心行健康体检者46例为对照组。对照组病例满足病例组入选标准的②③④。对照组中,男28例,女18例;年龄30~78岁,平均(53.25±8.68)岁。2组一般资料差异无统计学意义(P>0.05),具有可比性。
1.2 方法
1.2.1 血压测定 病例组入院时,对照组体检时,于卧位或坐位由专人采用标准台式水银血压计检测左侧上肢肱动脉的收缩压及舒张压,检测前安静休息10 min,测量至少3次,取平均值。
1.2.2 AngⅡ及IL-6检测 病例组于入院时、入院第3天和第7天,清晨空腹采集肘静脉血。AngⅡ采用同位素放射免疫分析法,严格按照试剂盒操作说明书检测,在检测管中依次加入待测样品或标准品、缓冲液、25I-AngⅡ,4℃放置反应24 h,加入免疫分离剂,震荡3 min混匀,3500转/min离心15 min,吸取上清液分离出抗原-抗体复合物,采用平衡法测定复合物的放射性部分计数,检测样品浓度。IL-6检测方法基本同上,但在3500转/min离心15 min后,吸弃上清液,采用平衡法测定各管沉淀的放射性部分计数,检测样品浓度。对照组于相同时间清晨体检时抽取静脉血按同样的方法予以检测。
1.2.3 IgG及C3检测 病例组于入院时、入院后第3天和第7天,清晨空腹采集肘静脉血。检测IgG及C3的血液用乙二胺四乙酸二钠(EDTA-Na2)抗凝,使用BeckmanARRYA360蛋白分析仪采用免疫散射比浊法,由专人严格按说明书测定。对照组于相同时间清晨体检时抽取静脉血按同样方法检测。
1.3 统计学处理
2 结果
2.1 2组被检者血压比较
病例组入院时平均舒张压及收缩压较对照组体检时明显升高(P<0.05),见表1。
2.2 2组被检者AngⅡ及免疫指标比较
病例组患者入院时AngⅡ及IL-6、IgG与对照组比较均显著升高(t=6.90、6.98、3.42,P=0.001、0.001、0.009),而C3与对照组比较显著降低(t=14.87,P=0.001),见表2。
2.3 病例组患者不用时间点AngⅡ及免疫指标变化及相关性
病例组AngⅡ与IgG在发病后均逐渐降低,但不同时点均差异无统计学意义(均P>0.05);IL-6与C3在入院第3天及第7天较入院时均显著升高(P<0.05),入院第7天较入院第3天均显著降低(P<0.05),见表3。病例组患者发病后不同时点AngⅡ与IL-6,IgG,C3水平无相关性(均P>0.05)。
表1 2组被检者收缩压与舒张压比较(mmHg,±s)
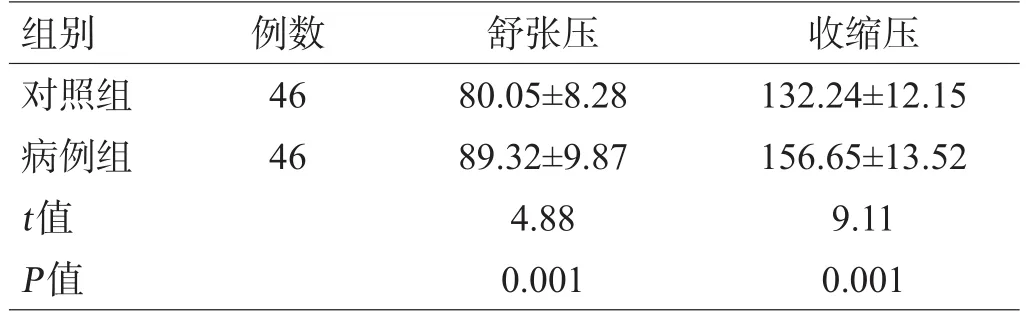
表1 2组被检者收缩压与舒张压比较(mmHg,±s)
组别对照组病例组t值P值例数46 46舒张压80.05±8.28 89.32±9.87 4.88 0.001收缩压132.24±12.15 156.65±13.52 9.11 0.001
表2 2组被检者AngⅡ及免疫指标比较(±s)

表2 2组被检者AngⅡ及免疫指标比较(±s)
组别对照组病例组入院时例数46 46 AngⅡ/(ng/L)22.24±8.86 37.62±12.24 IL-6/(ng/mL)0.15±0.03 0.21±0.05组别对照组病例组入院时IgG/(g/L)10.65±2.28 13.08±4.24 C3/(g/L)1.19±0.10 0.62±0.24
表3 病例组不同时间点的AngⅡ及免疫指标变化(±s)

表3 病例组不同时间点的AngⅡ及免疫指标变化(±s)
注:与入院时比较,①P<0.05;与入院后第3天比较,②P<0.05
时间点入院时入院第3天入院第7天AngⅡ/(ng/L)37.62±12.24 35.98±12.18 34.65±11.68 IL-6/(ng/mL)0.21±0.05 1.19±0.04①1.17±0.02①②时间点入院时入院第3天入院第7天IgG/(g/L)13.08±4.24 12.88±4.16 12.76±4.19 C3/(g/L)0.62±0.24 1.79±0.28①1.48±0.18①②
3 讨论
随着人类生活方式的改变,心脑血管病仍然是第一大致死性或致残性疾病,且有发病逐渐年轻化的趋势。脑梗死后缺血区及周围区神经元损伤由神经内分泌及免疫反应等参与,因此急性脑梗死患者神经内分泌因子及免疫因子的变化及相关性值得进一步研究。
肾素-血管紧张素-醛固酮系统(renin-angiotensin aldosterone system,RAAS)是机体重要的神经内分泌系统之一,通过AngⅡ与广泛受体结合而升高血压,如收缩血管平滑肌、分泌醛固酮增多;刺激交感神经系统,增强阻力血管收缩;使心肌细胞肥大和间质纤维化等[1-5]。虽然RAAS与脑血管病的关系尚不明确,但RAAS功能亢进确实与脑血管病有关。研究表明[6,7],RAAS功能亢进能改变血管结构,促进动脉粥样硬化,增加血小板凝聚力,增加血栓形成的风险,增加脑梗死的发病。研究表明,脑损伤后AngⅡ在脑脊液及外周血均升高,并与脑组织水含量正相关,而在恢复期降低,脑梗死后缺血缺氧脑组织水中逐渐增高,因此AngⅡ含量与脑梗死进展有一定相关性。本研究发现,急性脑梗死患者AngⅡ含量与血压均较对照组显著升高,表明AngⅡ含量与高血压确实与脑梗死有一定相关性。
脑梗死患者常存在体液免疫及细胞免疫异常的表现,激活并且释放各种炎性介质。免疫异常可能与脑梗死的发病机制有一定的关联。IL-6在血液中主要由活化的单核细胞、巨噬细胞及T淋巴细胞分泌而来,是一种参与免疫和炎症反应的多功能的促炎细胞因子,可刺激血小板衍生因子及上调AngⅡ的表达使血管壁收缩[8-11],研究表明与脑梗死存在一定的关联。本研究发现IL-6在脑梗死患者中含量显著增高,而在第7天时开始显著降低,表明IL-6可能在脑梗死患者急性期发挥炎性作用,而后逐渐降低,这与文献报道[12]一致。
IgG反映机体的体液免疫状态,而C3在补体中含量最高,是补体激活途径的中心,参与机体适应免疫过程,调节细胞免疫,维护机体的内环境稳定等。研究发现,急性脑梗死患者IgG含量升高,但随着时间的进展逐渐降低,但是各时间点均无显著差异,因此可知,急性脑梗死患者存在体液免疫,且IgG增高与急性脑梗死关系密切[13]。C3在发病后较对照组显著降低,可能与疾病发展的早期补体耗竭有关,随病程进展急剧增加,在入院第3天即显著高于对照组,在入院第7天有所降低但仍较对照组高,表明C3在急性脑梗死的病程进展中有一定作用,可能与血脑屏障破坏使大量炎性细胞激活,产生大量的炎性介质及炎性因子有关。
综上可知,急性脑梗死患者出现AngⅡ及免疫反应的改变,并且随着病程进展出现不同趋势变化,但本研究未进行长期随访,有进一步研究的必要。
[1]杨慧,王红霞,李汇华.肾素-血管紧张素系统对心血管系统疾病的网络调节[J].生理科学进展,2013,44:183-187.
[2]彭健,罗礼云,李铁,等.肾素-血管紧张素系统双基因多态性与老年人冠心病慢性心力衰竭的关系[J].中国循环杂志,2011,26:93-96.
[3]Daimon M,Kamba A,Murakami H,et al.Association between pituitary-adrenal axis dominance over the renin-angiotensin-aldosterone system and hypertension[J].J Clin Endocrinol Metab,2016,101:889-897.
[4]Wang HB,Yang J.The role of renin-angiotensin aldosterone system related micro-ribonucleic acids in hypertension[J].Saudi Med J,2015,36: 1151-1155.
[5]Yuan YM,Luo L,Guo Z,et al.Activation of renin-angiotensin-aldosterone system(RAAS)in the lung of smoking-induced pulmonary arterial hypertension(PAH)rats[J].J Renin Angiotensin Aldosterone Syst,2015,16: 249-253.
[6]张梅,张运,谈红,等.动脉粥样硬化与肾素血管紧张素系统及纤溶系统的关系[J].中国医学影像技术,2002,18:49-50.
[7]董政军,谈红,吴晓晴,等.兔动脉粥样硬化斑块与肾素-血管紧张素系统关系的研究[J].动物医学进展,2003,24:81-83.
[8]Lee DL,Leite R,Fleming C,et al.Hypertensive response to acute stress is attenuated in interleukin-6 knockout mice[J].Hypertension,2004, 44:259-263.
[9]徐良志,张晨.血管紧张素Ⅱ对成骨细胞IL-6表达的影响[J].郑州大学学报(医学版),2014,49:629-633.
[10] Li Y,Wang Y,Ding X,et al.Serum levels of TNF-α and IL-6 are associated with pregnancy-induced hypertension[J].Reprod Sci,2016,23: 1402-1408.
[11]Jasiewicz M,Knapp M,Waszkiewicz E,et al.Enhanced IL-6 transsignaling in pulmonary arterial hypertension and its potential role in disease-related systemic damage[J].Cytokine,2015,76:187-192.
[12] Oleksowicz L,Mrowiec Z,Zuckerman D,et al.Platelet activation induced by interleukin-6:evidence for a mechanism involving arachidonic acid metabolism[J].Thromb Haemost,1994,72:302-308.
[13]李海军,于盈.急性脑梗塞病人血清Ig与补体C3的动态变化及临床意义[J].临床医学,2004,24:2-4.
(本文编辑:雷琪)
R741;R743.3
ADOI10.16780/j.cnki.sjssgncj.2017.04.022
聊城市第二人民医院神经内科山东 聊城 252600
2016-09-02
陈孝伟hfl_53646@163. com
