贝母素甲对多药耐药人白血病细胞活力和凋亡的影响及机制
2017-08-09齐彦廖斌徐成波皇甫真萍陈佳薇福建中医药大学附属人民医院福州350004
齐彦,廖斌,徐成波,皇甫真萍,陈佳薇(福建中医药大学附属人民医院,福州350004)
贝母素甲对多药耐药人白血病细胞活力和凋亡的影响及机制
齐彦,廖斌,徐成波,皇甫真萍,陈佳薇
(福建中医药大学附属人民医院,福州350004)
目的 观察贝母素甲对多药耐药白血病人细胞K562/A02活力与细胞凋亡的影响,探讨活性氧(ROS)在此过程中的作用。方法 将K562/A02细胞成3组,药物组分别加入终浓度为100、200、400 μmol/L的贝母素甲;NAC预处理组采用5 mmlo/L ROS清除剂N-乙酰-L-半胱氨酸(NAC)预处理后,再加入终浓度为400 μmol/L的贝母素甲;对照组加等体积的药物溶解介质RPMI1640培养基。采用MTT法检测各组细胞活力,流式细胞术检测细胞凋亡情况,紫外分光光度法检测细胞内ROS、GSH水平。结果 与对照组比较,药物组细胞活力均降低(P<0.05或<0.01)、细胞内ROS水平增高(P均<0.01)、GSH水平下降(P均<0.01)、细胞凋亡率上升(P均<0.05),NAC预处理组的细胞活力、细胞凋亡率和ROS水平无明显变化(P均>0.05)。结论 贝母素甲可抑制多药耐药人白血病细胞K562/A02的细胞活力、诱导其凋亡;其机制是通过诱导细胞ROS爆发,引起GSH水平下降,从而逆转多药耐药的发生。
贝母素甲;慢性粒细胞白血病;K562/A02;多药耐药;活性氧;细胞活力;细胞凋亡
慢性粒细胞白血病(CML)是由Bcr-Abl酪氨酸激酶持续激活引起的血液系统恶性肿瘤。肿瘤细胞的多药耐药现象(MDR)是导致CML化疗失败主要原因之一[1]。浙贝母为百合科植物浙贝母的干燥鳞茎,具有清热化痰、散结解毒的功效[2]。现代药理研究显示,浙贝母的主要成分贝母素甲可抑制多种肿瘤细胞生长,逆转肿瘤细胞的MDR[3~5],但具体作用机制的研究不多。活性氧(ROS)是细胞内一类重要信号分子,参与细胞增殖、凋亡、多药耐药产生等诸多事件[6,7]。一些化疗药物如Chaetominine、小白菊内酯、小檗胺等能调节多药耐药CML细胞内的ROS水平,诱导细胞凋亡,抑制细胞增殖[8~10]。2015~2016年,我们采用多药耐药CML细胞株K562/A02细胞[11]进行体外研究,观察贝母素甲对多药耐药CML细胞体外增殖和凋亡的影响,探讨ROS的变化及其机制,为贝母素甲治疗CML耐药提供实验依据。
1 材料与方法
1.1 材料 人CML多药耐药细胞株K562/A02由福建省血液病研究所惠赠。RPMI1640培养基和胎牛血清(FBS)购自美国Gibco公司;贝母素甲(纯度>98%)和盐酸阿霉素购自美国阿拉丁工业公司;MTT和二甲基亚砜(DMSO)购自美国Amresco公司;ROS清除剂N-乙酰-L-半胱氨酸(NAC)、Annexin V-FITC细胞凋亡检测试剂盒,ROS检测试剂盒和GSH检测试剂盒购自碧云天生物技术研究所。细胞培养瓶、培养板购自美国Corning公司;IX70倒置相差显微镜及数码摄像装置产自日本Olympus公司;二氧化碳培养箱购自德国Heraeus公司,超净工作台为苏州净化设备有限公司产品,ELX800全自动酶标仪产自BioTek公司,全波长多功能微孔板检测仪Infinite 200 PRO产自瑞士TECAN公司。
1.2 细胞培养与分组 取K562/A02接种于含10% FBS的RPMI1640培养基,置于37 ℃、饱和湿度、5% CO2培养箱中培养,2~3 d传代1次。培养基中加入盐酸阿霉素1 μg/mL维持细胞的耐药性。实验前1周更换不含盐酸阿霉素的培养基,取对数生长期细胞用于实验。将细胞分为药物组、对照组和NAC预处理组,各药物组分别加入终浓度为100、200、400 μmol/L的贝母素甲;对照组加等体积的药物溶解介质于RPMI1640培养基;NAC预处理组先加入5 mmol/LNAC预处理1 h,再加入终浓度为400 μmol/L的贝母素甲。
1.3 细胞活力观察 取对数生长期细胞,按4×104/mL接种于96孔板,每孔细胞悬液体积为100 μL。常规培养过夜后,按照1.2方法进行分组处理,每组设6个平行孔。培养24 h,用常规MTT法检测。每孔分别加入5 mg/mL MTT溶液15 μL,培养3 h,离心弃上清,加入DMSO振荡溶解沉淀。选择570 mn为主波长,630 nm为参比波长,在酶标仪上测定各孔的光吸收值(A值)。实验重复3次。
1.4 细胞凋亡观察 按照1.2方法将细胞分组处理,常规培养24 h。离心收集细胞,用预冷的PBS洗涤,取适量细胞加入195 μL Annexin V-FITC结合液,再加入5 μL Annexin V-FITC和10 μL碘化丙啶染色液,室温避光孵育20 min,上流式细胞仪检测。每份样品检测104个细胞,计数处于细胞周期早期、晚期凋亡的细胞数,计算早期调亡率、晚期凋亡率。双参数结果以二维散点图显示,数据由FCM计算机软件分析输出。实验重复3次。
1.5 细胞内ROS检测 药物组加入终浓度为200 μmol/L的贝母素甲后,分别于培养0、3、6、9、12、24 h时检测细胞内ROS表达。取ROS表达最高的时点,按1.2方法将细胞分组处理,检测各组ROS表达。各组细胞分别加入10 μmol/L DCFH-CA检测探针,于37 ℃细胞培养箱中避光孵育30 min,离心收集细胞,用无血清细胞培养液洗涤3次。选择488 nm为激发波长,525 nm为发射波长,于全波长多功能微孔板检测仪检测。ROS表达以相对于对照组的倍数(fold)表示。实验重复3次。
1.6 细胞内GSH检测 按照1.2方法将细胞分为药物组和对照组,常规培养24 h,计数并收集细胞,用PBS洗涤1次,加入细胞沉淀体积3倍量的蛋白去除试剂溶液,充分振荡;利用液氮和37 ℃温水快速冻融2次,4 ℃离心10 min,取上清。取适量待测上清液加入检测工作液,25 ℃孵育45 min。加入0.5 mg/mL的NADPH 50 μL,于405 nm处检测光吸收值,根据标准曲线计算总GSH含量。同时取部分上述准备好的待测上清液,加入5%体积的GSH清除辅助液和1%体积的GSH清除工作液,25 ℃反应60 min清除GSH,然后加入检测工作液,参照总GSH的测定方法,检测细胞内氧化型谷胱苷肽(GSSG)含量。将测定得到的总GSH含量减去GSSG含量,计算得出细胞中GSH含量。实验重复3次。

2 结果
2.1 各组细胞活力比较 药物组加入100、200、400 μmol/L贝母素甲后,细胞活力A值分别为0.392±0.040、0.314±0.022、0.161±0.033,对照组和NAC预处理组细胞活力A值分别为0.462±0.012、0.497±0.028。药物组细胞活力较对照组均降低(P均<0.05或<0.01),NAC预处理组细胞活力与对照组比较无统计学差异(P>0.05)。
2.2 各组细胞凋亡率比较 见表1。药物组加入100、200、400 μmol/L贝母素甲后细胞凋亡率较对照组上升(P均<0.05),NAC预处理组细胞凋亡率与对照组比较无统计学差异(P>0.05)。
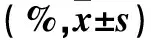
表1 各组细胞凋亡率比较
注:与对照组比较,*P<0.05。
2.3 各组细胞ROS水平比较 药物组加入200 μmol/L贝母素甲处理0、3、6、9、12、24 h时的细胞ROS水平分别为对照组的1.00、1.10±0.09、1.34±0.06、1.56±0.06、1.21±0.08、1.04±0.06倍,培养3 h时ROS水平开始上升,9 h时达到峰值,然后随时间延长开始下降,24 h时与对照组无统计学差异。采用100、200、400 μmol/L贝母素甲处理细胞9 h,细胞ROS水平分别为对照组的1.22±0.01、1.64±0.09、1.91±0.14倍,均高于对照组(P均<0.01);NAC预处理组培养9 h时细胞ROS水平为对照组的1.06±0.08倍,与对照组比较无统计学差异(P>0.05)。
2.4 各组细胞GSH水平比较 药物组加入100、200、400 μmol/L贝母素甲后细胞GSH水平分别为(4.44±0.17)、(3.87±0.31)、(3.06±0.14)μmol/L,与对照组的(5.68±0.06)μmol/L比较,P均<0.01。
3 讨论
CML是一组由多潜能造血干细胞异常增殖引起的恶性骨髓性疾病,发病率为1/10万~1.5/10万[12]。虽然以伊马替尼为代表的酪氨酸激酶抑制剂已成功用于CML的一线治疗,大幅度提高了患者的存活率[13],但仍有众多患者在治疗中产生对化疗药物的MDR,导致化疗失败。逆转MDR是CML治疗的重点之一[3]。产生MDR的机制很多,除了P-糖蛋白(P-gp)过表达及其对底物的外排作用之外,ROS信号亦参与其中[14]。在阿霉素诱导的K562多药耐药性细胞中,GSH等抗氧化系统活性的上升和ROS生成的抑制是细胞产生耐药性的关键因素之一[7]。
中药贝母首载于《本草正义》,其性寒,味大苦,具有清热化痰、散结解毒的功效,是临床常用的化痰药物。近年研究发现,贝母属植物提取物对炎症、高血压、肿瘤等多种疾病具有治疗潜力[15]。贝母素甲是中药浙贝母的主要成分之一,具有抗肿瘤活性[3~5,16,17]。胡凯文等[5]率先利用MTT法检测到贝母素甲对多药耐药CML细胞K562/A02具有体外细胞毒作用,但具体作用机制未明。因此,研究贝母素甲对多药耐药CML细胞增殖抑制的作用机制具有重要意义。
本研究显示贝母素甲可显著抑制K562/A02细胞活力,引起细胞内ROS上升,GSH含量下降。贝母素甲对K562/A02细胞ROS的诱导作用具有剂量与时间依赖性,可被ROS清除剂NAC所抑制。而NAC预处理几乎完全消除了贝母素甲对K562/A02细胞活力的抑制和细胞凋亡的诱导。
许多研究表明,大量的ROS可以和细胞内脂质、蛋白质、DNA等分子相互作用,触发相关信号通路,导致细胞氧化损伤乃至死亡。细胞内的抗氧化防护系统(如GSH)能清除过多ROS,防护ROS造成的氧化损伤。细胞中GSH含量下降常伴随着细胞凋亡率上升[18]。一些药物可通过引起K562细胞及其多药耐药细胞中ROS的爆发和GSH含量的下降,进而抑制细胞活力、诱导细胞凋亡,杀伤白血病细胞[1,19]。郑智等[20]研究表明,复方浙贝母颗粒协同阿霉素可有效降低K562/A02移植瘤组织细胞中GSH含量,抑制抗氧化酶谷胱甘肽-S-转移酶的表达,提高难治耐药性白血病临床缓解率。因此,ROS爆发与GSH含量下降导致的氧化-还原平衡破坏可能是贝母素甲抑制K562/A02细胞活力、诱导细胞凋亡的重要机制,ROS在这一过程中扮演着重要角色。
细胞凋亡常常是细胞ROS爆发的一个后继事件。本研究发现,贝母素甲处理在3 h时开始诱导ROS生成增加,9 h左右达到峰值,随后开始下降并恢复至与对照组相当的水平,表明贝母素甲可剂量依赖性地诱导K562/A02细胞凋亡,提示贝母素甲诱导的ROS升高是一个相对短期的过程,在对细胞产生氧化损伤的同时,可能具有信号效应,能激活相应的信号分子而引起细胞凋亡。随着细胞凋亡数量增多,特别是晚期凋亡的细胞因功能受损导致ROS生成能力下降,药物引起的ROS产生随之减少。这亦从一个侧面提示贝母素甲刺激细胞产生ROS进而诱导细胞凋亡可能是其抗肿瘤机制之一。Wang等研究发现,平贝母和川贝母中提取的生物碱可激活Caspase-3,激活Caspase依赖性凋亡[15,21,22]。有报道表明刺激K562细胞ROS的产生可促进Caspase-3表达,诱导细胞凋亡[23,24]。因此,贝母素甲在刺激K562/A02细胞产生ROS、引起细胞凋亡的过程中是否激活了Caspase-3相关通路有待于后续研究。
综上所述,贝母素甲可通过抑制细胞活力、诱导细胞凋亡来抑制多药耐药白血病细胞K562/A02的生长。在这一过程中,贝母素甲诱导细胞ROS爆发,引起GSH含量下降。ROS清除剂NAC预处理可消除贝母素甲对K562/A02生长的抑制作用,提示ROS在贝母素甲抑制多药耐药白血病细胞K562/A02生长的过程中起关键作用。
[1] Wang L, Deng Q, Wang J, et al. Effect of CIK on multidrug-resistance reversal and increasing the sensitivity of ADR in K562/ADR cells[J]. Oncol Lett, 2014,8(4):1778-1782.
[2] 王忠华,史姗姗,陈雨,等.浙贝母生物碱提取工艺研究[J].中药材,2010,33(1):128-132.
[3] 谌海燕,陈信义.贝母素甲抑制人乳腺癌细胞MCF-7/TAM增殖及其对细胞凋亡的影响[J].中医药学报,2012,40(4):12-15.
[4] 唐晓勇,唐迎雪.浙贝母碱对肺癌A549/DDP细胞多药耐药的逆转作用观察及机制探讨[J].山东医药,2012,52(18):4-6.
[5] 胡凯文,郑洪霞,齐静,等.浙贝母碱逆转白血病细胞多药耐药的研究[J]. 中华血液学杂志,1999,20(12):33-34.
[6] Cen JA, Qi Y, Tao YF, et al. HZ08, a great regulator to reverse multidrug resistance via cycle arrest and apoptosis sensitization in MCF-7/ADM[J]. Eur J Pharmacol, 2010,647(1-3):21-30.
[7] Kalinina E, Novichkova M, Scherbak NP, et al. GSH-dependent redox regulation and antioxidant enzymes in the formation of resistance to doxorubicin in K562 human erythroleukemia cells[J]. Adv Exp Med Biol, 2001,500:241-244.
[8] Yao JY, Wei X, Lu YH. Chaetominine reduces MRP1-mediated drug resistance via inhibiting PI3K/Akt/Nrf2 signaling pathway in K562/Adr human leukemia cells[J]. Biochem Bioph Res Co, 2016,473(4):867-873.
[9] 石倩倩,丁亚辉,祁瑞哲,等.小白菊内酯诱导耐药白血病细胞K562/ADR凋亡的研究[J]. 中国药理学通报,2012,28(12):1736-1740.
[10] 邹凌琳,周圆,杨铭,等.钙调素拮抗剂O-(4-乙氧基-丁基)-小檗胺对人白血病细胞K562和K562/A02生长的抑制作用[J]. 中国药理学通报,2009,25(10):1313-1317.
[11] Zhou QX, Chen YL, Chen X, et al. In Vitro Antileukemia Activity of ZSTK474 on K562 and Multidrug Resistant K562/A02 Cells[J]. Int J Biol Sci, 2016,12(6):631-638.
[12] Rumjanek VM, Vidal RS, Maia RC. Multidrug resistance in chronic myeloid leukaemia: how much can we learn from MDR-CML cell lines[J]. Biosci Rep, 2013,33(6):875-888.
[13] Mathisen MS, Kantarjian HM, Cortes J, et al. Practical issuessurrounding the explosion of tyrosine kinase inhibitors for the management of chronic myeloid leukemia[J]. Blood Rev, 2014,28(5):179-187.
[14] 董宪喆,毕明刚.活性氧对P-糖蛋白调节作用的研究进展[J].中国药理学通报,2010,26(10):1386-1390.
[15] Wang D, Jiang Y, Wu K, et al. Evaluation of antitumor property of extracts and steroidal alkaloids from the cultivated Bulbus Fritillariae ussuriensis and preliminary investigation of its mechanism of action[J]. BMC complementary and alternative medicine, 2015,15:29.
[16] 李冬云,陈信义,姜靖雯.复方浙贝颗粒研究现状与应用前景分析[J].中国药物与临床,2009,9(2):85-87.
[17] 李伟,胡凯文,苏伟,等.浙贝母散剂逆转急性白血病多药耐药的临床研究[J].北京中医药大学学报,2004,27(1):63-65.
[18] Park YK, Do YR, Jang BC. Apoptosis of K562 leukemia cells by Abnobaviscum F (R), a European mistletoe extract[J]. Oncol Rep, 2012,28(6):2227-2232.
[19] Zhang J, Cao M, Yang WW, et al. Inhibition of Glucose-6-Phosphate Dehydrogenase Could Enhance 1,4-Benzoquinone-Induced Oxidative Damage in K562 Cells[J]. Oxid Med Cell Longev, 2016,21:1-11.
[20] 郑智,侯丽,许亚梅,等.复方浙贝颗粒联合阿霉素影响K562/A02移植瘤细胞耐药相关酶表达研究[J]. 医学研究杂志,2009,38(12):29-31,146.
[21] Wang DD, Feng Y, Li Z, et al. In vitro andin vivo antitumor activity of Bulbus Fritillariae Cirrhosae and preliminaryinvestigation of its mechanism[J]. Nutr Cancer, 2014,66(3):441-452.
[22] Wang DD, Wang S, Feng Y, et al. Antitumor effects of Bulbus Fritillariae cirrhosae on Lewis lung carcinoma cells in vitro and in vivo[J]. Ind Crops Prod, 2014,54:92-101.
[23] Wang XD, Li CY, Jiang MM, et al. Induction of apoptosis in human leukemia cells through an intrinsic pathway by cathachunine, a unique alkaloid isolated from Catharanthus roseus[J]. Phytomedicine, 2016,23(6):641-653.
[24] Luo J, Kong W, Yang M. HJC, A new arylnaphthalene lignan isolated from Justicia procumbens, causes apoptosis and caspase activation in K562 leukemia cells[J]. J Pharmacol Sci, 2014,125(4):355-363.
Effects of peimine on cell viability and apoptosis of multidrug resistant human leukemia cells
QIYan,LIAOBin,XUChengbo,HUANGFUZhenping,CHENJiawei
(People′sHospitalAffiliatedtoFujianUniversityofTraditionalChineseMedicine,Fuzhou350004,China)
Objective To investigate the effects of peimine on cell viability and apoptosis of multidrug resistant human leukemia K562/A02 cells and the function of reactive oxygen species (ROS) in this progress. Methods The K562/A02 cells were divided into three groups. Cells in the drug group were treated with peimine with the final concentrations of 100, 200, and 400 μmol/L, respectively. Cells in the N acetyl cysteine (NAC) pretreatment group were treated with 5 mmol/L antioxidant NAC, followed by 400μmol/L peimine. Cells in the control group were treated with an equal volume of dissolution medium RPMI1640. The cell viability of each group was detected by MTT, the apoptosis was detected by flow cytometry, and the levels of ROS and glutathione (GSH) in the cells were detected by UV spectrophotometry. Results Compared with the control group, the cell viability of the drug group decreased (P<0.05 orP<0.01), intracellular ROS level increased (P<0.01), GSH concentration decreased (P<0.01), and the apoptosis rate increased (P<0.05). However, the cell viability, the apoptosis rate, and the ROS level in NAC pretreatment group showed no obvious change (allP>0.05). Conclusion Peimine inhibits the cell viability and induces apoptosis of multidrug resistant leukemia K562/A02 cells through inducing the ROS outbreak and thus increasing the GSH content.
peimine; chronic myeloid leukemia; K562/A02; multidrug resistance; reactive oxygen species; cell viability; apoptosis
福建省教育厅中青年教师教育科研项目(JA14161)。
齐彦(1977-),女,副主任医师,硕士,主要研究方向为中西医结合治疗血液病。E-mail: 3362313804@qq.com
廖斌(1961-),男,主任医师,硕士,主要研究方向为中西医结合治疗血液病。E-mail: liaobin1961@qq.com
10.3969/j.issn.1002-266X.2017.26.005
R733.7
A
1002-266X(2017)26-0017-04
2017-03-30)
