超声对木瓜蛋白酶酶解产物分子量分布的影响
2017-08-09郑德娟曹雁平北京食品营养与人类健康高精尖创新中心北京工商大学北京00048食品添加剂与配料北京市高校工程研究中心北京00048
张 杰,丁 琳,白 鸽,郑德娟,曹雁平,2,*(.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 00048; 2.食品添加剂与配料北京市高校工程研究中心,北京 00048)
超声对木瓜蛋白酶酶解产物分子量分布的影响
张 杰1,丁 琳1,白 鸽1,郑德娟1,曹雁平1,2,*
(1.北京食品营养与人类健康高精尖创新中心,北京工商大学,北京 100048; 2.食品添加剂与配料北京市高校工程研究中心,北京 100048)
本文探讨了超声对木瓜蛋白酶酶解产物分子量大小及分布的影响。以牛血清白蛋白为底物,采用高效液相色谱法测定游离酶和固定化酶在超声和非超声作用下的酶解产物肽分子量大小及分布情况。结果表明,游离酶和固定化酶在超声和非超声条件下,酶解产物肽分子量大小及分布有一定的差异。非超声条件下,游离木瓜蛋白酶酶解效果明显比固定化酶酶解效果要好。比较超声条件下游离木瓜蛋白酶和固定化木瓜蛋白酶酶解产物分子量大小及分布情况发现:游离木瓜蛋白酶超声条件下酶解肽主要分布在180~1000 Da、1000~5000 Da这两个范围内,而固定化木瓜蛋白酶超声条件下酶解肽在<180 Da所占比例比较大。
游离酶,固定化酶,超声,高效液相色谱法,肽分子量分布
生物活性肽是具有抗氧化、降血压、抗血栓、减脂、呈味、免疫活性等的特定肽类的总称,这些肽有2~20个氨基酸,分子质量小于6000 Da[1]。多数生物活性肽是以非活性状态存在于蛋白质的长链中,当用适当的蛋白酶水解时,其分子片段与活性被释放出来[2]。酶法生产小分子肽已在世界范围内引起关注,成为当今世界相关领域研究的主要方向[3]。小分子肽是经大分子蛋白进一步酶解精制而成的,其生理活性取决于酶解后的肽分子量大小及氨基酸序列,所以测定肽的相对分子量大小显得尤为重要。近年来,高效液相色谱法因其准确性高、重现性好,能准确地表示出肽类的分子量大小及分布而得到广泛应用[4-5]。
自上世纪70年代开始,固定化酶因其稳定性高、可重复利用、易与产物分离、可实现自动化生产而逐渐成为酶工程领域中最为活跃的研究方向之一[6]。但由于包埋法制备固定化酶的载体材料会对分子的扩散传质产生抑制作用,酶活力往往会有不同程度的损失[7]。为提高固定化酶活力,使固定化酶更符合工业化生产,国内外学者进行了大量研究。肖琼等[8]发现超声处理玉米秸秆的纤维素酶时酶解得率比未加超声波时酶解得率提高了48.3%。黄卓烈等[9]利用超声处理酵母过氧化氢酶(CAT)发现酵母多酚氧化酶活性的提高是由超声处理对酶分子构象的进行改变而引起的。Basto等[10]研究了20、150、500 kHz的超声波处理对酶活性的影响,研究证明150 kHz条件下的酶解效果最好。目前关于超声波处理对蛋白酶酶解的影响已经有不少文献报道,但是对超声处理固定化酶来控制酶解产物肽分子量大小的研究还比较少。
本文以游离酶木瓜蛋白酶与包埋法制备出的海藻酸钠-壳聚糖固定化木瓜蛋白酶为研究对象,采用高效液相色谱法对不同超声功率和声强作用下游离酶和固定化酶酶解产物分子量大小及分布进行测定,明确超声条件对酶解产物分子量分布的影响,为生物活性肽的开发提供了一定的实验数据基础。
1 材料与方法
1.1 材料与仪器
海藻酸钠、壳聚糖、无水碳酸钠、磷酸二氢钾、氢氧化钠、三氯乙酸、三羟甲基氨基甲烷、盐酸、无水氯化钙 国药集团化学试剂有限公司;福林酚试剂、牛血清白蛋白、木瓜蛋白酶(测定活力4.96×105U/g) Sigma公司;L-谷胱甘肽 拜尔迪生物技术有限公司;乙醇、乙腈、三氟乙酸 北京迈瑞达科技有限公司;肽标准品:细胞色素C(Mw12355)、抑肽酶(Mw6511.44)、杆菌肽(Mw1422.69)、甘氨酸-甘氨酸-色氨酸-精氨酸(Mw451.2)、甘氨酸-甘氨酸-甘氨酸(Mw189.1) 北京半夏科技发展有限公司。
JXD-02型多频槽式处理系统 北京金星超声波技术设备有限公司;DC-2006型低温恒温水浴 浙江宁波新芝生物科技股份有限公司;UVmini-1240型紫外可见分光光度计 日本岛津公司;CP214电子分析天平 上海市奥豪斯仪器有限公司;FE20型pH计 梅特勒-托利多仪器(上海)有限公司;DF-101S型集热式恒温加热磁力搅拌器 河南省巩义市予华有限责任公司;Waters2695高效液相色谱仪 Waters公司。
1.2 实验方法
1.2.1 固定化木瓜蛋白酶的制备 称取0.57 g海藻酸钠和0.03 g壳聚糖溶于20 mL pH7.0的Tris-盐酸缓冲液中,于60 ℃磁力搅拌加热至溶解并搅拌均匀,冷却至室温,加入1 mL 0.005 g/mL木瓜蛋白酶液,搅拌均匀。将此混合液缓慢滴入0.6 mol/L氯化钙溶液中形成小球,置于4 ℃冰箱下30 min。用去离子水清洗,滤纸擦干,备用[11]。
1.2.2 肽分子量大小及分布的测定
1.2.2.1 测定条件 色谱柱为TSKgelG2000 SWXL(300 mm×7.8 mm)凝胶柱;流动相为乙腈∶水∶三氟乙酸=45∶55∶0.1(体积比);紫外检测器的波长设为220 nm;泵流速设为0.5 mL/min;柱温设为30 ℃;进样体积为10 μL。
1.2.2.2 分子量校正曲线 分别用流动相制成质量分数为1 mol/mL的上述不同分子量肽标准品溶液,用孔径0.45 μm聚四氟乙烯膜过滤后进样,得到一系列标准品的色谱图。以各标准品相对分子量的对数(lgMw)对保留时间作图,得到标准曲线和线性回归方程。
1.2.2.3 样品分子量的确定 不同超声条件下酶解样品处理后进入HPLC检测,把色谱图中各个峰的保留时间代入1.2.2.2所得线性回归方程中,计算酶解产物肽分子量的大小,根据色谱峰各个峰峰面积计算不同肽分子量所占的比例。
1.2.3 木瓜蛋白酶的酶解条件 准确量取20 μL游离木瓜蛋白酶或者称取1 g固定化木瓜蛋白酶,以保证游离酶和固定化酶酶活力均维持在6 U/g,加入3 mL谷胱甘肽和10 mL牛血清白蛋白,在酶解pH7、酶解温度为40 ℃的条件下反应30 min,于90 ℃高温加热灭酶10 min。静置分层,取上清液在10000 r/min、4 ℃的条件下离心20 min,取上清液,用孔径0.45 μm聚四氟乙烯膜过滤,备用。
1.2.4 游离木瓜蛋白酶酶解牛血清白蛋白
1.2.4.1 非超声条件下游离木瓜蛋白酶酶解牛血清白蛋白 准确量取20 μL游离木瓜蛋白酶,按上述1.2.3酶解条件酶解牛血清白蛋白,用1.2.2测定。
1.2.4.2 超声条件下游离木瓜蛋白酶酶解牛血清白蛋白 准确量取20 μL游离木瓜蛋白酶,在超声频率分别为28、40、50、135 kHz,超声声强分别为0.05、0.15、0.25、0.35、0.45 W/cm2,超声温度为40 ℃的条件下,按上述1.2.3酶解条件酶解牛血清白蛋白,用1.2.2测定。
1.2.5 固定化木瓜蛋白酶酶解牛血清白蛋白
1.2.5.1 非超声条件下固定化木瓜蛋白酶酶解牛血清白蛋白 称取1 g固定化木瓜蛋白酶,按上述1.2.3酶解条件酶解牛血清白蛋白,用1.2.2测定。
1.2.5.2 超声条件下固定化木瓜蛋白酶酶解牛血清白蛋白 称取1 g固定化木瓜蛋白酶,在超声频率分别为28、40、50、135 kHz,超声声强分别为0.05、0.15、0.25、0.35、0.45 W/cm2,超声温度为40 ℃的条件下,按上述1.2.3酶解条件酶解牛血清白蛋白,用1.2.2测定。
1.3 数据处理
实验中每个处理重复三次,实验各值均为三个平行数据的均值。数据统计结果与分析应用Microsoft Excel 2007和Origin 9.0软件。
2 结果与讨论
2.1 标准曲线
高效液相色谱法所用色谱柱为TSK凝胶柱,其原理是按分子量大小对物质进行洗脱分离。样品在洗脱过程中大分子无法进入凝胶颗粒的孔径中,只能从流动相中以较快的速度流出层析柱,而小分子则能自由出入凝胶颗粒中,因此就要花费较长的时间流经柱床,从而使不同大小的分子得以分离[12]。
表1是各标准品的出峰时间,以各标准品相对分子量的对数(lgMW)对保留时间作图,得到分子校正曲线方程为y=-0.251x+7.053,R2=0.971。

表1 各标准品的出峰时间Table 1 Peak time of each standard

图1 各标准品的相对分子量的对数与保留时间的关系曲线Fig.1 Curve of logarithm of relative molecular weight and retention time of each standard
2.2 游离木瓜蛋白酶酶解产物分子量分布
2.2.1 28 kHz下不同超声声强对游离木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果如图2所示。
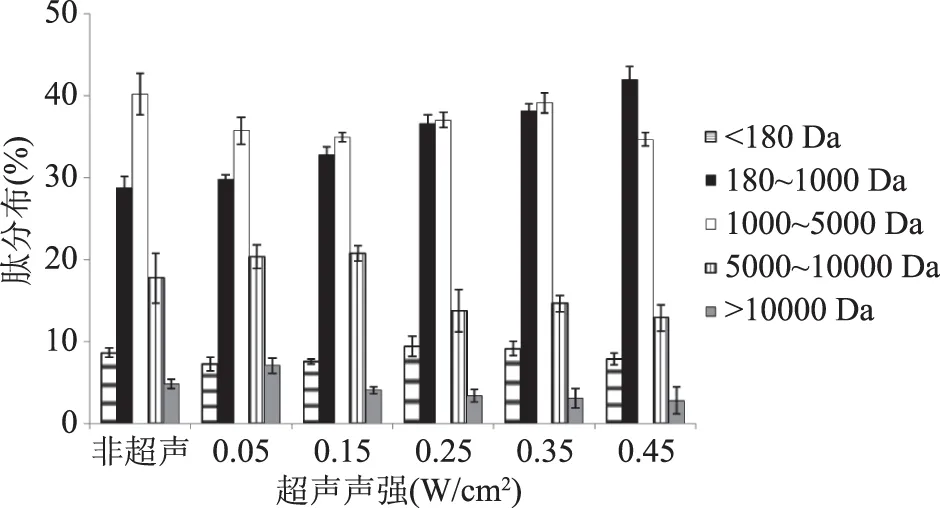
图2 28 kHz频率下游离木瓜蛋白酶酶解产物分子量分布Fig.2 Molecular weight distribution of papain hydrolyzate under 28 kHz frequency
由图2可知,游离木瓜蛋白酶在非超声、超声频率28 kHz时,肽分子量在<180 Da和>10000 Da范围内所占比例比较小,多集中在180~10000 Da之内。随着超声声强的增大,肽分子量在180~1000 Da范围内所占比例有所增加,变化比较明显。可能是由于木瓜蛋白酶作用位点广泛,并具有低强度的酶切特异性,所以各个肽分子量分布范围均比较多。
2.2.2 40 kHz下不同超声声强对游离木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果如图3所示。

图3 40 kHz频率下游离木瓜蛋白酶酶解产物分子量分布Fig.3 Molecular weight distribution of papain hydrolyzate under 40 kHz frequency
由图3可知,游离木瓜蛋白酶在非超声、超声频率40 kHz时酶解产物肽分子量分布差异不大,多集中于180~10000 Da之间。其中,随着超声声强的增加肽分子量在180~1000 Da范围内有所增加,1000~5000 Da范围变化比较小,5000~10000 Da范围内先增加后有所减少。张艳艳[13]发现超声波破坏了谷朊蛋白的网络结构,适当的超声波预处理使得蛋白分子分布更加均匀,而过大的超声波预处理功率又使得蛋白分子重新聚集折叠,不利于蛋白分子酶解,这与本研究的结论一致。
2.2.3 50 kHz下不同超声声强对游离木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果如图4所示。
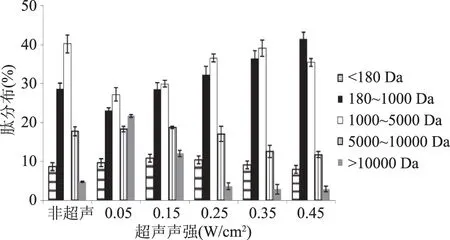
图4 50 kHz频率下游离木瓜蛋白酶酶解产物分子量分布Fig.4 Molecular weight distribution of papain hydrolyzate under 50 kHz frequency
由图4可知,游离木瓜蛋白酶在超声频率50 kHz时,随着超声声强的增加,酶酶解产物肽分子量分布有明显变化。在0.05 W/cm2时肽分子量分布比较集中,随着超声声强增加,分子量在180~5000 Da的肽显著增加,而>10000 Da的肽显著减少(p<0.05)。Giizey等[14]研究发现用高强度超声处理牛血清蛋白会引起蛋白α螺旋结构的含量增加,与本研究的趋势一样。
2.2.4 135 kHz下不同超声声强对游离木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果如图5所示。

图5 135 kHz频率下游离木瓜蛋白酶酶解产物分子量分布Fig.5 Molecular weight distribution of papain hydrolyzate under 135 kHz frequency
由图5发现,游离木瓜蛋白酶在135 kHz频率下酶解产物肽分子量主要集中在180~10000 Da范围内。随着超声声强增加,分子量在180~5000 Da的肽显著增加,分子量在5000~10000 Da的肽所占比例有所减少,在0.45 W/cm2时变化最为明显。
朱国辉等[15]发现经超声不同功率处理菠萝果蛋白酶的酶活较非超声均有所增加,且最适功率为100 W,超声功率再增加,酶活反而会有所降低,这与本研究的趋势一致。
超声对游离酶酶促反应的影响主要集中于对酶和底物结构的改变。Ma等[16]研究了高强度超声场对碱性蛋白酶的作用机理发现超声场对碱性蛋白酶的酶活力和分子结构均有影响。任晓峰[17]利用原子力显微镜观察发现,超声波使得玉米醇溶蛋白结构被破坏,导致蛋白颗粒疏松,蛋白酶更容易进入玉米醇溶蛋白颗粒内部,有利于疏水性氨基酸的释放。
2.3 固定化木瓜蛋白酶酶解产物分子量分布
2.3.1 28 kHz下不同超声声强对固定化木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果如图6所示。

图6 28 kHz频率下固定化木瓜蛋白酶酶解产物分子量分布Fig.6 Molecular weight distribution of immobilized papain hydrolyzate under 28 kHz frequency
由图6可知,固定化木瓜蛋白酶非超声条件下酶解效果比较差,分子量分布范围在>10000 Da最多,高达93.81%,其他分子量范围所占总比例不足10%,与游离酶酶解产物分子量分布相比有明显差异。可能是由于酶固定化过程中载体与酶之间的相互作用,酶活力往往会有不同程度的损失,所以固定化酶酶解效果往往不好。在超声频率为28 kHz,随着超声声强的增加,肽分子量分布变化比较明显,其中<180 Da肽分子量呈现先增加后降低的趋势,在0.35 W/cm2时所占比例最大。
2.3.2 40 kHz下不同超声声强对固定化木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果分别如图7所示。

图7 40 kHz频率下固定化木瓜蛋白酶酶解产物分子量分布Fig.7 Molecular weight distribution of immobilized papain hyrolyzate under 40 kHz frequency
由图7可知,固定化木瓜蛋白酶在超声频率为40 kHz时,随着超声声强的增大,肽段分子量<180 Da所占比例变化明显,呈现先增加后降低的趋势,在0.25 W/cm2达到最大值。由此认为一定的超声条件下可以提高固定化木瓜蛋白酶的酶解活性,故超声对提高固定化酶酶解效果有一定影响。Govind等[18]发现超声可以促进固定化酶的酶活,并且随着超声功率的增加,酶活力呈现先增大后减小的趋势,并在100 W时超声作用最明显,这与本研究的趋势一致。
2.3.3 50 kHz下不同超声声强对固定化木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果分别如图8所示。

图8 50 kHz频率下固定化木瓜蛋白酶酶解产物分子量分布Fig.8 Molecular weight distribution of immobilized papain hydrolyzate under 50 kHz frequency
由图8可知,固定化木瓜蛋白酶在超声频率为50 kHz时,随着超声声强的增大,肽段分子量<180 Da所占比例变化明显,呈现先增加后降低的趋势,在0.25 W/cm2达到最大值。说明固定化酶在小功率超声作用条件下酶解效果不明显。随着超声声强增加小分子多肽所占比例显著增加。朱少娟等[19]的研究结果表明,将胰蛋白酶、底物分别进行超声处理,经紫外和荧光光谱分析发现一定的超声波可能使酶及底物分子构象发生变化,提高胰蛋白酶水解活性。由此证明超声对提高固定化酶酶解效果有显著影响。
2.3.4 135 kHz下不同超声声强对固定化木瓜蛋白酶酶解产物分子量的影响 酶解产物分子量大小及分布结果分别如图9所示。

图9 135 kHz频率下固定化木瓜蛋白酶酶解产物分子量分布Fig.9 Molecular weight distribution of immobilized papain hydrolyzate under 135 kHz frequency
由图9可知,固定化木瓜蛋白酶在超声频率为135 kHz时,随着超声声强的增大,肽段分子量<180 Da所占比例变化明显。在超声功率为0.25 W/cm2时,分子量大于10000 Da所占的比例最大,高达60.98%。超声对固定化酶酶促反应的影响与载体结构、酶结构、底物结构的改变有关。Lin Chen等[20]研究发现,酶解前适当的预处理能够使蛋白质原本致密的结构变的松散,暴露其内部的作用位点,使水解速度加快,提高蛋白质的水解度,利于酶解。黄正华等[21]报道,超声促进了木瓜蛋白酶作用底物酪蛋白在海藻酸钠及壳聚糖凝胶中的扩散作用。朱少娟等[19]研究发现一定的超声波可能使酶及底物分子构象发生变化,提高胰蛋白酶水解活性。
3 结论
本文采用高效液相色谱法研究了超声对木瓜蛋白酶酶解产物分子量大小及分布的影响,结果表明,游离酶和固定化酶在非超声及超声条件下,酶解产物肽分子量大小及分布有一定的差异。非超声条件下,游离木瓜蛋白酶酶解效果明显比固定化酶酶解效果要好。比较超声条件下游离木瓜蛋白酶和固定化木瓜蛋白酶酶解产物分子量大小及分布情况发现:游离木瓜蛋白酶超声条件下酶解肽主要分布在180~1000、1000~5000 Da这两个范围内,而固定化木瓜蛋白酶超声条件下酶解肽在<180 Da所占比例比较大。
酶法制备生物活性肽生产成本低,产品安全性高,生产条件温和,水解进程易于控制,可定位生产特定的肽,能较好地满足生产需要,具有良好的应用前景。本文只是针对超声处理辅助酶解控制产物分子量方面进行了一定程度的研究,但是还需要对蛋白质预处理技术和可控酶解技术方面进行深入探讨。
[1]Moral,Reigm,Toldrf. Bioactive peptides generated from meat industry by-products[J]. Food Research International,2014(65):344-349.
[2]苏秀兰.生物活性肽的研究进展[J].内蒙古医学院学报,2006,28(5):471.
[3]崔凤霞.海参胶原蛋白生化性质及胶原肽活性研究[D].
青岛:中国海洋大学,2007.
[4]陈星,李晓磊,吴琼. 不同蛋白酶酶解产物活性大豆肽分子量分布状态的研究[J]. 西南大学学报(自然科学版),2010(7):1-7.
[5]陈季旺,姚惠源,陈尚卫.米糠可溶性蛋白酶解物的分子量分布的研究[J].中国油脂,2004(1):36-39.
[6]尹志娜.固定化酶及其在食品和生物领域的研究进展[J].生命科学仪器,2009,7(10):11-15.
[7]Roberto F,Vero’nica R,Cesar M,et al. Stabilization of multiservice enzymes via immobilization and post-immobilization techniques[J]. Journal of Molecular Catalysis,1999(9):181-189.
[8]肖琼,姚春才,勇强,等.玉米秸秆超声辅助酶水解[J].南京林业大学学报,2007,31(4):85-88.
[9]黄卓烈,林茹,何平,等. 超声波对酵母过氧化氢酶及多酚氧化酶活性的影响[J].中国生物工程杂志,2003,23(4):89-93.
[10]Basto C,Silva C J,Gübitz G,et al. Stability and decolourization ability of Trametesvillosa laccase in liquid ultrasonic fields[J].Ultrasonics Sonochemistry,2007,14(3):355-362.
[11]黄正华,曹雁平,许朵霞,等. 成胶条件对壳聚糖-海藻酸凝胶硬度的影响[J]. 中国食品学报,2015(2):163-167.
[12]张宜涛,于伟,江国永,等. 高效凝胶过滤色谱法测定肽的相对分子量分布[J]. 饲料畜牧,2012(8):42-44.
[13]张艳艳. 基于超声预处理的谷朊蛋白ACE抑制肽制备及其过程原位监测技术研究[D].镇江:江苏大学,2016.
[14]Gtizey D,Giilseren I,Bruce B,et al. Interfacial properties and structural conformation of thermosonicated bovine serum albumin[J]. Food Hydrocolloid,2006(20):669-677.
[15]朱国辉,黄卓烈,徐凤彩,等. 超声波对菠萝果蛋白酶活性和光谱的影响[J]. 应用声学,2003(6):10-14,38.
[16]Haile Ma,Liurong Huang,Junqiang Jia,et al. Effect of energy-gathered ultrasound on Alcalase[J]. Ultrasonics Sonochemistry,2011,10(1):419-424.
[17]任晓峰. 扫频超声预处理对玉米醇溶蛋白特性及其酶法制备ACE抑制肽的影响[D].镇江:江苏大学,2014.
[18]Govind V,Mangesh D,Virendra K. Ultrasound assisted enzyme catalyzed synthesis of glycerol carbonate from glycerol and diethyl carbonate[J].Ultrasonics Sonochemistry,2015(22):311-316.
[19]朱少娟,施用晖,乐国伟.超声波对胰蛋白酶水解酪蛋白的影响[J].食品与生物技术学报,2005,24(2):50-54.
[20]Lin Chen,Jianshe Chen,Jiaoyan Ren. Modications of soy protein isolates using combined extrusion pre-treatment and controlled enzymatic hydrolysis for improved emulsifying properties[J]. Food Hydrocolloids,2011(25):887-897.
[21]Z.H Huang,Y P Cao,D X Xu,et al. Effect of ultrasound on the diffusion properties of casein entrapped in alginate-chitosan gel[J]. Ultrasonics Sonochemistry,2015(26):149-156.
Effect of ultrasonic on molecular weight distribution of papain hydrolyzate
ZHANG Jie1,DING Lin1,BAI Ge1,ZHENG De-juan1,CAO Yan-ping1,2,*
(1.Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Technology & Business University(BTBU),Beijing 100048,China; 2.Beijing Engineering Research Center for Food Additives and Ingredients,Beijing 100048,China)
The influence of ultrasonic on the molecular weight and distribution of papain hydrolyzate was discussed in this paper. The enzymolysis products of free and immobilized enzymes were determined by high performance liquid chromatography(HPLC)with bovine serum albumin as substrate. The results showed that there were significant differences in the molecular weight and distribution of the hydrolyzate peptide between free and immobilized enzymes under ultrasound and non-ultrasound conditions. The molecular weight and distribution of free papain and immobilized papain hydrolyzate under ultrasonic conditions were found to be mainly distributed in the range of 180~1000 Da and 1000~5000 Da. The proportion of hydrolyzed peptides in immobilized papain under the condition of<180 Da was relatively large.
free enzyme;immobilized enzyme;ultrasonic;high performance liquid chromatography;peptide molecular weight distribution
2015-01-05
张杰(1990-),女,硕士研究生,研究方向:固定化酶,E-mail:zjzxw722@163.com。
*通讯作者:曹雁平(1961-),男,博士,教授,研究方向:食品化学与安全,E-mail:caoyp@th.btbu.edu.cn。
国家自然科学基金项目(31371722)。
TS201.3
A
1002-0306(2017)14-0116-05
10.13386/j.issn1002-0306.2017.14.023
