超声辅助提取黑果枸杞花色苷的工艺优化
2017-08-09李建颖王青霞李孟璇天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室天津300134
郑 覃,李建颖,杨 璐,王青霞,王 佳,李孟璇(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
超声辅助提取黑果枸杞花色苷的工艺优化
郑 覃,李建颖*,杨 璐,王青霞,王 佳,李孟璇
(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津 300134)
利用响应面分析法对黑果枸杞花色苷的超声辅助提取工艺进行优化。以总花色苷含量为指标,选取液料比、超声提取温度、超声提取时间和乙醇浓度为主要因素进行单因素实验,并通过响应面分析法进行四因素三水平的Box-Behnken实验,对提取条件进行优化。结果表明:液料比20.4∶1 mL/g,超声提取温度48 ℃,超声提取时间24.8 min,乙醇浓度79%为最佳提取条件,该条件下花色苷提取量可达(14.999±0.014)mg/g。各因素对花色苷提取量的影响程度依次为:超声提取温度>乙醇浓度>超声提取时间>液料比。
黑果枸杞,响应面分析,提取,花色苷,工艺优化
黑果枸杞为茄科枸杞属的植物,其果微甜,性平,清热,拥有很好的药用和食用价值。黑枸杞中富含丰富的花色苷类成分[1],是一种天然的抗氧化剂[2],抗氧化活性远强于维生素C、维生素E等[3-4],其结构上含有的众多酚羟基能够阻断自由基链式反应,从而有效清除活性氧簇(ROS)[5-6]。
花色苷的提取受多种因素的影响,主要因素有原料比表面积、提取溶剂的种类、浓度、液料比、pH、提取温度、时间以及提取次数等[7]。目前,花色苷的提取方法有水提取、有机溶剂提取、超临界流体萃取、超声波提取和酶解辅助提取等方法[8],普遍存在提取率低、有机溶剂易污染环境等缺点。根据提取花色苷目的的不同,可选取不同的溶剂进行提取实验。例如,若是为了对提取的花色苷进行定性定量分析,常选取三氟乙酸甲醇溶液,因为采用此种溶液提取不会破坏花色苷类物质的结构,且不易将大分子的蛋白质、糖类带入;若是为了将提取的花色苷用于食品添加,则常采用酸性乙醇溶液,因为此法可保持最大色素得率,保持色素稳定性及提取物安全[9]。研究表明,花色苷类物质本身结构不稳定,光照、温度、pH等理化性质都会影响其结构的稳定性;提取时应避免光照,温度不宜太高,提取时间也不宜过长,避免花色苷类成分发生降解[10-13]。同时,溶剂提取法虽然操作相对简单,对设备要求较低,但是也存在提取效率低,杂质含量高,提取时间较长与热不稳定等缺点,故实际操作时,常采用超声、震荡或微波等辅助提取[14-16]。本实验将超声波提取法与有机溶剂提取法相结合,研究不同因素条件下对黑果枸杞花色苷提取的影响,通过响应面优化实验确定最佳工艺条件,为黑果枸杞花色苷的综合开发与利用提供理论及技术支持。
1 材料与方法
1.1 材料与仪器
黑果枸杞干果 甘肃省民勤县购买;乙醇 分析纯,天津市凯通化学试剂有限公司;盐酸 分析纯,天津市风船化学试剂科技有限公司;冰乙醇 分析纯,天津大学科威公司;醋酸钠 分析纯,天津市德恩化学试剂有限公司;氯化钾 分析纯,天津光复科技发展有限公司;锦葵色素-3-葡萄糖苷标准品 上海华蓝化学科技有限公司。
DK-8AS电热恒温水浴锅 上海精密科学仪器有限公司;AUY220电子分析天平 日本岛津公司;RV10DIGITAL旋转蒸发仪 德国IKA;UV-2600紫外可见分光光度计 日本岛津公司;XO-SM50超声波微波协同反应系统 南京先欧仪器制造有限公司;DH-101电热鼓风干燥箱 上海精密科学仪器有限公司;LWF6-BI低温粉碎机 福建莆田电宏强有限公司;SHB-Ⅲ循环水式多用真空泵 郑州长城科技工贸有限有限公司;Bante210 pH计 上海般特仪器有限公司;SW-CJ-1FB超净工作台 苏州净化设备有限公司。
1.2 实验方法
1.2.1 样品预处理 将黑果枸杞置于35 ℃恒温条件下,烘干至恒重,粉碎,过60目筛,即得黑果枸杞干粉[17]。
1.2.2 总花色苷提取工艺 准确称取2.000 g黑果枸杞干粉,置于100 mL圆底烧瓶中;加入1%盐酸酸化乙醇(体积比1∶99),避光恒温超声辅助提取(超声频率40 kHz);4000 r/min离心5 min收集上清液;酸性乙醇定容至100 mL,即得提取液。
1.2.3 总花色苷含量测定 采用pH试差法测定总花色苷的含量[18-20],以锦葵色素-3-葡萄糖苷为计量标准,测定总花色苷的含量[21]。
将得到的提取液分别用pH1.0(0.2 mol/L KCl∶0.2 mol/L HCl=25∶67,v/v)和pH4.5(0.2 mol/L NaAc·3H2O:0.2 mol/L HAc=1∶1,v/v)缓冲液稀释10倍,混合均匀后,放入恒温水浴锅中平衡30 min,作为实验组。采用1%酸性乙醇代替提取液,同样条件下处理,平衡30 min,作为空白组。待平衡结束后,分别测其在530 nm和700 nm下的吸光度。按下式计算总花色苷含量[22-23]:
花色苷含量(mg/g)=[(A530-A700)pH1.0-(A530-A700)pH4.5×Mw×DF×V]/ε×L×m
式中:Mw-锦葵色素-3-葡萄糖苷的相对分子质量,493200 mg/mol;DF-稀释因子;V-提取液的体积,0.1 L;ε-摩尔消光系数,29600 L/(mol·cm);L-光程厘米数,1 cm;m-原料的质量,2.000 g。
1.2.4 单因素实验
1.2.4.1 超声提取温度对花色苷提取效果的影响 采用超声波辅助的方法,以酸化的80%乙醇为提取溶剂,分别在30、40、50、60、70 ℃的水浴中提取黑果枸杞花色苷,液料比为20∶1 mL/g,提取25 min。
1.2.4.2 超声提取时间对花色苷提取效果的影响 采用超声波辅助的方法,以酸化的80%乙醇为提取溶剂,提取温度50 ℃,提取液料比为20∶1 mL/g,设定不同的提取时间(15、20、25、30、35 min)提取黑果枸杞花色苷。
1.2.4.3 乙醇浓度对花色苷提取效果的影响 采用超声波辅助的方法,设定不同浓度(50%、60%、70%、80%、90%)的酸化乙醇为提取溶剂,提取温度50 ℃,提取液料比为20∶1 mL/g,提取黑果枸杞花色苷,提取25 min。
1.2.4.4 液料比对花色苷提取效果的影响 采用超声波辅助的方法,以酸化的80%乙醇为提取溶剂,提取温度50 ℃,设定不同液料比(10∶1、20∶1、30∶1、40∶1、50∶1 mL/g)提取黑果枸杞花色苷,提取25 min。
1.2.5 响应面优化实验 根据响应面实验设计原理,综合单因素实验的结果,选择超声提取时间、超声提取温度、乙醇浓度和液料比四个因素,以黑果枸杞中花色苷含量为响应值,设计响应面实验[24-26]。因素水平见表1。
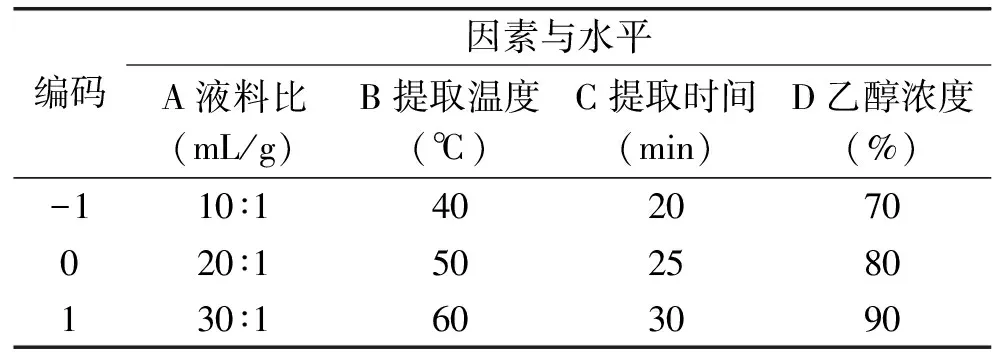
表1 实验因素水平Table 1 Experimental factors and levels
1.2.6 数据处理 本文在单因素实验分析的基础上,采用Box-Benhnken设计方案,借助Design-Expert 8.0软件并结合方差分析法,得出最优的黑果枸杞花色苷的提取条件。
2 结果与分析
2.1 超声提取温度对花色苷提取效果的影响
超声提取温度对花色苷提取效果的影响如图1所示。由图1可见,随着温度的升高,花色苷的含量也在逐渐上升。由分子运动论可知,温度升高会使分子运动加快,溶解和扩散的速度也随之加快,温度较高可能会使细胞膜结构发生变化,更易使花色苷被释放到溶剂中,从而使其花色苷的含量逐渐上升[27]。但温度到达50 ℃以后,花色苷的提取效果明显下降,是由于温度过高使部分花色苷的结构遭到破坏,最终使得提取效果降低,所以50 ℃为最佳超声提取温度。

图1 超声提取温度对花色苷提取效果的影响Fig.1 Effect of extraction temperature on the anthocyanins extraction
2.2 超声提取时间对花色苷提取效果的影响
超声提取时间对黑果枸杞花色苷提取的影响如图2所示。由图2可见,随着超声提取时间的延长,花色苷的含量逐渐增加。但当时间超过25 min后,花色苷的含量呈明显下降的趋势,一方面是由于超声时间过长,氧化或光照反应会导致花色苷发生分解,使其含量降低;另一方面是由于超声提取时间过长导致其他非花色苷成分大量溶出,从而使得提取率降低。所以最佳超声提取时间为25 min。

图2 超声提取时间对花色苷提取效果的影响Fig.2 Effect of extraction time on the anthocyanins extraction
2.3 乙醇浓度对花色苷提取效果的影响
乙醇浓度对黑果枸杞花色苷提取的影响如图3所示。由图3可知,随着乙醇浓度的不断增高,黑果枸杞提取物中的花色苷的含量逐渐上升,说明在一定范围内,随着乙醇浓度的增加,溶剂的渗透力也随之增加,从而有利于花色苷的溶出,但当乙醇浓度过高时,溶液的极性降低不利于弱极性的花色苷的溶出。所以80%的乙醇为最佳提取溶剂。

图3 乙醇浓度对花色苷提取效果的影响Fig.3 Effect of ethanol concentration on the anthocyanins extraction
2.4 液料比对花色苷提取效果的影响
液料比对黑果枸杞提取效果的影响如图4所示。由图4可以看出,随着液料比的逐渐增加,花色苷的质量分数先上升后下降,原因是溶剂在一定范围内能充分提取花色苷,若进一步增加液料比,花色苷不再溶出,而其他成分溶出,会使花色苷的浓度降低,且成本会增大,所以最佳液料比为20∶1 mL/g。

图4 液料比对花色苷提取效果的影响Fig.4 Effect of liquid-solid ratio on the anthocyanins extraction
2.5 响应面优化花色苷提取条件
2.5.1 响应面实验结果 综合单因素实验结果,根据Box-Benhnken的中心组合实验设计原理,以花色苷含量Y为响应值,利用Design-Expert软件设计四因素三水平的响应面实验,实验结果如表2所示。

表2 响应面实验结果Table 2 Result of response surface test

表3 回归模型的方差分析Table 3 Variance analysis of regression model
注:**表示在0.01水平显著;* 表示在0.05水平显著。
2.5.2 方差分析 使用Design-Expert 8.0软件对29个实验点的响应值进行方差分析,由于交互项C×D极不显著,因此采用手动优化的方法对得到的回归模型进一步优化,分析结果见表3。
经回归拟合后,得到黑果枸杞花色苷提取率对各实验因子的二次多项回归方程为:
Y=14.99+0.021A-0.15B-0.025C-0.075D+0.022AB+0.028AC-0.035AD+0.067BC-0.12BD-0.24A2-0.32B2-0.39C2-0.28D2
该方程中各项系数绝对值的大小直接反映各因素对响应值的影响程度,系数的正、负反映了影响的方向。由于该方程的二次项系数均为负值,可以推断方程代表的抛物面开口向下,因而具有极大值点,可以进行优化分析。由方程的一次项系数可以得出,影响黑果枸杞花色苷提取率因素的主次顺序为:B(提取温度)>D(乙醇浓度)>C(提取时间)>A(液料比)。
由表3可知,整个回归模型极显著(p<0.0001),说明模型是有意义的;校正R2=0.9488说明该模型能解释94.88%响应值的变化;失拟项不显著(p>0.05),表明模型与实际情况拟合较好,使用该方程代替真实的实验点进行分析是可行的。一次项B、D显著,A、C不显著,BC、BD交互项影响显著,其他交互项影响不显著,二次项A2、B2、C2、D2影响极显著。
2.5.3 交互作用分析 为进一步研究因素间的交互作用,通过Design-Expert绘制响应曲面图进行直观分析,结果见图5、图6。

图5 温度与乙醇浓度对花色苷含量的交互作用Fig.5 Effect of interaction between temperatureand ethanol concentrationon the anthocyanin content
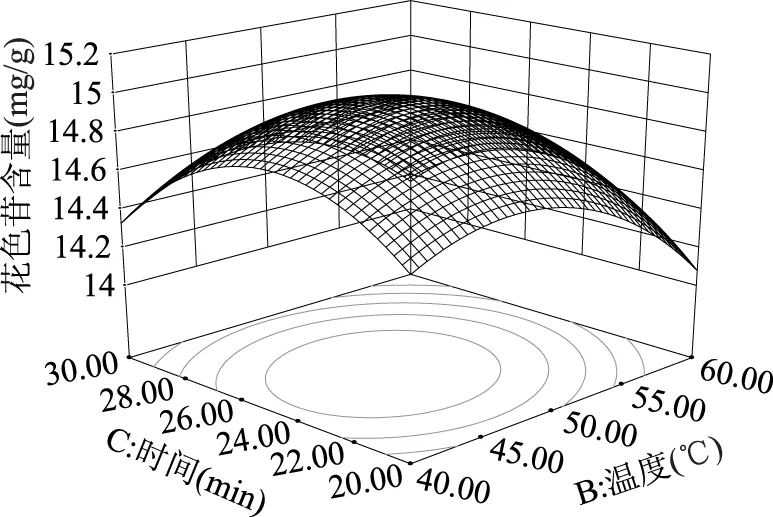
图6 温度与时间对花色苷含量的交互作用Fig.6 Effect of interaction between temperature and time on the anthocyanin content
由图5可知:在一定范围内,花色苷含量随提取温度及提取剂的浓度的增大都是先增加后降低,这一点与单因素实验时整体趋势相符;通过方差分析可知,提取温度与乙醇浓度交互项对提取的花色苷含量影响显著(p<0.05)。由图6可知:在一定范围内,随着提取温度的增大,提取的花色苷的含量平缓增加,到达一定值后,随着提取温度的增大而迅速降低;随着提取时间的增加,提取的花色苷的含量先增加后降低,整体趋势与单因素实验时基本相符;由方差分析结果可知,提取温度与提取时间交互项对提取的花色苷含量影响显著(p<0.05)。
2.5.4 最佳提取工艺的预测及验证 对优化后的回归方程求解,在实验范围内提取花色苷的最佳工艺条件为:液料比20.37∶1 mL/g,提取温度47.77 ℃,提取时间24.75 min,乙醇浓度79.08%,此条件下提取的花色苷含量理论上可达15.01 mg/g。考虑到实际实验条件,将其校正为液料比20.4∶1 mL/g,提取温度48 ℃,提取时间24.8 min,乙醇浓度79%,在此条件下进行三组平行实验,提取得到的花色苷的含量为(14.999±0.014)mg/g,结果与预测值基本相符,证明了该模型的有效性。
3 结论与讨论
超声辅助提取黑果枸杞花色苷的过程中,各因素对花色苷提取效果的影响大小依次为提取温度>乙醇浓度>提取时间>液料比。采用响应面法优化提取工艺,经验证实验,最终确定最佳工艺条件为20.4∶1 mL/g,提取温度48 ℃,提取时间24.8 min,乙醇浓度79%,此条件下提取得到的黑果枸杞花色苷含量为(14.999±0.014)mg/g。与潘自皓[5]等采用静置法,提取溶剂1%甲酸,提取温度75 ℃,料液比30∶1 mL/g,每次提取时间1 h和提取次数3次,提取得到黑果枸杞花色苷含量为(4.51±0.06)mg/g相比,采用超声辅助酸性乙醇作提取剂提取黑果枸杞花色苷,极大程度上节约了时间,且提取率明显提高。
[1]李进,赵红艳,原惠,等. 黑果枸杞色素性质研究[J]. 食品科学,2006,27(10):146-151.
[2]何如喜. 超声波辅助提取野生黑果枸杞花青素工艺研究[J]. 青海师范大学学报:自然科学版,2015,31(1):49-55.
[3]Araceli C,Madelourdes P H,Maelena P,et al. Chemical studies of anthocyanins:A review[J]. Food Chemistry,2009,113(4):859-871.
[4]Lee J H,Lee H J,Choung M G. Anthocyanin compositions and biological activities from the red petals of Korean edible rose(Rosahybridacv. Noblered)[J].Food Chemistry,2011,129(2):272-278.
[5]潘自皓,顾子杨,周帅,等. 黑枸杞花色苷提取工艺的优化[J]. 食品工业科技,2016,37(16).
[6]Rice-Evans C A,Miller N J. Antioxidant activities of flavonoids as bioactive components of food[J]. Biochemical Society Transactions,1996,24(3):790-795.
[7]Cissé M,Bohuon P,Sambe F,et al. Aqueous extraction of anthocyanins from Hibiscus sabdariffa:Experimental kinetics and modeling[J]. Journal of Food Engineering,2012,109(1):16-21.
[8]马养民,逯文静. 蓝莓果中花青素的乙醇提取工艺研究[J]. 安徽农业科学,2011,39(35):21768-21769.
[9]米佳,闫亚美,曹有龙,等. 花色苷类物质的提取、分离、鉴定[J]. 宁夏农林科技,2016,57(1):40-47.
[10]赵立仪,李路宁,申芮萌,等. 酰基化蓝莓花青素的稳定性研究[J]. 食品工业科技,2014,35(22):299-303.
[11]Maran J P,Sivakumar V,Thirugnanasambandham K,et al. Extraction of natural anthocyanin and colors from pulp of jamun fruit[J]. Journal of Food Science and Technology,2014,52(6):1-10.
[12]Chandrasekhar J,Madhusudhan M C,Raghavarao K. Extraction of anthocyanins from red cabbage and purification using adsorption[J]. Food and Bioproducts Processing,2012,90(4):615-623.
[13]Anuar N,Mohd Adnan A F,Saat N,et al. Optimization of extraction parameters by using response surface methodology,purification,and identification of anthocyanin pigments in Melastomamalabathricum fruit[J].The Scientific World Journal,2013:1-10.
[14]张元德,白红进,殷生虎,等. 黑果枸杞花色苷色素微波辅助提取的优化[J]. 新疆农业科学,2010,47(7):1293-1298.
[15]时玉晴,苏东民,苏东海,等. 超声波辅助法提取黑色小麦麸皮花色苷工艺优化[J]. 粮食与油脂,2015(4):15-18.
[16]陈亮,张炜,陈元涛,等. 响应曲面法优化黑果枸杞多糖的超声提取工艺[J]. 食品科技,2015(1):220-227.
[17]孙婧超,刘玉田,赵玉平,等. pH示差法测定蓝莓酒中花色苷条件的优化[J]. 中国酿造,2011(11):171-174.
[18]王少波,杜永峰,姚秉华. pH示差法测定黑豆皮中的花青素[J]. 化学分析计量,2008,17(1):46-47.
[19]张玲艳,王宏权. 黑枸杞花青素的提取及其抗氧化活性研究[J]. 食品工业,2014(12):88-91.
[20]张文君,宋春晓,张国锋,等. 山楸梅浆果中花青素提取方法的优化和测定[J]. 中成药,2016,38(8):1856-1858.
[21]谭亮,董琦,曹静亚,等. 黑果枸杞中花色苷的提取与结构鉴定[J]. 天然产物研究与开发,2014(11):1797-1802.
[22]涂宗财,尹月斌,姜颖,等. 超声波辅助提取玫瑰茄花青素的工艺优化[J]. 食品研究与开发,2011,32(10):1-4.
[23]师文添,扶庆权. 玫瑰茄中花青素的超声波提取工艺研究[J]. 食品研究与开发,2010,31(12):86-89.
[24]吕春茂,王新现,董文轩,等. 响应面法优化越橘花色苷微波辅助提取工艺参数[J]. 食品科学,2011,32(6):71-75.
[25]刘青梅,高娟,姜敏芳,等. 响应面法优化杨梅渣中花色苷提取工艺[J]. 中国食品学报,2014,14(6):90-96.
[26]吐尔逊,王选东,李婷. 黑果枸杞色素的提取工艺研究[J]. 安徽农业科学,2007(4):1111-1112.
[27]张艳臻. 物质的分子运动论和温度[J]. 物理通报,1996(4):8-13.
Process optimization for ultrasonic-assisted extraction of anthocyanins fromLyciumruthenicumMurray
ZHENG Tan,LI Jian-ying*,YANG Lu,WANG Qing-xia,WANG Jia,LI Meng-xuan
(College of Biotechnology and Food Science,Tianjin University of Commerce, Tianjin Key Laboratory of Food Biotechnology,Tianjin 300134,China)
The ultrasonic-assisted extraction process of anthocyanins fromLyciumruthenicumMurray was optimized by response surface methodology in this paper. Total anthocyanins content as index,the liquid to solid ratio,extraction temperature,extraction time and ethanol concentration were selected as the main factors through the single factor experiment. Thus the Box-Behnken experimental design was carried out with four factors and three levels and the response surface methodology was applied to optimize the extraction conditions.The results indicated that the optimal extraction conditions were determined as follows:the liquid to solid ratio of 20.4∶1 (mL/g),extraction temperature of 48 ℃,extraction time of 24.8 min and ethanol concentration of 79%. Under the above conditions,the extraction content of anthocyanins could reach(14.999±0.014)mg/g. The primary and secondary order of the factors affecting the extraction content of anthocyanins was extraction temperature,alcohol concentration,extraction time,and liquid to solid ratio.
LyciumruthenicumMurray;response surface methodology;extraction;anthocyanins;process optimization
2016-11-30
郑覃(1994-),男,硕士研究生,研究方向:食品加工与贮藏,E-mail:m18222069272_1@163.com。
*通讯作者:李建颖(1961-),女,硕士,教授,研究方向:天然产物的提取、分离与纯化,E-mail:ljying@tjcu.edu.cn。
天津商业大学科技成果转化奖励项目(60207-2015CGZH0202);国家级大学生创新训练计划项目(201510069047);天津市大学生创业实践计划项目(201610069044)。
TS255.1
B
1002-0306(2017)14-0227-06
10.13386/j.issn1002-0306.2017.14.044
