两种不同方法制备南极磷虾富脂蛋白的对比研究
2017-08-09尹利昂薛长湖田利利姜晓明尹利端李兆杰中国海洋大学食品科学与工程学院山东青岛66003烟台新时代健康产业有限公司山东烟台64006
尹利昂,薛长湖,田利利,姜晓明,尹利端,李兆杰,薛 勇,*(.中国海洋大学食品科学与工程学院,山东青岛 66003; .烟台新时代健康产业有限公司,山东烟台 64006)
两种不同方法制备南极磷虾富脂蛋白的对比研究
尹利昂1,薛长湖1,田利利1,姜晓明1,尹利端2,李兆杰1,薛 勇1,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003; 2.烟台新时代健康产业有限公司,山东烟台 264006)
以冷冻南极磷虾为原料,通过优化自溶条件,采用控制自溶的方式,制备一种富含ω-3的复合物,并就其基本组成、蛋白质变化与分布、营养评价等,与等电点促溶/促沉法制备的富脂蛋白进行对比研究。优化的自溶条件为55 ℃和pH7.5条件下自溶3 h。实验结果表明,两种蛋白均为富含ω-3多不饱和脂肪酸的蛋白-脂质复合物,含有全部的人体必需氨基酸,超过FAO/WHO/UNU对食品蛋白质中必需氨基酸的要求,而自溶法制备的富脂蛋白在总脂、磷脂、ω-3多不饱和脂肪酸含量,以及必需氨基酸总量上均优于后者,平均值分别达到了43.88%干基、48.84%总脂、31.52%脂质和517.4 mg/g蛋白。由此可见,控制自溶是一种高效的制备富脂蛋白的方式,有助于磷虾富脂蛋白作为功能性海洋食品的开发。
南极磷虾,富脂蛋白,自溶,ω-3多不饱和脂肪酸
南极磷虾是一种生活在南极海域的浮游生物,在南极食物链系统中担任重要角色[1]。作为地球上生物蕴藏量最大的物种,南极磷虾资源的开发利用引起全世界越来越多的关注。南极磷虾,一般指南极大磷虾(Euphausiasuperba),除了虾油产品外,其作为人类日常食物的来源尚受到一定的成本和技术上的限制,但它有着均衡的营养组成,整虾含有77.9%~83.1%的水分、0.4%~3.6%的脂质、11.9%~15.4%的蛋白质,以及约2%的甲壳质和碳水化合物[2]。南极磷虾蛋白的营养高于一般畜禽肉蛋白和牛乳蛋白,含有全部的人体必需氨基酸,必需氨基酸的总量达到212.1 mg/g 蛋白质[3]。南极磷虾脂质含有比例可观的多不饱和脂肪酸,其中,DHA和EPA含量分别为16.6%~36.5%和11.1%~24.8%脂质[4],且多以磷脂型存在[5]。
南极磷虾加工的限制性因素较多:含有较高比例的可溶性蛋白成分;其蛋白质在本体死亡和冷冻后极易发生变性;南极磷虾肌肉中含有4.5~570 mg/kg的氟[6];南极磷虾体内,尤其是头胸部的消化系统,含有丰富的和较强活性的自溶酶系,主要是蛋白酶类和酯酶类。南极磷虾的这些特征增加了传统途径的加工成本,使磷虾资源的大宗利用受到限制,而尚未规模化的作为人类食物的来源。
有学者研究发现,等电点促溶/促沉法制备低氟南极磷虾基料时,所形成的蛋白复合物,在一定程度发生了脂质的富集,可以认为是一种富脂蛋白[7]。本实验意在利用南极磷虾自溶酶的生化特点,尝试制备一种新的富脂蛋白,以推动磷虾加工的研究和相关产品的进一步开发。迄今,相关学者对磷虾自溶酶的生化性质进行了较为深入的研究[8-12],但利用自溶酶作用制备南极磷虾制品的开发尚未见文献报道。本研究利用冷冻南极磷虾为原料,经脱氟、优化条件和控制自溶,制备了一种富含ω-3多不饱和脂肪酸(polyunsaturatedfattyacids,PUFAs)的蛋白-脂质复合物,通过与原料虾肉、等电点促溶/促沉法制备的富脂蛋白相比较,以期证明其是一种营养价值高、安全性好的富脂蛋白。
1 材料与方法
1.1 材料与仪器
南极磷虾(E.superba) 2015年3月捕捞于南极FAO 48.1海域,中国水产有限公司;三羟甲基氨基甲烷(Tris) 北京索莱宝科技有限公司;对硝基苯酚(p-NP)、对硝基苯酚丁酸酯(p-NPB)、苯甲酰-L-精氨酰-对硝基苯胺(BApNA) 美国Sigma-Aldrich公司;石油醚、乙醚、乙酸、氯仿、甲醇、油酸、乙醇、十二烷基硫酸钠(SDS) 国药集团化学试剂有限公司;福林-酚乙液 上海君瑞生物技术有限公司;其他试剂等均为分析纯。
JB-1A型磁力搅拌器 上海精密科学仪器有限公司;JJ-1精密增力电动搅拌器、HH-4型数显恒温水浴锅 常州国华电器有限公司;GL-20M型高速冷冻离心机 上海卢湘仪离心机仪器厂;016-240改进型鱼肉分离机 中国水产科学研究院上海渔业机械研究所;PF-1氟选择电极、232甘汞参比电极 上海雷磁精密仪器有限公司;自动电位滴定仪 济南海能仪器股份有限公司;Biochrom 30+全自动氨基酸分析仪 英国Biochrom公司;6980N气相色谱仪、5973质谱仪、石英毛细管柱HP-INNOWAX(30 m×0.32 mm×0.25 μm) 美国安捷伦公司;BRUKER AV500核磁共振波谱仪 德国布鲁克公司。
1.2 实验方法
1.2.1 去壳南极磷虾虾肉的制备 脱氟:将冷冻南极磷虾在4 ℃的2 mol/L磷酸溶液中解冻6 h,以降低虾壳中的氟,防止其向虾肉中迁移。
采肉:沥干磷虾表面水分,以鱼肉分离机采取虾肉,得到去壳南极磷虾肉。
1.2.2 自溶法制备富脂南极磷虾蛋白
1.2.2.1 南极磷虾粗酶液的制备 收集冷冻南极磷虾虾头,加入2倍质量的Tris-HCl缓冲液(0.05 mol/L,pH7.5,4 ℃),高速匀浆后,匀浆液4 ℃、10000 r/min离心30 min,收集上清液,得南极磷虾粗酶液[13]。粗酶液于-80 ℃冰箱冻存。
1.2.2.2 内源酶最适温度的测定 取pH7.5的粗酶液,参考Erlanger等的方法[14],以苯甲酰-L精氨酰-对硝基苯胺(BApNA)为底物,以吸光值最高的pH所对应的酶活力为100%,进行粗酶液中蛋白酶在不同温度条件(5~65 ℃)下相对活力的测定;采用对硝基苯酚(p-NP)法[15],以对硝基苯酚丁酸酯(p-NPB)为底物,以吸光值最高的pH所对应的酶活力为100%,进行粗酶液中脂肪酶在不同温度条件(5~65 ℃)下相对酶活力的测定。
1.2.2.3 内源酶最适pH的测定 以55 ℃为反应温度,BApNA为底物,以吸光值最高的pH所对应的酶活力为100%,进行粗酶液中蛋白酶在不同pH(pH3~11)下相对活力的测定;以p-NPB为底物,以吸光值最高的pH所对应的酶活力为100%,进行粗酶液中脂肪酶在不同pH(pH3~11)下相对酶活力的测定。
1.2.2.4 自溶过程及自溶时间选择 准确称取8~10 g的去壳南极磷虾肉,加入3倍体积的Tris-HCl缓冲液(0.05 mol/L,pH7.5,4 ℃),于冰浴条件下高速匀浆。保持pH稳定,加入南极磷虾肉质量1/20的上述南极磷虾粗酶液,分别于55 ℃水浴、温和搅拌条件下自溶1、2、3、4 h,快速升温灭酶(90 ℃保持5 min),并于冷却后离心(5000 r/min,10 min),收集沉淀部分即自溶法制备的富脂蛋白。
以Folch方法[16]提取其中的脂质,以薄层色谱法(TLC)分析不同的自溶时间节点时,游离脂肪酸(FFA)、溶血卵磷脂(LPC)等脂质品质劣化代表产物含量的变化趋势。以油酸(C18∶1)为参照,中性展开剂为石油醚∶乙醚∶乙酸=85∶15∶1(v/v/v),极性展开剂为氯仿∶甲醇∶水=65∶25∶4(v/v/v)。
1.2.3 等电点促溶/促沉法制备富脂南极磷虾蛋白 准确称取8~10 g的去壳南极磷虾肉,加入3倍体积的4 ℃的蒸馏水,高速匀浆。以10 mol/L和4 mol/L NaOH调节匀浆液pH至11.5,在冰浴条件下搅拌30 min以溶解南极磷虾蛋白,5000 r/min离心10 min,收集沉淀部分,重复一次以上的蛋白溶解操作。将先后两次离心的上清混合,以10 mol/L和4 mol/L HCl调节混合液pH至4.5,冰浴静置30 min,5000 r/min离心10 min,收集沉淀部分,得等电点促溶/促沉法制备的富脂蛋白[7]。
1.2.4 基本成分分析 水分含量:采用直接干燥法测定,参照GB/T 5009.3-2010。总脂含量:参照Folch[16]的方法,采用氯仿/甲醇(2/1,v/v)提取磷虾油,以虾油质量除以样品质量,即得总脂含量;该磷虾油用于脂肪酸组成分析和磷脂、游离脂肪酸含量测定。蛋白质含量:采用凯氏定氮法测定,参照国标GB/T 5009.5-2010。灰分含量:参照国标GB/T 5009.4-2010测定。总氟含量:精确称量2 g样品,采用碱熔固定-高温灰化-氟离子选择电极法测定[17],以0.1 mol/L高氯酸为氟的提取试剂。
1.2.5 蛋白质的双向二维电泳分析 提取和纯化两种富脂蛋白,采用双向二维电泳(2-DE)分析几种蛋白的分布特征[18]。
1.2.5.1 电泳样品的制备 在研钵中倒入液氮预冷,然后将样品置于研钵中,再次迅速加入液氮,待液氮挥发完之后再倒一次液氮,至研钵中液氮停止沸腾后迅速研磨,直至组织变成粉末,均匀而没有明显颗粒。在研钵中加入800 μL RB(使用前加入1×PMSF),充分溶解粉末后转移至1.5 mL EP管中。
将EP管中样品以超声破碎仪进行超声破碎,频次为8次/轮,共超声8~9轮。每完成一轮的超声破碎,将样品立即冰浴1 min,然后进行离心(4 ℃,12000 r/min,20 min),收集上清液。将上清液分装成3管,每管约250 μL,每管再加入4倍样本体积丙酮-20 ℃沉淀过夜。沉淀完的蛋白质进行离心(4 ℃,12000 r/min,20 min),倒去上清液后,平放于干净的纸巾上自然干燥,即可得到处理后的蛋白质团块,-80 ℃保存备用。
1.2.5.2 二维电泳条件 一向等电聚焦电泳(IEF):pH3~10;二向垂直电泳(SDS-PAGE):15~170 kDa;染色:银染。以ImageMaster 2D platinum 5.0进行图像分析。
1.2.6 氨基酸组成分析 参照GB/T5009.124-2003。
1.2.7 脂肪酸组成分析 虾油脂肪酸甲酯化条件:取磷虾油10 mg,加入1 mL 10%浓硫酸-甲醇溶液(或浓盐酸∶甲醇=1∶5),于90 ℃水浴甲酯化30 min,冷却后加入正己烷1 mL振荡,静置分层,取上清液供GC/MS分析[19]。
色谱条件:HP-INNOWax石英毛细管柱(30 m×0.32 mm×0.25 μm),高纯氦气为载气,采用恒压模式,压力为54 kPa,分流比为25∶1。进样口温度为230 ℃,检测器温度为250 ℃,柱温以3 ℃/min由140 ℃升到210 ℃,然后在210 ℃下保持10 min,整个分析过程为33 min。
质谱条件:GC/MS接口温度280 ℃,EI离子源,电离能量70 eV,离子源温度230 ℃,扫描周期2.84次/s,质量扫描范围m/z 50~500 u。
1.2.8 磷脂和游离脂肪酸含量测定 磷脂含量测定[20]:核磁共振法(31PNMR)。以三氯甲烷∶氘代甲醇(2∶1)溶剂为溶剂,磷酸三苯酯(TPP)为内标物进行核磁共振分析。
游离脂肪酸含量测定:采用自动电位滴定法[21],以石油醚∶乙醇(2∶1)为混合溶剂,0.1 mol/L NaOH溶液为滴定试剂。
1.3 数据处理
各数据均平行测定三次。运用分析软件SPSS 18.0进行统计分析,采用one-way ANOVA算法进行方差分析。多重比较分析采用Tukey’s test算法判断显著性差异(p<0.05)。表2~表3同。
2 结果与分析
2.1 自溶条件的优化
2.1.1 自溶温度和pH的选择 南极磷虾自溶酶系主要由蛋白酶和脂肪酶构成,为探索最佳的自溶效果,本实验验证了在不同温度和pH条件下两种酶类的相对活性。如图1所示,南极磷虾蛋白酶系的最高相对活性对应的温度为55 ℃、pH为7.5,体现了其类胰蛋白酶的属性。这与以往研究者报道的结果一致,Kubota等[22]认为对自溶起主要作用的是消化道内的蛋白酶,这些酶最适pH为6~8;Osnes等[9]也认为磷虾自溶酶中起着决定作用是类胰蛋白酶,整体自溶酶活性在中性至弱碱性条件下最强;Kimoto等[10]研究显示南极大磷虾的类胰蛋白酶对其自溶起主要的作用;Konagaya[23]通过分离鉴定南极磷虾体内的蛋白酶,也认为其主要的蛋白酶为类胰蛋白酶。
就脂肪酶类而言,由图1可以看出,南极磷虾脂肪酶系为低温酶,其较适宜的温度为5~40 ℃,最高相对活性对应的温度为35 ℃、pH为7.5。Turkiewicz等[24]的研究表明,磷虾酯酶在pH4.6和37 ℃下具有最大活性,55 ℃下5 min热处理可以使其完全失活。尚宪明[12]进行了反应温度和反应pH对酶促反应速率影响的实验,结论认为,南极磷虾脂肪酶最佳反应pH为8.0左右,其对较高温度的稳定性差,在35 ℃具有最佳反应速率,具有低温脂肪酶的催化特性,并分析这可能与其生活环境相关。

图1 冷冻南极磷虾自溶酶的相对活性Fig.1 Relative activity of autoenzyme from frozen Antarctic krill注:(a)和(b)分别表示自溶酶在不同温度和pH条件下相对活性的变化。
脂肪酶类在自溶过程中,容易导致脂质的酶促降解,引起游离脂肪酸(FFA)和溶血卵磷脂(LPC)水平的上升,使自溶产物的脂质发生品质的劣化,因此有必要采取合适的自溶条件,在促进蛋白酶类作用的同时,抑制脂肪酶类的活性。鉴于蛋白酶在55 ℃和pH7.5分别显现最高的相对活性,而在55 ℃反应温度下,脂肪酶类的相对活性只有最高时的20%~30%,本实验采用的自溶温度和pH分别为55 ℃和7.5。
2.1.2 自溶时间的选择 一般来说,随着自溶时间的延长,脂肪酶作用对自溶产物的不利影响会逐渐增大,如图2所示,在不同时间(1、2、3、4 h)的平行自溶产物中,随着自溶时间的延长,作为脂质劣化标志性产物的FFA、LPC呈现增加的趋势,在1~3 h的自溶中,二者含量的增加比较缓慢,而自溶4 h时则呈现急剧增加的特点。为避免脂质劣化给自溶产物带来不利影响,优化的自溶时间以3 h为宜。因此,结合自溶效果,本实验选择自溶时间为3 h的反应产物为富脂蛋白。

表1 南极磷虾肉和两种富脂蛋白的基本成分Table 1 Basic composition of AKM,OEP-A and OEP-ISP
注:AKM,南极磷虾肉;OEP-A,自溶3 h制备的富脂蛋白;OEP-ISP,等电点促溶/促沉法制备的富脂蛋白。表2~表3同

图2 不同自溶时间所对应脂质的薄层色谱分析Fig.2 TLC analysis oflipid from OEP with different autolysis time注:(a)中性展开;(b)极性展开;TG-甘油三酯。
2.2 基本成分分析
所制备OEP-A的干物质得率平均为40.53%,OEP-ISP的干物质得率平均为41.16%。去壳南极磷虾肉及两种富脂蛋白的基本组成见表1。原料中蛋白质含量(68.05%±0.45%干基)远高于总脂含量(19.72%±0.32%干基)。自溶过程中,蛋白酶能够有效的降解蛋白质,而在溶解/等电沉淀法中,在等电点pH4.5处,半数以上的蛋白能够析出而形成沉淀[25],这也是自溶方法的干物质得率略低于后者的原因。
由表1可知,OEP-ISP中的蛋白、总脂的比例接近2∶1,这与王灵昭等[25]使用等电点溶解-沉淀法(ISP方法)所制备的低氟南极磷虾基料中蛋白、总脂的比例相接近。OEP-A中的蛋白、总脂的比例略高于1∶1,就总脂含量而言,自溶方式比等电点促溶/促沉方式对脂质的富集能力更强,这可能是由于在酶解过程中,蛋白酶作用较强而脂肪酶作用较弱,有相当比例的非水溶性蛋白质经酶解后,以多肽、氨基酸的形式进入到上清液中。两种富脂蛋白中的平均干基氟含量分别为35.27 mg/kg和24.81 mg/kg,符合美国FDA对食品中氟含量100 mg/kg的限定标准要求,ISP法对氟的脱除效果较自溶方式稍好。这可能是由于ISP过程中,除了经历水洗作用,蛋白质的完全溶解使氟释放的比较充分,相关研究结果证实酸处理更能加速氟的脱除[6,26-28]。表1数据对比说明,自溶是有效的富集脂质的方式。同时,自溶过程所产生的上清液,含有蛋白质、多肽、氨基酸及部分脂质,经有效的脱氟后,可以作为后续开发风味类产品的原料。
2.3 蛋白质的分布情况
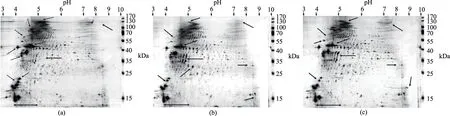
图3 南极磷虾蛋白与两种富脂蛋白的双向二维电泳图谱Fig.3 2-DE spectrum of protein from AKM,OEP-A and OEP-ISP注:(a)、(b)、(c)分别为AKM、OEP-A和OEP-ISP蛋白的双向二维电泳图。
由于制备原理的不同,OEP-A及OEP-ISP的蛋白分布情况有所差异,如图3所示。由图3可以看出,南极磷虾蛋白的2-DE图谱上的斑点集中在pH4~5,尤其以pH4.5处最为集中,说明南极磷虾蛋白的等电点在pH4.5附近,这与已报道的南极磷虾蛋白等电点pH4.6相近[25],同时说明实验中制备OEP-ISP所采用的等电点是正确的。南极磷虾蛋白的分子量集中在35~55 kDa和70~100 kDa。由图3(a)~图3(c)对比可以看出,南极磷虾肉蛋白(图3(a))在170 kDa处有少量斑点(spots),该斑点通常被认为是鱼类、对虾和磷虾肌原纤维蛋白中的肌球蛋白重链(myosin heavy chain,MHC)的所在[29-30]。MHC斑点或条带的弱化,是其所在的蛋白质凝胶性和ATPase活性减弱的表征。这说明,南极磷虾在经历了死亡和长期冻藏后,其蛋白质可能发生了较严重的降解和变性。在图3(b)及图3(c)中,MHC的斑点几乎完全消失,并且代表肌动蛋白的40~55 kDa的斑点也明显的减少和弱化,这可能是肌原纤维蛋白受温度、酸碱作用的影响,发生了进一步的降解[31-32]。据文献报道,在自溶过程中,肌球蛋白与肌动蛋白是蛋白酶作用的主要对象[33]。与此同时,低于35 kDa的小分子量蛋白斑点增加,图3(c)的增加尤其明显,说明酸碱对南极磷虾蛋白质的降解作用较强。

表2 南极磷虾肉蛋白和两种富脂蛋白的氨基酸组成Table 2 Amino acid composition of protein from AKM,OEP-A,and OEP-ISP
注:Lys,赖氨酸;Trp,色氨酸;Phe,苯丙氨酸;Tyr,络氨酸;Met,甲硫氨酸;Cys,半胱氨酸;Thr,苏氨酸;Ile,异亮氨酸;Leu,亮氨酸;Val,缬氨酸;His,组氨酸;Glu,谷氨酸;Asp,天冬氨酸;Ala,丙氨酸;Arg,精氨酸;Ser,丝氨酸;Gly,甘氨酸;Pro,脯氨酸;EAA,必需氨基酸;NEAA,非必需氨基酸。
2.4 氨基酸组成分析
氨基酸组成特别是必需氨基酸(EAA)的含量,是衡量蛋白质营养价值的重要指标。由表2可以看出,3种南极磷虾蛋白中必需氨基酸的含量,分别达到486.8、517.4和503.8 mg/g蛋白,均超过FAO/WHO/UNU对成人(婴儿)食品蛋白中必需氨基酸的要求[277(292.6) mg/g蛋白][34]。OEP-A和OEP-ISP蛋白的必需氨基酸总量在AKM蛋白的基础上得到提升,OEP-A蛋白的必需氨基酸总量更高。经过两种方式的处理,赖氨酸、谷氨酸、天冬氨酸和精氨酸的含量增加明显,其中标志蛋白质营养价值的赖氨酸(Lys),在OEP-A中的含量达到93.4 mg/g蛋白,高于在AKM和OEP-ISP中的含量(88.5、89.7 mg/g蛋白)。
2.5 脂肪酸组成分析
3种脂质的脂肪酸组成如表3所示。OEP-A的PUFAs含量超过了其它2种脂质,其中EPA(C20∶5 n-3)和DHA(C22∶6 n-3)的含量之和达到30.44%,明显高于AKM的28.39%和OEP-ISP的28.50%,ω-3 PUFAs(C18∶3 n-3、C20∶5 n-3、C22∶6 n-3)含量达31.52%,这说明OEP-A的脂质含有丰富的ω-3 PUFAs,考虑到OEP-A中的总脂含量达到43.88%干基,故本实验将自溶法制备的脂质-蛋白复合物称为ω-3富脂蛋白(omega-3-enriched protein,OEP)。

表3 南极磷虾肉和两种富脂蛋白脂质的脂肪酸组成Table 3 Fatty acid composition of lipids from AKM,OEP-A,and OEP-ISP
注:SFAs,饱和脂肪酸;MUFAs,单不饱和脂肪酸;PUFAs,多不饱和脂肪酸。
2.6 磷脂和游离脂肪酸含量分析
本实验采用核磁共振方法(31P NMR)以准确定量脂肪中的磷脂含量,结果见图4。

图4 自溶法所制备的富脂蛋白脂质的31P NMR谱图Fig.4 31P NMR spectrum of lipid from OEP prepared with autolysis
3种脂质的磷脂和游离脂肪酸含量如表4所示,OEP-A脂质的磷脂含量(48.84%±0.57%总脂)比AKM脂质中磷脂含量(33.16%±0.41%总脂)和OEP-ISP脂质中磷脂含量(34.97%±0.48%总脂)明显提高,说明OEP-A是一种富含磷脂结合型脂质的复合物。自溶酶解法提高脂质中磷脂含量的作用机制尚未见报道,故这一发现将作为后续研究的重点。OEP-A所含的脂质,可以对人体的神经系统和心血管系统健康起到良好的维护作用[35],不仅是由于其含有丰富的ω-3 PUFAs,还有重要一点是,其脂肪酸主要以磷脂结合的形式存在,据相关研究证实,磷脂型脂质在人体内的吸收效率和安全程度更高[36-37]。因此,OEP-A可以认为是一种富含磷脂型PUFAs的复合物。OEP-A脂质中的游离脂肪酸含量较AKM的略有增加,这可能是自溶过程中脂肪酶的分解作用所致。

表4 三种脂质的磷脂和游离脂肪酸含量Table 4 Phospholipid and free fatty acid content of lipid from AKM and two OEP
3 结论
本研究的结果表明,可以通过优化的自溶方法:于55 ℃、pH7.5条件下经自溶酶3 h的作用,制备得到富含ω-3的蛋白-脂质复合物。该复合物具有优异的氨基酸及脂肪酸组成,其EAA、ω-3 PUFAs分别达到517.4 mg/g蛋白和31.52%脂质,并含有较高的磷脂含量(48.84%总脂),安全的氟含量(35.27 mg/kg干重)以及合理的游离脂肪酸含量(4.72%总脂)。该富脂蛋白制备过程中产生的副产物可以用于开发磷虾风味产品,为南极磷虾的综合利用提供新途径。自溶法制备的富脂蛋白对人体健康有积极的意义,具有开发功能性海洋食品的潜在价值。
[1]SuzukiT,Shibata N. The utilization of Antarctic krill for human food[J].Food Reviews International,1990,6:119-147.
[2]Grantham G J. The Southern Ocean:The Utilization of krill[M]. Rome:FAO,1977:1-61.
[3]Chen Y C,Tou J C,Aczynskia J. Amino acid and mineral composition of protein and other components and their recovery yields from whole Antarctic krill(Euphausiasuperba)using isoelectric solubilization/precipitation[J]. Journal of Food Science,2009,74:H31-H39.
[4]Virtue P,Johannes R E,Nichols P D,et al. Biochemical composition ofNyctiphanesaustralisand its possible use as an aquaculture feed source:lipids,pigments and fluoride content[J]. Marine Biology,1995,122:121-128.
[5]Nie Y C,Zhang B,Zhao X Y,et al. Seasonal Variation in Lipids and Protein Content of Antarctic Krill(Euphausiasuperba)[J]. Progress in Fishery Sciences,2016,37:1-8.
[6]Jung H R,Kim M A,Seo Y S,et al. Decreasing effect of fluoride content in Antarctic krill(Euphausiasuperba)by chemical treatments[J]. International Journal of Food Science and Technology,2013,48:1252-1259.
[7]Wang L Z,Xue C H,Wang Y M,et al. Extraction of proteins with low fluoride level from Antarctic krill(Euphausiasuperba)and their composition analysis[J]. Journal of Agricultural and Food Chemistry,2011,59:6108-6112.
[8]Sjoödahl J,Emmer Å,Vincent J,et al. Characterization of proteinases from Antarctic krill(Euphausiasuperba)[J]. Protein Expression and Purification,2002,26:153-161.
[9]Osnes K K,Mohr V. Peptide hydrolases of Antarctic krill,Euphausiasuperba[J]. Comparative Biochemistry and Physiology B:Biochemistry and Molecular Biology,1985,82:599-606.
[10]Kimoto N. Classification of proteases in Antarctic krill[J]. Agric Biol Chem,1983,47(11):2577-2583.
[11]任艳.南极磷虾蛋白加工利用的初步研究[D]. 青岛:中国海洋大学,2009.
[12]尚宪明.南极大磷虾脂肪酶提取纯化及其酶学性质研究[D]. 青岛:中国海洋大学,2011.
[13]杭虞杰,李学英,杨宪时,等.南极磷虾自溶酶性质的初步研究[J].食品科学,2011,32(13):198-200.
[14]Erlanger B F,Kokowsky N,Cohen W. The preparation and properties of two new chromogenic substrates of trypsin[J].Archs Biochem Biophys,1961,95:271-278.
[15]郑毅,叶海梅,吴朝娟,等.脂肪酶活力测定研究进展[J].工业微生物,2005,35(9):36-40.
[16]Folch J,Lees M,Sloane-Stanley G H. A simple method for the isolation and purification of total lipids from animal tissues[J].J Biol Chem,1957,226:497-509.
[17]Marian Kjellevold Malde,Kjell Bjorvatna,Kåre Julshamn. Determination of fuoride in food by the use ofalkali fusion and fuoride ion-selective electrode[J].Food Chemistry,2001,73:373-379.
[18]O’Farrell PH. High resolution two-dimensional electrophoresis of proteins[J]. J Biol Chem,1975,250:4007-4021.
[19]楼乔明.几种海洋动物脂质分析及EPA磷脂的活性[D]. 青岛:中国海洋大学,2011.
[20]崔常乐,滕英来,汪勇,等. 核磁共振磷谱内标法测定磷脂酰胆碱的含量[J].中国粮油学报,2016,31(5):158-162.
[21]薛斌,曹文明,包杰,等.自动电位滴定法测定米糠油酸值的研究[J].中国油脂,2014,39(11):33-37.
[22]KubotaM,Sakai K. Autolysis of Antarctic krill protein and its inactivation by combined effects of temperature and pH[J]. Trans Tokyo Univ Fish,1978,2:53-63.
[23]Konagaya S.Protease activity and autolysis of Antarctic krill[J].Nippon Suisan Gakkaishi,1980,46(2):175-183.
[24]Turkiewicz M,Kalinowska H,Krystynowicz A,et al. Lipolytic activity of Antarctic krill,EuphausiasuperbaDana[J]. Polish Polar Res,1995,16:185-198.
[25]王灵昭.南极磷虾(Euphausiasuperba)蛋白质深加工新技术的研究[D]. 青岛:中国海洋大学,2012.
[26]Sands M,Nicol S,McMinn A. Fluoride in Antarctic marine crustaceans[J]. Marine Biology,1998,132:591-598.
[27]AdelungD,Buchholz F,Culik B,et al. Fluoride in tissues of krillEuphausiasuperbadana andMeganyctiphanesnorvegicaM. sars in relation to the moult cycle[J]. Polar Biol,1987,7:43-50.
[28]Xie C L,Kim H S,Shim K B,et al. Organic acid extraction of fluoride from Antarctic krillEuphausiasuperba[J]. Fish Aquat Sci,2012,15:203-207.
[29]Yoshikawa K,Inoue N,KawaiY,et al. Changes of the Solubility and ATPase activity of carp myofibrils during frozen storage at different temperatures[J].Fisheries Science,2011,61(5):804-812.
[30]Martinez I,Friis T J,Careche M. Post mortem muscle protein degradation duringice-storage of Arctic(Pandalusborealis)andtropical(PenaeusjaponicusandPenaeusmonodon)shrimps:a comparative electrophoretic and immunological study[J].J Sci Food Agric,2001,81:1199-1208.
[31]Inger V H Kjaersgård,Mette R Nørrelykke,Flemming Jessen. Changes in cod muscle proteins during frozen storagerevealed by proteome analysis and multivariate dataanalysis[J].Proteomics,2006,6:1606-1618.
[32]Li T T,Li J R,Hua W Z,et al. Protein changes in post mortem large yellow croaker(Pseudosciaenacrocea)monitored by SDS-PAGE and proteome analysis[J]. Food Control,2014,41:49-55.
[33]Sun L C,Chen Y L,Zhong C,et al. Autolysis of krill protein from North Pacific krillEuphausiapacificaduring protein recovery via isoelectric solubilization/precipitation[J]. Fish Sci,2014,80:839-847.
[34]WHO/FAO/UNU. Protein and amino acid requirements in human nutrition. Report of a joint WHO/FAO/UNU expert consultation[R]. WHO Technical Report Series 935,2007.
[35]Sally T,Rosanna W S,Chung E W,et al. Dietary Krill Oil Supplementation Reduces Hepatic Steatosis,Glycemia,and Hypercholesterolemia in High-Fat-Fed Mice[J].J Agric Food Chem,2009,57:9339-9345.
[36]Ruxton C,Reed S,Simpson M,et al. Health benefits of omega-3 polyunsaturated fatty acids:a review of the evidence[J]. J Hum Nutr Diet,2004,17:449-459.
[37]Gigliotti J C,Davenport M P,Beamer S K,et al. Extraction and characterisation of lipids from Antarctic krill(Euphausiasuperba)[J]. Food Chemistry,2011,125:1028-1036.
Comparative research of two omega-3-enriched protein prepared from Antarctic krill(Euphausiasuperba)with different methods
YIN Li-ang1,XUE Chang-hu1,TIAN Li-li1,JIANG Xiao-ming1,YIN Li-duan2,LI Zhao-jie1,XUE Yong1,*
(1.College of Food Science and Engineering,Ocean University of China,Qingdao 266003,China; 2.Yantai New Era Health Industry Co.,Ltd.,Yantai 264006,China)
Omega-3-enriched protein(OEP)was prepared with controlled autolysis from Antarctic krill(Euphausiasuperba)meat(AKM)with optimization,and compared with OEP prepared with isoelectric solubilization/precipitation(ISP)from basic composition,nutritional evaluation,and variations and distributions of proteins. The optimized condition was that autolysis at 55 ℃ and pH7.5 for 3 h,either protein was demonstrated to be a protein-lipid complex which was rich in ω-3 polyunsaturated fatty acids(ω-3 PUFAs),and exhibited excellent amino-acid composition in all the essential amino acids,exceeding the requirements of the FAO/WHO/UNU for food protein. Total lipid,phospholipid,ω-3 PUFAs and essential amino acids were richer in the OEP prepared with autolysis,and the average values reached 43.88% dry basis,48.84%total lipid,31.52% lipid and 517.4 mg/g protein. This study indicated that controlled autolysis was an efficient way of preparation of ω-3-enriched protein,promotingits development as a functional seafood product in future.
Antarctic krill;ω-3-enriched protein;autolysis;ω-3 PUFAs
2016-12-20
尹利昂(1983-),男,博士研究生,工程师,研究方向:水产品加工,E-mail:yinliang2011@163.com。
*通讯作者:薛勇(1976-),男,博士,教授,研究方向:水产品加工,E-mail:xueyong@ouc.edu.cn。
山东省科技重大专项海洋食品现代加工与产业链质量控制体系研究(2015ZDZX05003)。
TS254.4
A
1002-0306(2017)14-0075-07
10.13386/j.issn1002-0306.2017.14.015
