心房颤动消融中瘢痕均质化改良:进展与实践
2017-08-09杨军陈明龙
杨军 陈明龙
·综述·
心房颤动消融中瘢痕均质化改良:进展与实践
杨军 陈明龙
心房颤动; 消融; 瘢痕; 均质化
心房颤动(房颤)是一种常见的具有潜在危害的心律失常。目前为止,房颤触发与维持的电生理机制还没有彻底阐述清楚。房颤需要基质来维持,电学或组织学的基质在维持房颤中起着重要的作用。电学基质重构常常是暂时的和可逆的,在阵发性房颤的维持中占有很重要的比重,而组织学重构趋于不可逆和进展的,在阵发性和持续性房颤的维持中均占主导地位[1-2]。
1 心房纤维化和房颤
心房组织学研究证实,不管病因学是什么,心房细胞的损伤及其随后的修复与重构将最终形成房颤的组织学基质。通过对传统抗心律失常药物治疗无效的孤立性房颤患者进行右心房和双心室心内膜心肌组织活检,发现存在房颤的心房组织学基质及其相关的双心室组织学变化[3]。心房疾病是可以单独存在的,而并不是一定继发于心室疾病。不管起因是什么,心房心肌的炎症反应已逐渐被认识到是房性心动过速(房速)[4]、永久性房颤[5]和孤立性房颤的主要病因。炎症因子(例如C-反应蛋白)在房颤患者中是升高的,并且可以预测未来可能发生房颤的风险[6]。事实上,炎症的最终结果是纤维化。在孤立性房颤、房颤合并二尖瓣瓣膜疾病和窦性心律患者进行心脏外科手术过程中,取左心房游离壁近房间隔部位的心房组织观察,研究发现100%房颤患者胶原蛋白Ⅰ升高,50%胶原蛋白Ⅲ升高,而纤维连接蛋白只有轻微的升高[7]。这些主要细胞外基质蛋白的表达证实了房颤与纤维化之间的关系[7]。从47个瓣膜性房颤患者行迷宫手术过程中,在左心房后壁和右心耳分别取心房组织进行研究[8]。术前房颤患者比窦性心律患者的心房细胞内径更大[(左心房(19.0±5.0) μm 比(13.9±3.5) μm,P< 0.01 和右心房(17.0±4.8) μm比(12.3±2.8) μm,P< 0.01)],心房内细胞纤维化更严重[(左心房(15.8±8.8)%比( 6.9±2.4)%,P< 0.01 和右心房 (15.2±6.2)%比(6.2±2.9)%,P< 0.01)]。另外,对于术前是房颤的患者,与行迷宫手术成功组相比,未成功组左心房细胞内径更大,细胞内纤维化程度也更严重。此外,仅在不成功的迷宫手术组观察到左心房细胞内纤维化比右心房程度更重。Corradi等[9]研究了慢性房颤合并行二尖瓣瓣膜手术的患者发现左心房有局部间质重构,并提出与左心耳相比,肺静脉口周围的左心房游离壁为明显的局部间质重构区域。以上研究从不同的角度确定了心房纤维化和房颤的正相关。
随着心房纤维化,纤维化胶原蛋白的积累导致心肌细胞间间隙扩大[10],肌束间的电学连接被破坏[11]。不良的组织耦联、不连续的传导和不一致的各向异性传导是房颤的电生理前提。
2 标测房颤患者左心房瘢痕
从电生理角度,心房纤维化通过分离心肌细胞耦联和降低传导速度,产生低幅、碎裂的心电图和不均一性传导,通过在窦性心律下进行电解剖标测,可以证实这些异常的电信号。因此,纤维化的区域可以通过三维标测转化为异常的电信号[12-13]。应用高密度标测技术的两个相似研究比较了不同房颤患者的电生理基质,发现随着房颤的进展,左心房平均电压逐渐降低、激动时间延长、低电压区(low voltage zone,LVZ)检出率更高以及复杂电位增加[12-13]。更重要的是,在Lin等[13]研究中,LVZ的定义为双极电压0.1~0.4 mV,移行区(transitional zone,TZ)为双极电压0.4~1.3 mV。13例无心血管危险因素接受左侧旁道导管消融的患者被认为左心房是正常的。在健康人群中,95%取样点的双极电压大于0.38 mV。因此,LVZ的上限Cutoff值定义为0.4 mV。窦性心律下的复杂电位定义为多波折≥3个正向或负向清晰的波峰,时限≥50 ms,认为是局部传导延迟。分析非持续性房颤患者左心房体部复杂电位的分布情况,其中95%的患者左心房复杂电位分布在双极电压<1.32 mV的区域。所以,定义双极电压在0.4~1.3 mV为TZ可以便于寻找这些异常电位。理论上讲,并不存在明确的分界线可以用来界定病变部位和非病变部位,因此,将LVZ定义为完全瘢痕即重度纤维化区域和将TZ定义为中度纤维化区域是较为合理的。
Verma等[14]首次进行了左心房瘢痕与导管消融结果之间关系的研究,电解剖标测发现6%房颤患者存在左心房瘢痕(双极电压<0.5 mV)。有左心房瘢痕的比无瘢痕的房颤患者,房颤复发率明显增高。应用延迟钆增强-磁共振成像(LGE-MRI)技术进行的影像学研究表明,LGE-MRI认为强化区域与组织活检发现纤维化负荷严重的区域之间有很强的相关性[15]。同样,应用LGE-MRI技术对三种不同临床类型房颤(阵发性房颤、持续性房颤和长程持续性房颤)进行心房组织基质研究,认为心房纤维化程度和持续性房颤之间只存在微弱的关系[16-17]。不同临床类型房颤患者的纤维化程度存在显著重叠,使得房颤临床类型不能准确预测心房纤维化程度。此外,所谓孤立性房颤患者,即没有其他心血管疾病的房颤与非孤立性房颤患者的心房纤维化负荷相同[18]。Mahnkopf等[18]报道,通过延迟增强MRI检测左心房强化增加与肺静脉电隔离后的房颤复发密切相关。近期DECAAF研究[19]表明消融前基线心房纤维化是心律失常复发的主要预测因素,使用MRI图像对纤维化程度进行分类,并对MRI图像质量和心房纤维化定量进行分析。基于延迟增强MRI检测,将心房纤维化程度分为4度:1度为小于10%;2度为10%及以上,但小于20%;3度为20%及以上,但小于30%;4度为30%及以上。纤维化程度为1度49例(18.9%),2度107例(41.2%),3度80例(30.8%),4度24例(9.2%)。该研究认为房颤的总成功率与消融策略术式无关,而取决于心房纤维化程度。Hwang等[20]研究表明通过LGE-MRI技术检测的左心房瘢痕区域与左心房电解剖标测的LVZ密切相关。Haissaguerre等[21]通过回顾分析临床标测技术联合影像和计算模型,得出结论认为房颤的驱动灶位于异质性结构/纤维化心房区域。另外,两项研究也描述了类似结果,通过将环状电极放在房颤患者的LVZ可记录到转子样激动[22-23]。
3 瘢痕均质化作为治疗房颤的消融策略
既然心房纤维化区域与房颤密切相关,以这些区域为导管消融靶点进行基质改良作为环肺静脉消融以外的一种新的策略。
3.1 基于双极电压标测的局部和线性消融
在Rolf等[24]研究中,纳入了178例阵发性或持续性房颤患者,把LVZ作为局部消融的靶点,其目的是通过射频消融使左心房病变的组织达到均质化。消融终点是局部电位显著下降、分离和应用消融导管高输出起搏时失夺获(电压10 V,脉宽2 ms)。当由于可能的附加损伤(例如:间隔部接近房室结或心房后壁接近食管)致消融基质不能达到均质化,或大范围消融可能产生形成大折返房速(接近心房顶部或前壁形成顶部依赖性房速或环二尖瓣环心房扑动)的关键峡部,需要合适的线性消融。这些线性消融点经过LVZ连接非传导组织与电解剖屏障,或者围绕大面积LVZ使病变组织与健康组织形成电隔离。通过局部电位幅度的下降,局部失夺获,线上双电位和在消融线附近部位起搏分析传导顺序,确定这些合适的消融点最终达到可证实的完全性阻滞(例如环二尖瓣环传导)。环肺静脉线性消融和(或)基质改良后,需要行冠状窦近端Burst刺激。如果诱导出规则的房速,需要射频消融终止房速并且以不能再次诱发为临床终点。如果诱导出房颤,将不再进一步基质改良。有LVZ的房颤患者12个月消融成功率为70%,没有LVZ的12个月消融成功率为62%。阵发性和持续性房颤患者成功率比较,差异无统计学意义(69% 比 61%,P=0.28)。同样的,针对阵发性房颤和非阵发性房颤患者的纤维化区域研究[25]进行BOX消融也可获得良好的效果。在环肺静脉消融之后,应用三维电解剖标测系统在窦性心律下完成的后壁电压标测并指导消融也能提高成功率[26]。瘢痕在左心房后壁定义为电压低于0.5 mV并且可重复的大于0.5 cm×0.5 cm的区域。左心房后壁一旦发现有低电压,更倾向于完成顶部线和底部线形成后壁BOX消融。重要的是,BOX的边框旨在包含LVZ。电压指导下的消融相比于传统消融,房颤/房速1年成功率明显增加(80%比57%,P=0.005)。另一项研究阵发性房颤合并经三维标测证实左心房有严重瘢痕的患者分别经三种消融策略(单纯肺静脉前庭电隔离、肺静脉前庭电隔离+瘢痕均质化或肺静脉前庭电隔离+非肺静脉触发灶消融)并对复发患者进行二次手术后,长期随访总成功率肺静脉前庭电隔离加瘢痕均质化(28/45,62%)和单纯肺静脉前庭电隔离(41/66,62%)均劣于肺静脉前庭电隔离加非肺静脉触发灶消融(56/66,85%)[27]。
3.2 基于通过窦性心律下标测到的不正常电位进行基质消融
环肺静脉电隔离后,根据窦性心律下的电压标测,进行电生理指导下选择性基质改良和三尖瓣峡部线性消融[28]。研究入选86例持续性和长程持续性房颤患者,通过电复律恢复窦性心律,在左心房进行高密度双极电压标测出LVZ(0.1~0.4 mV)和TZ(0.4~1.3 mV)。对所有LVZ电位进行消融并使双极电位小于0.1 mV。如果在TZ中标测到窦性心律下异常电位,则进行针对异常电位的消融以实现电静止或异常电位的消除。额外的消融线用来阻断隔离线或解剖屏障至LVZ形成折返的通路(图1和图2)。在转复成窦性心律的患者中,70% (55/79)有LVZ和TZ合并窦性心律下异常电位并且接受了额外的消融,而30% (24/79)没有LVZ以及异常电位的基质,无需进一步消融。78例患者接受传统的Stepwise消融策略作为对照组。经过大于30个月的随访,结果提示窦性心律维持率为69.8%比51.3%。单次手术后研究组有3.5%患者发生手术相关房速,而对照组有30%发生手术相关房速(P=0.0003)。该策略提出了一种更全面的基质改良方法,不仅针对重度纤维化区域,而且针对中度纤维化区域。这种方法类似于常规病理性室性心动过速消融,并且应该是治疗性(房颤)和预防性(房速)策略的组合。
3.3 基于通过房颤下标测到的电位特征进行消融
一项研究在完成肺静脉电隔离后,在房颤过程中针对LVZ内或边缘具有明显不同激动特征的部位进行了消融[29]。对持续性房颤患者,这种消融策略似乎比传统单纯肺静脉电隔离更有效。手术终点是房颤终止和靶点区域电位电压<0.5 mV、电活动>房颤周长的70%,在研究中,在窦性心律下通过冠状窦远端和中段行心房Burst刺激,刺激周长250~180 ms。如果在180 ms以上反复的心房Burst刺激不能诱导出持续时间>6 s的房颤,认为该患者不能诱发出房颤,可行窦性心律下或冠状窦起搏(周长800 ms)节律下电压标测。LVZ定义为双极电压<1.0 mV。对于自发或诱发的房颤患者,首先进行左心房和冠状窦标测,只有当左心房消融不成功时为了缩短手术时间和减少患者的射线暴露剂量,进行右心房标测。对具有上面提到的电位特征的每个低电压位点进行射频消融20~40 s。平均随访13个月,结果提示单次手术后69%(59/85)的患者无心律失常发生,显著高于对照组47%(31/66),差异有统计学意义P<0.001[29]。Yagishita等[30]研究使用了相同的房颤节律下LVZ定义,在肺静脉电隔离术后行LVZ改良,共入选201例患者,超过80%为非阵发性房颤。对标测到的大范围LVZ内及周边进行了改良,隔离LVZ,然后将最近的消融线连接至二尖瓣环。峡部<15 mm需要进行消融,除非局部电压>0.5 mV,侧壁峡部例外,除非含有显著LVZ。研究者发现随访12个月,1次手术后有144例(72%)患者无房颤复发,多次手术后平均随访3.1年发现有148例 (74%)患者无心律失常复发。
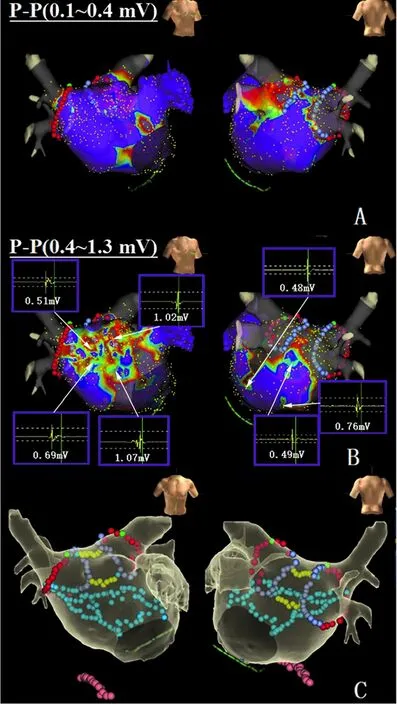
图1 1例房颤患者行PVI消融、三尖瓣峡部消融及电复律恢复窦性心律后,高密度标测的左心房基质 A.定义LVZ为0.1~0.4 mV;B.TZ (0.4~1.3 mV) 合并有复杂电位;C.显示相关的消融点。本例患者做了LVZ均质化,消除TZ复杂电位,前壁线,前壁及后壁瘢痕区域BOX消融。
4 争论
随着瘢痕均质化作为房颤治疗附加基质改良策略的进展,仍有几点问题不清楚。4.1 LVZ的定义
(1)标测区域不同。Kapa等[31]建议双极电压Cutoff值为0.27 mV可将健康和不健康的左心房心肌在动态增强MRI上明显区别开来,该值非常接近由EAM界定左心房-肺静脉连接处和左心房后壁中瘢痕的Cutoff值的下限0.2 mV。然而在左心房其他区域,电压Cutoff值0.45 mV可以更好地区分健康与瘢痕性心肌。因此,他们提出了范围从0.2~0.45 mV的Cutoff值,而不是单个Cutoff值,这样可以在考虑左心房双极电压分布中的区域异质性时更好地区分左心房瘢痕。但是,只有一个值用于指导LVZ消融。(2)标测电极的极间距不同。大部分上面提到的研究使用双极电压0.5 mV来定义瘢痕,然而环状标测电极与消融导管的极间距显著不同。(3)标测时心脏节律不同。大部分瘢痕的定义基于窦性心律下采集的电信号,但是在其他研究中是在房颤节律或冠状窦起搏节律下进行标测并定义瘢痕。虽然电压在窦性心律与房颤之间存在线性相关性,在电解剖标测时通过调整电压Cutoff值可以识别出类似程度的左心房纤维化基质[32],但不同节律之间的匹配值尚未定义。
4.2 瘢痕均质化的方法学
(1)瘢痕均质化、瘢痕隔离、基于瘢痕的线性消融和消除瘢痕之间通道的消融是近来研究最常应用的基质改良策略。(2)纤维化基质是不均一的,不能仅仅定义为健康(正常)或不健康(瘢痕)。(3)右心房瘢痕标测与消融是否可进一步提高成功率仍然不清楚。
房颤患者的影像学研究和电解剖标测研究可以更详细了解维持房颤的左心房基质。这也引出纤维化指导下的基质改良概念,这种策略很有前景,虽然目前缺乏大样本研究和长期随访结果的有力证据。未来,三维标测系统、高密度高分辨率的标测工作将有助于使瘢痕均质化更准确。
[1] Schoonderwoerd BA, Van Gelder IC, Van Veldhuisen DJ, et al. Electrical and structural remodeling: role in the genesis and maintenance of atrial fibrillation. Prog Cardiovasc Dis,2005,48(3):153-168.
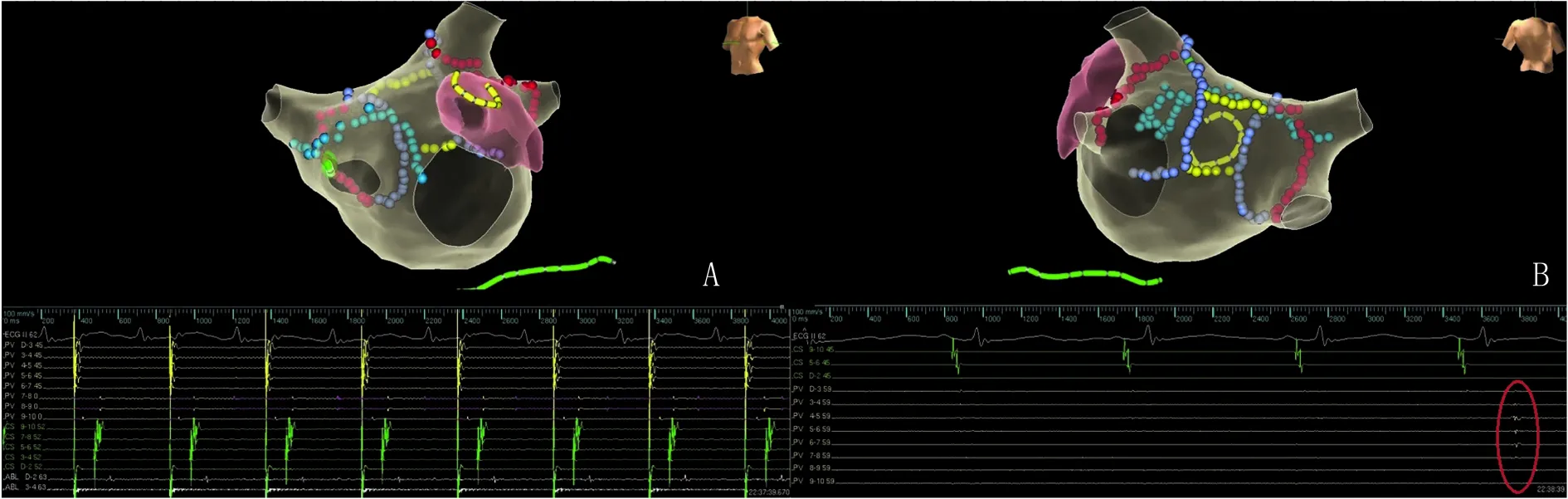
图2 1例房颤患者行PVI、前壁线、后壁BOX消融,验证消融线及被隔离区域 A.将可调弯消融导管置于前壁线下方,环肺标测电极置于左心耳,起搏左心耳,左房激动顺序从左心耳开始,经过CS12到CS90,再到消融导管头端,表明前壁线阻断。描计图依次是体表心电图(Ⅱ),环肺标测电极,腔内冠状窦电极(由近至远)和消融导管;B.将环肺标测电极置于后壁BOX区域内,可记录到自律性电位,与左心房电位无关。描计图依次是体表心电图(Ⅱ),腔内冠状窦电极(由近至远)和环肺标测电极。
[2] Hoit BD, Shao Y, Gabel M. Left atrial systolic and diastolic function accompanying chronic rapid pacing-induced atrial failure. Am J Physiol,1998,275(1 Pt 2):H183-H189.
[3] Frustaci A, Chimenti C, Bellocci F, et al. Histological substrate of atrial biopsies in patients with lone atrial fibrillation. Circulation,1997,96(4):1180-1184.
[4] Frustaci A, Cameli S, Zeppilli P. Biopsy evidence of atrial myocarditis in an athlete developing transient sinoatrial disease. Chest,1995,108(5):1460-1462.
[5] Mihm MJ, Yu F, Carnes CA, et al. Impaired myofibrillar energetics and oxidative injury during human atrial fibrillation. Circulation,2001,104(2):174-180.
[6] Liu T, Li G, Li L, et al. Association between C-reactive protein and recurrence of atrial fibrillation after successful electrical cardioversion: a meta-analysis. J Am Coll Cardiol,2007,49(15): 1642-1648.
[7] Boldt A, Wetzel U, Lauschke J, et al. Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart,2004,90(4):400-405.
[8] Kainuma S, Masai T, Yoshitatsu M, et al. Advanced left-atrial fibrosis is associated with unsuccessful maze operation for valvular atrial fibrillation. Eur J Cardiothorac Surg,2011,40(1):61-69.
[9] Corradi D, Callegari S, Benussi S,et al. Regional left atrial interstitial remodeling in patients with chronic atrial fibrillation undergoing mitral-valve surgery. Virchows Arch,2004,445(5):498-505.
[10] Assayag P, Carré F, Chevalier B, et al. Compensated cardiac hypertrophy: arrhythmogenicity and the new myocardial phenotype. I. Fibrosis. Cardiovasc Res,1997,34(3):439-444.
[11] Kawara T, Derksen R, de Groot JR, et al. Activation delay after premature stimulation in chronically diseased human myocardium relates to the architecture of interstitial fibrosis. Circulation,2001,104(25):3069-3075.
[12] Teh AW, Kistler PM, Lee G, et al. Electroanatomic remodeling of the left atrium in paroxysmal and persistent atrial fibrillation patients without structural heart disease. J Cardiovasc Electrophysiol,2012,23(3):232-238.
[13] Lin Y, Yang B, Garcia FC, et al. Comparison of left atrial electrophysiologic abnormalities during sinus rhythm in patients with different type of atrial fibrillation. J Interv Card Electrophysiol,2014,39(1):57-67.
[14] Verma A, Wazni OM, Marrouche NF, et al. Pre-existent left atrial scarring in patients undergoing pulmonary vein antrum isolation: an independent predictor of procedural failure. J Am Coll Cardiol,2005,45(2):285-292.
[15] McGann CJ, Silva F, Patel A, et al.Left Atrial Structural Remodeling on LGE MRI Correlates with Histology. J Am Coll Cardiol. 2012,59(13): E1235.
[16] Akoum N, Daccarett M, McGann C, et al. Atrial fibrosis helps select the appropriate patient and strategy in catheter ablation of atrial fibrillation: a DE-MRI guided approach. J Cardiovasc Electrophysiol,2011,22(1):16-22.
[17] McGann C, Akoum N, Patel A, et al. Atrial fibrillation ablation outcome is predicted by left atrial remodeling on MRI. Circ Arrhythm Electrophysiol,2014,7(1):23-30.
[18] Mahnkopf C, Badger TJ, Burgon NS, et al. Evaluation of the left atrial substrate in patients with lone atrial fibrillation using delayed-enhanced MRI: implications for disease progression and response to catheter ablation. Heart Rhythm,2010,7(10):1475-1481.
[19] Marrouche NF, Wilber D, Hindricks G, et al. Association of atrial tissue fibrosis identified by delayed enhancement MRI and atrial fibrillation catheter ablation The DECAAF Study. JAMA,2014,311(5):498-506.
[20] Hwang SH, Oh YW, Lee DI, et al. Evaluation of quantification methods for left arial late gadolinium enhancement based on different references in patients with atrial fibrillation. Int J Cardiovasc Imaging,2015,31(Suppl 1):91-101.
[21] Haissaguerre M, Shah AJ, Cochet H, et al. Intermittent drivers anchoring to structural heterogeneities as a major pathophysiological mechanism of human persistent atrial fibrillation. J Physiol, 2016,594(9):2387-2398.
[22] Yang G, Yang B, Wei Y, et al. Catheter ablation of nonparoxysmal atrial fibrillation using electrophysiologically guided substrate modification during sinus rhythm after pulmonary vein isolation. Circ Arrhythm Electrophysiol,2016,9(2):e003382.
[23] Jadidi AS, Lehrmann H, Keyl C, et al. Ablation of Persistent Atrial Fibrillation Targeting Low-Voltage Areas With Selective Activation Characteristics. Circ Arrhythm Electrophysiol,2016,9(3). pii: e002962.
[24] Rolf S, Kircher S, Arya A, et al. Tailored atrial substrate modification based on low-voltage areas in catheter ablation of atrial fibrillation. Circ Arrhythm Electrophysiol,2014,7(5):825-833.
[25] Kottkamp H, Berg J, Bender R, et al. Box Isolation of Fibrotic Areas (BIFA): A Patient-Tailored Substrate Modification Approach for Ablation of Atrial Fibrillation. J Cardiovasc Electrophysiol, 2016,27(1):22-30.
[26] Cutler MJ, Johnson J, Abozguia K, et al. Impact of Voltage Mapping to Guide Whether to Perform Ablation of the Posterior Wall in Patients With Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol,2016,7(1):13-21.
[27] Mohanty S, Mohanty P, Di Biase L, et al. Long-term follow-up of patients with paroxysmal atrial fibrillation and severe left atrial scarring: comparison between pulmonary vein antrum isolation only or pulmonary vein isolation combined with either scar homogenization or trigger ablation. Europace,2016,[Epub ahead of print].
[28] Yamaguchi T, Tsuchiya T, Nakahara S, et al. Efficacy of Left Atrial Voltage-Based Catheter Ablation of Persistent Atrial Fibrillation. J Cardiovasc Electrophysiol,2016,27(9):1055-1063.
[29] Jadidi AS, Lehrmann H, Keyl C, et al. Ablation of persistent atrial fibrillation targeting low-voltage areas with selective activation characteristics. Circ Arrhythm Electrophysiol, 2016,9(3): e002962.
[30] Yagishita A, Gimbel JR, DE Oliveira S, et al. Long-term outcome of left atrial voltage-guided substrate ablation during atrial fibrillation: A novel adjunctive ablation strategy. J Cardiovasc Electrophysiol,2017,28(2):147-155.
[31] Kapa S, Desjardins B, Callans DJ, et al. Contact electroanatomic mapping derived voltage criteria for characterizing left atrial scar in patients undergoing ablation for atrial fibrillation. J Cardiovasc Electrophysiol,2014,25(10):1044-1052.
[32] Yagishita A, DE Oliveira S, Cakulev I, et al. Correlation of left atrial voltage distribution between sinus rhythm and atrial fibrillation: Identifying structural remodeling by 3-D electroanatomic mapping irrespective of the rhythm. J Cardiovasc Electrophysiol,2016,27(8):905-912.
10.3969/j.issn.1004-8812.2017.07.009
210029 江苏南京,南京医科大学第一附属医院
陈明龙,Email: chenminglong@njmu.edu.cn
R541.75
2017-05-10)
