大肠癌组织中Galectin-3与MMP-2的表达及临床意义
2017-08-09季伟涛王晓磊展鹏远
季伟涛 王晓磊 展鹏远
大肠癌组织中Galectin-3与MMP-2的表达及临床意义
季伟涛 王晓磊 展鹏远
目的探讨大肠癌组织中Galectin-3与MMP-2的表达水平及临床意义。方法收集60例结肠癌组织标本及28例癌旁正常肠黏膜组织标本,同时收集大肠腺瘤标本31例。采用免疫组化(SP)法测定标本中的Galectin-3、MMP-2的表达水平,分析两组的相关性。结果大肠癌、大肠腺瘤中的Galectin-3、MMP-2阳性表达水平明显高于正常大肠黏膜(P<0.05),大肠癌组织Galectin-3、MMP-2阳性表达水平明显高于大肠腺瘤(P<0.05)。低分化、有淋巴结转移、浸润程度达肌层或浆膜层的大肠癌组织表达水平明显高于中高分化、无淋巴结转移、浸润未超肌层者(P<0.05)。两者呈正相关。结论大肠癌组织中存在MMP-2、Galectin-3表达升高,两者高表达与大肠癌的浸润、转移、分化有关,故MMP-2、Galectin-3的测定可能为判断大肠癌的进展有一定的临床意义。
大肠癌;Galectin-3;MMP-2
大肠癌是目前常见的一种恶性肿瘤。浸润和转移是其重要特性之一,也是某些实体肿瘤不能治愈的原因。基质金属蛋白酶(MMP-2)对细胞外基质有降解作用,这一作用利于肿瘤血管的形成,因此其参与了肿瘤的浸润和转移过程[1-2]。β-半乳糖苷结合蛋白-3(Galectins-3)属凝集素家族的重要成员之一,它可作为MMP-2的底物,故被认为在肿瘤浸润和转移中同样发挥着重要作用[3]。本研究通过对大肠癌组织中的Galectin-3和MMP-2表达水平进行测定,探讨两者在大肠癌发生和进展中的作用。
1 材料和方法
1.1 材料收集2015-01—2016-11在河南大学第一附属医院外科行手术切除术治疗的患者60例,均经手术病理确诊。共收集60例大肠癌标本及癌旁正常黏膜组织28例作为对照,同时选择同期行外科手术切除的大肠腺瘤标本31例。排除标准:术前行放化疗治疗者;其他部位的恶性肿瘤者;伴有免疫性疾病者。60例患者中男31例,女29例,年龄30~74岁,中位年龄54.8岁;原发病灶部位:结肠23例,直肠37例;分化程度:低分化16例,中高分化44例;浸润程度:达肌层或浆膜层43例,未超肌层17例;伴有淋巴结及远处转移34例。
1.2 方法采用免疫组化(SP)法测定标本中的Galectin-3、MMP-2的表达水平,兔抗人Galectin-3多克隆抗体、兔抗人MMP-2多克隆抗体均由上海领成生物技术有限公司提供;免疫组化MaxVision试剂盒羊抗鼠/兔由上海将来实业股份有限公司提供。取3μm石蜡切片,脱蜡至水,以3%过氧化氢室温孵育10 min,消除内源性过氧化物酶活性,蒸馏水冲洗,磷酸缓冲盐溶液(PBS)浸泡5 min,微波炉加热柠檬酸钠缓冲液(0.01 mmol/L)至沸腾后,取标本切片置入其中,抗原热修复15 min,室温下静置4 min,磷酸缓冲盐溶液冲洗5 min,共冲洗3次。滴加Ⅰ抗50μL(Galectin-3 1∶80工作液,MMP-2 1∶80工作液),置于4℃冰箱过夜。磷酸缓冲盐溶液冲洗5 min,共冲洗3次。滴加Ⅱ抗(快捷型酶标羊抗鼠、兔IgG聚合物),室温孵育15 min。磷酸缓冲盐溶液冲洗5 min,共冲洗3次。DAB显色5 min,终止显色,蒸馏水冲洗。苏木素复染,透明、封片,于高倍镜下观察。
1.3 SP结果评定Galectin-3、MMP-2蛋白主要表达于胞质,胞质内可观察到棕黄色或棕褐色颗粒,可判断为阳性细胞。以染色强度和阳性细胞所占百分比来评定。在400倍视野下,每张切片上任选4个视野进行观察,根据切片中平均阳性比及染色程度进行计分,最低0分,最高3分。无着色为0分,淡黄色为1分,黄或深黄色为2分,褐或棕褐色为3分;无阳性细胞0分,阳性细胞比低于25%为1分,25%~75%之间为2分,超75%为3分。将两项积分相加后总分进行分级,0分为阴性(-),1~2分为弱阳性(+),3~4分为(++),5~6分为(+++)。
1.4 统计学方法采用SPSS 21.0统计学软件进行数据分析,采用秩和检验和Spearman等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 大肠癌、大肠腺瘤、正常大肠黏膜中的Galectin-3、MMP-2表达情况(表1)大肠癌、大肠腺瘤中的Galectin-3、MMP-2阳性表达水平明显高于正常大肠黏膜(P<0.05),大肠癌组织Galectin-3、MMP-2阳性表达水平明显高于大肠腺瘤(P<0.05)。
2.2 不同临床特征结肠癌组织的Galectin-3、MMP-2阳性表达水平情况(表2~3)Galectin-3、MMP-2阳性表达水平在性别、年龄、肿瘤位置上差异无统计学意义(P>0.05),低分化、有淋巴结转移、浸润程度达肌层或浆膜层的大肠癌组织表达水平明显高于中高分化、无淋巴结转移、浸润未超肌层者(P<0.05)。
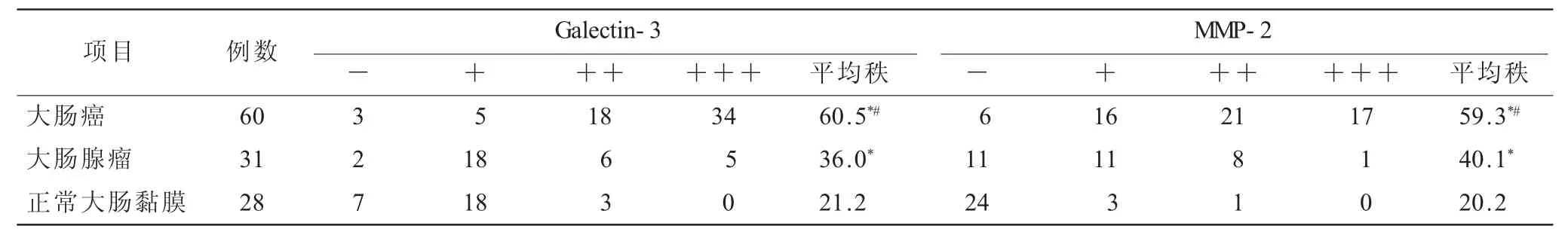
表1 大肠癌、大肠腺瘤、正常大肠黏膜中的Ga lectin-3、MMP-2表达情况(n)
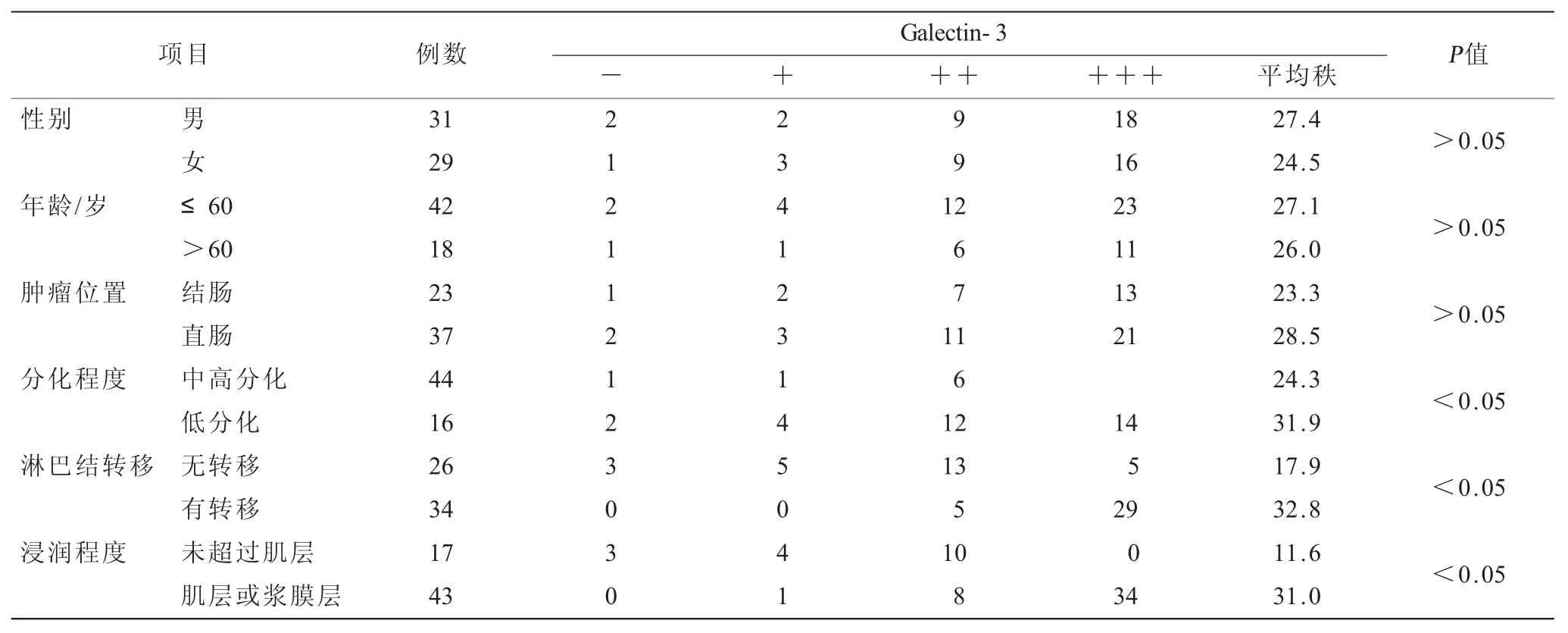
表2 不同临床特征结肠癌组织的Galectin-3阳性表达水平情况(n)
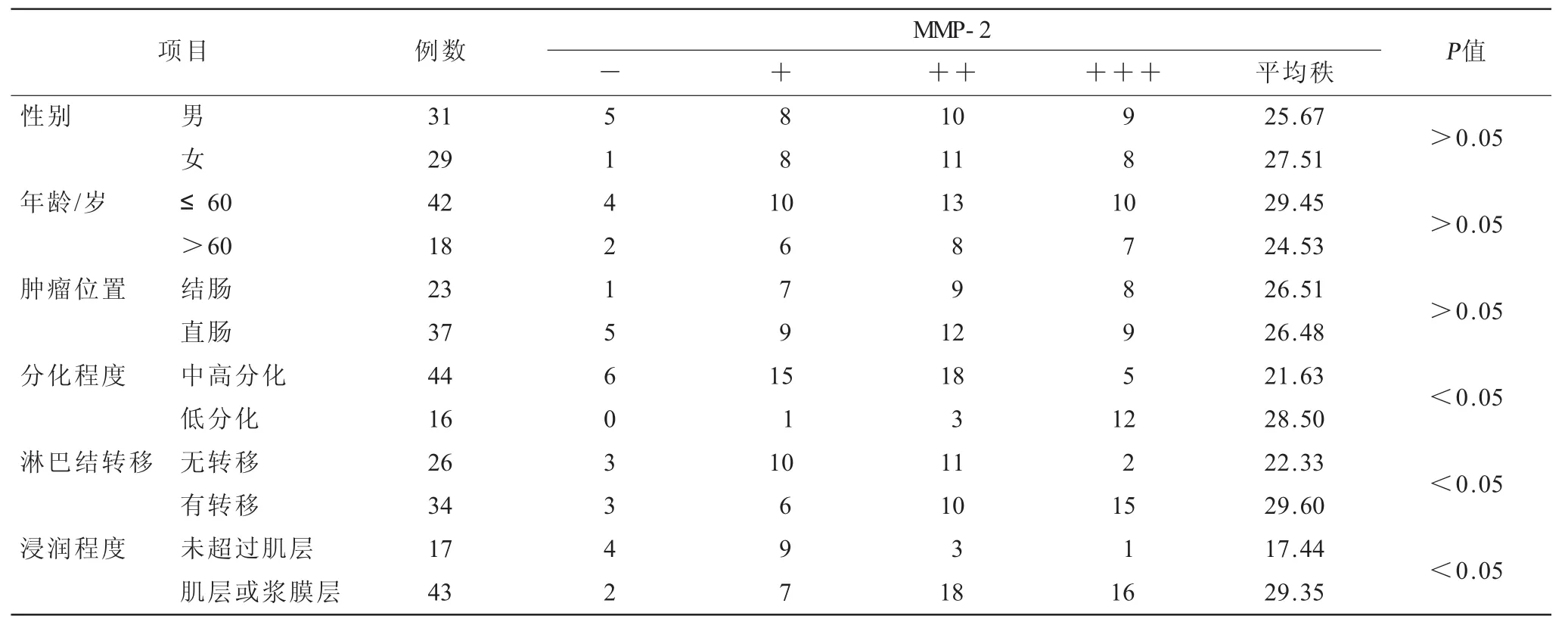
表3 不同临床特征结肠癌组织的MMP-2阳性表达水平情况(n)
2.3 大肠癌组织中Galectin-3、MMP-2表达的关系Pearman等级相关分析显示,大肠癌组织中Galectin-3表达与MMP-2表达呈正相关(r=0.723,P=0.001,表4)。

表4 大肠癌组织中Galectin-3、MMP-2表达的关系(n)
3 讨论
浸润和转移是导致恶性肿瘤患者死亡的主要原因。肿瘤组织及其间质基底膜可防御肿瘤细胞浸润和扩散,基底膜的完整性被破坏为恶性肿瘤侵袭创造了条件[4]。正常情况下,基底膜主要成分为Ⅳ型胶原,而MMP-2是MMPs家族的重要成员,可通过降解Ⅳ、Ⅴ型胶原和层黏连蛋白来破坏基底膜的完整性[5]。武雪亮等[6]研究证实,MMP-2可引起患者免疫反应,促进肿瘤血管形成,为肿瘤的转移提供了条件,故MMP-2参与了恶性肿瘤的侵袭和转移过程。有研究表明,MMP-2的表达水平与肺癌、乳腺癌等恶性肿瘤远处转移、分化程度、组织学分型等密切相关[7-8],本研究结果与之相符,提示MMP-2的高表达在大肠癌的发生和进展中起着重要作用,且与癌细胞的浸润和转移呈正相关。
Galectin-3作为MMP-2的底物,现有研究表明,Galectin-3可能参与了肿瘤的浸润和转移,另外Galectin-3具有糖亲和性、参与炎症细胞的游走及延缓细胞凋亡等作用[9-10],故肿瘤组织中Galectin-3高表达可促进细胞聚集和提高内皮细胞的亲和性,这为肿瘤转移提供了可能。
本研究结果显示,大肠癌组织中Galectin-3表达明显高于正常大肠黏膜和大肠腺瘤,且与肿瘤的分化程度、浸润深度、是否转移有关,其表达水平与MMP-2呈正相关,说明随着大肠癌病情的进展,Galectin-3随之增强,进而影响大肠癌侵袭能力,促进了肿瘤的分化和淋巴结转移,使患者的预后不良。
综上所述,大肠癌组织中存在MMP-2、Galectin-3表达升高,两者高表达与大肠癌的浸润、转移、分化有关,故MMP-2、Galectin-3的测定可能为判断大肠癌的进展有一定的临床意义。
[1]秦惠萍.血清VEGF和MMP-2检测在结直肠癌诊断中的临床意义[J].检验医学,2016,31(11):79-80.
[2]乌日尼勒图,德力格尔图,刘.COX-2和MMP-2在结直肠癌浸润转移中的表达及意义[J].内蒙古医科大学学报,2015,84(3):201-202.
[3]王一凤,邓莅霏,廖兵.Galectin-3、Cytokeratin-19在甲状腺良、恶性肿瘤中的表达[J].实用癌症杂志,2015,21(4):106-107.
[4]曹庆生,杨宝友,李志超.HGF、MMP-2和VEGF在结直肠癌中的表达[J].贵阳医学院学报,2014,39(6):601-603.
[5]刘永源,何瑜.结直肠癌患者血清Ang-2和MMP-2水平的变化及临床意义[J].中国现代医药杂志,2014,81(7):98-99.
[6]武雪亮,王立坤,薛军.Id-1和MMP-2表达与结直肠癌临床病理特征及预后的关系[J].山东医药,2016,41(34):92-93.
[7]张瑜红,谭至柔,黄雪,等.基质金属蛋白酶-2及组织抑制因子在结肠腺瘤癌变过程中的表达及意义[J].微创医学,2015,75(2):20-22.
[8]单铁英,单铁强,岳峰,等.直肠癌组织中Id-2和MMP-9的表达与临床病理学指标的关系[J].重庆医学,2015,68(31):4392-4395.
[9]徐美容,王先进,张书莲,等.Galectin-3和VEGF在宫颈病变组织中的表达及意义[J].南昌大学学报:医学版,2014,38(3):481-482.
[10]薛刚,刘军超,黄静,等.血清与组织glactin-3联合检测在甲状腺癌早期诊断中的价值[J].南方医科大学学报,2013,33(7):1027-1030.
2017-03-13)
1005-619X(2017)08-0852-03
10.13517/j.cnki.ccm.2017.08.030
475001河南大学第一附属医院外科
