HER-2阳性乳腺癌术后辅助治疗的临床疗效和预后分析
2017-08-07彭玉珍
何 杨,彭玉珍,方 芳
(皖南医学院第一附属医院 弋矶山医院 1.肿瘤内科;2.甲乳外科,安徽 芜湖 241001)
HER-2阳性乳腺癌术后辅助治疗的临床疗效和预后分析
何 杨1,彭玉珍1,方 芳2
(皖南医学院第一附属医院 弋矶山医院 1.肿瘤内科;2.甲乳外科,安徽 芜湖 241001)
目的:分析46例HER-2阳性乳腺癌患者术后辅助治疗的临床疗效,探讨影响无病生存期(DFS)的预后因素。方法:随访2011年10月~2016年2月HER-2阳性乳腺癌术后行辅助治疗的患者46例,按是否联合曲妥珠单抗治疗分为观察组和对照组,观察组(EC-TH组)21例,对照组(EC-T组)25例。无病生存期DFS及单因素预后分析采用Kaplan-Meier法,Log-rank法对比进行显著性检验;多因素预后分析采用COX回归分析;不良反应采用秩和检验。结果:①与EC-T组相比,EC-TH组的DFS显著延长(χ2=4.827,P=0.028)。②单因素分析发现,雌孕激素受体状态、区域淋巴结转移情况、术后病理TNM分期及不同分组治疗方案是本研究中HER-2阳性乳腺癌DFS的影响因素(P<0.05)。COX多因素回归分析进一步得出:区域淋巴结转移情况、术后病理TNM分期及不同分组给予的治疗方案是HER-2阳性乳腺癌DFS的预后独立影响因素(P<0.05)。③两组不良反应差异无统计学意义(P>0.05)。结论:术后辅助化疗联合曲妥珠单抗治疗HER-2阳性乳腺癌可有效提高无病生存期,不良反应可耐受。区域淋巴结无转移、术后病理TNM分期较早及联合曲妥珠单抗治疗的HER-2阳性乳腺癌患者DFS较长。
HER-2阳性乳腺癌;辅助治疗;临床疗效;预后
HER-2的表达状况与乳腺癌患者的预后密切相关,HER-2阳性提示肿瘤具有高度侵袭性[1]。现有研究证实,以曲妥珠单抗(herceptin,治疗方案中简称H)为代表的HER-2靶向药物应用可显著降低复发转移和死亡风险[2-3]。本文回顾性总结了我院2011年10月~2016年2月HER-2阳性乳腺癌辅助治疗的临床应用情况。
1 资料与方法
1.1 一般资料 回顾性筛选2011年10月~2016年2月我院收治的乳腺癌患者46例,均为女性,年龄35~70岁,中位年龄49岁。入选标准∶①原发病灶均行规范外科手术治疗;②病理诊断明确;③HER-2阳性(诊断标准为HER-2免疫组化检测或FISH检测HER-2阳性);④ECOG评分≤1;⑤相关检查排除远处转移;⑥化疗前检查血常规、肝肾功能及心电图无明显异常,心脏彩超左室射血分数(LVEF)≥50%;⑦治疗前未接受过靶向治疗及化放疗;⑧已签署治疗知情同意书。两组患者的临床资料比较无统计学意义(P>0.05,表1)。
表1 两组患者临床资料比较
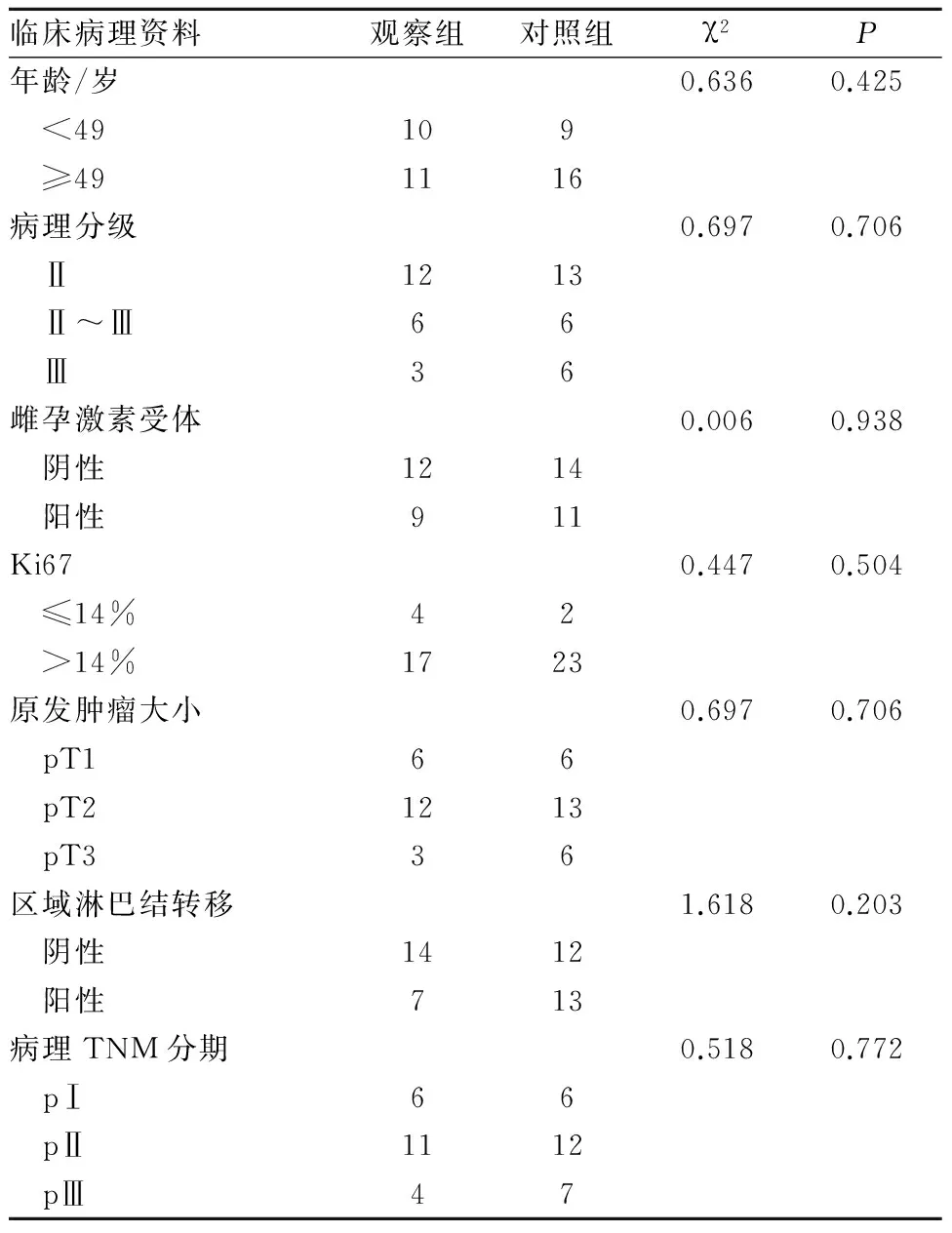
临床病理资料观察组对照组χ2P年龄/岁0.6360.425 <49109 ≥491116病理分级0.6970.706 Ⅱ1213 Ⅱ~Ⅲ66 Ⅲ36雌孕激素受体0.0060.938 阴性1214 阳性911Ki670.4470.504 ≤14%42 >14%1723原发肿瘤大小0.6970.706 pT166 pT21213 pT336区域淋巴结转移1.6180.203 阴性1412 阳性713病理TNM分期0.5180.772 pⅠ66 pⅡ1112 pⅢ47
1.2 治疗方法 对照组25例,予以EC-T方案治疗(表柔比星60 mg/m2静脉滴注,d1;环磷酰胺600 mg/m2静脉滴注,d1,每3周重复1次,4周期;后序贯予以多西他赛75 mg/m2静脉滴注,d1,每3周重复1次,4周期;共8周期)。观察组21例,予以EC-TH方案治疗(同对照组化疗方案,多西他赛化疗同时予曲妥珠单抗静滴,首剂8 mg/kg,之后维持剂量6 mg/kg,每3周重复1次,H治疗时间共1年)。上述两组在使用多西他赛及曲妥珠单抗前常规予以抗过敏处理。观察组在EC 4周期化疗结束后、T每2周期化疗后、H维持治疗期间每3个月复查血常规、肝肾功能、肿瘤标记、胸片、乳腺及腋下淋巴结B超、腹盆腔B超等);基线、3个月、6个月和9个月时行心脏彩超监测心功能,如出现LVEF<50%或较治疗前数值下降≥16%,则暂停治疗,跟踪检测LVEF,数值恢复≥50%方可继续用药。对照组在EC 4周期化疗结束后、T每2周期化疗后复查(内容同上)。
1.3 评价标准 不良反应按照NCI-CTC 2.0标准分为0~4级。
1.4 随访 随访时间从手术后第1天开始,随访内容包括上述复查内容,截止到2016年12月31日。无病生存期(disease-free survival,DFS)定义为初次治疗到第1次复发,包括局部复发和(或)远处转移或因任何原因死亡之间的时间。
1.5 统计分析 用SPSS 16.0软件作统计分析,临床资料采用卡方检验及Fisher确切概率法;无病生存期DFS及单因素预后分析采用Kaplan-Meier法计算,Log-rank法对比进行显著性检验;多因素预后分析采用COX回归分析;不良反应采用秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 无病生存分析 本研究共纳入46例患者,截止随访时间2016年12月31日,中位随访时间30.5个月(14~64个月);无复发转移病例列为截尾病例,无失访病例。观察组(EC-TH组)中位随访时间31个月(22~64个月),有1例出现复发转移(5%);对照组(EC-T组)中位随访时间29个月(14~46个月),有5例出现复发转移(20%)。两组生存资料经Log-rank法进行显著性检验,结果提示与EC-T组相比,EC-TH组的DFS显著延长(χ2=4.827,P=0.028,图1)。

图1 两组无病生存期(DFS)曲线比较
2.2 预后相关的单因素分析 影响因素赋值如下:①病理分级Ⅱ为0,Ⅱ~Ⅲ为1,Ⅲ为2;②雌孕激素受体阴性为0,阳性为1;③Ki67表达≤14%为0,>14%为1;④原发肿瘤大小pT1为0,pT2为1,pT3为2;⑤区域淋巴结转移阴性为0,阳性为1;⑥TNM分期pⅠ为0,pⅡ为1,pⅢ为2;⑦分组EC-TH组为0,EC-T组为1;⑧截尾为0,复发为1。
采用Kaplan-Meier法分析后发现,雌孕激素受体状态(χ2=4.467,P=0.035)、区域淋巴结转移情况(χ2=5.633,P=0.018)、术后病理TNM分期(χ2=5.631,P=0.038)及不同分组治疗方案(χ2=4.827,P=0.028)是本研究中HER-2阳性乳腺癌DFS的影响因素。
2.3 预后相关的多因素分析 影响因素赋值同上。采用COX多因素回归模型分析进一步得出:区域淋巴结转移情况、术后病理TNM分期及不同分组治疗方案是HER-2阳性乳腺癌DFS的独立影响因素(P<0.05,表2)。
2.4 不良反应对比 两组患者治疗相关不良反应多表现为骨髓抑制,以白细胞减少为著,予以粒细胞集落刺激因子治疗后基本可恢复正常值。恶心呕吐及肌肉关节痛多表现为Ⅰ~Ⅱ,无需特殊处理。脱发发生率高,且多为Ⅲ~Ⅳ(P>0.05,表3)。上述不良反应均未导致相关性死亡,患者均可耐受。
表2 HER-2阳性乳腺癌DFS的COX多因素分析

影响因素βSEWaldχ2PHR95%可信区间最低值最高值区域淋巴结转移1.8270.8454.6750.0316.2131.18632.538术后病理TNM分期2.4621.2034.1890.04111.7291.110123.940分组治疗方案2.2561.0864.3150.0389.5421.13680.158雌孕激素受体-0.092 0.7700.0140.9050.9120.2024.129
表3 两组不良反应比较

不良反应观察组对照组0Ⅰ~ⅡⅢ~Ⅳ0Ⅰ~ⅡⅢ~ⅣZP白细胞减少39931210-0.0730.942血红蛋白减低81217162-0.7820.434血小板减少81128161-0.1400.889恶心呕吐1011012130-0.0250.980心脏毒性19202410-0.7480.455肌肉关节痛15601870-0.0420.966脱发23162419-0.2270.821
3 讨论
HER-2是表皮生长因子受体家族的成员之一,其异常激活后会导致肿瘤复发转移[4-5]。在原发性乳腺癌患者中,约有20%~30%表现出HER-2过表达或者基因扩增[6]。已有研究证实,HER-2的表达情况是乳腺癌患者重要的预后指标,也是抗HER-2分子靶向药物疗效的预测指标。
曲妥珠单抗(赫赛汀)是第一个抗HER-2的人源化单克隆抗体,相关研究及临床报道集中于曲妥珠单抗治疗晚期乳腺癌方面。而国内外乳腺癌治疗指南均推荐曲妥珠单抗作为HER-2阳性乳腺癌辅助治疗的标准方案[7],相关研究报道[8]曲妥珠单抗用于HER-2阳性乳腺癌的术后辅助治疗,可以明显提高早期乳腺癌治愈机会,并有效降低患者复发和死亡风险。其中Slamond等[9]的B-31/NSABP-9831研究提示蒽环类、环磷酰胺序贯紫杉醇类药物化疗联合曲妥珠单抗靶向药物辅助治疗早期乳腺癌效果优于该化疗方案单纯应用不联合曲妥珠单抗。Jones等[10]的BCIRG006研究证实了多西他赛、卡铂联合曲妥珠单抗可以作为对心脏安全要求更高患者的另一个选择。
本研究回顾性纳入46例HER-2阳性术后乳腺癌患者,均符合2016中国抗癌协会制定的乳腺癌诊治指南与规范指南关于术后辅助化疗及曲妥珠单抗辅助治疗原则[7],按是否接受了曲妥珠单抗靶向治疗分为EC-TH组和EC-T组(考虑到表柔比星的心脏毒性较阿霉素小,故选用表柔比星)。根据术后随访资料统计分析,随访时间内EC-TH组的DFS达95.2%,高于EC-T组(80.0%),提示术后应用曲妥珠单抗联合化疗辅助治疗可显著延长患者的DFS。
一般认为,乳腺癌患者的发病年龄<35岁的青年乳腺癌为影响预后的高危因素[11-12],本研究纳入的46例患者年龄均≥35岁,故未予赋值分析年龄对DFS预后影响。按照乳腺癌分子分型的标志物检测判定标准以14%判断Ki67高低的界值,46例患者中Ki67≤14%仅有6例,故亦未予赋值分析。
根据雌孕激素受体的表达情况HER-2阳性乳腺癌可分为Luminal B样HER-2阳性型、ERBB2+型,其中Luminal B样患者雌孕激素受体(+),ERBB2+型患者雌孕激素受体(-)[13]。现有国内外相关报道[14-16]对于受体表达情况是否为HER-2阳性乳腺癌的独立预后因素结论尚不一致,本研究虽然发现经单因素分析后发现ERBB2+型患者DFS较短(P<0.05),可能由于Luminal B样HER-2阳性型乳腺癌患者尚可接受内分泌治疗,预后相对较好。但经进一步COX多因素回归分析未能显示雌孕激素受体阳性是DFS独立保护因素。
一般来说,肿块越大,区域淋巴结转移数目越多,则TNM分期越晚,患者预后越差。MSKCC模型[17]设计了以多个临床病理因素为变量的区域淋巴结转移预测模型,统计了9个相关变量,亦证实了有无淋巴结转移及转移数目的增加对乳腺癌预后的影响。本研究预后分析未发现肿块体积对患者无病生存时间的确切影响,但发现区域淋巴结状况和术后病理TNM分期是影响HER-2阳性乳腺癌DFS的独立危险因素(P<0.05)。可能是由于出现区域淋巴结转移的患者pTNM分期也相对较晚,说明在影响手术后HER-2阳性乳腺癌无病生存时间上pTNM分期中淋巴结转移情况是主要的预后指标。该结论也与郭晨明等回顾总结558例我国HER-2阳性乳腺癌预后影响因素的Meta分析结果一致[18]。
本研究中两组患者的不良反应主要集中在骨髓抑制、脱发及恶心呕吐等方面,除了白细胞减少和脱发Ⅲ~Ⅳ发生率较高,其他反应均为Ⅰ~Ⅱ轻度反应。蒽环类化疗药物和曲妥珠单抗心脏毒性主要表现为无症状LVEF下降直至心力衰竭[19]。有报道[20]显示:应用曲妥珠单抗治疗HER-2阳性乳腺癌的随机对照实验中,无症状LVEF下降率约为10%左右,心力衰竭的发生率为0.5%~2.5%,但未出现因治疗引起的心源性死亡病例。本研究中46例患者均未出现严重的心脏毒性反应及心脏彩超左室射血分数(LVEF)显著下降,这可能与化疗前严格进行心电图及心脏彩超排除不符合入选标准者有关。经秩和检验分析后发现,两组各种不良反应发生率及严重程度相近,无统计学差异(P>0.05)。
综合指南及以上分析结果,原发灶>1.0 cm(>0.5 cm酌情)且心功能正常的HER-2阳性(免疫组化检测或FISH检测阳性)乳腺癌的术后辅助治疗推荐联用曲妥珠单抗,可以延长无病生存时间,且不良毒副反应未见明显增加。由于区域淋巴结转移情况、术后病理TNM分期是影响DFS独立预后因素,且术后予以曲妥珠单抗辅助治疗具有保护因素,故有淋巴结转移及pTNM分期较晚的HER-2阳性乳腺癌患者,术后辅助治疗更强调曲妥珠单抗联合化疗的及时应用。
[1] KROGER N,MILDE-LANGOSCH K,RIETHDORF S,etal.Prognostic and predictive effects of immunohistochemical factors in high-riskprimary breast cancer patients[J].Clin Cancer Res,2006,12(1):159-168.
[2] ROMOND EH,PEREZ EA,BRYANT J,etal.Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer[J].N Engl J Med,2005,353(16):1673-1684.
[3] SLAMON D,EIERMANN W,ROBERT N,etal.Adjuvant trastuzumab in HER2-positive breast cancer[J].N Eng J Med,2011,365(14):1273-1283.
[4] VU T,SLIWKOWSKI MX,CLARET FX.Personalized drug combinations to overcome trastuzumab resistance in HER2-positive breast cancer[J].Biochim Biophys Acta,2014,1846(2):353-365.
[5] WILKS ST.Potential of overcoming resistance to HER2-targeted therapies through the PI3K/Akt/mTOR pathway[J].Breast,2015,24(5):548-555.
[6] SLAMON DJ,GODOLPHIN W,JONES LA,etal.Studies of the HER-2/neuproto-oncogene in human breast and ovarian cancer[J].Science,1989,244:707-712.
[7] 江泽飞,邵志敏,徐兵河.人表皮生长因子受体2阳性乳腺癌临床诊疗专家共识2016[J].中华医学杂志,2016,96(14):1091-1096.
[8] PICCART-GEBHART MJ,PROCTER M,LEYLAND-JONES B,etal.Trastuzumab after adjuvantchemotherapy in HER2-positive breastcancer[J].N Engl J Med,2005,353(16):1659-1672.
[9] SLAMOND,EIERMANNW,ROBERTN,etal.Adjuvant trastuzumab in HER2-positive breast cancer[J].N Eng J Med,2011,365(14):1273-1283.
[10] JONES SE,COLLEA R,PAUL D,etal.Adjuvant docetaxel and cyclophosphamide plus trastuzumab in patients with HER2-amplified early stage breast cancer:a single-group,open-label,phase 2 study[J].Lancet Oncol,2013,14(11):1121-1128.
[11] ZHANG MM,MO JY,HUANG P,etal.Clinicopathologic profiles of breast cancer in young women: a report of 85 cases[J].Chinese Journal of General Surgery,2014,23(5):665-669.
[12] 高国璇,于大鹏,张虹,等.青年女性乳腺癌临床病理学特点及预后相关因素分析[J].中国实用外科杂志,2016,36(1):122-125.
[13] PEROU CM,SORLIE T,EISEN MB,etal.Molecular portraits of human breast tumours[J].Nature,2000,406(6797):747-752.
[14] MONTEMURRO F,DI COSIMO S,ARPINO G.Human epidermal growth factor receptor 2(HER2)-positive and hormone receptor-positive breast cancer:new insights into molecular interactionsand clinical implications[J].Ann Oncol,2013,24(11):2715-2724.
[15] BAGARIA SP,RAY PS,WANG J,etal.Prognostic value of basal phenotype in HER2-overexpressing breast cancer[J].Ann Surg Oncol,2012,19(3):935-940.
[16] 方华,玉素甫·买买提,黄韬,等.临床病理因素与不同分子分型乳腺癌患者预后的相关性分析[J].武汉大学学报(医学版),2016,37(5):801-806.
[17] VANZEE KJ,MANASSEH DE,BEVILACQUA JL,etal.Anomogram for predicting the likelihood of additional node metastasis in breast cancer patients with a positive sentinel node biopsy[J].Ann Surg Oncol,2003,10(10):1140-1151.
[18] GUO CM,WU N,GUO LY.Prognostic factors for HER-2-positive breast cancer in China:a Meta-analysis[J].Chin J Gen Surg,2016,25(2):264-270.
[19] 李伟,潘燕,李学军,等.HER2阳性乳腺癌治疗药物曲妥珠单抗耐药机制及新一代靶向药物研究进展[J].中国临床药理学杂志,2014,30(1):48-51.
[20] BABAR T,BLOMBERG C,HOFFNER E,etal.Anti-HER2 cancer therapy and cardiotoxicity[J].Curr Pharm Des,2014,20(30):4911-4919.
Analysis on the clinical effect and prognosis in patients with HER-2 positive breast cancer following postoperative adjuvant therapy
HE Yang,PENG Yuzhen,FANG FANG
Department of Medical Oncology,The First Affiliated Hospital of Wannan Medical college,Wuhu 241001,China
Objective:To assess the clinical efficacies of postoperative adjuvant therapy for patients with HER-2 positive breast cancer,and investigate the factors affecting disease-free survival(DFS).Methods: Follow-up was performed in 46 women with HER-2 positive breast cancer undergone postoperative adjuvant therapy in our hospital from October 2011 to February 2016.The patients were allocated to observational group(EC-TH group,n=21) and control group(EC-T group,n=25) according to presence or absence of trastuzumab therapy.Kaplan-Meier product-limit method was used and univariate analysis was performed to estimate the DFS and prognosis,respectively,and the log-rank test was used to compare the difference in groups.Cox proportional models were fitted for multivariate analysis.Rank-sum test was performed to compare adverse reactions in patients in therapy.Results:①Patients in EC-TH group had longer DFS than those in EC-T group(χ2=4.827,P=0.028);②Univariate analysis indicated that hormone receptor level,regional lymph node metastasis,TNM stage and treatment were factors affecting DFS in patients of HER-2 positive breast cancer(P<0.05).The multifactor analysis demonstrated that regional lymph node metastasis,TNM stage and treatment were independent factors affecting DFS(P<0.05);③The adverse reactions remained no significant difference between groups(P>0.05).Conclusion:Combined trastuzumab with adjuvant chemotherapy can significantly improve the DFS in patients with HER-2 positive breast cancer,and the toxicity can be in tolerable limit.Patients of HER-2 positive breast cancer with no regional lymph nodes metastasis,early TNM stage and combined trastuzumab therapy have longer DFS.
HER-2 positive breast cancer;adjuvant therapy;clinical effect;prognosis
1002-0217(2017)04-0333-05
2017-02-08
何 杨(1976-),女,主治医师,硕士,(电话)0553-5739060,(电子信箱)heyang322@sina.com; 方 芳,女,主任医师,副教授,硕士生导师,(电子信箱)tianfang.5000@aliyun.com,通信作者。
R 737.9
A
10.3969/j.issn.1002-0217.2017.04.008
