中草药及其活性成分对他克莫司药动学作用机制研究进展①
2017-08-07刘亚妮师少军
万 景 刘亚妮 师少军
(华中科技大学同济医学院附属协和医院药学部,武汉430022)
中草药及其活性成分对他克莫司药动学作用机制研究进展①
万 景 刘亚妮 师少军
(华中科技大学同济医学院附属协和医院药学部,武汉430022)
他克莫司(Tacrolimus,Tac)是从筑波链霉菌(Streptomycestsukubaensis)发酵液中提取的一种代谢产物,其与环孢素(Cyclosporine A,CsA)同属于钙调磷酸酶抑制药(Calcineurin inhibitors,CNIs)。其化学结构属23元环大环内酯类抗生素,具有高亲脂性和不溶于水的特性。该药主要通过抑制IL-2释放,全面抑制T淋巴细胞来发挥免疫抑制作用。Tac在体内、体外抑制淋巴细胞活性的能力分别比CsA强10~100倍[1]。1994年FDA批准Tac用于实体器官移植,目前已广泛用于各种器官移植术后排斥反应的预防和治疗,具有很好的疗效。
由于Tac治疗窗浓度较窄,药动学个体差异大,且术后不良反应和并发症较多,如真菌感染、高血压、高血糖等,临床上常需要联合用药。但联合用药将可显著影响Tac浓度,浓度低时易出现移植排斥反应,而浓度高又会导致毒性反应,如肾毒性、肝毒性,故了解药物相互作用的分子机制对提高治疗作用,减少药品不良反应的发生具有重要意义[2]。Tac主要通过细胞色素P450(Cytochrome P450,CYP)3A 亚家族代谢,进行脱甲基作用或羟化作用。同时,Tac亦是P-糖蛋白(P-glycoprotein,P-gp) 的底物。此外,核受体孕烷X受体(Pregnane X receptor,PXR)、组成型雄烷受体(Constitutive androstane recptor,CAR)等上游基因也调控CYP3A和多药耐药(MDR1)基因的表达[3]。因此,CYP3A4、CYP3A5、CYP氧化还原酶、MDR1、PXR、CAR等基因多态性,以及影响这些药物代谢酶、转运体和核受体的联合用药均可能改变Tac的药动学特征[4,5]。
随着中草药作为补充和替代药物(CAM)的应用日益普及和国际化,中草药-化学药相互作用受到国内外广泛关注[6],近年在国内外发生了多例因中草药相互作用所致毒副作用事件[7]。由于一些中草药及其活性成分对CYP3A4、CYP3A5、P-gp、PXR、CAR等药物代谢酶、转运体和核受体具有诱导或抑制作用[6,7],可与Tac发生药动学相互作用,进而影响Tac的疗效和毒副作用。本文将综述移植患者临床常用六种中草药(生姜、北美黄莲、五味子、贯叶连翘、枳实、枳壳)对Tac药动学的影响,并对作用机制进行深入探讨,旨在为Tac的临床合理应用、提高疗效和减少毒副作用提供依据。
1 常用中草药对Tac药动学的影响
1.1 生姜(Ginger) 生姜是姜科植物姜(Zingiber officinale Roscoe)的新鲜根状茎,味辛辣,性微温。生姜富含辛辣成分,包括萜类挥发油(Volatile oils)(1%~3%)。鲜姜最丰富的辛辣成分为姜辣素(Gingerols),干姜中其含量略有减少,姜辣素化合物中药理活性最强的组分为6-姜辣素(6-gingerol)。而干姜中主要有效成分为姜烯酚(Shogaols),其为姜辣素脱水产物,其中6-姜烯酚(6-shogaol)含量最高[8]。现代药理研究表明,生姜挥发油、姜辣素和姜烯酚具有多重药理活性,包括抗氧化、抗炎、免疫调节、抗风湿、抗肿瘤、防晕止吐、降糖、保护胃黏膜等生物活性,临床可用于心脑血管疾病、风湿性关节炎、胃溃疡等疾病的辅助治疗[8,9]。
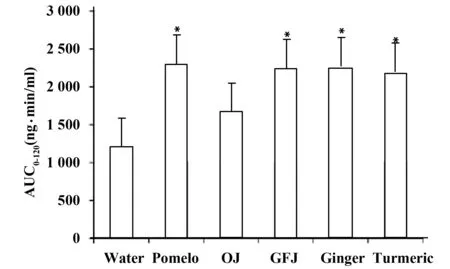
图1 大鼠灌胃给予蒸馏水(对照组)、柚子汁、橙汁、葡萄柚汁、生姜汁和姜黄对Tac的药时曲线下面积(AUC)的影响±s,n=3-5)[10]Fig.1 AUC values of tacrolimus pretreated with water,orange juice,grapefruit juice,pomelo juice,ginger juice,and turmeric juice ±s,n=3-5)[10] Note:*.P<0.05,vs water.
此外,尚有待进一步深入研究探讨生姜对CYPs和其他重要功能蛋白的确切作用机制,发现和确认潜在的生姜-化学药相互作用,以便减少和避免二者相互作用所致毒副作用。
1.2 北美黄莲(Goldenseal) 北美黄连(植物名,HydrastisCanadensis),属毛莨科植物,产于北美洲,是北美民间常用草药,其干燥根与根茎入药,1830年《美国药典》首次收载。其药用价值主要体现在高含量异喹啉类生物碱,包括北美黄连碱(Hydrastine)2%~4%、小檗碱(Berberine)2%~3%、北美黄连次碱(Hydrastinine)、坎那定(Canadine)等[17]。此外还含有罂粟素、绿原酸、植物甾醇、树脂、挥发油等成分。北美黄连具有抗菌消炎、镇静降压、收敛止血、愈伤、利胆等作用,在临床广泛用于呼吸道、消化道、泌尿生殖道黏膜等炎症治疗[18]。
近年来已有不少北美黄莲生物碱小檗碱导致Tac血药浓度升高的个例报道[19,20]。Hou等[20]报道了1例特发性肾病综合征患儿体内小檗碱与Tac药动学相互作用。小檗碱可显著影响Tac的体内处置,显著增加Tac的谷浓度(Co)和肾毒性。使用小檗碱(0.2 g,Tid),Tac的Co从8 ng/ml增至22 ng/ml,而血清肌酐从62 μmol/L增至109 μmol/L。该患者基因型分别为:野生型CYP3A4*1B,突变型纯合子CYP3A5*3/*3和突变型纯合子MDR1 C3435T (T/T)。该患者携带CYP3A5*3/*3导致CYP3A5活性显著降低;同时其携带MDR1C3435T (T/T)导致P-gp活性亦显著降低。因此,小檗碱主要通过抑制CYP3A4导致Tac血药浓度增加。当降低Tac临床剂量(0.1 mg/kg,Bid调整为3 mg,Qd)5日后,Tac的Co降至12 ng/ml,而血清肌酐降至84 μmol/L。一些体内外研究同样表明,北美黄莲对CYP3A4和P-gp具有抑制作用[21,22]。
由于北美黄莲常用于治疗腹泻,因此与Tac同时服用时,应仔细监测Tac的血药浓度,根据治疗药物监测结果调整剂量。
1.3 五味子(Schisandra chinensis) 五味子始载于《神农本草经》,被列为上品。五味子为木兰科植物五味子Schisandra chinensis (Turcz.) Baill.和华中五味子Schisandra sphenanthera Rehd.et Wils.的干燥成熟果实;前者习称“北五味子”,后者习称“南五味子”。其主要有效成分为挥发性成分、木脂素类和有机酸类三大部分。其中木脂素类有:五味子素(Schizandrin)、五味子甲、乙、丙素(Schizandrin A、B、C)、五味子醇(Schizandrol)、五味子醇甲、乙(Schizandrol A、B)、五味子酯甲、乙、丙、丁、戊(Schisantherin A、B、C、D、E)等[23]。五味子及其活性成分具有保肝益肾、抗肿瘤、保护心脑血管、镇静催眠、抗炎、抗氧化等多种功能[24]。研究表明五味子可能部分通过Nrf2介导信号通路调节代谢酶和转运体发挥肝脏保护功能[25]。此外,不少研究表明五味子可作为CNIs(Tac、CsA)有效的辅助用药,联合应用可缓解CNIs毒副作用[26,27]。
近年来,在健康受试者、移植受者以及大鼠体内多项研究表明,五味子提取物(Schisandra chinensis extract,SchE)可显著增加Tac的血药浓度,提示SchE和五味子活性成分可作为Tac助减剂[28-34]。Xin等[30]在12例健康受者体内研究了SchE对Tac药动学的影响。与单独使用Tac比较,联合服用SchE后Tac的峰浓度(Cmax),AUCo-24均显著增加[(66.4 vs 22.2 ng/ml;274.8 vs 129.5 ng/(h·ml)]。分析表明SchE通过抑制肠道CYP3A4和/或P-gp,导致吸收增加和肠道代谢减少所致(图2)。14例肝脏移植受者同时服用Tac和SchE,与Tac单独用药组比较,联合服药组Tac的Cmax,AUC0-12和一阶矩曲线下面积(AUMC0-12)分别增加了183%、212%和227%(P<0.01)[29]。Xin等[30]在肾移植受者体内研究了SchE对Tac药动学的影响。64例受者随机分为联用药组(Tac+SchE)和单用药组(Tac)(n=32),临床观察6个月。研究表明治疗6个月后,联用组患者Tac剂量下降34.0%,而谷浓度和浓度与剂量比值(C/D)分别增加100.5%和220.7%,与基线值比较差异具有统计学意义(P<0.01);而单用药组Tac剂量下降14.3%,而谷浓度和C/D比值分别增加7.74%和53.8%。治疗6个月后,与单用药组比较,联用药组的谷浓度和C/D分别增加了55.1%和94.5%(P<0.01)。肝脏移植和肾移植受者体内SchE对Tac药动学作用机制尚不完全明确,但至少部分与其抑制CYP3A4、P-gp和其他转运体[如,有机阴离子转运多肽(OATP1B1)]相关。Wang等[34]报道大鼠单次和多次灌胃给予五味子醇提取物可显著增加Tac的AUC(7~12倍)和Cmax(10倍),这与SchE抑制多种CYPs代谢酶相关。
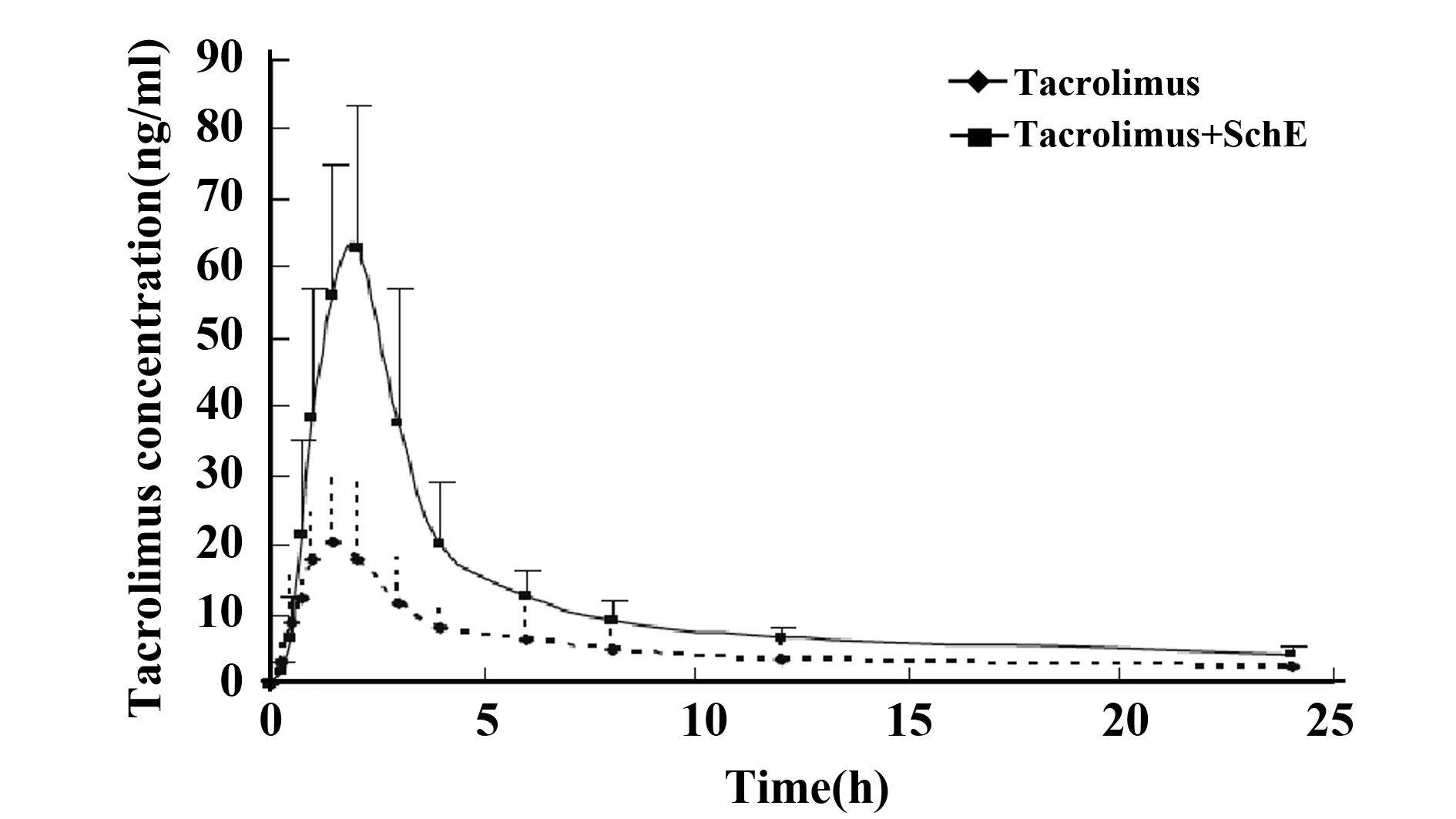
图2 12例健康受试者单独服用他克莫司(Tac)和联合服用五味子提取物(SchE)的药-时曲线[28]Fig.2 Blood concentration-time curves of tacrolimus in 12 healthy volunteers after oral administration of tacrolimus alone and coadministrations with Schisandra sphenanthera extrac (SchE)
炼化产业产能过剩受周期波动、政府因素和市场因素影响,同时跟炼化企业市场分布、企业自身的经营规模也是分不开的,因此综合考虑经济波动、市场因素、政府因素和企业自身的影响,本文选取产能利用率作为解释变量,经济波动、政府投资、市场需求以及企业规模指标作为被解释变量,变量指标选取的解释如下:
多项人体和动物实验探讨了五味子及其活性成分(如五味子素、五味子醇)升高Tac血药浓度的机制[35-37]。Qin等[35]通过体内、体外实验研究了五酯片(SchE)对Tac在肠道和肝脏吸收和首过代谢的影响,结果表明五酯片具有抑制P-gp外排和CYP3A代谢作用,并且认为减少肠道首过效应是增加Tac口服生物利用度的主要原因。也有学者在体内外进一步了五味子6个主要活性成分(五味子甲、乙、丙素,五味子醇甲、乙,五味子酯甲)对Tac吸收和代谢的影响。大鼠灌胃给予五味子6个主要活性成分[0.024 mmol/(L·kg)]可不同程度增加Tac(1.89 mg/kg)的生物利用度(152.0%、109.6%、46.4%、41.4%、598.4%、159.5%)。体外研究表明6个活性成分均可不同程度抑制P-gp和CYP3A作用(五味子醇乙作用最强)[36,37]。而Wang等[34]研究表明,五味子提取物对大鼠CYPs具有抑制或诱导多方面的影响。
因此,五味子及其活性成分具有显著提高实体器官移植患者Tac血药浓度的作用,但五味子不同活性成分(例如五味子素、五味子醇、五味子酯)对CYPs和P-gp的作用并不明确,其确切相互作用机制有待更进一步深入研究。
1.4 贯叶连翘(Hypericum perforatum) 贯叶连翘为藤黄科植物贯叶连翘(HypericumperforatumL)的全草,别名贯叶金丝桃、小对叶草、千层楼等,在西方国家又名圣约翰草(St John′s Wort, SJW)。贯叶连翘中含有多种化学成分,常分为四类。苯并二蒽酮化合物:金丝桃素(Hypericin)、伪金丝桃素(Pseudohypericin)等;间苯三酚化合物:贯叶金丝桃素(Hyperforin)、加贯叶金丝桃素(Ad-hyperforin)等;黄酮类化合物:金丝桃苷(Hyperin)、斛皮苷(Quercitrin)、异斛皮苷(Isoquercitrin)、芦丁(Rutin) 等;其他:挥发油、双黄酮、胆碱、氨基酸等[38]。贯叶连翘及其有效成分具有抗抑郁、抗肿瘤、抗病毒、抗菌、止咳、镇痛等多种药理作用[39]。临床上常用于治疗轻、中度抑郁症及焦虑症。
已有个例报道和临床试验研究SJW提取物对Tac药动学的作用[40-42]。Mai等[41]在10例肾移植受者体内进行临床试验,给予常规剂量Tac后联用SJW提取物(600 mg,Qd)14 d,结果发现SJW可显著降低Tac的AUC、Cmax和谷浓度(Ctrough),降低幅度大于50%。经剂量校正AUC中位数从180 ng/(h·ml)降至75.9 ng/(h·ml);Cmax从23 ng/ml 降至12.7 ng/ml;Ctrough从10.8 ng/ml降至3.8 ng/ml(见图3)。SJW通过调控核受体(PXR)诱导CYP3A4和P-gp可解释以上现象。另一项在10名健康受试者体内的研究同样表明,服用SJW(300 mg,Tid×18 d)可显著降低Tac的AUC[(306.9±175.8) ng/(h·ml) vs(198.7±139.6)ng/(h·ml),P<0.01];显著增加表观清除率(CL/F)[(349.0±126.0)ml·/(h·kg) vs(586.4±274.9)ml/(h·kg),P<0.01]。这主要是SJW对CYP3A4和P-gp的诱导作用所致[42]。近年来大量体内外研究表明,SJW是一种对代谢酶(CYP3A4)和转运体(P-gp)作用显著的诱导剂,同时也是上游调控基因PXR的有效激动药,这是导致SJW-药物相互作用的主要原因[38]。而且其诱导作用主要与贯叶金丝桃素含量相关,而黄酮类化合物、金丝桃素等关联性不大[43,44]。
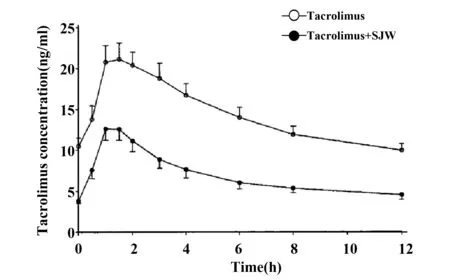
图3 10例健康受试者单独服用他克莫司(Tac)和联合服用圣约翰草(SJW)的药-时曲线[41]Fig.3 Blood concentration-time curves of tacrolimus in 10 healthy volunteers after oral administration of tacrolimus alone and coadministrations with St John's wort (SJW)[41]
贯叶连翘与Tac联合使用发生代谢性相互作用的机制已基本明确,临床应避免两者合用,如需合用时则必须调整增加Tac给药剂量。
1.5 枳实、枳壳 枳实、枳壳为中医临床十分常用的二味理气药,应用历史悠久。枳实为芸香科植物酸橙(CitrusaurantiumL)及其栽培变种或甜橙(CitrussinensisOsbeck)的干燥幼果。枳壳同为芸香科植物酸橙及其栽培变种的干燥未成熟果实。二者性状相近,功效相似。枳实和枳壳的主要化学成分有三大类:生物碱类(Alkaloids)、黄酮苷类(Flavon-oid glycosides)和挥发油类(Volatile oil)。二者化学成分主要区别不是种类差异,而是包含化学成分的质量分数差异[45]。现代药理研究表明,枳实和枳壳具有多重药理作用,包括强心、升高血压、抗休克、抗炎、抗氧化、调节胃肠平滑肌、兴奋及抑制子宫、抗溃疡、镇静、镇痛、中枢抑制和利尿等作用[46]。临床常用于治疗或预防胃胀、消化不良、食欲不振等胃肠道疾病。
Lin等[47]研究枳实、枳壳对Tac药动学作用并进行了机制探讨。6只SD大鼠单独灌胃Tac(1.5 mg/kg)或联合给予枳壳或枳实(2 g/kg),考察枳壳、枳实对Tac药动学的影响。结果表明,枳壳对Tac药动学参数(AUC、Cmax、Tmax)均无影响。而枳实显著降低了Tac的AUC0-480[(2 485.4±964.2)ng/(min·ml) vs (696.2±182.5)ng/(min·ml),P<0.05]和Cmax[(19.2±4.2)ng/ml vs (5.3±0.8)ng/ml],P<0.05),分别下降了72.4%和72.0%(见图4)。考虑到枳实并不影响Tac的体内代谢,其主要通过激活P-gp和/或CYP3A4活性,减少Tac的吸收,从而降低Tac的生物利用度。在LS180细胞的机制研究也证实枳实可增强肠道P-gp的外排活性。同样,枳实可降低口服CsA的生物利用度,而枳壳对CsA药动学无影响[48]。
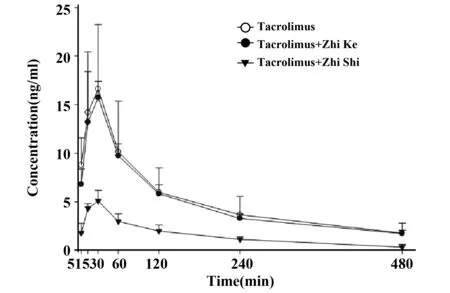
图4 SD大鼠单独灌胃Tac或联合给予枳壳或枳实的药-时曲线±s,n=6)[47]Fig.4 Blood concentration-time profiles of tacrolimus in 6 rats after oral administration of tacrolimus alone (1.5 mg/kg) and coadminist-rations with 2 g/kg of Zhi Ke or Zhi Shi decoctions[47]
因此,我们强烈建议在临床应用中避免联合使用枳实与钙调磷酸酶抑制药(Tac、CsA),以降低同种异体移植物排斥反应的风险。
2 结语与展望
器官移植是终末期器官功能衰竭最有效的治疗手段,中国每年约有1万例器官移植手术,累计移植量已超过10万例。有效抑制移植器官后免疫系统出现的各种排斥反应是提高患者移植手术成功率的关键,因此免疫抑制治疗是器官移植成功的基石,移植受者在器官移植后必须接受免疫抑制药的治疗[49]。Tac是一种强效、新型免疫抑制药,以其为基础的免疫抑制方案已成为实体器官移植(心肝肾)后一线基础用药方案。但Tac具有治疗窗窄、生物利用度低、个体差异大等特点,联用时易于发生药物相互作用,增加不良反应发生风险,应引起高度重视[50]。
中草药是中国的传统医药,近年来在国内外应用日趋广泛,特别是常与化学药联合使用防治各种慢性疾病。由于中草药常含有多种活性成分,与化学药合用时,一方面可通过抑制或诱导药物代谢酶和转运体,在代谢和转运环节发生相互作用;另一方面可发生配伍不当等导致药效学相互作用,从而使化学药疗效增强甚至产生毒副作用,或疗效减弱甚至治疗失败[6,7]。其中对CYPs和P-gp的抑制或诱导作用是发生中草药-化学药相互作用的主要机制,因此研究中草药及其活性成分的调节作用至关重要。
如前文所述,多项体内、体外研究表明,移植患者临床常用六种中药及其主要有效成分可调节CYP3A或P-gp的活性和表达,显著影响Tac的吸收或代谢,进而影响其疗效和毒副作用。生姜、北美黄连、五味子可显著增加Tac的生物利用度(AUC)和血药浓度;而贯叶连翘、枳实呈现相反作用;枳壳则无影响。但一些中草药相互作用研究(如生姜、枳实、枳壳)仅在动物体内观察,由于人体和动物CYPs亚家族等存在差异,尚需进一步在人体进行相互作用及其机制探究。由于中草药及其活性成分复杂,其对药物代谢酶和转运体的作用机制更为复杂,因此有待深入研究中草药及其有效成分对Tac药动学作用机制研究。
[1] Krämer BK,Montagnino G,Krüger B,etal.Efficacy and safety of tacrolimus compared with ciclosporin-A in renal transplantation:7-year observational results[J].Transpl Int,2016,29(3):307-314.
[2] Oda K,Yamano K,Otsuka Y.In vitro-in vivo extrapolations to evaluate the effect of concomitant drugs on tacrolimus (FK506) exposure[J].Biopharm Drug Dispos,2015,36(5):265-274.
[3] 常伟宇,辛华雯.中草药对孕烷X 受体和组成型雄烷受体等核受体通路影响的研究进展[J].中国药师,2014,17(12):2127-2131.
[4] Tang JT,Andrews LM,van Gelder T,etal.Pharmacogenetic aspects of the use of tacrolimus in renal transplantation:recent developments and ethnic considerations[J].Exp Opin Drug Metab Toxicol,2016,12(5):555-565.
[6] Shi S,Klotz U.Drug interactions with herbal medicines[J].Clin Pharmacokinet,2012,51 (2):77-104.
[7] Di Lorenzo C,Ceschi A,Kupferschmidt H,etal.Adverse effects of plant food supplements and botanical preparations:a systematic review with critical evaluation of causality[J].Br J Clin Pharmacol,2015,79(4):578-592.
[8] Khodaie L,Sadeghpoor O.Ginger from ancient times to the new outlook[J].Jundishapur J Nat Pharm Prod,2015,10(1):e18402.
[9] Lete I,Allué J.The effectiveness of ginger in the prevention of nausea and vomiting during pregnancy and chemotherapy[J].Integr Med Insights,2016,11:11-17.
[10] Egashira K,Sasaki H,Higuchi S,etal.Food-drug interaction of tacrolimus with pomelo,ginger,and turmeric juice in rats[J].Drug Metab Pharmacokinet,2012,27(2):242-247.
[11] Qiu JX,Zhou ZW,He ZX,etal.Estimation of the binding modes with important human cytochrome P450 enzymes,drug interaction potential,pharmacokinetics,and hepatotoxicity of ginger components using molecular docking,computational,and pharmacokinetic modeling studies[J].Drug Des Devel Ther,2015,9:841-866.
[12] Zhang W,Lim LY.Effects of spice constituents on P-glycoprotein-mediated transport and CYP3A4-mediated metabolism in vitro[J].Drug Metab Dispos,2008,36(7):1283-1290.
[13] Mukkavilli R,Gundala SR,Yang C,etal.Modulation of cytochrome P450 metabolism and transport across intestinal epithelial barrier by ginger biophenolics[J].PLoS One,2014,9(9):e108386.
[14] Jiang X,Williams KM,Liauw WS,etal.Effect of ginkgo and ginger on the pharmacokinetics and pharmacodynamics of warfarin inhealthy subjects[J].Br J Clin Pharmacol,2005,59(4):425-432.
[15] Young HY,Liao JC,Chang YS,etal.Synergistic effect of ginger and nifedipine on human platelet aggregation:a study in hypertensive patients and normal volunteers[J].Am J Chin Med,2006,34(4):545-551.
[16] Chiang HM,Chao PD,Hsiu SL,etal.Ginger significantly decreased the oral bioavailability of cyclosporine in rats[J].Am J Chin Med,2006,34(5):845-855.
[17] Le PM,McCooeye M,Windust A.Application of UPLC-QTOF-MS in MS(E) mode for the rapid and precise identification of alkaloids in goldenseal (Hydrastis canadensis)[J].Anal Bioanal Chem,2014,406(6):1739-1749.
[18] Chen S,Wan L,Couch L,etal.Mechanism study of goldenseal-associated DNA damage[J].Toxicol Lett,2013,221(1):64-72.
[19] 蔡明志,陈 凯,范 星,等.盐酸小檗碱引起他克莫司血药浓度升高1例分析[J].实用医药杂志,2014,31(2):156-157.
[20] Hou Q,Han W,Fu X.Pharmacokinetic interaction between tacrolimus and berberine in a child with idiopathic nephrotic syndrome[J].Eur J Clin Pharmacol,2013,69(10):1861-1862.
[21] Gurley BJ,Swain A,Hubbard MA,etal.Supplementation with goldenseal (Hydrastis canadensis),but not kava kava (Piper methysticum),inhibits human CYP3A activity in vivo[J].Clin Pharmacol Ther,2008,83(1):61-69.
[22] Etheridge AS,Black SR,Patel PR,etal.An in vitro evaluation of cytochrome P450 inhibition and P-glycoprotein interaction with goldenseal,Ginkgo biloba,grape seed,milk thistle,and ginseng extracts and their constituents[J].Planta Med,2007,73(8):731-741.
[23] Lu Y,Chen DF.Analysis of Schisandra chinensis and Schisandra sphenanthera[J].J Chromatogr A,2009,1216(11):1980-1990.
[24] Jang MK,Nam JS,Kim JH,etal.Schisandra chinensis extract ameliorates nonalcoholic fatty liver via inhibition of endoplasmic reticulum stress[J].J Ethnopharmacol,2016,185:96-104.
[25] He JL,Zhou ZW,Yin JJ,etal.Schisandra chinensis regulates drug metabolizing enzymes and drug transporters via activation of Nrf2-mediated signaling pathway[J].Drug Des Devel Ther,2014,9:127-146.
[26] Sun Z,Ren M,Wu Q,etal.Co-administration of Wuzhi capsules and tacrolimus in patients with idiopathic membranous nephro-pathy:clinical efficacy and pharmacoeconomics[J].Int Urol Nephrol,2014,46(10):1977-1982.
[27] Lai Q,Wei J,Mahmoodurrahman M,etal.Pharmacokinetic and nephroprotective benefits of using Schisandra chinensis extracts in a cyclosporine A-based immune-suppressive regime[J].Drug Des Devel Ther,2015,9:4997-5018.
[28] Xin HW,Wu XC,Li Q,etal.Effects of Schisandra sphenanthera extract on the pharmacokinetics of tacrolimus in healthy volunteers[J].Br J Clin Pharmacol,2007,64(4):469-475.
[29] Jiang W,Wang X,Xu X,etal.Effect of Schisandra sphenanthera extract on the concentration of tacrolimus in the blood of liver transplant patients[J].Int J Clin Pharmacol Ther,2010,48(3):224-229.
[30] Xin HW,Li Q,Wu XC,etal.Effects of Schisandra sphenanthera extract on the blood concentration of tacrolimus in renal transplant recipients[J].Eur J Clin Pharmacol,2011,67(12):1309-1311.
[31] Wang K,Qu QS,Zhang YX,etal.Effects of Wuzhi capsule on blood concentration of tacrolimus after renal transplantation[J].J Biol Regul Homeost Agents,2016,30(1):155-159.
[32] Qin XL,Yu T,Li LJ,etal.Effect of long-term co-administration of Wuzhi tablet (Schisandra sphenanthera extract) and prednis-one on the pharmacokinetics of tacrolimus[J].Phytomedicine,2013,20(3-4):375-379.
[33] Wei H,Tao X,Di P,etal.Effects of traditional chinese medicine Wuzhi capsule on pharmacokinetics of tacrolimus in rats[J].Drug Metab Dispos,2013,41(7):1398-1403.
[34] Wang B,Yang S,Hu J,etal.Multifaceted interaction of the traditional Chinese medicinal herb Schisandra chinensis with cytochrome P450-mediated drug metabolism in rats[J].J Ethnopharmacol,2014,155(3):1473-1482.
[35] Qin XL,Bi HC,Wang XD,etal.Mechanistic understanding of the different effects of Wuzhi Tablet (Schisandra sphenanthera extract) on the absorption and first-pass intestinal and hepatic metabolism of Tacrolimus (FK506) [J].Int J Pharm,2010,389(1-2):114-121.
[36] Qin XL,Chen X,Zhong GP,etal.Effect of Tacrolimus on the pharmacokinetics of bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) and the potential roles of CYP3A and P-gp[J].Phytomedicine,2014,21(5):766-772.
[37] Qin XL,Chen X,Wang Y,etal.In vivo to in vitro effects of six bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) on the CYP3A/P-glycoprotein-mediated absorption and metabolism of tacrolimus[J].Drug Metab Dispos,2014,42(1):193-199.
[38] Russo E,Scicchitano F,Whalley BJ,etal.Hypericum perforatum:pharmacokinetic,mechanism of action,tolerability,and clinical drug-drug interactions[J].Phytother Res,2014,28(5):643-655.
[39] Süntar I,Oyard O,Akkol EK,etal.Antimicrobial effect of the extracts from Hypericum perforatum against oral bacteria and biofilm formation[J].Pharm Biol,2016,54(6):1065-1070.
[40] Bolley R,Zülke C,Kammerl M,etal.Tacrolimus-induced nephrotoxicity unmasked by induction of the CYP3A4 system with St John′s wort[J].Transplantation,2002,73(6):1009.
[41] Mai I,Störmer E,Bauer S,etal.Impact of St John′s wort treatment on the pharmacokinetics of tacrolimus and mycophenolic acid in renal transplant patients[J].Nephrol Dial Transplant,2003,18(4):819-822.
[42] Hebert MF,Park JM,Chen YL,etal.Effects of St.John′s wort (Hypericum perforatum) on tacrolimus pharmacokinetics in healthy volunteers[J].J Clin Pharmacol,2004,44(1):89-94.
[43] Godtel-Armbrust U,Metzger A,Kroll U,etal.Variability in PXR-mediated induction of CYP3A4 by commercial preparations and dry extracts of St John′s wort[J].Naunyn Schmiedebergs Arch Pharmacol,2007,375 (6):377-382.
[44] Komoroski BJ,Zhang S,Cai H,etal.Induction and inhibition of cytochromes P450 by the St John′s wort constituent hyperforin in human hepatocyte cultures[J].Drug Metab Dispos,2004,32 (5):512-518.
[45] 王红勋.枳实与枳壳的现代药理与临床应用研究[J].中国卫生标准管理,2014,5(16):39-40.
[46] Stohs SJ,Preuss HG,Shara M.A review of the human clinical studies involving Citrus aurantium (bitter orange) extract and its primary protoalkaloid p-synephrine[J].Int J Med Sci,2012,9(7):527-538.
[47] Lin SP,Wu PP,Hou YC,etal.Different influences on tacrolimus pharmacokinetics by coad ministrations of zhi ke and zhi shi in rats[J].Evid Based Complement Alternat Med,2011,2011:751671.
[48] Wang MJ,Hou YC,Tsai SY,etal.Effects of coad ministrations of unripe fruits and ripe peels of Citrus aurantium on cyclosporine pharmacokinetics in rats[J].J Food Drug Anal,2007,15(3):265-270.
[49] Allison TL.Immunosuppressive therapy in transplantation[J].Nurs Clin North Am,2016,51(1):107-120.
[50] Vanhove T,Annaert P,Kuypers DR.Clinical deter minants of calcineurin inhibitor disposition:a mechanistic review[J].Drug Metab Rev,2016,48(1):88-112.
[收稿2016-10-12 修回2016-11-21]
(编辑 许四平 刘格格)
10.3969/j.issn.1000-484X.2017.07.032
①本文为国家自然科学基金面上项目(No.81273591)、国家自然科学基金青年项目(No.81503161)和中央高校基本科研业务费专项资金(No.2014YGYL003,2012016YX2D050)。
万 景(1972年-),女,主管药师,主要从事临床药学方面的研究,E-mail:jingwan2015@163.com。
及指导教师:师少军(1973年-),男,硕士,教授,主任药师,硕士生导师,主要从事临床药学和遗传药理学方面的研究,E-mail:sjshicn@163.com。
R969
A
1000-484X(2017)07-1106-06
