NKT细胞发育过程中microRNA表达谱变化①
2017-08-07郑全辉闫振宇孙贺军王佳骥左蓉洁
王 姗 郑全辉 田 枫 闫振宇 孙贺军 王佳骥 左蓉洁 刘 遄 陈 光
(华北理工大学基础医学院,河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室,唐山063000)
NKT细胞发育过程中microRNA表达谱变化①
王 姗 郑全辉 田 枫②闫振宇③孙贺军 王佳骥 左蓉洁 刘 遄 陈 光
(华北理工大学基础医学院,河北省慢性疾病重点实验室,唐山市慢性病临床基础研究重点实验室,唐山063000)
目的:探讨自然杀伤性T细胞(NKT)发育、成熟过程中microRNA表达谱变化。方法:采用流式细胞仪分选小鼠胸腺不同发育阶段NKT细胞,提取细胞总RNA,经反转录和预扩增后利用TaqMan低密度microRNA表达谱分析阵列检测NKT发育、成熟过程中发生表达变化的microRNAs,并采用real-time PCR进一步验证。结果:NKT细胞发育、成熟过程中,共有92个microRNAs表达发生显著变化。表达显著增加的microRNAs有71个,其中有36个表达持续增加;而表达显著降低的microRNAs有21个,其中有12个表达持续降低。选取Let-7f、miR-150、miR-155、miR-223、miR-24和miR-29进行real-time PCR,发现Let-7f、miR-150、miR-24、miR-29在NKT细胞发育、成熟过程中表达增加,而miR-223和miR-155表达降低,其表达变化趋势与表达谱分析一致。结论:NKT细胞发育、成熟过程中伴随大量特异microRNAs的不同表达变化,提示特异microRNA调控NKT细胞的发育和功能。
自然杀伤性T细胞;microRNA;细胞发育
自然杀伤性T细胞(Natural killer T cell,NKT)是一群细胞表面既表达T细胞受体α链(小鼠:Vαl4-Jα18,人:Vα24-Jα18)和β链(小鼠:Vβ8.2,Vβ7,Vβ2,人:Vβ11),同时又表达NK细胞受体如NK1.1的T细胞亚群[1]。在小鼠胸腺,表达Vαl4-Jα18T细胞受体α链的NKT前体细胞经历MHCⅠ类样分子CD1d的阳性选择后,CD24表达降低并伴随着CD44和NK1.1表达的逐渐增加,开始一系列的发育和成熟过程。NKT细胞在胸腺发育主要分为三个阶段,初始阶段NKT细胞表现为CD44-NK1.1-(stage 1),此后,随着NKT细胞的逐渐发育、成熟,CD44表达增加,表现为CD44+NK1.1-(stage 2),成熟阶段的NKT细胞表达NK1.1,表现为CD44+NK1.1+(stage 3)[2]。因此,基于NK1.1的表达,小鼠NKT细胞可分为NK1.1+成熟细胞亚群和NK1.1-非成熟细胞亚群。另外,基于CD4的表达,小鼠NKT细胞又可分为CD4+单阳性细胞亚群和CD4-CD8-双阴性细胞亚群[3]。由于NKT细胞在接受CD1d提呈的脂类抗原刺激后,短时间内即可大量产生Th1、Th2和Th17型细胞因子,因此,NKT细胞在感染性疾病、自身免疫病和肿瘤的发生、发展及治疗中发挥重要作用。
microRNAs是长度为20~23 nt的短链非编码RNAs,通过与靶mRNA结合在转录后水平调控特异基因表达,从而在细胞增殖、发育、分化和谱系形成等基本功能中发挥重要作用[4]。Dicer属于核糖核酸内切酶,在胞浆成熟microRNAs产生中发挥关键作用。已有研究发现,Dicer 敲除小鼠出现胸腺及外周NKT细胞数量减少,发育、成熟障碍及细胞活化和细胞因子分泌功能显著降低,表明microRNAs作为一个整体调控机制在NKT细胞发育、分化和功能发挥过程中具有重要作用[5,6]。然而,特异microRNAs在NKT细胞中的作用目前仍所知甚少,因此大大限制了利用特异microRNA及其靶点调控NKT细胞功能及在多种疾病防治中的应用。为此,本研究采用低密度microRNA array 技术检测了NKT细胞发育、成熟过程microRNA表达谱变化,以期为深入研究NKT细胞的发育、成熟和功能发挥提供新的靶点。
1 材料与方法
1.1 材料
1.1.1 小鼠 C57BL/6小鼠购自北京维通利华实验动物技术有限公司,并在华北理工大学SPF级小鼠房繁殖、饲养。实验选取4~8周龄小鼠进行研究,小鼠实验操作按华北理工大学实验动物管理委员会规定进行。
1.1.2 试剂 荧光素标记的α-Galcer/CD1d四聚体购自日本麒麟公司。荧光素标记的抗小鼠TCR-β(H57-597)、NK1.1 (PK136)、CD44抗体(IM7)、Biotin标记CD8抗体、抗Biotin磁珠购自BD或eBioscience公司,磁珠分选系统购自美天旎生物技术公司。大鼠抗小鼠FcR单克隆抗体(2.4G2)取自2.4G2杂交瘤细胞培养上清。MirVana microRNA提取试剂盒(AM1561)、TaqMan®microRNA 反转录试剂盒(PN 4322171)、TaqMan®低密度 microRNA表达谱分析阵列板(Low density Assays A,B)以及特异microRNAs反转录(RT)和PCR引物(TM)购自美国Ambion公司。
1.2 方法
1.2.1 细胞分选 分离小鼠胸腺细胞,台盼蓝染色、计数后用PBS缓冲液 (1×PBS;2%FBS;2 mmol/L EDTA) 重悬,加入2.4G2至20 μl/107细胞,4℃,10 min。为提高不同发育阶段NKT细胞的分选效率,胸腺细胞悬液首先加入Biotin标记抗小鼠CD8抗体(2 μl/107细胞),4℃,孵育10 min,加入抗Biotin磁珠(2 μl/107细胞),4℃,孵育15 min,PBS洗涤2次后采用磁珠分选系统剔除小鼠CD8+胸腺细胞(CD8SP和CD4 CD8 DP)。在剩余胸腺细胞中分别加入适量抗小鼠TCR-β抗体、α-Galcer/CD1d四聚体、抗小鼠NK1.1和抗小鼠CD44抗体,4℃,孵育30 min,经PBS缓冲液洗涤2次后采用Aria Ⅱ流式细胞仪(BD)分选不同发育阶段NKT细胞。
1.2.2 总RNA提取 离心收集以上分选不同发育阶段NKT细胞,采用MirVana microRNA试剂盒,按说明书提取细胞总RNA。 采用Nanodrop 测定RNA 浓度和质量(OD 260/280和260/230比值),将OD 260/280>1.75 同时OD 260/230>1.20的RNA样品进行后续反转录。
1.2.3 反转录和预扩增 分别取不同发育阶段NKT细胞总RNA 3 μl (30 ng), 加入0.80 μl 10×megaplex 反转录引物,0.20 μl dNTPs with dTTP (100 mmol/L),1.50 μl MultiScribeTM反转录酶(50 U/μl),0.80 μl 10 × RT Buffer,0.90 μl MgCl2(25 mmol/L),0.10 μl RNA酶抑制剂,0.70 μl无RNA酶水,冰上放置 5 min,采用ABI 9700 PCR仪,程序:16℃ 2 min,42℃ 1 min 40循环,50℃ 1 s,保持85℃ 5 min,保持4℃,进行反转录。采用不同发育阶段NKT细胞cDNA 2.5 μl进行预扩增,分别加入12.5 μl TaqMan®PreAmp Master Mix (2×);2.5 μl MegaplexTM预扩增引物 (10×);7.5 μl无RNAase 水,预扩增条件:95℃10 min, 55℃ 2 min, 72℃ 2 min;95℃ 15 s和60℃ 4 min进行12个循环,保持4℃。预扩增产物加入75 μl 0.1×TE (pH8.0),-20℃保存。
1.2.4 MicroRNA array 取以上稀释预扩增产物9 μl,加入450 μl TaqMan®Universal PCR Master Mix和441 μl无RNAase水,充分混匀后分别加入TaqMan®低密度microRNA表达谱分析阵列板A (含384 个功能已知microRNAs)和B(含384个功能未知 microRNAs),每个板子包含4次重复的mammalian U6 (MammU6-4395470)作为内参。阵列板经1 200 r/min离心1 min,采用7900 HT 序列检查系统和系统默认热循环条件(Applied Biosystems)进行microRNA 表达谱检测。
1.2.5 数据分析 采用ABI TaqMan SDS v2.3 软件获取NKT细胞特定发育阶段microRNA表达的初始ΔCT值[ΔCT=CT靶miR-CT MammU6],利用以下公式计算NKT细胞不同发育阶段特定microRNA的表达倍数变化(FC):FC=2-ΔΔCT,ΔΔCT=[CT靶miR(stagen+1)-CT MammU6]-[CT靶miR(stagen)-CT MammU6]。将FC值转换成以2为底的对数(Log2)值并绘制NKT细胞不同发育阶段microRNA表达谱变化热图,选取表达变化至少在一倍(2 fold)以上的特异microRNA进行分析。对NKT细胞不同发育阶段microRNAs 重复测定3次。
1.2.6 Real-time PCR 采用以上提取不同发育阶段NKT细胞总RNA,分别以不同特异microRNA(Let-7f,miR-150,miR-155,miR-223,miR-24,miR-29,snoRNA-202) 的RT引物进行反转录,以TM引物进行PCR扩增,每组标本设3个重复孔,并以snoRNA-202为内参,计算各组特异microRNA在NKT不同发育阶段的相对CT值(ΔCT)及表达变化(2-ΔCT)。
1.3 统计学处理 采用GraphPad Prism v5.0 软件进行数据处理和统计分析,结果采用双尾Student′st检验,P<0.05 为组间有统计学差异。
2 结果
2.1 不同发育阶段NKT细胞分选 新鲜分离小鼠胸腺细胞,首先按比例加入Biotin标记抗小鼠CD8抗体和抗Biotin磁珠,去除CD8+胸腺细胞以提高NKT细胞比例,抗TCR-β抗体和α-Galcer/CD1d四聚体染色显示,CD8+T细胞剔除导致胸腺NKT细胞比例增加10倍以上(图1A);进一步采用抗CD44和抗NK1.1抗体染色,发现小鼠NKT细胞以成熟stage 3(CD44+NK1.1+)为主,占85%以上,而非成熟stage 2(CD44+NK1.1-)和stage 1(CD44-NK1.1-)NKT细胞分别约占10%和2%,表明NKT细胞发育正常(图1B)。采用AriaⅡ流式细胞仪分选不同发育阶段NKT细胞,分选纯度在90%以上,用于后续microRNA表达谱分析。
2.2 NKT细胞发育成熟过程中microRNA表达谱变化 提取不同发育阶段NKT细胞总RNA,经反转录和预扩增后分别加入到microRNA分析阵列板A和B,检测NKT细胞发育过程中microRNA表达谱变化(图2)。结果分析发现,NKT细胞从非成熟stage 1到成熟stage 3发育成熟过程中,发生显著表达变化的microRNAs共有92个。其中,与stage 1相比,stage 3表达显著增加的microRNAs有71个(表1),而表达显著降低的microRNAs有21个(表2)。
2.3 NKT细胞发育成熟过程中表达持续增加和降低的microRNAs 进一步分析发现,NKT细胞从stage 1、stage 2到stage 3发育成熟过程中,有36个microRNAs表达持续增加,其中miR-28*表达增加最为显著,其次分别为miR-324-3p和miR-491(图3A);相反,有12个microRNAs 在NKT细胞发育成熟过程中表达持续降低,其中miR-211表达降低最为明显,其次分别为miR-125b-5p和miR-449a(图3B)。
2.4 NKT细胞发育成熟过程中特异microRNA表达 选取array发现在NKT细胞发育成熟过程中表达变化的特异microRNAs(Let-7f,miR-150,miR-24,miR-29a,miR-223,miR-155,),采用Real-time PCR进一步确认其表达。结果显示:Let-7f在非成熟stage 1和stage 2 NKT细胞中几乎没有表达,而在成熟stage 3 NKT细胞中表达显著增加;miR-150、miR-24、miR-29a则在stage 1、stage 2和stage 3 NKT细胞中表达逐渐增加。相反,miR-223,miR-155在stage 1 NKT细胞中表达高,在stage 2和stage 3 NKT细胞中表达显著降低。以上特异microRNA在NKT发育成熟过程中的表达变化趋势与microRNA array检测结果一致(图4)。
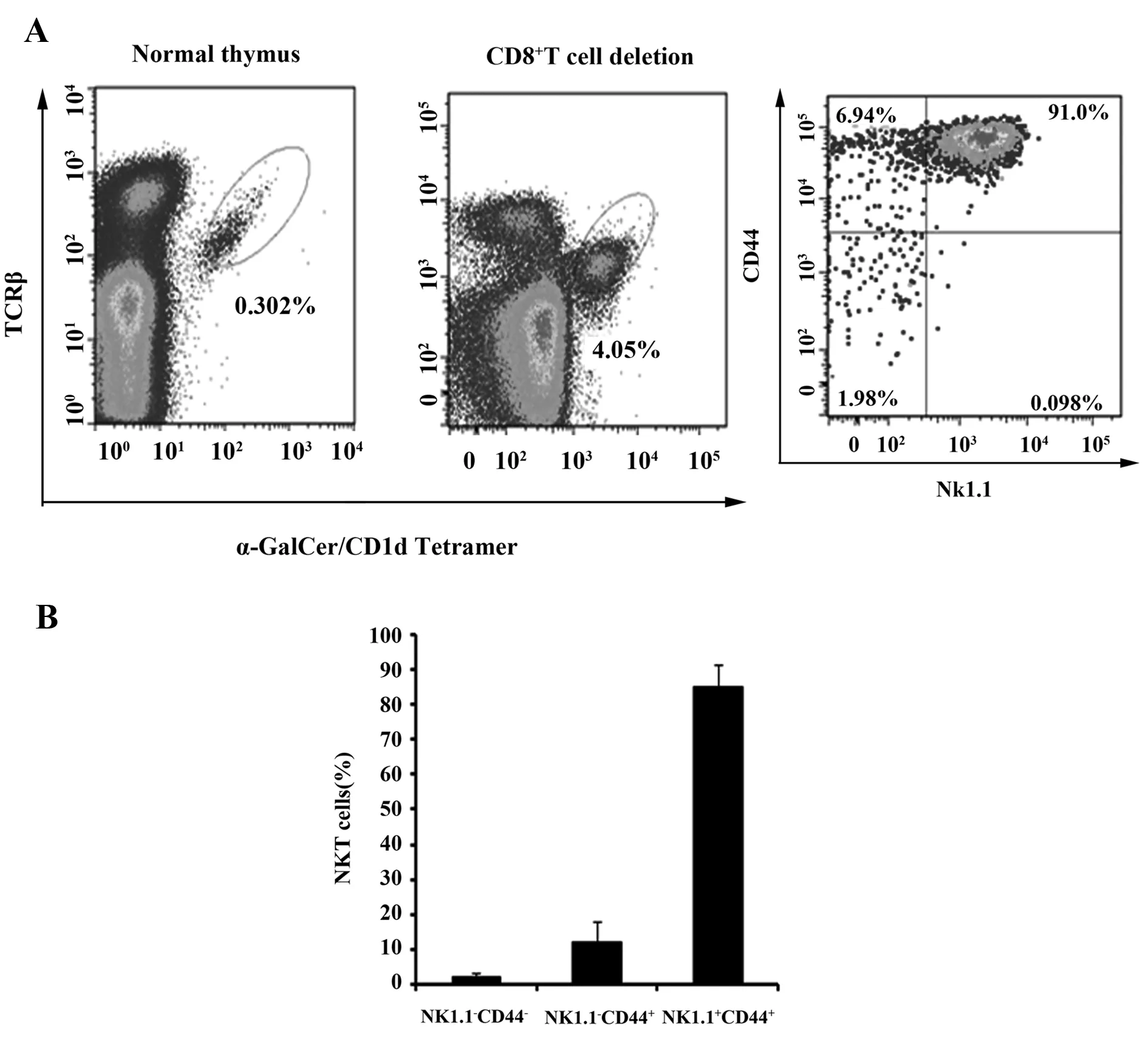
图1 胸腺CD8+T 细胞剔除和不同发育阶段NKT 细胞分选Fig.1 CD8+T cell deletion and flow cytometry sorting of stage 1(NK1.1-CD44-),stage 2 (NK1.1-CD44+) and stage 3 (NK1.1+CD44+) NKT cellsNote: Mouse thymocytes were first stained with Biotin-labeled CD8 antibodies and CD8+ T cells were then deleted by anti-biotin beads.The left thymocytes were then stained with anti-NK1.1 and anti-CD44 antibodies,different developmental stages of NKT cells were sorted by flow cytometry.
表1 与stage1 NKT细胞相比,stage3 NKT细胞表达显著增加的microRNAs
Tab.1 Expression increased microRNAs in stage3 NKT cells compared with that in stage1 NKT cells
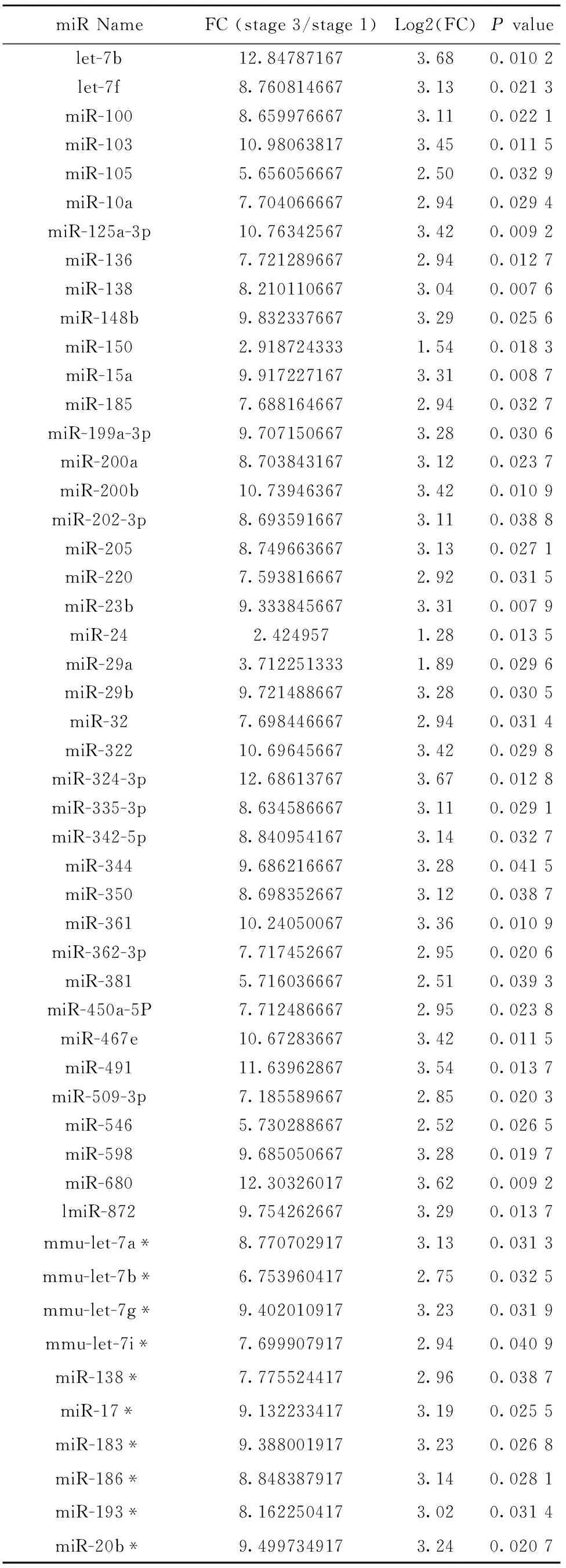
miRNameFC(stage3/stage1)Log2(FC)Pvaluelet-7b12.847871673.680.0102let-7f8.7608146673.130.0213miR-1008.6599766673.110.0221miR-10310.980638173.450.0115miR-1055.6560566672.500.0329miR-10a7.7040666672.940.0294miR-125a-3p10.763425673.420.0092miR-1367.7212896672.940.0127miR-1388.2101106673.040.0076miR-148b9.8323376673.290.0256miR-1502.9187243331.540.0183miR-15a9.9172271673.310.0087miR-1857.6881646672.940.0327miR-199a-3p9.7071506673.280.0306miR-200a8.7038431673.120.0237miR-200b10.739463673.420.0109miR-202-3p8.6935916673.110.0388miR-2058.7496636673.130.0271miR-2207.5938166672.920.0315miR-23b9.3338456673.310.0079miR-242.4249571.280.0135miR-29a3.7122513331.890.0296miR-29b9.7214886673.280.0305miR-327.6984466672.940.0314miR-32210.696456673.420.0298miR-324-3p12.686137673.670.0128miR-335-3p8.6345866673.110.0291miR-342-5p8.8409541673.140.0327miR-3449.6862166673.280.0415miR-3508.6983526673.120.0387miR-36110.240500673.360.0109miR-362-3p7.7174526672.950.0206miR-3815.7160366672.510.0393miR-450a-5P7.7124866672.950.0238miR-467e10.672836673.420.0115miR-49111.639628673.540.0137miR-509-3p7.1855896672.850.0203miR-5465.7302886672.520.0265miR-5989.6850506673.280.0197miR-68012.303260173.620.0092lmiR-8729.7542626673.290.0137mmu-let-7a*8.7707029173.130.0313mmu-let-7b*6.7539604172.750.0325mmu-let-7g*9.4020109173.230.0319mmu-let-7i*7.6999079172.940.0409miR-138*7.7755244172.960.0387miR-17*9.1322334173.190.0255miR-183*9.3880019173.230.0268miR-186*8.8483879173.140.0281miR-193*8.1622504173.020.0314miR-20b*9.4997349173.240.0207
续表1
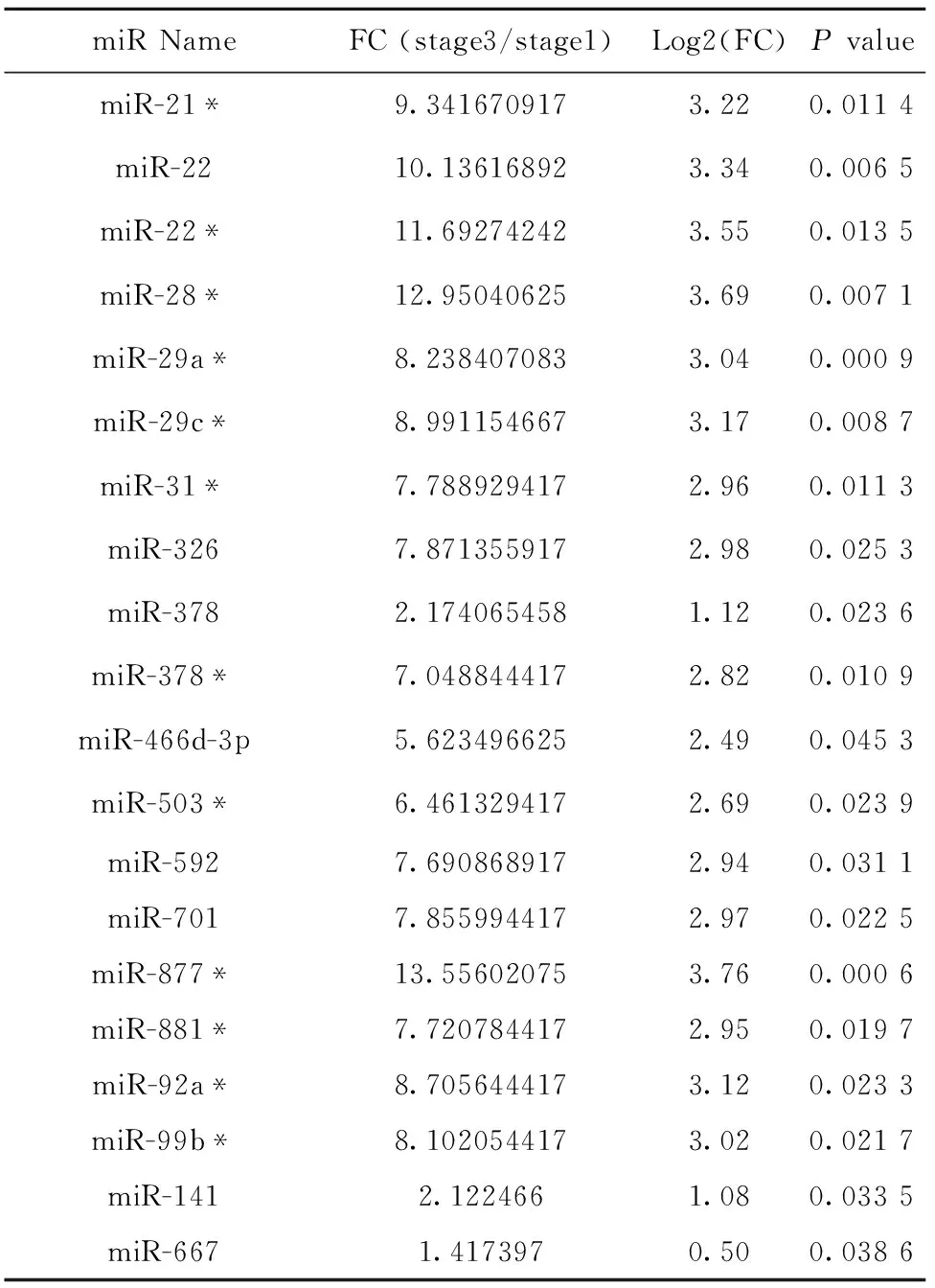
miRNameFC(stage3/stage1)Log2(FC)PvaluemiR-21*9.3416709173.220.0114miR-2210.136168923.340.0065miR-22*11.692742423.550.0135miR-28*12.950406253.690.0071miR-29a*8.2384070833.040.0009miR-29c*8.9911546673.170.0087miR-31*7.7889294172.960.0113miR-3267.8713559172.980.0253miR-3782.1740654581.120.0236miR-378*7.0488444172.820.0109miR-466d-3p5.6234966252.490.0453miR-503*6.4613294172.690.0239miR-5927.6908689172.940.0311miR-7017.8559944172.970.0225miR-877*13.556020753.760.0006miR-881*7.7207844172.950.0197miR-92a*8.7056444173.120.0233miR-99b*8.1020544173.020.0217miR-1412.1224661.080.0335miR-6671.4173970.500.0386
表2 与stage 1 NKT细胞相比,stage 3 NKT细胞表达显著降低的microRNAs
Tab.2 Expression decreased microRNAs in stage 3 NKT cells compared with that in stage 1 NKT cells
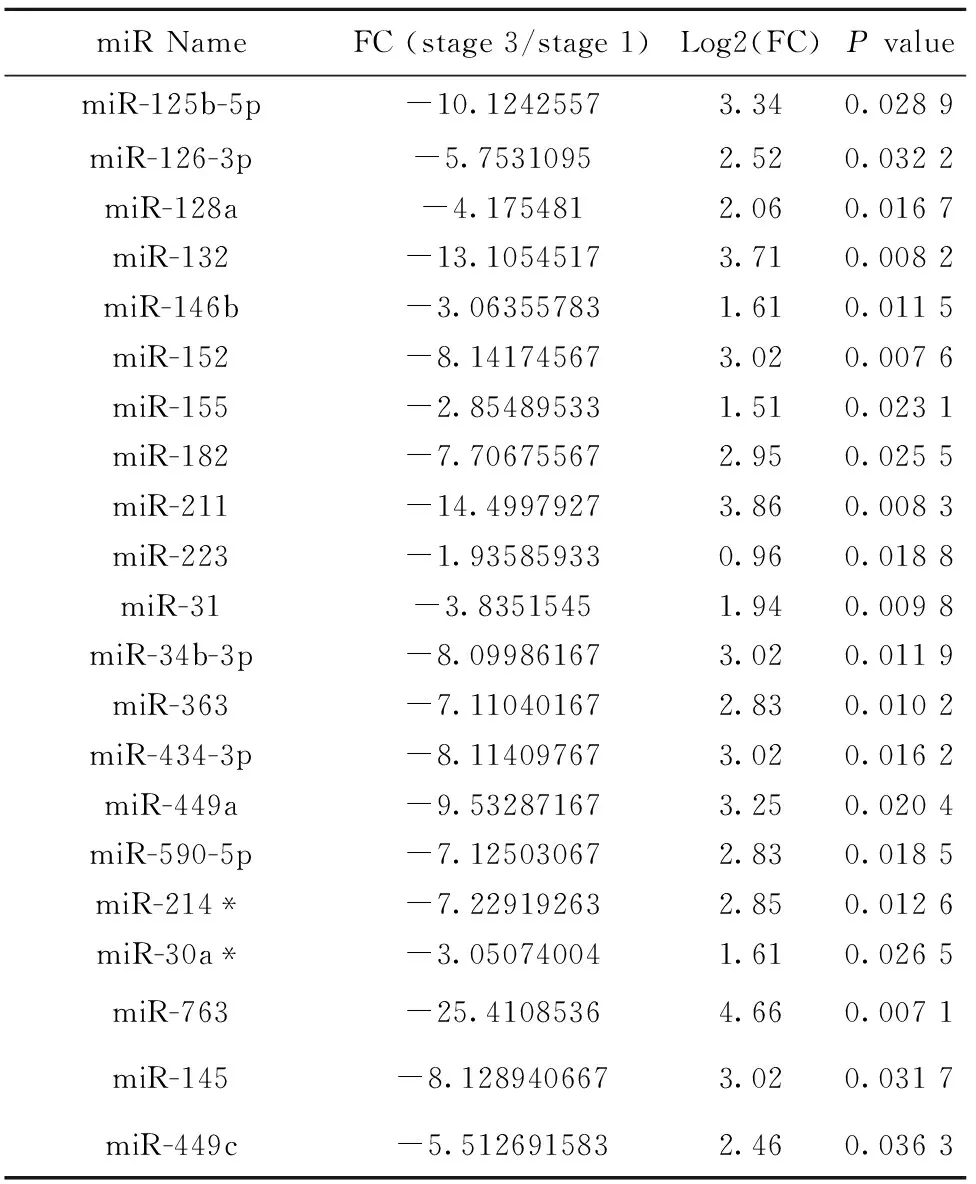
miRNameFC(stage3/stage1)Log2(FC)PvaluemiR-125b-5p-10.12425573.340.0289miR-126-3p-5.75310952.520.0322miR-128a-4.1754812.060.0167miR-132-13.10545173.710.0082miR-146b-3.063557831.610.0115miR-152-8.141745673.020.0076miR-155-2.854895331.510.0231miR-182-7.706755672.950.0255miR-211-14.49979273.860.0083miR-223-1.935859330.960.0188miR-31-3.83515451.940.0098miR-34b-3p-8.099861673.020.0119miR-363-7.110401672.830.0102miR-434-3p-8.114097673.020.0162miR-449a-9.532871673.250.0204miR-590-5p-7.125030672.830.0185miR-214*-7.229192632.850.0126miR-30a*-3.050740041.610.0265miR-763-25.41085364.660.0071miR-145-8.1289406673.020.0317miR-449c-5.5126915832.460.0363
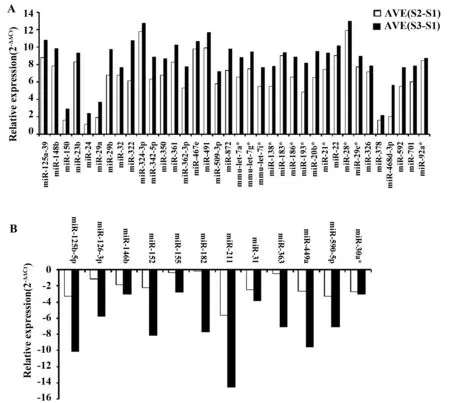
图3 NKT细胞发育成熟过程中表达持续增加和降低的microRNAsFig.3 Continuously increased and decreased microRNAs during development and maturation of NKT cellsNote: microRNA expressional profile analysis revealed that there are 36 microRNAs whose expression increased continuously from stage 1 to stage 3 NKT cells (A),and there are 12 microRNAs whose expression decreased continuously from stage 1 to stage 3 NKT cells(B).
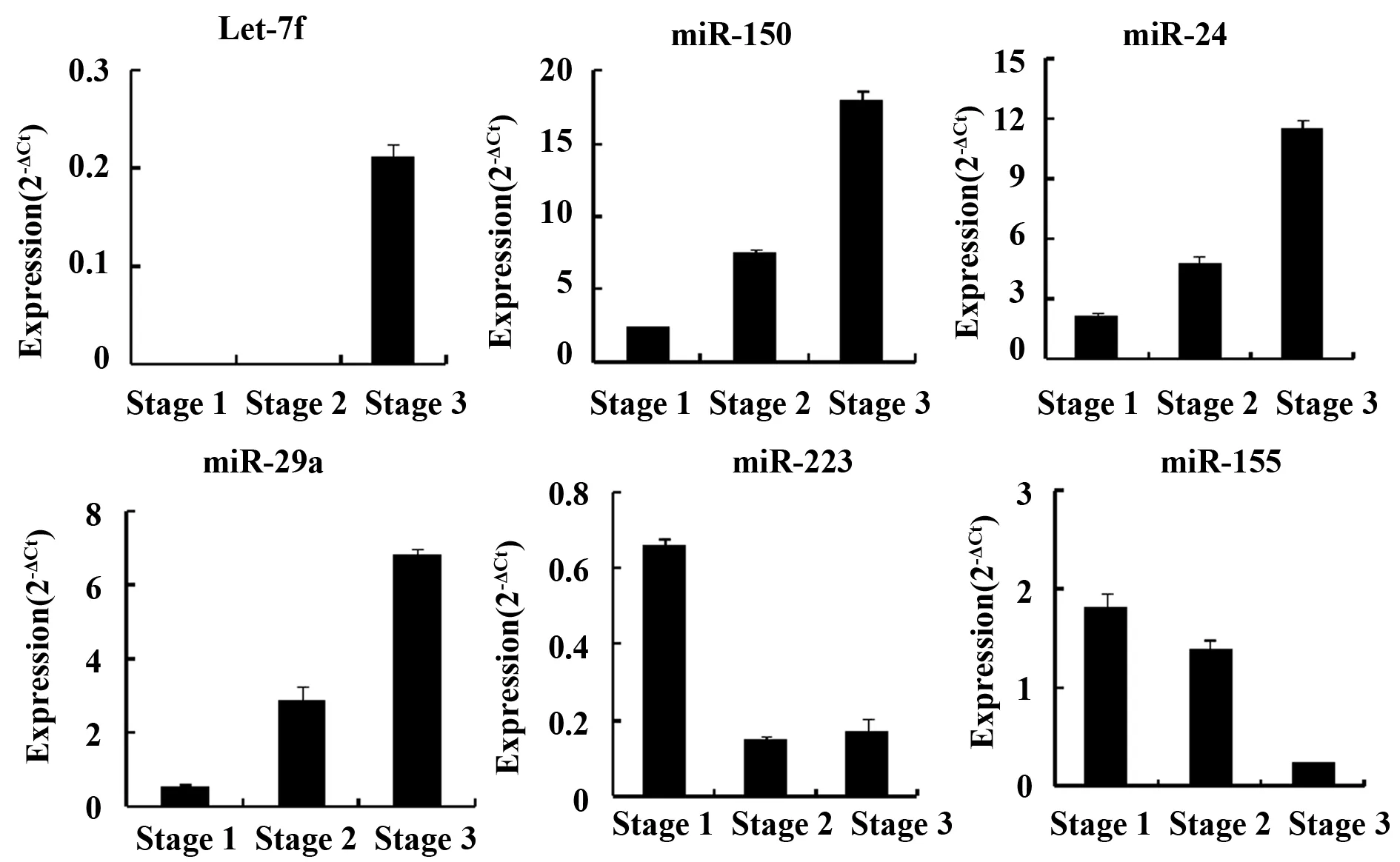
图4 NKT细胞发育成熟过程中特异microRNA的表达变化Fig.4 Expression changes of specific microRNA in process of NKT development and maturationNote: The expression changes of let-7f,miR-150,miR-24,miR-29a,miR-223 and miR-155 in the process of NKT development were detected by single real-time PCR.
3 讨论
microRNAs已被证明是细胞发育和分化过程中重要的基因表达调控机制。microRNA发生机制异常导致NKT细胞数量显著减少,活性降低和细胞因子产生缺陷[5,6]。在此研究中,我们进一步检测了NKT细胞发育、成熟过程中microRNAs表达谱变化,发现NKT细胞的发育、成熟过程伴随大量特异microRNAs表达的显著改变,并且呈现不同的表达变化趋势,提示不同特异microRNA在NKT细胞发育、成熟和效应发挥过程中具有其特异调控功能。
近年来已有研究陆续证实以上发生表达变化的特异microRNAs在NKT细胞发育、成熟和功能发挥过程中发挥关键作用。例如,miR-150是NKT细胞发育、成熟过程表达持续增加的microRNA(图3A,图4),我们先前研究发现miR-150缺失导致胸腺NKT细胞数量减少,成熟阶段stage 3(CD44+NK1.1+)NKT细胞所占比例和数量显著降低,而stage 1(CD44-NK1.1-)和stage 2(CD44+NK1.1-)NKT细胞没有显著变化,表明miR-150在NKT细胞成熟阶段发挥重要调控作用[7]。同样,Lethal-7(let-7) microRNAs家族成员let-7b、let-7f、mmu-let-7a*、mmu-let-7b*、mmu-let-7g*、mmu-let-7i*在NKT细胞发育、成熟过程表达显著增加(表1,图3A,图4)。Pobezinsky等[8]近期研究证实:let-7 microRNAs和Zbtb16 mRNA(编码谱系特异转录因子PLZF)的表达在NKT细胞发育、成熟过程中呈相反趋势变化,let-7 microRNAs在stage 1和stage 2 NKT细胞中低表达,但在stage 3 NKT细胞中表达显著增加;而Zbtb16 mRNA在stage 1和stage 2高表达,在stage 3 NKT细胞表达显著降低。研究者进一步通过let-7 microRNAs基因敲除和靶点分析实验发现,降低let-7 microRNAs表达导致PLZF产生异常增加,NKT细胞发育阻滞在stage 2阶段。由于胸腺stage 3 NKT细胞主要产生IFN-γ,而stage 2 NKT细胞主要产生IL-4和IL-17,因此表明let-7 microRNAs通过靶向PLZF调控NKT细胞的发育和效应功能[9]。另外,本研究中发现miR-155在NKT细胞发育、成熟过程中表达持续降低(图3B,图4),与此结果一致,Burocchi等[10]发现miR-155在stage 1 NKT细胞中表达最高,而在stage 2和stage 3表达渐进性降低,采用转基因小鼠过表达miR-155则导致其靶基因Ets1和ITK表达显著降低,NKT细胞发育阻滞在stage 2阶段。由此可见,与调控NKT细胞发育、成熟和功能发挥密切相关的特异microRNA可能主要存在于其发育过程中发生持续表达变化的microRNAs中。
目前,本研究中发现的大多数发生表达变化的特异microRNAs在NKT细胞发育、成熟和功能发挥中的作用未知,但从已有研究结果推测,主要表达在淋巴细胞谱系的特异microRNAs,除以上已报道的microRNAs外,其他如miR-21、miR-22、miR-29a、miR-31等可能在NKT细胞发育、成熟和效应功能中发挥重要作用。一方面,以上microRNAs在NKT细胞发育、成熟过程中表达持续增加(miR-21,miR-22,miR-29a)或降低(miR-31)(图3A、B,图4);另一方面,以上microRNAs参与NKT细胞发育、成熟及效应发挥相关信号传导通路的调控,如mTOR/PTEN/Akt信号通路在NKT细胞发育、成熟过程中发挥关键作用,而已有在其他非NKT细胞中发现,miR-21,miR-22、miR-31对mTOR/PTEN/Akt信号通路均有重要调控作用,并且miR-21和miR-31对此信号通路的调控作用相反,这与miR-21和miR-31在NKT细胞发育、成熟过程中呈相反趋势表达变化也是一致的[11-13](图3A、B)。miR-29a属于miR-17-92家族成员,研究发现miR-29a能直接靶向IFN-γ mRNA,进而抑制IFN-γ的产生,因此miR-29a可能在调控NKT细胞的效应功能方面发挥作用[14]。虽然有相关文献支持,以上microRNAs在NKT细胞发育、成熟和/或功能发挥中的确切作用尚需在后续实验中逐步加以证实。
总之,本研究发现在NKT细胞发育、成熟过程中伴随大量特异microRNAs的不同表达变化。尽管其中有些microRNAs在NKT细胞发育、成熟和/或功能发挥中的作用已被证实,大多数发生表达变化的特异microRNA对于NKT细胞发育、成熟和效应功能的调控作用及信号通路尚需进一步研究。因此,本次实验中大量新发现与NKT细胞发育和成熟密切相关的microRNAs将为全面了解NKT细胞的生物学特性提供新的研究靶点。
[1] Bendelac A,Savage PB,Teyton L.The biology of NKT cells[J].Annu Rev Immunol,2007,25(1):297-236.
[2] Godfrey DI,Stankovic S,Baxter AG.Raising the NKT cell family[J].Nat Immunol,2010,11(3):197-206.
[3] Das R,Sant′Angelo DB,Nichols KE.Transcriptional control of invariant NKT cell development[J].Immunol Rev,2010,238(1):195-215.
[4] Bartel DP.MicroRNAs:genomics,biogenesis,mechanism,and function[J].Cell,2004,116(2):281-297.
[5] Zhou L,Seo KH,He HZ,etal.Tie2 cre-induced inactivation of the miRNA-processing enzyme Dicer disrupts invariant NKT cell development[J].Proc Natl Acad Sci U S A,2009,106 (25):10266-10271.
[6] Fedeli M,Napolitano A,Wong MP,etal.Dicer-dependent microRNA pathway controls invariant NKT cell development[J].J Immunol,2009,183(4):2506-2512.
[7] 郑全辉,张爱红,郑爱华,等.MiR-150特异调控胸腺iNKT细胞的发育和成熟[J].中国免疫学杂志,2013,29(2):130-134.
[8] Pobezinsky LA,Etzensperger R,Jeurling S,etal.Let-7 microRNAs target the lineage-specific transcription factor PLZF to regulate ter minal NKT cell differentiation and effector function[J].Nat Immunol,2015,16(5):517-524.
[9] Monteiro M,Graca L.NKT cells:innate lymphocytes with a diverse response[J].Crit Rev Immunol,2014,34(1):81-90.
[10] Burocchi A,Pittoni P,Tili E,etal.Regulated expression of miR-155 is required for iNKT cell development[J].Front Immunol,2015,6:140.
[11] Yang W,Gorentla B,Zhong XP,etal.mTOR and its tight regulation for iNKT cell development and effector function[J].Mol Immunol,2015,68(2):536-545.
[12] Hu Y,Wang C,Li Y,etal.MiR-21 controls in situ expansion of CCR6+regulatory T cells through PTEN/AKT pathway in breast cancer[J].Immunol Cell Biol,2015,93(8):753-764.
[13] Amr KS,Bayoumi FS,Elgengehy FT,etal.The role of microRNA-31 and microRNA-21 as regulatory biomarkers in the activation of T lymphocytes of Egyptian lupus patients[J].Rheumatol Int,2016,36(11):1617-1625.
[14] Steiner DF,Thomas MF,Hu JK,etal.MicroRNA-29 regulates T-box transcription factors and interferon-γ production in helper T cells[J].Immunity,2011,26,35(2):169-181.
[收稿2016-11-22 修回2017-01-04]
(编辑 张晓舟)
microRNA profile changes in development of NKT cells
WANGShan,ZHENGQuan-Hui,TIANFeng,YANZhen-Yu,SUNHe-Jun,WANGJia-Ji,ZUORong-Jie,LIU-Chuan,CHENGuang.
NorthChinaUniversityofScienceandTechnology,HebeiKeyLaboratoryforChronicDiseases,SchoolofBasicMedicalScience,Tangshan063000,China
Objective:To explore the microRNA profile changes in the development of NKT cells.Methods: Differently developmental stage of NKT cells in mouse thymus were sorted by flow cytometry.Total RNA were extracted,reversely transcribed and pre-amplified.TaqMan low density microRNA assay and single real-time PCR were applied to detect the expression changes of microRNAs in the developmental process of NKT cells.Results: There were total 92 microRNAs whose expression changed significantly during the development and maturation of NKT cells.Among them,increasly expressed microRNAs were 71,including 36 microRNAs whose expression continuously increased;decreasly expressed microRNAs were 21,including 12 microRNAs whose expression continuously decreased.In addition,single real-time PCR analysis showed that the expression of Let-7f,miR-150,miR-24,miR-29 increased,while the expression of miR-223 and miR-155 decreased during the development and maturation of NKT cells.Conclusion: NKT development and maturation is accompanied by expression changes of large amount of microRNAs,indicating that specific microRNA regulates NKT development and function.
Nature killer T cell;microRNA;Cell development
10.3969/j.issn.1000-484X.2017.07.005
①本文受国家自然科学基金面上项目(81373111)资助。
王 姗(1991年-),女,硕士,主要从事NKT细胞的发育和功能研究。
及指导教师:郑全辉(1973年-),男,博士,副教授,主要从事免疫调节细胞发育功能研究,E-mail: zhqhdlp@sohu.com。
R392.11
A
1000-484X(2017)07-0979-05
②北京大学医学部实验动物科学部,北京100191。
③华北理工大学附属医院血液病学科,唐山063000。
