ABIN蛋白家族结合泛素链与A20参与调控NF-κB的影响与意义①
2017-08-07王森林李扬秋
陈 千 王森林 林 晨 李扬秋
(暨南大学微生物与免疫学系 广东省分子免疫与抗体工程重点实验室血液病研究所,广州510632)
ABIN蛋白家族结合泛素链与A20参与调控NF-κB的影响与意义①
陈 千 王森林 林 晨 李扬秋②
(暨南大学微生物与免疫学系 广东省分子免疫与抗体工程重点实验室血液病研究所,广州510632)
1 ABIN概述
ABIN蛋白家族包含ABIN1、ABIN2、ABIN3三种蛋白,这三种蛋白都显示出有限的序列同源性:含有同源区域AHD1和泛素交联区域UBAN(图1)。
AHD1可介导ABIN蛋白与A20相结合,UBAN可介导ABIN与泛素相交联,通过ABIN结合泛素、A20编辑泛素的方式来抑制NF-κB的活化,这体现出了ABIN蛋白家族的同一性。
在组织分布和抑制激活上,ABIN蛋白家族表现出明显的差异性。ABIN1大量表达在活化的免疫组织和细胞上,与NF-κB亚型中的p105和p100相互作用,p105和p100具有抑制转录的作用,ABIN1通过A20编辑泛素或竞争泛素链来激活P105和P100,最终抑制NF-κB活化。ABIN2广泛存在于鼠类动物和人类的组织或细胞系中,既能作用于p105和p100来抑制NF-κB活化,也能作用于p52和p50来激活NF-κB,与ABIN1相比,其作用较为复杂。ABIN3能被李斯特菌诱导产生,在体内不同器官组织,其表达量也显著不同,其与ABIN1作用在NF-κB上的靶点类似,可抑制NF-κB活化。
ABIN蛋白,最初,研究人员通过对泛素进行酵母双杂交筛选,发现ABIN1是一种泛素交联蛋白。Wagner等[1]的研究中发现这些交联蛋白的活性取决于泛素链的长度,泛素链越长,ABIN1蛋白的活性越大,且ABIN1蛋白不与单体泛素进行交联,而是与至少由3个泛素基团所组成的多聚泛素链进行交联。编码人类ABIN1蛋白的基因是TNIP1,基因位于染色体5q32-33.1上,由18个外显子构成。其遗传物质mRNA可在活化的CD4+和CD8+等T淋巴细胞中呈现出高水平表达,这说明TNIP1基因在免疫系统组织细胞中广泛表达,且T淋巴细胞的活化与ABIN1蛋白表达的正向调节有着紧密的联系。ABIN1的cDNA克隆揭示了其有两种亚型的ABIN1蛋白存在,即ABIN-1α和ABIN-1β。两种亚型蛋白中不同外显子的缺失或者碱基对的插入,都会形成不同的亚型转录产物,后者在正常人和白血病患者中表现出明显的差异表达。一个有趣的现象是,在急性髓性白血病的药物化疗的时候,完整的ABIN1和ABIN-1α3蛋白的表达水平明显降低,这提示治疗急性髓性白血病的药物会破坏某些作用靶点,达到NF-κB抑制效应。
ABIN2蛋白是一种在人类和鼠类中发现的一种分子量大约49 kD的蛋白,其与ABIN1不同的是,ABIN2蛋白在TNF、LPS、IFN-γ等刺激下,其表达量并不发生改变,这意味ABIN2不是依赖NF-κB调控表达的蛋白[2]。人类ABIN2基因位于染色体4p16.3上,包含6个外显子,其与鼠类的基因定位和外显子构成不一样,但是与鼠类ABIN2相同的是,它们的cDNA都共同编码一个分子量接近49 kD的蛋白,后者显示出78%的氨基酸同源性。ABIN2定位在细胞质,在N端,包含有4个可能存在的螺旋卷曲区域,但是第195号氨基酸的缺失会使得ABIN2进入细胞核,这预示着N端可能参与ABIN2在细胞质的定位作用。ABIN3蛋白是最早发现在人类单核巨噬细胞感染李斯特菌时,被诱导产生的一种新蛋白。其与ABIN1相同的是,两者都是参与NF-κB调控表达的蛋白。人类ABIN3基因位于染色体4q27上,编码一个分子量接近39 kD的蛋白。与人类ABIN3蛋白类似的是,鼠类ABIN3蛋白也能经由单核巨噬细胞受到IL-1、TNF和TLR等刺激这条途径所产生。通过对3种人类ABIN蛋白进行全长度蛋白序列的比对分析发现,与ABIN2相比,ABIN3和ABIN1有更多的同源性,这是因为ABIN2缺乏AHD3区域,而后者在ABIN1和ABIN3中都普遍存在。对人体组织进行RNA印迹分析,显示ABIN3蛋白mRNA在脑、肝、脾、肺、肌肉、皮肤等组织器官中呈现出高表达,在肾、骨髓呈现低表达,在心脏、唾液腺等多种腺体中无表达。
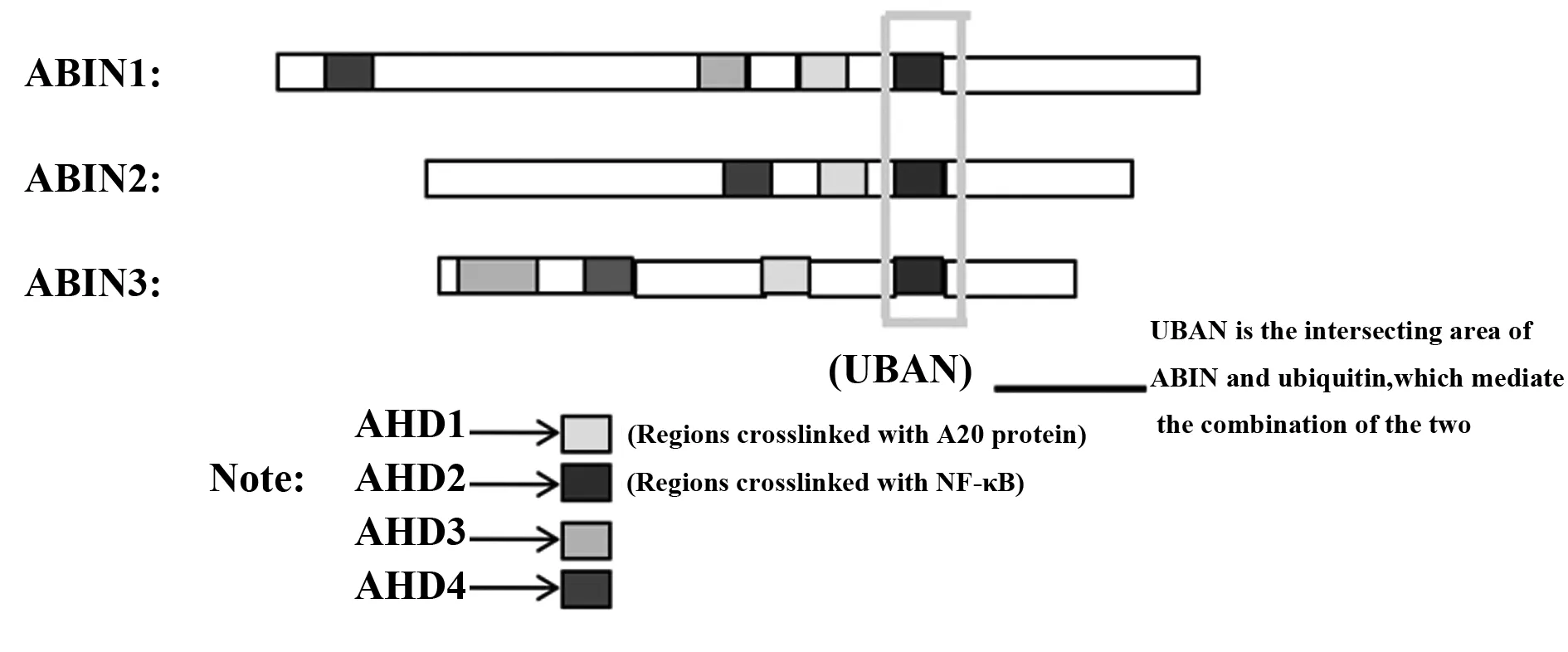
图1 ABIN家族的结构性区域Fig.1 Structural domains of ABINsNote: Localization and sequence alignment of AHD and UBAN domains in ABIN-1,-2 and -3.
由此看来,ABIN蛋白家族各成员在组织内分布的特点可使其成为潜在的治疗靶点,其在外源性抗原(如化疗药物、超抗原等)的刺激下,通过抑制或活化NF-κB信号通路的途径,来对分布组织周围的免疫细胞或器官产生不同形式的免疫调节,影响着机体免疫系统内环境的稳定。
2 A20与机体的免疫调节
2.1 A20与泛素化修饰 A20(也称为TNFAIP3),是一种1990年首次在人类脐静脉中发现的,由细胞因子诱导的蛋白。在体内,A20是一种有效的抗炎因子,能够限制多个细胞内的信号级联反应[3]。虽然最初A20被描述成一种能抑制TNF诱导的细胞凋亡的抑制剂,但后续大量研究表明,过度表达的A20能抑制不同刺激所引起的NF-κB信号的激活,这其中就涉及泛素化修饰。泛素化修饰是一种可逆的、能够对蛋白质翻译的产物进行修饰的过程,是NF-κB信号通路活化调节的最重要机制[4-7]。这一修饰过程参与细胞增殖、分化、转录调节、炎症免疫等众多生命活动的调控,与机体免疫调节与自身免疫耐受联系紧密。Lu等[8]对小鼠进行靶向基因标记,敲除小鼠的A20基因,阻断其编码的A20蛋白介导的去泛素化效应后数周,发现丧失去泛素化能力的小鼠对TNF所引起的结肠炎表现出高敏感性,实验进一步研究发现,这是由于A20能提高E3泛素连接酶的活性,后者能构筑k48泛素链,诱导NF-κB调节蛋白的泛素化,进而靶向降解调节蛋白,从而导致炎性转录蛋白的降解。而阻断这一效应,则导致小鼠结肠炎加重。
Fuminori等[9]的研究证明A20蛋白C端的锌指结构7(ZF7)能对多聚泛素链发挥特异性识别作用,以此来促进A20蛋白在TNF受体(TNFR)介导的NF-κB信号中的聚集,最终抑制NF-κB活化。Bosanac等[10]发现锌指结构4(ZF4)能使得自身结合绑定E2泛素结合酶,并提高E3泛素连接酶的活性,这两种酶能在A20促进受体交联蛋白(RIP)的活化中发挥重要的作用,进而影响到NF-κB的活化。
2.2 A20与肿瘤免疫 与以往A20主要涉及的炎症报道不同的是,近年越来越多的研究显示A20在血液肿瘤中也存在表达水平低下的情况。Yang等[11]在多例弥漫大B型淋巴瘤患者的血液细胞中,检测到A20的转录和翻译水平均比正常成年人低下。实验利用佛波酯/离子霉素(PMA/IO)刺激弥漫大B淋巴瘤后,利用PCR和Western blot技术发现PMA/IO能显著上调A20的转录和翻译水平,流式细胞术检测凋亡后发现,弥漫大B型淋巴瘤细胞在PMA/IO的诱导下发生凋亡。Kato等[12]对淋巴细胞肿瘤患者的基因样本进行高通量基因芯片分析后发现,患者基因样本中A20存在缺失或者失活等特点。由于A20能通过负反馈抑制NF-κB的活化,因此,在多种血液肿瘤中A20失活或下调的情况与NF-κB通路的活化有关,而上调A20的表达,能促进肿瘤细胞的凋亡。目前的研究认为,在T细胞白血病和B细胞淋巴瘤中,A20是作为一个肿瘤抑制因子发挥作用的[13-15]。如果能以A20为治疗靶点,开发针对上调A20的化疗药物,将对淋巴系统肿瘤的治疗起到积极的推动作用。
3 A20协同ABIN蛋白对NF-κB信号的调控
A20通过两种信号通路来协助ABIN蛋白抑制NK-κB的激活。在通路1中(如图2)ABIN蛋白扮演一个适配器(adaptor)蛋白的形象,偶联A20到一个活跃的、多聚泛素化的NF-κB调节蛋白身上, 例如NEMO。模型进一步阐明,ABIN蛋白能促进提高A20作为水解酶和E3连接酶的活性,且与多聚泛素化NF-κB调节蛋白结合后,A20随即发挥其水解酶的特性,介导K63连接的多聚泛素链断裂,导致K63的去泛素化,最终使NF-κB调节蛋白失活,NF-κB受到抑制。在通路2中,A20发挥E3连接酶的特性来构筑K48相连的多聚泛素链,后者与以NEMO为代表的NF-κB调节蛋白相结合形成K48泛素化NEMO,K48泛素化NEMO再与蛋白酶体相结合最终导致NEMO的降解,抑制NF-κB活化。总之,对于NK-κB调节蛋白来说,K63连接的泛素自发断裂和K48连接的泛素被蛋白酶体标记进而降解这两种途径,其结果都导致NK-κB转录因子受到抑制。
综上所述,在抑制NF-κB信号通路活化的进程中,A20扮演效应器的角色,类似免疫细胞中的CD8+T细胞,发挥杀伤效应,而ABIN蛋白家族则以适配器的形式,类似CD4+T细胞,其发挥的辅助作用,可介导A20对泛素化蛋白发挥水解效应,参与抑制NF-κB通路的激活状态。
4 ABIN蛋白家族在调控NF-κB信号表达中的影响
4.1 ABIN1蛋白的对NF-κB的调控机制 在经典的受体-转换器(adaptors)-接头分子(TRAFs)-IKK的NF-κB激活途径中,IKK激活后,导致NF-κB抑制因子(IκB)被降解释放出NF-κB,最终进入细胞核内启动相关炎症细胞因子的表达。在这个过程中,泛素化链与转换器或接头分子相结合,通过泛素化酶的作用,对转换器和接头分子进行泛素化修饰,通过激活转化生长因子激酶(TAK1)来调节IKK的活化。最近的研究发现ABIN1蛋白在调节NK-κB信号,维持免疫稳态中发挥重要作用,其能参与到与A20调控相关的NF-κB作用靶点中去,在结合泛素链和A20这两者中发挥重要作用。Callahan等[16]在牛皮癣患者身上发现,Tnip1基因编码的ABIN1是一种能与泛素广泛结合的蛋白,通过AHD1区域(ABIN和A20共表达区域)的作用与A20相结合,后者通过介导去泛素化效应阻断IKK上游激活分子MyD88与泛素链相结合,抑制IKK的活化,阻碍NF-κB激活。研究显示,除了NF-κB外,在JNK、ERK、p38MAPK等多种促炎信号通路中,ABIN1也表现出重要的抑制效应。另外ABIN1和NEMO(即IKK-γ)共表达的能与NF-κB调节蛋白相结合的区域(UBAN),能特异性的介导ABIN1与相应泛素化的调节蛋白相结合,抑制NF-κB不同亚基的活化。最后除了AHDs和UBAN区域能各自发挥抑制NK-κB转录因子的作用外,ABIN1蛋白也能竞争NEMO羧基末端的结合区域(NBD),发挥其在NK-κB上的抑制作用[17,18]。
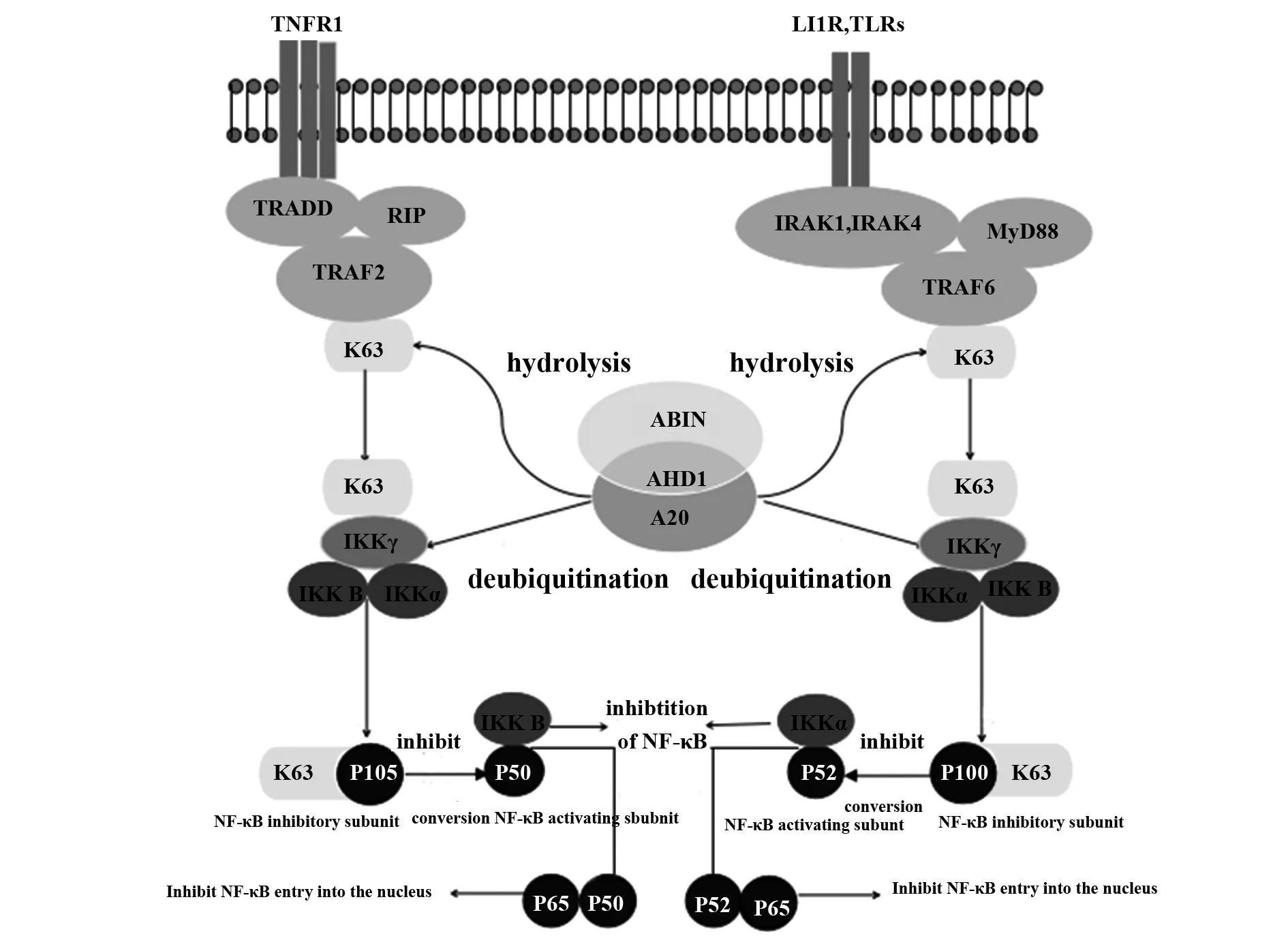
图2 A20结合ABIN蛋白抑制效应机制Fig.2 Inhibitory effect mechanism of A20 and ABIN protein
事实上,ABIN1蛋白也能与多聚泛素链相结合,竞争IL-1受体相关激酶1(IRAK1)、受体交互蛋白(RIP)等NF-κB调节蛋白与后者相结合,进而影响NK-κB的活性(表1)。ABIN1蛋白和NEMO蛋白共表达的调节蛋白结合区域(UBAN)保守氨基酸的突变,能削弱ABIN1蛋白和这些多聚泛素化蛋白的交联作用[19,20]。同样地,ABIN1蛋白单独表达的泛素结合区域(NBD)突变后不能够减弱TNF诱导NF-κB活性的能力[21]。这说明,ABIN1抑制NF-κB活化的能力既可以通过与NEMO的泛素联合区域UBAN,也能通过自身的泛素结合区域(NBD)发挥作用。
4.2 ABIN2蛋白的对NF-κB的调控机制 ABIN2蛋白是一种NF-κB基因表达的负向调控者,其与ABIN1蛋白类似,能与A20相结合,作用于NEMO,抑制IL-1R等诱导的NF-κB激活,表现出干预NF-κB下游游信号的能力。另外,ABIN2的过表达能抑制EGF诱导的NF-κB激活,并且也表现出干预NF-κB上游信号蛋白的能力: 通过与A20相结合,后者抑制RIP1、IRAK1等NF-κB调节蛋白与接头分子TRAF2或TRAF5(泛素连接酶)相结合,通过抑制调节蛋白的泛素化来抑制NF-κB的活化。在Liu等[22]的研究显示,通过缺失定位法(deletion mapping),发现一个含50个氨基酸大小的片段在ABIN2与IKKγ(NEMO)结合的过程中发挥重要作用,且RIP也有类似于ABIN2的氨基酸残余领域。当ABIN2在细胞中过表达时,会与IKKγ绑定在一起,竞争受体交联蛋白(RIP)结合IKKγ的位点,阻碍RIP和IKKγ之间的联系,也就大大削减其介导NK-κB激活的能力。
表1 与ABIN1相交蛋白的交联区域
Tab.1 Region of protein that intersects ABIN1

CrossingproteinCross-linkingregionInfluenceofcrosslinkingA20AHD-1Cross-linkingwithNF-κBcranscriptionfac-torsNEMONBDInhibitionofNF-κBtranscriptionfactorsRIP-1UBANRegulationofDISC,controlcellapoptosisTRAF-1UBANInhibitTLR/MyD88signalNF-κB(p105)AHD-2InhibitionofNF-κBtranscriptionfacors
Note:AHD1.ABIN homology region 1;AHD2.ABIN homology region 2;NBD.NEMO binding region;Ubiquitin binding region of UBAN.ABIN and NEMO protein;TRAF1.TNF receptor related factor 1.
但也有研究显示,ABIN2蛋白也能促进NK-κB信号的激活。Leotoing等[23]通过体外激酶试验测定IKKα的活性,发现在缺乏ABIN2的时候,检测到对IκBα起作用的IKKα激酶活性非常微弱,这显示ABIN2能够强化IKKα介导的NF-κB的活性,在NF-κB激活转录中发挥积极的调控作用。实验进一步发现,ABIN-2也能极大增强IKKα自身磷酸化。通过Western blot实验发现,ABIN-2不仅能显著增加体内IκBα磷酸化丝氨酸32和丝氨酸36的含量,还能增强IKKα的磷酸化。上述实验结果表明ABIN-2能诱导体内IKKα自身磷酸化,提高激酶活性,最终促进NF-κB的活化。不过,研究也发现当ABIN2蛋白缺乏时,脂多糖(LPS)和B与T淋巴细胞受体诱导NF-κB信号激活并不受到影响。
由此,提示ABIN2蛋白对NF-κB抑制因子的激酶(IKK)的各个亚基有不同的调控作用,该作用究竟如何直接影响到NF-κB的活化仍需要深入研究。
4.3 ABIN3蛋白的对NF-κB的调控机制 对人类ABIN3蛋白mRNA启动子进行的分析显示,ABIN3能在脂多糖(LPS)和TNF诱导NF-κB活化的途径中大量表达。这揭示,ABIN3蛋白表达可能参与NF-κB的调控。与ABIN其他家族蛋白相似,人类ABIN3也能结合A20并通过后者来编辑泛素链,来达到抑制TNFR1、IL-1R等受体介导的NF-κB激活,但对IKK-β介导的NF-κB激活产生不了作用[1,24]。
另有研究发现,ABIN3在小鼠与人类中对NK-κB所发挥的调控作用截然相反。通过对小鼠和人的ABIN3基因进行大量扩增,进行序列分析后发现,小鼠中缺乏完整的ABIN同源区域,由于ABIN蛋白家族共用AHD区域,因此联合图1和表2可以得出ABIN3与A20结合的区域是AHD1,与NF-κB结合的区域是AHD2。因此,通过ABIN3与NF-κB相结合后,A20能发挥去泛素化效应抑制NF-κB活化。因此鼠类ABIN3蛋白缺失AHD2区域,就不能与ABIN3蛋白的AHD2位点进行结合,故对NF-κB的激活产生不了抑制效应。 然而在人类中,ABIN3却能够抑制Toll样受体(TLR)、TNF信号诱导的NF-κB活性,其调控的机制是:首先,人类ABIN3蛋白具有能结合NF-κB的AHD2区域,后者能与NF-κB上的相应位点进行结合,来抑制NF-κB的活化。其次,ABIN3蛋白能在单核细胞中强制表达,通过抑制IκBα细胞质的降解,进而抑制NF-κB的激活。
与AHD2区域在正常小鼠ABIN3中缺失的相似性研究发现,AHD3区域在正常人类ABIN2中也存在缺失现象。对这些缺失区域的研究目前还比较少,究竟其在疾病的易感性方面,在基因层面所发挥的作用有多大,还是一个待解决的问题。
除了NEMO外,其他NF-κB调节蛋白例如RIP(受体蛋白)也都能在TNF受体1(TNFR1)的介导下与K63泛素化链相结合后,A20能抑制RIP与K63之间的结合,从而终止TNFR1介导的NF-κB下游的信号通路。因此,进一步探寻A20与NF-κB调节蛋白的关系,或许能为ABIN抑制NF-κB提供新的理论依据。
5 结语
ABIN蛋白家族是一类能独立或协同A20发挥NF-κB抑制效应的蛋白质,其各成员的同一性和异质性使其慢慢成为NF-κB信号研究方向的热点。但是,在现今对NF-κB展开的研究中,ABIN所占的权重还很小,在不同物种以及如何影响IKK各亚基等有关机制的理论研究中,所达到的深度还不够,还需要更深层次的研究。因此,进一步开展有关ABIN对NF-κB调控机制的研究,将对建立以ABIN为作用靶点的治疗策略起到推动作用。
[1] Waqner S,Carpentier I,Roqov V,etal.Ubiquitin binding mediates the NF-κB inhibitory potential of ABIN proteins[J].Oncoqene,2008,27(26):3739-3745.
[2] Van HS,Dalaei F,Heyninck K,etal.Identification of a novel A20-binding inhibitor of nuclear factor-κB activation termed ABIN-2[J].J Biol Chemistry,2001,276(32):30216-30223.
[3] Koizumi M,Inoue T,Yamazaki H,etal.A20:linking a complex regulator of ubiquitylation to immunity and human disease[J].Nihon Iqaku Hoshasen Gakkai Zasshi,1995,55(8):603-605.
[4] Chen ZJ.Ubiquitin Signaling in the NF-κB pathway[J].Nat Cell Biol,2005,7(8):758-765.
[5] Shin C,Ito Y,Ichikawa S,etal.MKRN2 is a novel ubiquitin E3 ligase for the p65 subunit of NF-κB and negatively regulates inflammatory responses[J].Scientific Reports,2017,7:46097.
[6] Vincendeau M,Hadian K,Messias AC,etal.Inhibition of Canonical NF-κB signaling by a small molecule targeting NEMO-ubiquitin interaction[J].Scientific Reports,2016,6:18934.
[7] Hailfinger S,Schmitt A,Schulzeosthoff K.The paracaspase MALT1 dampens NF-κB signaling by cleaving the LUBAC subunit HOIL-1[J].Febs J,2015,283(3):400-402.
[8] Lu TT,Onizawa M,Hammer GE,etal.Dimerization and ubiquitin mediated recruitment of A20,a complex deubiquitinating enzyme[J].Immunity,2013,38(5):896-905.
[9] Tokunaga F,Nishimasu H,Ishitani R,etal.Specific recognition of linear polyubiquitin by A20 zinc finger 7 is involved in NF-κB regulation[J].EMBO J,31(19):3856-3870.
[10] Bosanac I,Wertz IE,Pan B,etal.Ubiquitin binding to A20 ZnF4 is required for modulation of NF-κB signaling[J].Mol Cell,2010,40(4):548-557.
[11] Yang WY,Li Y,Li PH,etal.PMA/IONO affects diffuse large B-cell lymphoma cell growth through upregulation of A20 expression[J].Oncol Reports,2016,36 (2):1069-1075.
[12] Kato M,Sanada M,Kato I,etal.Frequent inactivation of A20 in B-cell lymphomas[J].Nature,2009,459(7247):712-716.
[13] Johnsen SJ,Gudlaugsson E,Skaland I,etal.Low protein A20 in minor salivary glands is associated with lyphoma inprimary sjogrens syndrome[J].Human Immunol,2016,83(3):181-187.
[14] Cen H,Tan X,Guo B.A20 mutation is not a prognostic marker for activated B-cell-like diffuse large B-cell lymphoma[J].PLoS One,2015,10(12):e0145037.
[15] Wu WS,Xu ZX,Chang KS.The promyelocytic leukemia protein represses A20-mediated transcription[J].J Biological Chemistry,2002,277(35):31734.
[16] Callahan JA,Hammer GE,Agelides A,etal.ABIN-1 protects against psoriasis by restricting MyD88 signals in dendritic cells[J].J Immunol,2013,191(2):535-539.
[17] Mauro C,Pacifico F,Lavorqna A,etal.ABIN1 binds to NEMO/IKKγ and co-operates with A20 in inhibiting NF-κB[J].J Biol Chem,2006,281(27):18482-18488.
[18] Nanda SK,Veniqalla RK,Ordureau A,etal.Polyubiquitin binding to ABIN1 is required to prevent autoimmuinty[J].J Exp Med,2011,208(6):1215-1228.
[19] Khanolkar RC,Kalogeropoulos M,Lawrie A,etal.Leukocyte Ig-Like receptor B1 restrains dendritic cell function through increased expression of the NF-κB regulator ABIN1/TNIP1[J].J Leukoc Biol,2016,100(4):737-746.
[20] Ramirez VP,Krueger W,Aneskievich BJ.TNIP1 reduction of HSPA6 gene expression occurs in promoter regions lacking binding sites for known TNIP1-repressed transcription factors[J].Gene,2016,555(2):430-437.
[21] Heyninck K,Kreike MM,Beyaert R.Structure-function analysis of the A20-binding inhibitor of NF-kappa B activation,ABIN-1[J].FEBS Letters,2003,536(1-3):135-140.
[22] Liu WK,Yen PF,Chien CY,etal.The inhibitor ABIN-2 disrupts the interaction of receptor-interacting protein with the kinase subunit IKKγ to block activation of the transcription factor NF-kB and potentiate apoptosis[J].Biochem J,2004,378(pt3):867-876.
[23] Leotoing L,Chereau F,Baron S,etal.A20-binding inhibitor of nuclear factor-κB (NF-κB) -2 (ABIN2) is an activator of inhibitor of NF-κB (IκB) Kinase α(KKα)-mediated NF-kB transcriptional activity[J].J Biol Chem,2011,286(37):32277-32288.
[24] Wullaert A,Verstrepen L,Van Huffel S,etal.LIND/ABIN-3 is a novel LPS-inducible inhibitor of NF-κB activation[J].J Biol Chem,2007,282:81-90.
[收稿2016-08-24 修回2016-10-13]
(编辑 张晓舟)
10.3969/j.issn.1000-484X.2017.07.031
①本文为国家自然科学基金(81270604、81570143)、国家自然科学基金重大研究计划项目(培育项目)(91129720)、广州市科技计划项目(201510010211)和中央高校基本科研业务费专项资金资助(21616108)。
陈 千(1991年-),男,在读硕士,主要从事白血病的肿瘤免疫学研究,E-mail:gxx859123@126.com。
R392.12
A
1000-484X(2017)07-1101-05
②通讯作者,E-mail:tlinc@jnu.edu.cn。
