瘦素通过NLRP3炎性体对小鼠骨髓树突状细胞的作用及机制①
2017-08-07于一云付思思
于一云 付思思 刘 磊 杨 洁 韩 磊 吕 玲
(复旦大学附属华山医院风湿科,上海200040)
瘦素通过NLRP3炎性体对小鼠骨髓树突状细胞的作用及机制①
于一云 付思思②刘 磊 杨 洁 韩 磊③吕 玲
(复旦大学附属华山医院风湿科,上海200040)
目的:探讨瘦素通过NLRP3炎性体对树突状细胞的作用及其机制。方法:体外诱导小鼠骨髓来源的树突状细胞(BMDCs),用不同浓度瘦素与BMDCs共同培养,分别检测培养上清IL-1β和IL-18的蛋白和基因水平,用FLICA试剂盒或ROS试剂盒分别在流式细胞仪上检测caspase-1活性或胞内ROS生成情况。瘦素与BMDCs共培养,加入caspase-1抑制剂或用siRNA干扰NLRP3基因表达,检测前后加入IL-1β和IL-18基因和蛋白表达水平。瘦素与BMDCs共培养,加入ROS抑制剂或KCL,检测加入前后IL-1β和IL-18蛋白分泌水平。结果:瘦素促进BMDCs分泌IL-1β和IL-18。瘦素通过上调NLRP3基因促进IL-1β和IL-18基因和蛋白表达,通过激活caspase-1蛋白提高IL-1β基因和蛋白水平,K+外流参与此过程。 结论:瘦素通过激活NLRP3炎性体促进BMDCs IL-1β和IL-18基因和蛋白表达,此过程部分通过K+外流实现。这提示瘦素可能是NLRP3炎性体的激活剂。
瘦素;NLRP3炎性体;树突状细胞;细胞因子
NLRP3,又名 NLAP3,与衔接蛋白 ASC 和效应蛋白 caspase-1 共同构成NLRP3 炎性体。NLRP3 炎性体是目前发现的配体最多的炎性体,可以被外源性病原微生物及内源性晶体、尿酸、dsDNA、ATP 等激活[1,2],各种配体主要通过3种方式激活 NLRP3 炎性体:细胞内 K+外流、ROS的产生和溶酶体破裂[2,3]。NLRP3 炎性体激活最终导致caspase-1 的活化从而促进炎症细胞因子 IL-1β、IL-18 的分泌而调节免疫应答和炎症反应[4]。NLRP3 主要在包括单核-巨噬细胞、树突状细胞(DC)等髓系细胞中表达,但是最近多篇研究报道Th1、Th2、Th17均可表达NLRP3[5-7]。因为NLRP3炎性体与多种疾病,包括Muckle-Wells综合征、阿尔茨海默病、2型糖尿病,以及实验性自身免疫性脑脊髓膜炎、系统性红斑狼疮等自身免疫性疾病相关,大量研究致力于阐明NLRP3炎性体在各种疾病中的作用及其机制[7-11]。
瘦素是脂肪细胞分泌的细胞因子样激素,其最基本的功能是控制代谢和能量输出,但是近来大量研究发现瘦素也可调节固有或适应性免疫应答。瘦素不仅促进NK细胞活化、中性粒细胞趋化、巨噬细胞分泌TNF-α、IL-6和IL-12[12],而且促进Th17应答[13]和下调Treg水平[14]。NAG-1小鼠WAT中caspase-1和ASC在基因和蛋白水平显著下降,同时伴随IL-18、IL-1β和瘦素水平下降[15],这提示瘦素和NLRP3炎性体可能存在某种相关。这里我们报道瘦素通过K+外流激活小鼠骨髓来源的树突状细胞(Bone marrow-derived dendritic cells,BMDCs)NLRP3炎性体进而促进IL-1β和IL-18分泌,这表明瘦素是NLRP3炎性体的一种新的激活剂而且可以作为NLRP3炎性体的调节剂。
1 材料与方法
1.1 主要材料和试剂 野生型 C57BL/6J(B6)小鼠6~8周龄,购于上海斯莱克公司;RPMI1640和胎牛血清购于Gibco;瘦素、GM-CSF和IL-4购于Pepro Tech;Ac-YVAD-cmk、KCl 均购于Sigma;caspase-1 FLICA试剂盒购于Immunochemistry;ROS检测试剂盒购于Abcam;CD11c流式抗体购于Biolegend;ELISA试剂盒购于R&D system或科诺迪生物科技有限公司;Trizol购于Invitrogen;逆转录试剂盒购于TaKaRa,Real-time PCR试剂盒购于Biotool;引物由生工生物工程公司合成;siRNA由拓然生物公司合成。
1.2 实验方法
1.2.1 小鼠BMDCs细胞的体外诱导和培养 无菌取B6小鼠的骨髓细胞,悬于RPMI1640 完全培养基中,加入GM-CSF 20 ng/ml,IL-4 15 ng/ml,37℃、5% CO2饱和湿度条件下培养。第4天轻晃培养皿,吸去培养上清,以去除未贴壁细胞。补充RPMI1640完全培养基至原来体积,补充GM-CSF 20 ng/ml,IL-4 15 ng/ml,继续培养。第7 天,重复第4 天的步骤。第10 天,轻柔地吹打皿底细胞,收集细胞悬液,离心洗涤。收获的细胞为普通未成熟DC 细胞(iDC)。若第9 天加入LPS 100 ng/ml 促成熟,第10天收获的细胞即为普通成熟DC 细胞(mDC)。使用CD11c流式抗体检测BMDCs的纯度,显微镜下观察BMDCs的形态。
1.2.2 小鼠BMDCs处理 分组如下:正常对照组,LPS组,ATP组,LPS+ATP组,不同剂量瘦素组(10、100、500 ng/ml)。其中瘦素与小鼠BMDCs共培养24 h,ATP、LPS、LPS+ATP分别与BMDCs共培养3 h,之后分别加入Ac-YVAD-cmk(18.4 μmol/L)或NLRP3 siRNA(20 μmol/L)或KCL(100 μmol/L),取共培养上清或细胞沉淀行下一步试验。
1.2.3 细胞因子检测 ELISA试剂盒检测培养上清中IL-1β和IL-18的水平。实验步骤按照说明书进行。
1.2.4 RNA提取、cDNA合成和实时定量PCR 根据说明书用Trizol试剂提取细胞总RNA,用逆转录试剂盒合成cDNA。实时荧光定量PCR在ABI Prism 7500 PCR上用SYBR green master mix进行。扩增产物用1%的琼脂糖凝胶电泳分析。所有基因表达量以GAPDH计算。所用引物序列如下:NLRP3-F:ATTACCCGCCCGAGAAAGG,NLRP3-R:CATGAGTGTGGCTAGATCCAAG;IL-1β-F:GTACAA-GGAGAACCAAGCAA,IL-1β-R:CCGTCTTTCATTACACAGGA;IL-18-F:AGGACACTTTCTTGCTTGC-C,IL-18-R:CACAAACCCTCCCCACCTAA。
1.2.5 流式细胞分析 体外诱导获得小鼠BMDCs后标记CD11c抗体检测BMDCs的纯度。不同浓度的瘦素(10、100、500 ng/ml)与小鼠BMDCs共培养24 h,用FLICA试剂盒检测caspase-1活性,用ROS检测试剂盒检测BMDCs ROS合成,THBP作为阳性对照。实验步骤按照说明书在流式细胞仪上进行。
1.2.6 siRNA转染 20 μmol/L NLRP3特异siRNA转染小鼠BMDCs细胞,使用Lipofectamin 2000按照说明书进行。6 h后转染细胞与不同浓度的瘦素(10、100、500 ng/ml)共培养24 h。荧光显微镜下观察红色荧光细胞转染表达情况,用实时荧光定量PCR分析NLRP3基因敲除的效果,所用引物序列如下:NLRP3-F:ATTACCCGCCCGAGAAAGG,NLRP3-R:CATGAGTGTGGCTAGATCCAAG。

2 结果
2.1 瘦素促进小鼠BMDCs IL-1β和IL-18分泌 体外诱导培养的BMDCs状态佳,纯度90%左右(图1)。为了研究瘦素对小鼠BMDCs细胞的作用,不同浓度的瘦素(10、100、500 ng/ml)加入小鼠BMDCs共培养24 h,以LPS+ATP作为阳性对照。收集细胞上清或细胞沉淀行ELISA或RT-PCR。结果证明高浓度瘦素(500 ng/ml)在基因和蛋白水平均促进小鼠BMDCs IL-1β(图2A、C)和IL-18(图2B、D)表达,尤其对IL-1β的基因促进作用更明显(P<0.001),瘦素100 ng/ml也可增强IL-1β基因表达(P<0.05)(图2C)。
2.2 瘦素激活caspase-1促进小鼠BMDCs IL-1β分泌而对IL-18无明显影响 IL-1β和IL-18前体水解成有活性的 IL-1β和IL-18,是IL-1β和IL-18合成和分泌的关键一步,这一步是通过NLRP3炎性体的组成部分caspase-1实现的[16,17]。因为瘦素促进小鼠BMDCs IL-1β和IL-18分泌,接下来我们探讨瘦素对caspase-1的作用。以LPS+ATP为阳性对照,结果我们发现,瘦素呈剂量依赖的关系增强caspase-1活性(图3A、B),用caspase-1抑制剂Ac-YVAD-cmk抑制caspase-1活性,IL-1β在基因和蛋白水平均有降低(图3C、D),而IL-18水平无明显变化(图3E)。
2.3 瘦素上调NLRP3基因表达促进小鼠BMDCs分泌IL-1β和IL-18 如前所述,NLRP3炎性体由NLRP3、ASC和caspase-1组成。瘦素可促进BMDCs分泌IL-1β和IL-18,而抑制caspase-1降低了瘦素引起的升高的IL-1β而对IL-18无明显作用,我们试图探讨瘦素对NLRP3的影响及抑制NLRP3对IL-1β和IL-18的影响。结果发现高浓度瘦素(500 ng/ml)可上调小鼠BMDCs NLRP3基因表达(图4A),用siRNA干扰NLRP3表达,并于荧光显微镜下观察转染效果(图4B),高浓度瘦素引起的升高的IL-1β(图4C、D)和IL-18(图4E)也随之下降,差异具有统计学意义。
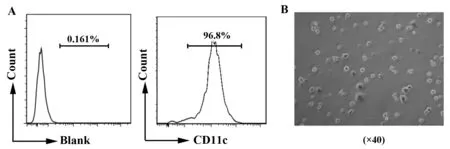
图1 小鼠骨髓来源的树突状细胞(BMDCs)纯度及形态Fig.1 Purity and morphology of BMDCs from mouseNote: A.Purity of BMDCs induced invitro by flow cytometry;B.Morphology of BMDCs under light microscope.
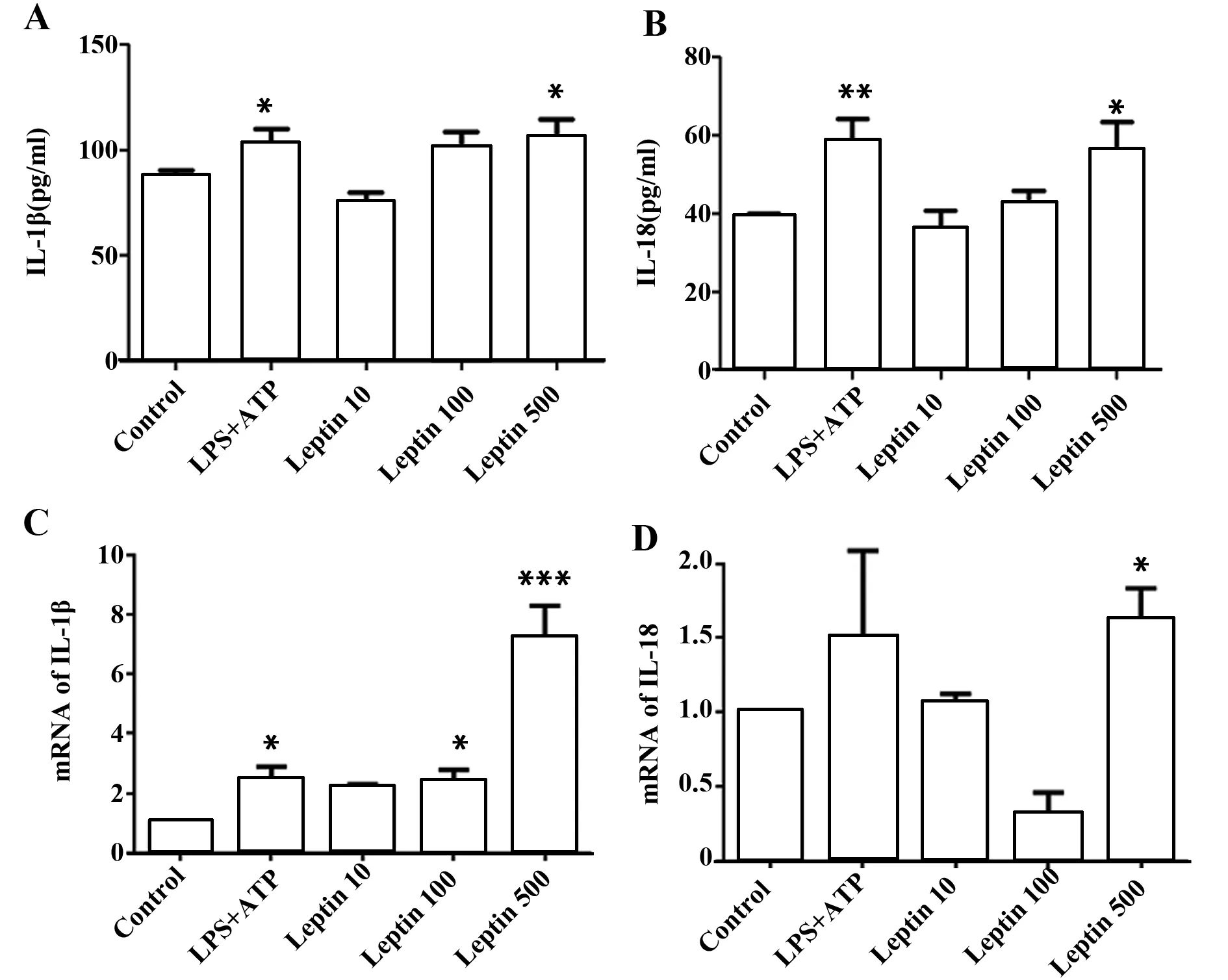
图2 瘦素促进BMDCs IL-1β和IL-18表达Fig.2 Leptin promotes IL-1β and IL-18 secretion in BMDCsNote: IL-1β(A) or IL-18(B) ELISA of culture supernatant from BMDCs incubated with LPS,ATP,LPS+ATP(L+A),or leptin at scalar doses(10 ng/ml,100 ng/ml,500 ng/ml)for 24 hours.Results are expressed as ng/ml and are means±SEM from four independent experiments. Relative mRNA level of pro-IL-1β(C) or IL-18(D) in BMDCs treated as above. Results are from three independent experiments.*.P<0.05, **.P<0.01,***.P<0.001.
2.4 K+外流参与瘦素引起的小鼠BMDCs IL-1β和IL-18升高 ROS是促进NLRP3炎性体激活的一种方式[18,19,20]。我们用流式细胞仪检测了不同浓度瘦素干预小鼠BMDCs后的ROS生成,结果发现不同浓度瘦素对ROS生成并没有明显影响(图5A、B)。
K+外流是促进NLRP3炎性体激活的另一种方式[21]。我们用不同浓度瘦素与100 mmol/L KCl共同培养,发现加入KCl抑制K+外流后高浓度瘦素引起的升高的IL-1β(图5C)和IL-18(图5D)水平明显下降。
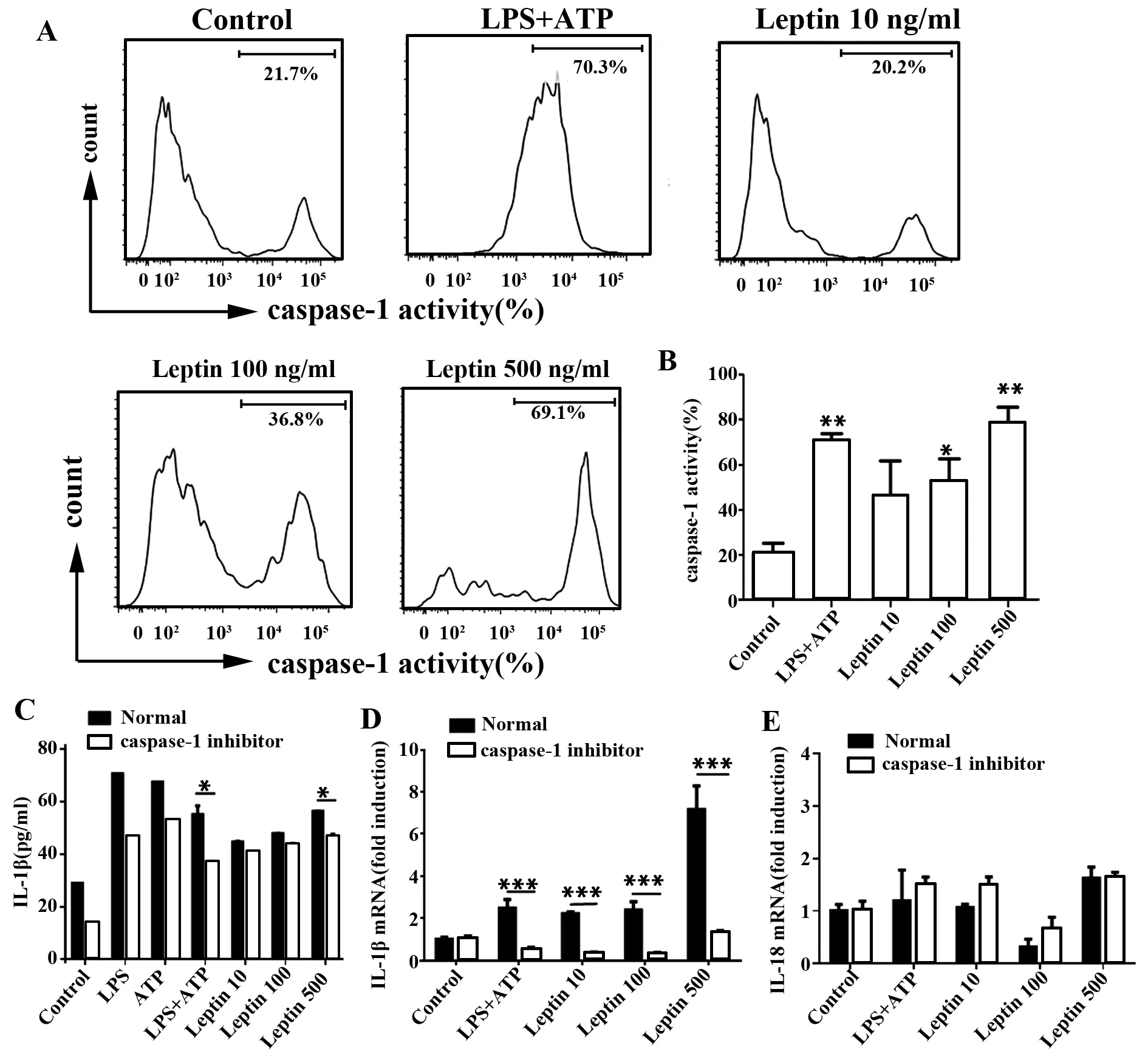
图3 瘦素促进BMDCs的caspase-1活化并分泌IL-1βFig.3 Caspase-1 activation facilitates IL-1β secretion in response to leptinNote: Caspase-1 activity was measured by intracellular FLICA staining in BMDCs incubated with LPS,ATP,LPS+ATP(L+A),or leptin at scalar doses(10 ng/ml,100 ng/ml,500 ng/ml)for 24 hours.Representative (A) and cumulative (B) data are from three experiments;C.ELISA of IL-1β inculture supernatant from BMDCs in the presence or absence of caspase-1 inhibitor Ac-YVAD-cmk(20 μmol/L) for 24 hours,results are expressed as ng/ml and are means±SEM from four independent experiments.Relative mRNA level of IL-1β(D) and IL-18(E) in BMDCs treated as in panel C.Results are from three independent experiments.*.P<0.05,**.P<0.01,***.P<0.001.


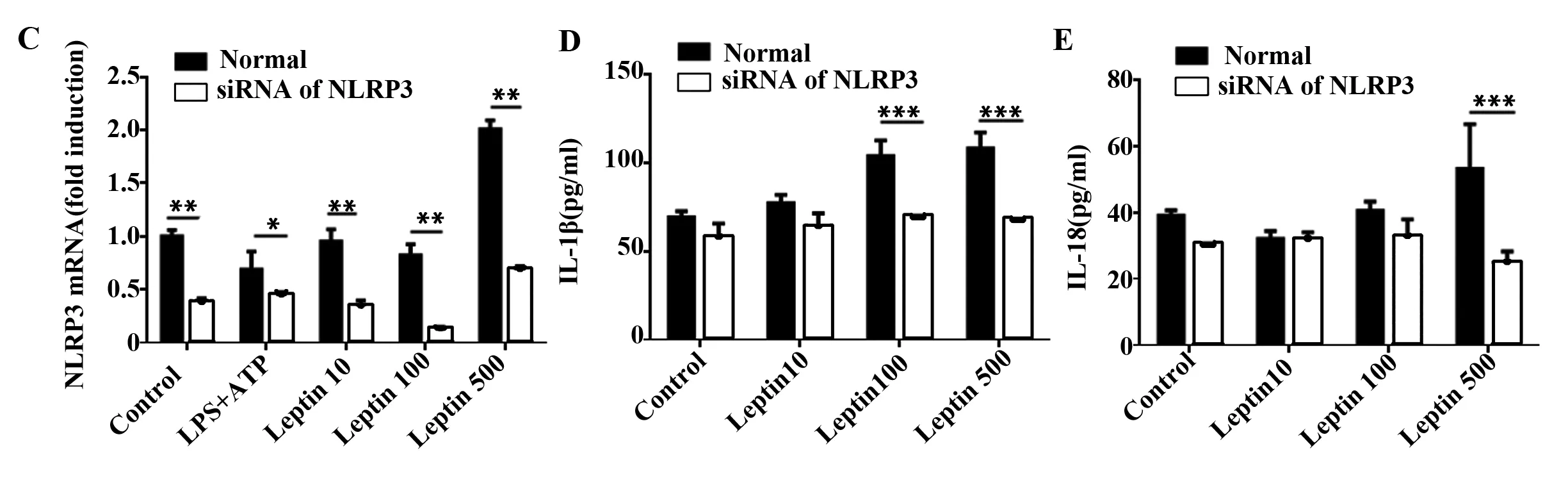
图4 瘦素上调BMDCs的NLRP3基因表达并分泌IL-1β和IL-18
Fig.4 NLRP3 up-regulation encourages IL-1β and IL-18 expression in response to leptin
Note: A. Relative mRNA level of NLRP3 in BMDCs incubated with LPS+ATP or leptin at scalar doses(10 ng/ml,100 ng/ml,500 ng/ml) for 24 hours;B.BMDCs nucleofected by NLRP3 specific siRNA carrying fluorescence and observed under fluorescence microscope;C.Relative mRNA level of NLRP3 in BMDCs after nucleofected with NLRP3 specific siRNA. IL-1β(D) or IL-18(E) ELISA of culture supernatant from BMDCs treated as inpanel C.*.P<0.05,**.P<0.01,***.P<0.001.
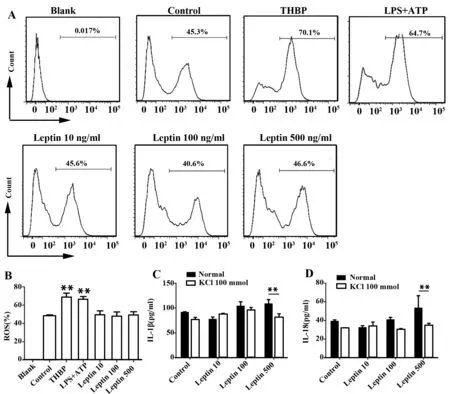
图5 K+外流参与瘦素引起的NLRP3炎性体活化并促进IL-1β和IL-18分泌Fig.5 K+ efflux is involved in producing IL-1β and IL-18 in response to leptinNote: A.Flow cytometric analysis of ROS in BMDCs incubated with leptin at scalar doses(10 ng/ml,100 ng/ml,500 ng/ml) for 24 hours.Using THBP as positive control.Representative data from three independent experiments;B. Cumulative data of ROS in BMDCs(treated as in panel A) from three experiments.IL-1β(C) or IL-18 (D) ELISA of culture supernatants from BMDCs incubated with leptin at scalar doses(10 ng/ml,100 ng/ml,500 ng/ml) for 24 hours in the presence or absence of KCl(100 mmol/L).*.P<0.05,**.P<0.01,***.P<0.001.
3 讨论
在这篇文章中我们发现瘦素在基因和蛋白水平促进小鼠BMDCs细胞分泌IL-1β和IL-18。之前一些研究报道:瘦素增加人外周血单个核细胞IL-1β释放,增强了人骨髓来源的DC细胞IL-1β的基因和蛋白表达水平[22]。瘦素促进牛外周血单个核细胞IL-1β分泌,但是对IL-1β的mRNA并没有影响[23]。而有些研究也发现瘦素促进人单核细胞分泌IL-18而对IL-1β并没有作用[24],甚至我们也发现瘦素可促进小鼠RAW264.7细胞IL-18分泌而不是IL-1β分泌(数据未发表)。IL-1β基因是IL-1细胞因子家族中最重要的一员,组织缺氧、微生物感染、 创伤等外界因素可以诱导多种细胞表达 IL-1β,包括单核、巨噬细胞、DC细胞、内皮细胞、角质形成细胞、系膜细胞以及人类肿瘤细胞,这些细胞被激活以后首先合成IL-1β 的前体,存在于胞浆中,没有活性。随后在IL-1β转换酶如caspase-1的作用下,产生成熟 IL-1β,从而发挥其生物学效应。实际上,虽然IL-1β和IL-18同是IL-1细胞因子家族,在结构和受体利用上非常相似,但是两者在表达、合成和加工方面并不相同[25-27]。李斯特菌产单核细胞(Lm)60蛋白是NLRP3炎性体非经典的激活剂,IL-1β和IL-18的产生是独立调节的,表明树突状细胞NLRP3炎性体产生IL-1β或IL-18需要完全不同的条件[28]。可能髓系免疫细胞是否对瘦素有应答及何种应答取决于细胞来源的种系及细胞分化的阶段。
我们发现瘦素上调NLRP3基因表达促进IL-1β和IL-18分泌而抑制caspase-1仅降低了IL-1β分泌而对IL-18无明显影响。尽管caspase-1是NLRP3炎性体的经典表现形式,但是近来caspase-8被鉴定为髓系细胞中的非经典炎性caspase,而且也可以产生IL-1β前体。Martin等[7]刚刚报道ATP 可诱导极化的Th17细胞表达IL-1受体,通过NLRP3和ASC依赖的方式活化caspase-8产生成熟IL-1β。据此我们推测瘦素可能通过caspase-8依赖的方式促进BMDCs产生IL-18,在今后的工作中我们将进一步验证。
目前ROS生成、K+外流和溶酶体破裂是NLRP3激活的三种主要方式。我们发现加入KCl抑制BMDCs K+外流可使高浓度瘦素引起的升高的IL-1β和IL-18水平下降,说明K+外流参与瘦素引起的小鼠BMDCs IL-1β和IL-18升高。遗憾的是,我们发现瘦素对BMDCs的ROS生成并没有明显影响。可能瘦素少量诱发细胞凋亡,因此作为细胞凋亡的代谢产物-ROS生成变化不大,所以并不参与这一机制。
综上所述,我们发现瘦素通过K+外流激活NLRP3炎性体促进小鼠BMDCs分泌IL-1β和IL-18,这提示瘦素可能是NLRP3炎性体的激活剂,今后可作为抗微生物和抗炎治疗的靶点。
[1] Kim Y,Wang W,Okla M,etal.Suppression of NLRP3 inflammasome by γ-tocotrienol ameliorates type 2 diabetes[J].Lipid Res,2016,57:66-76.
[2] Shin MS,Kang Y,Lee N,etal.Self double-stranded(ds)DNA induces IL-1β production from human monocytes by activating NLRP3 inflammasome in the presence of Anti-dsDNA antibodies[J].J Immunol,2013,190:1407-1415.
[3] Tschopp J,Schroder K.NLRP3 inflammasome activation:the convergence of multiple signalling pathways on ROS production? [J].Nat Rev Immunol,2010,10:210-215.
[4] Próchnicki T,Mangan MS,Latz E,etal.Recent insights into the molecular mechanisms of the NLRP3 inflammasome activation[J].F1000 Faculty Rev,2016,doi:10.12688/F1000 research.86141.
[5] Arbore G,West EE,Spolski R,etal.T helper 1 immunity requires complement-drivenNLRP3 inflammasome activity in CD4+T cells[J].Science,2016,352(6292):aad1210.
[6] Bruchard M,Rebé C,Derangère V,etal.The receptor NLRP3 is a transcriptional regulator of TH2 differentiation[J].Nat Immunol,2015,16:859-870.
[7] Martin BN,Wang C,Zhang CJ,etal.T cell-intrinsic ASC critically promotes TH17-mediated experimental autoimmune encephalo-myelitis[J].Nat Immunol,2016,17:583-592.
[8] Mortimer L,Moreau F,MacDonald JA,etal.NLRP3 inflammasome inhibition is disrupted in a group of auto-inflammatory disease CAPS mutations[J].Nat Immunol,2016,17:1176-1186.
[9] White CS,Lawrence CB,Brough D,etal.Inflammasomes as therapeutic targets for Alzheimer′s disease[J].Brain Pathol,2017,27(2):223-234.
[10] Kim Y,Wang W,Okla M,etal.Suppression of NLRP3 inflammasome by γ-tocotrienol ameliorates type 2 diabetes[J].J Lipid Res,2016,57:66-76.
[11] Lu A,Li H,Niu J,etal.Hyperactivation of the NLRP3 inflammasome in myeloid cells leads to severe organ damage in experimental lupus[J].J Immunol,2017,198:1119-1129.
[12] Fernández-Riejos P,Najib S,Santos-Alvarez J,etal.Role of leptin in the activation of immune cells[J].Mediators Inflamm,2010,doi.org/10.1155/2010/568343.
[13] Yu Y,Liu Y,Shi FD,etal.Cutting edge:Leptin-induced RORγt expression in CD4+T cells promotes Th17 responses in systemic lupus erythematosus[J].J Immunol,2013,190:3054-3058.
[14] Liu Y,Yu Y,Matarese G,etal.Cutting edge:fasting-induced hypoleptinemia Expands functional regulatory T cells in systemic lupuserythematosus[J].J Immunol,2012,188:2070-2073.
[15] Wang X,Chrysovergis K,Kosak J,etal.Lower NLRP3 inflammasome activity in NAG-1 transgenic mice is linked to a resistance to obesity and increased insulin sensitivity[J].Obesity(Silver Spring),2014,22:1256-1263.
[16] Gross O,Thomas CJ,Guarda G,etal.The inflammasome:an integrated view[J].Immunol Rev,2011,243:13-15.
[17] Fu S,Xu L,Li S,etal.Baicalin suppresses NLRP3 inflammasome and nuclear factor-kappa B(NF-κB)signaling during Haemophilus parasuis infection[J].Vet Res,2016,47:80.
[18] Braga TT,Forni MF,Correa-Costa M,etal.Soluble uric acid activates the NLRP3 inflammasome[J].Sci Rep,2017,7:39884.
[19] Yin Y,Zhou Z,Liu W,etal.Vascular endothelial cells senescence is associated with NOD-like receptor family pyrin domain-containing 3(NL RP3)inflammasome activation via reactive oxygen species(ROS)/thioredoxin-interacting protein(TXNIP)pathway[J].Int J Biochem Cell Biol,2017,84:22-34.
[20] Toksoy A,Sennefelder H,Adam C,etal.Potent NLRP3 inflammasome activation by the HIV reverse-transcriptase inhibitor abacavir[J].J Biol Chem,2017,292(7):2805-2814.
[21] Grob CJ,Mishra R,Schneider KS,etal.K+efflux-independent NLRP3 inflammasome activation by small molecules targeting mitochondria[J].Immunity,2016,45:761-773.
[22] Mattioli B,Straface E,Quaranta MG,etal.Leptin promotes differentiation and survival of human dendritic cells and licenses them for Th1 priming[J].J Immunol,2005,174:6820-6828.
[23] Ahmed M,Shaban Z,Yamaji D,etal.Induction of proinflammatory cytokines and caspase-1 by leptin in monocyte/macrophages from holstein cows[J].J Vet Med Sci,2007,69:509-514.
[24] Jitprasertwong P,Jaedicke KM,Nile CJ,etal.Leptin enhances the secretion of interleukin(IL)-18,but not IL-1β,from human monocytes via activation of caspase-1[J].Cytokine,2014,65:222-230.
[25] Sims JE,Smith DE.The IL-1 family:regulators of immunity[J].Nat Rev Immunol,2010,10:89-102.
[26] Puren AJ,Fantuzzi G,Dinarello CA.Gene expression,synthesis,and secretion of interleukin 18 and interleukin 1beta are differentially regulated in human blood mononuclear cells and mouse spleen cells[J].Proc Natl Acad Sci U S A,1999,96:2256-2261.
[27] Arend WP,Palmer G,Gabay C.IL-1,IL-18,and IL-33 families of cytokines[J].Immunol Rev,2008,223:20-38.
[28] Schmidt RL,Lenz LL.Distinct licensing of IL-18 and IL-1β secretion in response to NLRP3 inflammasome activation[J].PLoS One,2012,7:e45186.
[收稿2017-03-09]
(编辑 张晓舟)
Impact and mechanism of leptin on bone marrow-derived dendritic cells(BMDCs)via NLRP3 inflammasome
YUYi-Yun,FUSi-Si,LIULei,YANGJie,HANLei,LÜLing.
DivisionofRheumatology,HuashanHospital,FudanUniversity,Shanghai200040,China
Objective:To investigate the role and mechanism of leptin on dendritic cells by NLRP3 inflammasome.Methods: BMDCs were induced in vitro,leptin with scalar doses was cocultured with BMDCs,IL-1β and IL-18 mRNA expression and protein secretion level were measured by q-RT-PCR and ELISA respectively.Caspase-1 activity or ROS synthesis were tested with FLICA kit or ROS detection assay kit on flow cytometry.IL-1β or IL-18 were detected after caspase-1 was inhibited by Ac-YVAD-cmk or NLRP3 was interfered by siRNA or ROS inhibitor DPI or KCL were added.Results: Leptin promoted secretion of IL-1β and IL-18.Leptin up-regulated NLRP3 and activted caspase-1 to secret proinflammtory cytokine,which K+efflux took part in.Conclusion: Leptin promotes secretion of IL-1β and IL-18 by activating NLRP3 inflammasome,and K+efflux takes part in this,which hints us that leptin may be an activator of NLRP3 inflammasome.
Leptin;NLRP3 inflammasome;Dendritic cells;Cytokine
10.3969/j.issn.1000-484X.2017.07.003
①本文受国家自然科学基金项目(81401345)和复旦大学附属华山医院北院青年医师培养计划资助。
于一云(1981年-),女,博士,主治医师,主要从事系统性红斑狼疮、痛风、硬皮病等方面的研究,E-mail:13788978206@163.com。
及指导教师:吕 玲(1964年-),女,博士,教授,主要从事自身免疫性疾病的研究,E-mail:huashanlvling@sina.com。
R392
A
1000-484X(2017)07-0971-05
②共同第一作者。
③上海市血液中心血液工程学科,上海200051。
