组织定居记忆性T细胞的免疫学特征研究进展①
2017-08-07余思菲吴长有
余思菲 吴长有
(中山大学中山医学院免疫研究所,广东省器官捐献和移植免疫重点实验室,广州510080)
·专题综述·
组织定居记忆性T细胞的免疫学特征研究进展①
余思菲 吴长有
(中山大学中山医学院免疫研究所,广东省器官捐献和移植免疫重点实验室,广州510080)
记忆性T细胞通过表达或不表达趋化因子受体CCR7和血管L-选择素CD62(CD62L)来实现在机体外周血和淋巴组织间的循环,分为中央型记忆性T细胞(Central memory T cells,TCM)和效应型记忆性T细胞(Effector memory T cells,TEM)[1,2]。一般情况下TCM细胞表达CCR7和CD62L,主要分布于外周组织免疫器官和淋巴结,当再次受抗原刺激时可迅速分裂增殖和分化;TEM细胞低水平表达或不表达CCR7和CD62L,主要存在于非淋巴组织和器官,参与周身循环,可迁移至外周炎症组织发生速发性效应功能。组织定居记忆性T细胞(Tissue-resident memory T cells,TRM)则不表达CCR7和CD62L,高表达CD69和/或CD103且不参与体循环[1,3,4](图1)。早在2001年,就有文献报道小鼠流感病毒感染后,肺中定居着一群长寿命的CD8+T细胞。李斯特菌和水疱性口炎病毒(Vesicular stomatitis virus,VSV)感染后,抗原特异性CD8+T细胞可迁移至非淋巴结组织并长期存活[5,6]。Gebhardt[7]和Walkim[8]等团队先后在LCMV感染的小肠黏膜和HSV感染的背根神经节及皮肤中发现,记忆性CD8+T细胞在感染后可停留于此而不参与血液循环。此后,人们在皮肤、肠黏膜、肺组织、阴道黏膜G[7]和W[8]甚至大脑等组织中先后鉴定出具有同样特征和功能的记忆性T细胞亚群,即TRM细胞。在过去十几年中,我们实验室对人呼吸系统中多种淋巴细胞亚群的记忆性细胞的免疫学功能进行了全面的研究,包括正常人外周血、鼻黏膜、结核性胸水等[9-12]。本文将结合国际上最新的研究成果和本实验室的相关研究结果,从表型、网络分化调控机制、功能等方面讨论TRM细胞的免疫学特征。
1 TRM细胞的表型特征及组织定居
TCM和TEM细胞参与体循环,是机体监视、预防和及时清除病原微生物再感染的关键[13,14]。然而,不同于TCM和TEM细胞,TRM细胞不表达趋化因子受体CCR7和归巢分子CD62L,不参与体循环,而是长期定居于某特定组织中,在局部组织中发挥快速而关键的保护性免疫应答。
除了不表达CCR7和CD62L外,不同组织中TRM细胞的表型特征具有明显的异质性[15]。我们取鼻息肉(Nasal polyps,NPs)、肺正常组织(lung normal tissue)、肠道淋巴结(lymph nodes)、扁桃体(tonsil)和外周血等样本,分离其中的单个核细胞,用流式细胞术分析记忆性(CD45RO+)T细胞的表型(图2)。与国际报道一致,结果显示鼻息肉、肺组织和淋巴结等低表达或不表达CD62L和CCR7,外周血中CD69和CD103的表达水平较低;鼻息肉、肺组织、扁桃体和淋巴结中的T细胞高表达CD69,鼻息肉、肺组织和扁桃体部分CD69+细胞表达CD103,其中以CD8+T细胞表达较高;淋巴结仅CD8+T细胞表达低水平的CD103。由此可见,特定组织定居的TRM细胞均高表达CD69分子,部分表达整合素E链(CD103)[15-17]。
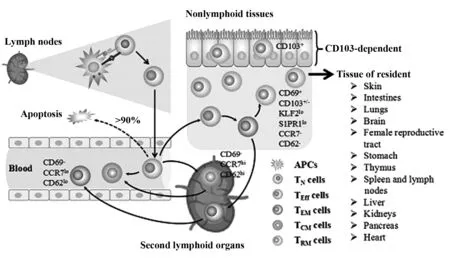
图1 记忆性T细胞的形成和体内循环Fig.1 Development and recirculation of memory T cellsNote: Naive T cells (TN cells) are activated by antigen presented by antigen presenting cells (APCs),and develop into effector T cells (TEff cells) to play immunological effects.More than 90% of TEff cells enter programmed apoptosis,only 5 to 10% cells develop into long-lived memory cells.Effector memory T cells do not express CCR7 and CD62L in nonlymphoid tissues;central memory T cells express CCR7 and CD62L,mostly in peripheral lymphoid tissues and lymph nodes;both of TCM and TEM cells can recirculate from peripheral blood to second lymphoid organs or nonlymphoid tissues.In local tissues,such as skin,intestines,lungs,brain,female reproductive tract,and so on,KLRG1-CD127hi precursor cells differentiate into TRM cells under the induction of inflammatory molecules,the expression of CD69 or CD103 on nonrecirculating TRM cells are up-regulated,and KLF2 and S1PR1 are down-regulated.
CD69是存在于许多不同组织部位TRM细胞的共同标志,如皮肤、肺、胃肠道的TRM细胞都表达CD69。最初,人们认为CD69是淋巴细胞早期活化的一个重要标志,与TCR信号的启动有密切关系[18]。但是,越来越多的研究证实TRM细胞上高表达的CD69不依赖于TCR的启动,与TRM细胞的组织定居密切相关[19]。有实验证明,T细胞上表达的CD69抑制1-磷酸鞘氨酸受体1(Sphingosine-1-phosphate receptor 1,S1PR1)的活性[20-22]。在人类和小鼠体内1-磷酸鞘氨醇(S1P)的分布水平是梯度分布的,由低到高依次为周围组织、淋巴结和血液。一方面,TRM细胞表面的CD69可结合到S1PR1的跨膜区域并促进其降解,从而阻止了这些T细胞识别S1P梯度的变化使得TRM细胞能够长期定居在组织当中。另一方面,组织中低水平的S1P亦影响了外周循环记忆性T细胞的进入。转录因子KLF2是调控S1PR1的上游关键因子,TRM细胞中观察到KLF2的表达水平明显降低[20]。CD103是TRM细胞另外一个重要的标志,在CD8+TRM细胞上的表达水平明显高于CD4+T细胞(图2)。CD103是与β7结合的整合素链,是屏障组织上皮细胞上表达的E钙黏蛋白的配体[23]。值得注意的是,并不是所有的TRM细胞均表达CD103,在肠道黏膜、次级淋巴结(脾脏)和肝脏等组织中均发现CD103-的TRM细胞[15,24-26]。小鼠病毒感染模型发现,小鼠近气道部位定居的TRM细胞不表达CD103,而高水平表达CD69和CD11a[27,28]。在某些组织中,除了定居的TRM细胞表达CD103外,组织中定居的固有淋巴样细胞(Innate lymphoid cells,ILCs)等其他细胞亚群也部分表达CD103[15,29]。我们分离鼻息肉组织中浸润的单个核细胞,用多色流式细胞术分析淋巴细胞中CD103+细胞的亚群(图 3)。结果显示,CD103主要表达于CD3+的T细胞中;进一步分析CD103+T细胞中CD4+、CD8+、NKT和γδ T细胞的百分比,结果显示以CD8+T细胞为主;非T细胞中,CD103+细胞以NK和单核细胞为主要。当首先设门于NK、B、单核细胞、CD4+、CD8+、NKT和γδ T细胞中,分析各细胞亚群中CD103的百分比,结果显示各细胞亚群中均部分表达CD103,其中以CD8+T细胞和γδ T细胞表达CD103的百分比最高。其他组织是否也存在类似的结果,还需要进一步的研究。
2 TRM细胞形成的调控机制
当病原微生物初次入侵机体,在淋巴结活化成熟的效应性T细胞游走至炎症部位,大部分效应性T细胞发挥作用后会进入一个程序性的凋亡过程,仅不到10%的细胞存活下来分化成为具有长寿命的记忆性T细胞(图1)。效应性T细胞分化为记忆性T细胞,与周围微环境及其自身转录因子的调控、归巢分子、细胞因子受体和其他表面分子的表达密切相关。已知,细胞接受TCR信号的刺激强度越大、炎症性细胞因子分泌越多,则分化为记忆性细胞的能力越低[30-33]。与外周循环记忆性CD8+T细胞不同,CD8+TRM细胞中EOMES和TCF1的表达降低,同时T-bet的表达也降低[19,34]。亦有研究发现,在肺组织CD103+TRM细胞的分化与T-bet密切相关[35]。皮肤中,T-bet的缺失将诱导KLRG-1低表达的TRM前体细胞的产生,并促进CD103的表达[19,36]。转录因子表达的高低,进一步调控细胞中其他分子的表达。klf2GFP转基因荧光示踪小鼠体内实验发现,参与调控S1P1表达的转录因子KLF表达降低后,T细胞表面S1PR1的表达明显降低,使得T细胞定居于组织部位而无法游走至外周[20]。细胞因子TGF-β、IL-33和TNF-α通过磷脂酰肌醇3激酶(Phosphatidylinositol-3-OH kinase,PI3K)和激酶Akt抑制KLF2的表达。此外,微环境中TGF-β与皮肤、肠道和肺组织中CD69+CD103+TRM细胞的分化密切相关[19,35,37-39],而CD103-TRM细胞的生成不依赖于TGF-β[40]。TGF-β亦可降低T-box转录因子T-bet和EOMES的表达,对皮肤表皮TRM细胞的形成至关重要[36]。然而,关于TGF-β调控CD69和CD103表达的分子机制还不明确。
细胞因子IL-15被认为在维持记忆性T细胞的稳定中发挥重要的作用,研究发现IL-15亦与TRM细胞的生成和维持有关。在HSV感染的皮肤中,IL-15的缺失将影响TRM细胞的生成[36]。在HSV感染前(7~14 d注射IL-15和/或IL-15R的中和抗体,TRM细胞的生成均将受到抑制。也有研究证实,IL-15只影响TRM细胞的分裂增殖而不参与调控TRM细胞的存活和维持[41]。除上述提到的细胞因子TGF-β、IL-33、TNF-α和IL-15参与TRM细胞的分化和组织定居以外,CD4+T细胞在组织中对CD8+TRM细胞的生成和定居至关重要[42,43]。Laidlaw等证实在TRM细胞形成的早期,未被CD4+T细胞辅助的CD8+T细胞无法正常的定居至气道上皮,且由于细胞表面与TGF-β作用的信号太弱导致CD8+T细胞表面CD103的表达降低。研究发现,CD4+T细胞产生大量的细胞因子IFN-γ促进肺CD103+CD8+TRM细胞的产生,并降低转录因子T-bet的表达而促进趋化因子受体CXCR3的表达。
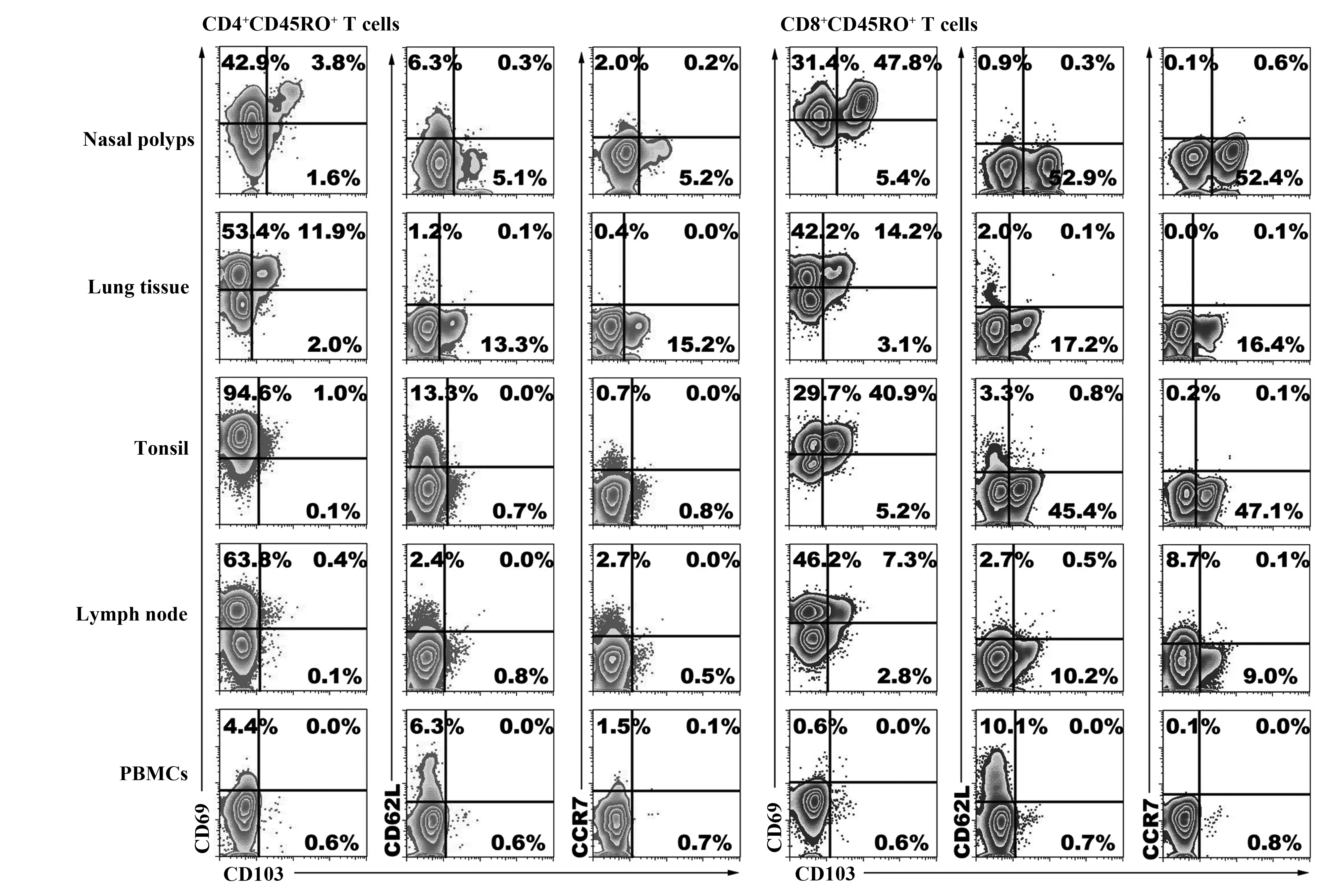
图2 不同组织中CD4+和CD8+记忆性T细胞的表型Fig.2 Phenotypical characteristics of memory CD4+ and CD8+ T cells from different tissuesNote: Mononuclear cells were isolated from nasal polyps, lung tissue,tonsil,lymph node,peripheral blood,and then flow cytometry was used to analyze the co-expression of CD103,CD69,CD62L and CCR7 on CD4+CD45RO+ (A) and CD8+CD45RO+ (B) T cells.
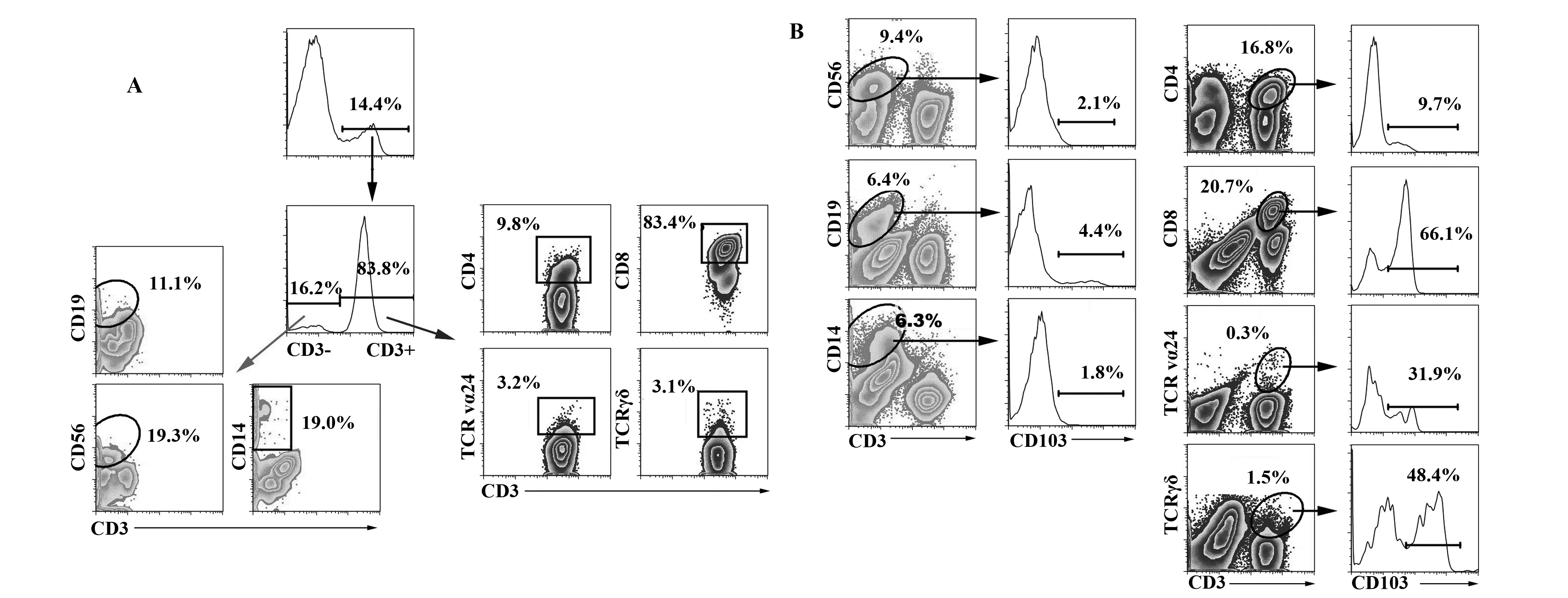
图3 鼻息肉组织中CD103+细胞的亚群分析Fig.3 Sub-population analysis of CD103+ T cells in nasal polypsNote: Mononuclear cells were isolated from nasal polyps,and then flow cytometry was used to analyze the sub-populations of CD103+ lymphocytes (A),and the frequencies of CD103+ on distinct sub-populations were also detected (B).
3 不同组织中的TRM细胞及其功能特性
在功能方面与TEM和TCM细胞相比较,TRM细胞能在病原微生物入侵机体的早期快速感应和识别抗原物质,不需要特异性增殖即可产生强烈的免疫效应[15,16]。一方面是TRM细胞定居位置更接近抗原,大部分抗原通过皮肤、黏膜等与外界接触的部位进入体内后,TRM细胞能快速感应并识别抗原,不需增殖即可发生特异性免疫应答,而循环的记忆性T细胞则需要经过定位、黏附、渗出的全过程才能到达感染部位。此外,TRM细胞可启动天然免疫而发挥广泛的组织抗病毒功能[44]。另一方面TRM细胞还可通过产生IFN-γ等细胞因子来募集循环的记忆性T细胞到达感染部位[28]。以下,我们将逐一分析皮肤、肺、肠道黏膜和阴道等不同组织中TRM细胞的基本特征和功能。
3.1 皮肤 正常成年人皮肤表面存在约20亿的T细胞,是整个血管系统细胞数量的2倍之多[45]。人皮肤中定居的T细胞全部表达CD45RO,同时表达皮肤相关的归巢分子CLA和CCR4,而生长于完全无菌环境的小鼠皮肤中T细胞的数量则极少[46,47]。TRM细胞而非其他的循环记忆性T细胞在皮肤局部发挥更为重要和快速的保护免疫效应[7]。同时,皮肤中的TRM细胞虽不参与体循环,却可以在皮肤局部不断地游走,快速识别再次入侵的病原微生物,对整个皮肤系统发挥重要的保护性作用[48]。在人皮肤组织中,表皮层和真皮层的TRM细胞在表型上略有差异[37]。表皮中以CD103+CD69+TRM细胞为主,真皮中以CD103-CD69+TRM细胞为主要,其中CD103+CD69+TRM细胞产生更高水平的效应性细胞因子,可快速启动天然免疫细胞,发挥广泛的抗病毒功能。除TRM细胞外,人和鼠皮肤中部分记忆性T细胞表达CCR7和CD62L,为中央型记忆性T细胞,依赖CCR7的表达可进出皮肤组织参与外周循环[37,49-51]。
3.2 肺 流感病毒感染小鼠是国内外研究TRM细胞的形成机制、表型特征和抗感染作用最早和最常用的模型之一,许多研究发现鼻滴感染比皮下感染病原体后更容易诱导肺组织产生免疫应答和肺TRM细胞[52,53]。在肺部流感病毒感染中,记忆性CD8+TRM的数量与抗流感的免疫保护作用成一定的正相关性[5,28,54];同时,肺部的CD4+TRM细胞比循环系统的CD4+记忆性T细胞在抗流感的免疫保护作用方面发挥更重要的作用[42,43]。TGF-β被证实促进CD103的表达,但是并不依赖于TGF-β活化的下游信号Smad4,虽然Smad4促进效应性和循环记忆性CD8+T细胞的分化[55]。肺CD4+TRM细胞表现出强烈的肺组织趋化性,过继转输给小鼠过后,肺组织来源的CD4+TRM细胞游走并定居于肺组织,比脾脏来源的记忆性CD4+T细胞提供更好的保护作用。选择性过表达IFN诱导转膜蛋白3(IFN-induced transmembrane protein,IFITM3)能够明显增强肺组织定居TRM细胞的抗流感病毒能力[56]。结核性胸膜炎胸液单个核细胞中CD4+和CD8+T细胞均高表达CD69分子,与CD69-T细胞相比较,CD69+T细胞经结核特异性抗原肽刺激后,产生更高水平的细胞因子和颗粒性分子,并表现出功能的多样性[57,58]。肺纤维化的小鼠模型中,鼻腔内疫苗接种,可以恢复原有的病理特征,疫苗诱导的肺TRM细胞发挥了至关重要的作用[59]。肺部过敏性疾病中,TRM细胞在过敏性哮喘中发挥的是一个调节作用,与其他的天然免疫细胞构成一个细胞网络,从而调控疾病的发生与发展[60]。肺部肿瘤中,CD8+CD103+淋巴细胞是一群肿瘤特异的TRM细胞,是肺部肿瘤生存和预后的一个重要调控因子[61]。
3.3 肠道黏膜 肠道黏膜组织是许多细菌和病毒易侵袭的部位,口腔单核细胞增多性李斯特菌感染机体后,效应性CD8+T细胞表达整合素α4β7和趋化因子受体CCR9并迁移至黏膜组织中,包括肠道黏膜[62,63]。迁移至肠道组织的CD8+T细胞表达CD127而不表达KLRG1,成为记忆性前体效应性T细胞(Memory precursor effector cells,MPECs)。CD127+KLRG1-CD8+T细胞在内源性TGF-β信号的作用下可快速表达CD69和CD103分子,其中CD103分子诱导细胞定居于肠道组织中,但是与TRM细胞在肠道组织中的长期定居无关[38]。此外,TGF-β信号也可以诱导α4β7的表达。与皮肤TRM细胞类似,肠道上皮层和固有层中TRM细胞的表型有一定的差异性。上皮层中主要以CD103+CD69+TRM细胞为主,而固有层中则包含CD103+和CD103-两群TRM细胞,在分化调控机制上两群细胞间也存在一定的差异性[40]。不同于CD103+TRM细胞的表型和分化条件,固有层中CD103-RM细胞高表达Klf2 mRNA、CD69分子、颗粒性杀伤分子Granzyme B和抗凋亡分子Bcl-2,其生成不依赖于TGF-β-TGF-βR信号及抗原刺激,而与局部炎症微环境相关。CXCR3-CXCL-10信号诱导CD8+T细胞迁移至炎症部位,影响CD103-TRM细胞的分化和病原体的清除。
3.4 阴道 女性阴道是生殖系统性疾病传染的主要通道,阴道作为一个限制性的免疫组织,在没有炎症和感染的情况下阻止活化的T细胞进入[64]。在改进HSV-2疫苗的免疫效果研发中,科学家发现皮下免疫疫苗合并阴道滴注趋化因子CXCR3单抗处理后,阴道黏膜中CD4+和CD8+T细胞明显高于单纯的皮下免疫组小鼠[65]。处理过后12周,定居于阴道黏膜中CD8+T细胞仍然明显高于单纯的皮下免疫组,而CD4+T细胞无长期定居特性。功能研究证实,阴道黏膜中长期定居的CD8+T细胞并不影响阴道中HSV-2的复制,而是通过抑制神经系统中HSV-2的复制来控制感染。同样,鼻滴免疫胸腺激酶缺陷的HSV-2后,亦可以诱导效应性CD8+T细胞迁移并长期定居于阴道黏膜,并在HSV-2感染早期发挥重要的免疫清除作用[66]。人乳头状瘤病毒载体经阴道免疫2次后,将诱导阴道中聚集大量的抗原特异性CD8+T细胞[67]。CD8+T细胞主要分布于阴道黏膜的内皮和上皮,高表达CD103而不表达CD62L,可在阴道组织中存活6个月之久,产生效应性细胞因子IFN-γ和TNF-α,在体内表现出显著的细胞毒性。诱导阴道内CD8+TRM细胞的产生,成为越来越多预防宫颈癌疫苗研发的关键点,并取得重大的突破[68]。
3.5 其他组织 除上述皮肤、肺、肠道和阴道组织以外,胃内皮及淋巴结、心脏、肾脏和前列腺甚至中枢神经脑组织中亦发现了表达CD69和/或CD103的TRM细胞[69]。正常情况下,淋巴细胞无法通过脑屏障,大脑被认为是免疫豁免区。然而,一旦发生感染,抗原特异性的CD8+T细胞将进入并长期定居于脑组织中,即脑TRM细胞[70]。滴鼻免疫水疱性口炎病毒VSV后,CD8+T细胞浸润至脑组织,在颅内树突状细胞(Dendritic cells,DCs)的信号提呈作用下表达CD103。但是,值得一提的是CD103的表达不依赖于抗原物质。CD103不仅对脑TRM细胞的表型特征有显著的影响,同时将影响TRM细胞的功能。脑CD103+TRM细胞分裂增殖能力弱,不参与外周循环,组织特异性要求高,一旦从组织中分离后将快速死亡[34,70]。基因组学分析脑CD103+TRM细胞的调控分子,与脑CD103-TRM细胞和脾脏CD103-TRM细胞相比较,脑CD103+TRM细胞高表达效应性分子Granzyme B、IL-2Ra和抑制性分子CTLA-4、PD-1,IFITM3的表达亦增加,转录因子EOSEM、T-bet和TCF-1表达下降[34]。此外趋化因子CCL3、CCL4和CXCL10在脑TRM细胞中的基因表达水平增加。
4 TRM细胞与疾病
TRM细胞对于局部组织中病原微生物的再感染具有强烈的保护性免疫应答作用,亦参与调控肿瘤的保护性免疫应答。同时,TRM细胞对变应原、自身抗体等病原体具有同样的免疫效应功能,这些抗原特异性的TRM细胞在局部组织一旦被激活,将造成严重的炎症反应,对机体造成伤害[71,72]。由于其组织定居、不参与外周循环、无需抗原提成细胞激活即可发生快速的免疫效应等特征,TRM细胞介导的炎症性疾病在临床上具有明显的特征,如病灶界限明显、持续时间长,对局部抗炎症治疗明显有效等。牛皮癣个典型的皮肤TRM细胞介导的自身免疫性疾病,其发现与临床抗E-选择素抗体药物CDP850的临床试验和皮肤移植实验有关[73,74]。CDP850已证实可以阻断血液中的T细胞游走至皮肤组织中,尽管CDP850的应用可以很好地清除体循环中的T细胞,但是并不能很好的改善牛皮癣炎症性病灶。提示,皮肤局部长久定居的TRM细胞而非循环系统来源的Tc17细胞(CD8+IL-17+TRM细胞)和Th22细胞(CD4+IL-22+TRM细胞)是顽固性牛皮癣的主要病因[75]。
5 结语
TRM细胞广泛地在各种外周组织中被鉴定及其不同于TEM和TCM细胞的分子调控机制和表型特征,使得人们越来越关注TRM细胞在临床的应用价值。特别是抗原特异性TRM细胞的发现,对研发特异性疫苗的作用价值不可估量。传统上,疫苗主要诱导机体体液免疫产生中和抗体发挥抗感染作用,但是对于很多病原体如真菌、胞内结核分枝杆菌(Mycobacterium tuberculosis,Mtb)、人免疫缺陷病毒(Human immunodeficiency virus 1,HIV-1)等,细胞免疫应答才是控制感染的关键。如何提高疫苗诱导机体局部组织中产生稳定而持久的抗原特异性TRM细胞的能力,将是科学家研发新型疫苗的重要突破口。目前,人们在小鼠实验中已经发现皮下注射和特异性趋化因子诱导可以促进阴道HSV-2和HPV特异性TRM细胞的生成,该免疫方法同时不会引起阴道局部和全身性的炎症反应[65,67]。这些研究基础,将是人们研发抗HIV-1疫苗的重要参考依据。
[1] Mueller SN,Gebhardt T,Carbone FR,etal.Memory T cell subsets,migration patterns,and tissue residence[J].Annu Rev Immunol,2013,31(0):137-161.
[2] 吴长有.初始和记忆T细胞的研究进展[J].现代免疫学,2005,25(5):353-356.
[3] Gebhardt T,Mueller SN,Heath WR,etal.Peripheral tissue surveillance and residency by memory T cells[J].Trends Immunol,2013,31(1):27-32.
[4] Carbone FR,Mackay LK,Heath WR,etal.Distinct resident and recirculating memory T cell subsets in non-lymphoid tissues[J].Curr Opin Immunol,2013,25(3):329-333.
[5] Hogan RJ,Usherwood EJ,Zhong W,etal.Activated antigen-specific CD8+T cells persist in the lungs following recovery from respiratory virus infections[J].J Immunol,2001,166(3):1813-1822.
[6] Masopust D,Vezys V,Marzo AL,etal.Preferential localization of effector memory cells in nonlymphoid tissue[J].Science,2001,291(5512):2413-2417.
[7] Gebhardt T,Wakim LM,Eidsmo L,etal.Memory T cells in nonlymphoid tissue that provide enhanced local immunity during infection with herpes simplex virus[J].Nat Immunol,2009,10(5):524-530.
[8] Wakim LM,Waithman J,van Rooijen N,etal.Dendritic cell-induced memory T cell activation in nonlymphoid tissues[J].Science,2008,319(5860):198-202.
[9] Xiao L,Jia L,Zhang Y,etal.Human IL-21+IFN-gamma+CD4+T cells in nasal polyps are regulated by IL-12[J].Sci Rep,2015,5:12781-12781.
[10] Yu SF,Zhang YN,Yang BY,etal.Human memory,but not naive,CD4+T cells expressing transcription factor T-bet might drive rapid cytokine production[J].J Biol Chem,2014,289(1):35561-35569.
[11] Fu X,Yang B,Lao S,etal.Human memory-like NK cells migrating to tuberculous pleural fluid via IP-10CXCR3 and SDF-1CXCR4 axis produce IFN-gamma in response to Bacille Calmette Guerin[J].Clin Immunol,2013,148(1):113-123.
[12] Yu S,Jia L,Zhang Y,etal.IL-12 induced the generation of IL-21-and IFN-gamma-co-expressing poly-functional CD4+T cells from human naive CD4+T cells[J].Cell Cycle,2015,14(21):3362-3372.
[13] Sallusto F,Lenig D,Forster R,etal.Two subsets of memory T lymphocytes with distinct homing potentials and effector functions[J].Nature,1999,401(6754):708-712.
[14] Ahmed R,Gray D.Immunological memory and protective immunity:understanding their relation[J].Science,1996,272(5258):54-60.
[15] Mueller SN,Mackay LK.Tissue-resident memory T cells:local specialists in immune defence[J].Nat Rev Immunol,2016,16(2):79-89.
[16] Schenkel JM,Masopust D.Tissue-resident memory T cells[J].Immunity,2014,41(6):886-897.
[17] Shin H,Iwasaki A.Tissue-resident memory T cells[J].Immunol Rev,2013,255(1):165-181.
[18] Shiow LR,Rosen DB,Brdickova N,etal.CD69 acts downstream of interferon-alphabeta to inhibit S1P1 and lymphocyte egress from lymphoid organs[J].Nature,2006,440(7083):540-544.
[19] Mackay LK,Rahimpour A,Ma JZ,etal.The developmental pathway for CD103(+)CD8+tissue-resident memory T cells of skin[J].Nat Immunol,2013,14(12):1294-1301.
[20] Skon CN,Lee JY,Anderson KG,etal.Transcriptional downregulation of S1pr1 is required for the establishment of resident memory CD8+T cells[J].Nat Immunol,2013,14(12):1285-1293.
[21] Mackay LK,Braun A,Macleod BL,etal.Cutting edge:CD69 interference with sphingosine-1-phosphate receptor function regulates peripheral T cell retention[J].J Immunol,2015,194(5):2059-2063.
[22] Cyster JG,Schwab SR.Sphingosine-1-phosphate and lymphocyte egress from lymphoid organs[J].Annu Rev Immunol,2012,30:69-94.
[23] Hadley GA,Higgins JM.Integrin alphaEbeta7:molecular features and functional significance in the immune system[J].Adv Exp Med Biol,2014,819:97-110.
[24] Schenkel JM,Fraser KA,Masopust D.Cutting edge:resident memory CD8 T cells occupy frontline niches in secondary lymphoid organs[J].J Immunol,2014,192(7):2961-2964.
[25] Anderson KG,Sung H,Skon CN,etal.Cutting edge:intravascular staining redefines lung CD8 T cell responses[J].J Immunol,2012,189(6):2702-2706.
[26] Tse SW,Cockburn IA,Zhang H,etal.Unique transcriptional profile of liver-resident memory CD8+T cells induced by immunization with malaria sporozoites[J].Genes Immun,2013,14(5):302-309.
[27] Turner DL,Bickham KL,Thome JJ,etal.Lung niches for the generation and maintenance of tissue-resident memory T cells[J].Mucosal Immunol,2014,7(3):501-510.
[28] Mcmaster SR,Wilson JJ,Wang H,etal.Airway-resident memory CD8 T cells provide antigen-specific protection against respiratory virus challenge through rapid IFN-gamma production[J].J Immunol,2015,195(1):203-209.
[29] Fuchs A,Vermi W,Lee JS,etal.Intraepithelial type 1 innate lymphoid cells are a unique subset of IL-12-and IL-15-responsive IFN-gamma-producing cells[J].Immunity,2013,38(4):769-781.
[30] Chang JT,Wherry EJ,Goldrath AW.Molecular regulation of effector and memory T cell differentiation[J].Nat Immunol,2014,15(12):1104-1115.
[31] Obar JJ,Lefrancois L.Memory CD8+T cell differentiation[J].Ann N Y Acad Sci,2010,1183:251-266.
[32] Sallusto F,Geginat J,Lanzavecchia A.Central memory and effector memory T cell subsets:function,generation,and maintenance[J].Annu Rev Immunol,2004,22:745-763.
[33] Angelosanto JM,Wherry EJ.Transcription factor regulation of CD8+T-cell memory and exhaustion[J].Immunol Rev,2010,236:167-175.
[34] Wakim LM,Woodward-Davis A,Liu R,etal.The molecular signature of tissue resident memory CD8 T cells isolated from the brain[J].J Immunol,2012,189(7):3462-3471.
[35] Laidlaw BJ,Zhang N,Marshall HD,etal.CD4+T cell help guides formation of CD103+lung-resident memory CD8+T cells during influenza viral infection[J].Immunity,2014,41(4):633-645.
[36] Mackay LK,Wynne-Jones E,Freestone D,etal.T-box transcription factors combine with the cytokines TGF-beta and IL-15 to control tissue-resident memory T cell fate[J].Immunity,2015,43(6):1101-1111.
[37] Watanabe R,Gehad A,Yang C,etal.Human skin is protected by four functionally and phenotypically discrete populations of resident and recirculating memory T cells[J].Sci Transl Med,2015,7(279):279r39.
[38] Sheridan BS,Pham QM,Lee YT,etal.Oral infection drives a distinct population of intestinal resident memory CD8(+)T cells with enhanced protective function[J].Immunity,2014,40(5):747-757.
[39] Zhang N,Bevan MJ.Transforming growth factor-beta signaling controls the formation and maintenance of gut-resident memory T cells by regulating migration and retention[J].Immunity,2013,39(4):687-696.
[40] Bergsbaken T,Bevan MJ.Proinflammatory microenvironments within the intestine regulate the differentiation of tissue-resident CD8(+)T cells responding to infection[J].Nat Immunol,2015,16(4):406-414.
[41] Schenkel JM,Fraser KA,Casey KA,etal.IL-15-independent maintenance of tissue-resident and boosted effector memory CD8 T cells[J].J Immunol,2016,196(9):3920-3926.
[42] Laidlaw BJ,Zhang N,Marshall HD,etal.CD4+T cell help guides formation of CD103+ lung-resident memory CD8+T cells during influenza viral infection[J].Immunity,2014,41(4):633-645.
[43] Mackay LK,Carbone FR.CD4 helpers put tissue-resident memory cells in their place[J].Immunity,2014,41(4):514-515.
[44] Slutter B,Harty JT.Instructing the instructor:tissue-resident T cells activate innate immunity[J].Cell Host Microbe,2014,16(4):421-423.
[45] Clark RA,Chong B,Mirchandani N,etal.The vast majority of CLA+T cells are resident in normal skin[J].J Immunol,2006,176(7):4431-4439.
[46] Clark RA.Skin-resident T cells:the ups and downs of on site immunity[J].J Invest Dermatol,2010,130(2):362-370.
[47] Booth JS,Toapanta FR,Salerno-Goncalves R,etal.Characterization and functional properties of gastric tissue-resident memory T cells from children,adults,and the elderly[J].Front Immunol,2014,5:294-294.
[48] Jiang X,Clark RA,Liu L,etal.Skin infection generates non-migratory memory CD8+T(RM)cells providing global skin immunity[J].Nature,2012,483(7388):227-231.
[49] Clark RA,Watanabe R,Teague JE,etal.Skin effector memory T cells do not recirculate and provide immune protection in alemtuzumab-treated CTCL patients[J].Sci Transl Med,2012,4(117):117r-117r.
[50] Debes GF,Arnold CN,Young AJ,etal.Chemokine receptor CCR7 required for T lymphocyte exit from peripheral tissues[J].Nat Immunol,2005,6(9):889-894.
[51] Bromley SK,Yan S,Tomura M,etal.Recirculating memory T cells are a unique subset of CD4+T cells with a distinct phenotype and migratory pattern[J].J Immunol,2013,190(3):970-976.
[52] Wu T,Hu Y,Lee YT,etal.Lung-resident memory CD8 T cells(TRM)are indispensable for optimal cross-protection against pulmonary virus infection[J].J Leukoc Biol,2014,95(2):215-224.
[53] Zhao J,Zhao J,Mangalam AK,etal.Airway memory CD4(+)T cells mediate protective immunity against emerging respiratory coronaviruses[J].Immunity,2016,44(6):1379-1391.
[54] Lee YN,Lee YT,Kim MC,etal.A novel vaccination strategy mediating the induction of lung-resident memory CD8 T cells confers heterosubtypic immunity against future pandemic influenza virus[J].J Immunol,2016,196(6):2637-2645.
[55] Hu Y,Lee YT,Kaech SM,etal.Smad4 promotes differentiation of effector and circulating memory CD8 T cells but is dispensable for tissue-resident memory CD8 T cells[J].J Immunol,2015,194(5):2407-2414.
[56] Wakim LM,Gupta N, mintern JD,etal.Enhanced survival of lung tissue-resident memory CD8(+)T cells during infection with influenza virus due to selective expression of IFITM3[J].Nat Immunol,2013,14(3):238-245.
[57] Li L,Qiao D,Fu X,etal.Identification of M.tuberculosis-specific Th1 cells expressing CD69 generated in vivo in pleural fluid cells from patients with tuberculous pleurisy[J].PLoS One,2011,6(8):e23700-e23700.
[58] Li L,Yang B,Zhang X,etal.Mycobacterium tuberculosis-specific polyfunctional cytotoxic CD8+T cells express CD69[J].Tuberculosis,2014,94(3):219-225.
[59] Collins SL,Chan-Li Y,Oh M,etal.Vaccinia vaccine-based immunotherapy arrests and reverses established pulmonary fibrosis[J].JCI Insight,2016,1(4):e83116-e83116.
[60] Hondowicz BD,An D,Schenkel JM,etal.Interleukin-2-dependent allergen-specific tissue-resident memory cells drive asthma[J].Immunity,2016,44(1):155-166.
[61] Djenidi F,Adam J,Goubar A,etal.CD8+CD103+tumor-infiltrating lymphocytes are tumor-specific tissue-resident memory T cells and a prognostic factor for survival in lung cancer patients[J].J Immunol,2015,194(7):3475-3486.
[62] Masopust D,Choo D,Vezys V,etal.Dynamic T cell migration program provides resident memory within intestinal epithelium[J].J Exp Med,2010,207(3):553-564.
[63] Hamann A,Andrew DP,Jablonski-Westrich D,etal.Role of alpha 4-integrins in lymphocyte ho ming to mucosal tissues in vivo[J].J Immunol,1994,152(7):3282-3293.
[64] Nakanishi Y,Lu B,Gerard C,etal.CD8(+)T lymphocyte mobilization to virus-infected tissue requires CD4(+)T-cell help[J].Nature,2009,462(7272):510-513.
[65] Shin H,Iwasaki A.A vaccine strategy that protects against genital herpes by establishing local memory T cells[J].Nature,2012,491(7424):463-467.
[66] Sato A,Suwanto A,Okabe M,etal.Vaginal memory T cells induced by intranasal vaccination are critical for protective T cell recruitment and prevention of genital HSV-2 disease[J].J Virol,2014,88(23):13699-13708.
[67] Cuburu N,Graham BS,Buck CB,etal.Intravaginal immunization with HPV vectors induces tissue-resident CD8+T cell responses[J].J Clin Invest,2012,122(12):4606-4620.
[68] Sun YY,Peng S,Han L,etal.Local HPV recombinant vaccinia boost following pri ming with an HPV DNA vaccine enhances local HPV-Specific CD8+T-cell-mediated tumor control in the genital tract[J].Clin Cancer Res,2016,22(3):657-669.
[69] Casey KA,Fraser KA,Schenkel JM,etal.Antigen-independent differentiation and maintenance of effector-like resident memory T cells in tissues[J].J Immunol,2012,188(10):4866-4875.
[70] Wakim LM,Woodward-Davis A,Bevan MJ.Memory T cells persisting within the brain after local infection show functional adaptations to their tissue of residence[J].Proc Natl Acad Sci U S A,2010,107(42):17872-17879.
[71] Park CO,Kupper TS.The emerging role of resident memory T cells in protective immunity and inflammatory disease[J].Nat Med,2015,21(7):688-697.
[72] Clark RA.Resident memory T cells in human health and disease[J].Sci Transl Med,2015,7(269):261r-269r.
[73] Bhushan M,Bleiker TO,Ballsdon AE,etal.Anti-E-selectin is ineffective in the treatment of psoriasis:a randomized trial[J].Br J Dermatol,2002,146(5):824-831.
[74] Boyman O,Hefti HP,Conrad C,etal.Spontaneous development of psoriasis in a new animal model shows an essential role for resident T cells and tumor necrosis factor-alpha[J].J Exp Med,2004,199(5):731-736.
[75] Cheuk S,Wiken M,Blomqvist L,etal.Epidermal Th22 and Tc17 cells form a localized disease memory in clinically healed psoriasis[J].J Immunol,2014,192(7):3111-3120.
[收稿2017-03-07]
(编辑 张晓舟)
10.3969/j.issn.1000-484X.2017.07.030
①本文为国家自然科学基金面上项目(No.31470888)。
余思菲(1987年-),女,博士,副研究员,主要从事T细胞的记忆性、功能多样性、分泌可塑性及临床意义方面的研究,E-mail:sifei_yu@163.com。
R392.1 R392.2
A
1000-484X(2017)07-1093-08
