原发性肝癌经导管肝动脉化疗栓塞术后应用不同保肝方案的效果比较研究
2017-08-07武中林吴勇超吴建华李顺宗李智岗
武中林,吴勇超,杨 超,吴建华,李顺宗,杨 光,李智岗
·论著·
原发性肝癌经导管肝动脉化疗栓塞术后应用不同保肝方案的效果比较研究
武中林,吴勇超,杨 超,吴建华,李顺宗,杨 光,李智岗*
目的 探讨原发性肝癌(PLC)经导管肝动脉化疗栓塞(TACE)术后应用不同保肝方案的保肝效果,为临床保肝治疗提供理论依据。方法 选取2013年10月—2016年10月河北医科大学第四医院收治的PLC患者180例,根据静脉滴注类保肝药物分类及保肝药物联合应用原则采用完全随机化分组分为6组(A、B、C、D、E、F组),每组30例。TACE术后给予两药联合保肝治疗,A组给予肝细胞膜修复保护剂+解毒类(多烯磷脂酰胆碱+还原型谷胱甘肽)、B组给予肝细胞膜修复保护剂+抗炎类(多烯磷脂酰胆碱+异甘草酸镁注射液)、C组给予肝细胞膜修复保护剂+利胆类(多烯磷脂酰胆碱+丁二磺酸腺苷蛋氨酸)、D组给予解毒类+抗炎类(还原型谷胱甘肽+异甘草酸镁注射液)、E组给予解毒类+利胆类(还原型谷胱甘肽+丁二磺酸腺苷蛋氨酸)、F组给予抗炎类+利胆类(异甘草酸镁注射液+丁二磺酸腺苷蛋氨酸)。记录并比较6组患者TACE术前3 d及术后第1天、第4天、第6天肝功能〔丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)〕水平,观察TACE相关并发症及药物不良反应。结果 不同保肝方案与时间在ALT、AST、TBIL、DBIL水平上存在交互作用(P<0.05),保肝方案、时间对ALT、AST、TBIL、DBIL水平的主效应显著(P<0.05)。6组患者术后第1天、第4天、第6天时ALT、AST、TBIL、DBIL水平较术前3 d时升高(P<0.05)。术前3 d和术后第1天时,6组患者ALT、AST、TBIL、DBIL水平比较,差异均无统计学意义(P>0.05)。术后第4天时,6组患者ALT、AST、TBIL、DBIL水平比较,差异有统计学意义(P<0.05);其中B、D、F组低于A、C、E组,F组低于B、D组(P<0.05)。术后第6天时,6组患者ALT、AST、TBIL、DBIL水平比较,差异有统计学意义(P<0.05);其中B、D、F组低于A、C、E组,F组低于B、D组,C组低于A、E组(P<0.05)。6组患者在治疗过程中主要不良反应为消化系统反应(表现为恶心、呕吐及食欲下降等)、轻度骨髓抑制、栓塞后综合征(表现为发热、肝区不适或肝区疼痛等),经对症处理后缓解,均未发生过敏、心悸、皮疹等药物不良反应。结论 急性肝损伤是TACE术后无法避免的并发症,抗炎类保肝药为首选药物,联合利胆类效果最佳,能有效改善患者肝功能,降低PLC介入治疗风险,值得临床推广使用。
肝肿瘤;栓塞,治疗性;肝损伤;保肝;治疗结果
武中林,吴勇超,杨超,等.原发性肝癌经导管肝动脉化疗栓塞术后应用不同保肝方案的效果比较研究[J].中国全科医学,2017,20(23):2862-2867,2874.[www.chinagp.net]
WU Z L,WU Y C,YANG C,et al.Comparative study of the effect of different hepatoprotective schemes for primary liver cancer after transhepatic arterial chemoembolization[J].Chinese General Practice,2017,20(23):2862-2867,2874.
原发性肝癌(primary liver cancer,PLC)是全世界范围最为常见的恶性肿瘤之一,严重危害了人类的生命健康,经导管肝动脉化疗栓塞(transhepatic arterial chemoembolization,TACE)是目前公认的非手术治疗的首选方法[1-3]。TACE术后最常见的并发症是急性肝损伤,严重者可出现黄疸、腹腔积液,甚至发生肝性脑病、急性肝衰竭等导致治疗相关性死亡[4-8],因此,TACE术后保肝治疗对患者具有十分重要的意义。研究显示,TACE术后应用保肝药物可减轻患者肝功能损伤及改善患者生活质量[9-13]。保肝药物种类繁多,其需要通过肝脏代谢,并非用得种类越多越好,若使用不当不仅会进一步增加肝脏负担不利于保肝,而且还会造成浪费[14-19]。如何选择保肝药物及选择哪几类保肝药物联合应用,最大限度发挥保肝作用又减少药物本身引起的肝损伤,使疗效最大化,不良反应最小化,促进TACE术后肝功能恢复,目前国内外对此没有明确指南及用药标准。因此,明确不同保肝方案与肝功能恢复之间的相关性具有重要临床意义,可为临床保肝治疗提供理论依据及合理建议。
1 资料与方法
1.1 纳入和排除标准 纳入标准:(1)首次TACE术前由超声、CT、MRI检查中至少两种影像学检查进行诊断,未行保肝治疗;(2)肝、肾功能检验水平在参考范围上限3倍以内,卡式(Karnofsky,KPS)评分≥60分。排除标准:(1)大量腹腔积液;(2)肝性脑病;(3)严重心、肺、肾功能不全;(4)肝功能Child-Pugh分级为C级;(5)有凝血功能障碍及出血倾向;(6)多发性转移癌。
1.2 一般资料 选取2013年10月—2016年10月河北医科大学第四医院收治的PLC患者180例,其中男114例,女66例;年龄35~76岁,平均年龄(59.2±8.3)岁。根据中国抗癌协会肝癌专业委员会2001年正式通过的PLC临床诊断与分期标准及肝功能Child-Pugh分级,其中Ⅱa期90例、Ⅱb期90例,A级153例、B级27例。根据静脉滴注类保肝药物分类及保肝药物联合应用原则采用完全随机化分组分为6组(A、B、C、D、E、F组),每组30例,其中Ⅱa期15例、Ⅱb期15例。6组患者性别、年龄、乙肝表面抗原(HBsAg)阳性率、肝功能Child-Pugh分级、门静脉瘤栓发生率、甲胎蛋白≥400 μg/L所占比例及动静脉瘘发生率比较,差异均无统计学意义(P>0.05,见表1)。
1.3 方法
1.3.1 TACE治疗 180例患者均签署TACE治疗知情同意书。患者均采用Seldinger技术穿刺股动脉,经股动脉置入5FRH导管,将导管插至腹腔干或变异肝动脉行数字减影血管造影(digital subtraction angiography,DSA),分析造影图像明确肝内肿瘤部位、大小、数量和供血动脉情况,以及有无门静脉瘤栓、动静脉瘘等。根据病变范围行肝固有动脉或肝左、右动脉或肿瘤供血动脉灌注化疗,灌注时间>30 min。将5FRH导管或微导管选至肿瘤供血动脉,如病灶局限于肝脏某叶或某段时使用微导管行超选择性栓塞,使用进口超液态碘化油(France Guerbet,12LU607A)与阿霉素(或羟喜树碱、丝裂霉素)混合制成乳剂作为栓塞剂,根据患者肿瘤血供及肝功能情况,在X线透视监视下缓慢行肿瘤供血动脉化疗栓塞,部分患者最后用自制明胶海绵碎末或明胶海绵颗粒加强栓塞,栓塞效果为复查造影显示肿瘤染色消失、主干存在。
1.3.2 TACE术后处理及保肝方案 6组患者TACE术后常规给予保肝、水化、支持及对症治疗(如抗乙肝病毒治疗)等。依据保肝药物作用机制及分类将静脉滴注类保肝药物分为6类:肝细胞膜修复保护剂、解毒类、抗炎类、利胆类、促进代谢类药物(维生素类、辅酶类)及其他类(生物制剂、肝细胞生长素、中成药制剂等),每类保肝机制基本相同。保肝方案依据保肝药物联合应用原则[14,17],除其他类外TACE术后给予两药联合保肝治疗,每类选择一种,其中促进代谢类药物(维生素类、辅酶类)为常规应用,A组给予肝细胞膜修复保护剂+解毒类(多烯磷脂酰胆碱+还原型谷胱甘肽)、B组给予肝细胞膜修复保护剂+抗炎类(多烯磷脂酰胆碱+异甘草酸镁注射液)、C组给予肝细胞膜修复保护剂+利胆类(多烯磷脂酰胆碱+丁二磺酸腺苷蛋氨酸)、D组给予解毒类+抗炎类(还原型谷胱甘肽+异甘草酸镁注射液)、E组给予解毒类+利胆类(还原型谷胱甘肽+丁二磺酸腺苷蛋氨酸)、F组给予抗炎类+利胆类(异甘草酸镁注射液+丁二磺酸腺苷蛋氨酸)。动脉灌注化疗方案,6组患者依据肝肾功能及一般情况给予奥沙利铂+5-氟尿嘧啶(5-Fu)+亚叶酸钙+阿霉素(或羟喜树碱、丝裂霉素)四药联合方案。
1.4 观察指标 记录6组患者TACE术前3 d(T0)及术后第1天(T1)、第4天(T2)、第6天(T3)肝功能〔丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、总胆红素(TBIL)、直接胆红素(DBIL)〕水平。记录6组患者TACE相关并发症及药物不良反应。
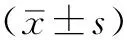
2 结果
2.1 不同治疗方法的各时间肝功能指标比较 不同保肝方案与时间在ALT、AST、TBIL、DBIL水平上存在交互作用(P<0.05),保肝方案、时间对ALT、AST、TBIL、DBIL水平的主效应显著(P<0.05)。6组患者T1、T2、T3时ALT、AST、TBIL、DBIL水平较T0时升高,差异均有统计学意义(P<0.05)。T0和T1时,6组患者ALT、AST、TBIL、DBIL水平比较,差异均无统计学意义(P>0.05)。T2时,6组患者ALT、AST、TBIL、DBIL水平比较,差异有统计学意义(P<0.05);其中B、D、F组低于A、C、E组,F组低于B、D组,差异均有统计学意义(P<0.05)。T3时,6组患者ALT、AST、TBIL、DBIL水平比较,差异有统计学意义(P<0.05);其中B、D、F组低于A、C、E组,F组低于B、D组,C组低于A、E组,差异均有统计学意义(P<0.05,见表2)。
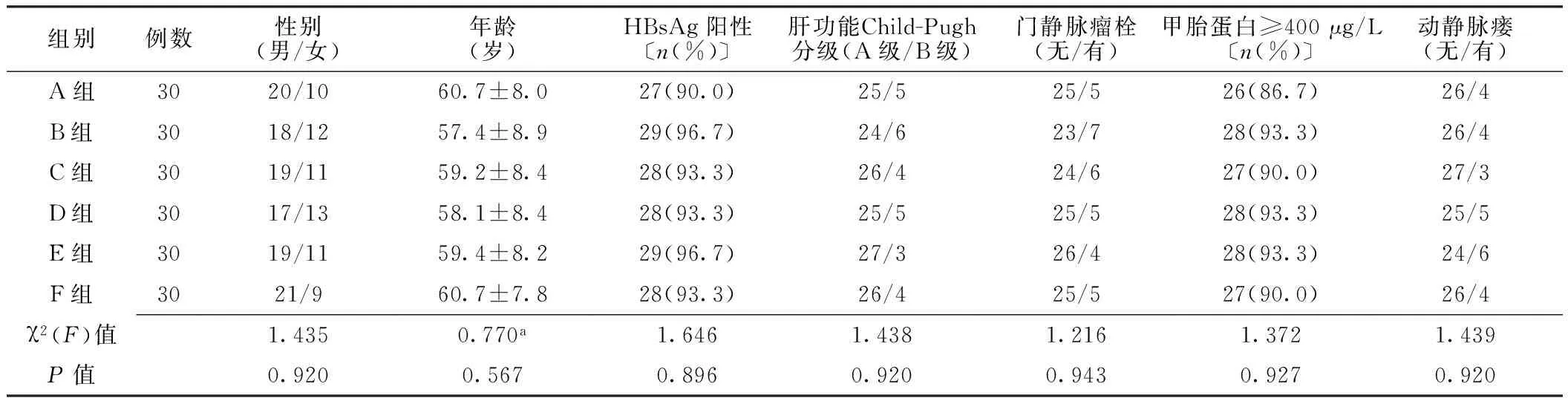
表1 6组患者一般资料比较
注:a为F值;HBsAg=乙肝表面抗原
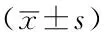
表2 6组患者介入术前及术后第1、4、6天ALT、AST、TBIL、DBIL水平比较
注:T0=术前3 d,T1=术后第1天,T2=术后第4天,T3=术后第6天;ALT=丙氨酸氨基转移酶,AST=天冬氨酸氨基转移酶,TBIL=总胆红素,DBIL=直接胆红素;与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05;与D组比较,dP<0.05;与E组比较,eP<0.05;与同组T0比较,fP<0.05
2.2 不良反应发生情况 6组患者在治疗过程中主要不良反应为消化系统反应(表现为恶心、呕吐及食欲下降等)、轻度骨髓抑制、栓塞后综合征(表现为发热、肝区不适或肝区疼痛等),经对症处理后缓解,均未发生过敏、心悸、皮疹等药物不良反应。
3 讨论
PLC发病率高且预后较差,全球每年新增病例中55%发生在我国[1],大多数患者在确诊时已处于中晚期,丧失了手术时机。TACE因有效地控制了肿瘤生长,明显延长了患者的生存期,现成为公认的非手术治疗首选和最有效的方法[1-3]。目前关于TACE疗效的文章国内外有大量报道,而忽略了安全性问题,TACE术后最常见的并发症是急性肝损伤[4-8],造成肝损伤的主要原因为:(1)栓塞剂所致肝损伤,因肝内血液循环特点如肝血窦、吻合支、侧支及反流等因素,即使采用超选择性栓塞,也无法避免栓塞剂进入无瘤区小动脉和毛细血管,引起肝组织缺血、缺氧,导致肝细胞变性坏死[3,8,20];(2)化疗药物所致肝损伤,化疗药物可通过不同的途径促发肝细胞凋亡[6-7,21];(3)肝炎病毒所致肝损伤,TACE术后机体对肝炎病毒的免疫抑制作用减弱,导致肝炎病毒在肝内大量复制或激活慢性肝炎病毒复制,进一步加重患者肝损伤,甚至可能直接导致肝衰竭[22-23]。肝功能中ALT和AST是反映肝细胞损伤的主要指标,其中ALT被世界卫生组织推荐为肝损伤最敏感的检测指标[14]。本研究显示,6组患者TACE术后第1、4、6天肝功能指标ALT、AST、TBIL、DBIL较术前3 d明显升高,说明急性肝损伤是TACE术后无法避免的并发症,同时提示TACE术中在保证疗效的前提下,应最大限度地保护正常肝组织[24]。
在我国90%以上的PLC是在乙型病毒性肝炎、肝硬化的基础上发生的[25],TACE术前许多患者已发生不同程度的肝功能损伤及肝功能储备下降。本研究显示,6组患者介入术前3 d内的肝功能指标较参考范围上限增高,说明患者TACE术前已发生了不同程度的肝功能损伤。TACE的栓塞剂及化疗药物对正常肝组织的损伤,使原本脆弱的肝功能进一步受损,因此我国患者术后更应进行积极有效地保肝治疗,减少肝细胞进一步损伤,使原本脆弱的肝功能尽快恢复。保肝药物种类繁多[15-17],目前报道TACE术后保肝治疗的研究也有很多,如张银华等[9]研究显示,腺苷蛋氨酸对PLC患者TACE术后肝损伤有很好的保护作用;辛文娟等[10]研究显示,异甘草酸镁在TACE术后肝损伤方面疗效确切,安全性较高;高慧涛等[11]研究显示,复方甘草酸苷联合舒肝宁可预防并减轻TACE对肝癌患者肝功能进一步的损伤,并可改善患者的生活质量;郑琳等[12]研究显示,丁二磺酸腺苷蛋氨酸联合异甘草酸镁注射液对PLC患者TACE术后出现急性肝损伤的近期保护效果满意,无明显不良反应;王莉等[13]研究显示,异甘草酸镁注射液联合还原型谷胱甘肽能较好地保护肝细胞,防治TACE术后肝损伤。以上研究取得了令人欣慰的结果,体现了保肝药物潜在的应用价值。保肝药物种类繁多,保肝方案同样众多,目前的研究及报道均较单一,未对不同保肝方案在治疗TACE所致急性肝损伤的效果进行分析及比较,因此明确不同保肝方案与肝功能恢复之间的相关性具有重要的临床意义,可为临床保肝治疗提供理论依据及合理建议。
正确认识保肝药物的作用机制,根据不同作用机制合理搭配,避免同类作用机制药物同时联用,才能更好地起到保肝作用[14,16-17]。研究显示,TACE术后应用保肝药物可减轻患者肝功能损伤及改善患者生活质量[9-10],联合使用不同作用机制的保肝药物可提高保肝治疗效果[11-13]。保肝药物联合应用原则是合理选药、合理搭配、避免重复,有针对性地选择2~3种联用[14,17]。任何药物都会出现不良反应,保肝药物并非用得种类越多越好,过多使用不仅会增加肝脏负担不利于保肝,而且还会造成浪费[16-17]。本研究显示,TACE术前3 d及术后第1天6组患者肝功能指标比较无差异;TACE术后第4天6组患者肝功能指标比较,B、D、F组低于A、C、E组,F组低于B、D组。说明各组治疗前肝功能无差异的情况下,抗炎类联合肝细胞膜修复保护剂、解毒类及利胆类保肝药物,能够更大强度地降低患者肝功能各指标水平,从而起到迅速有效的保肝作用。本研究显示,TACE术后第6天6组患者肝功能指标比较,B、D、F组低于A、C、E组,F组低于B、D组,C组低于A、E组。说明针对TACE所致急性肝损伤,抗炎类保肝药物为首选药物,联合利胆类效果最佳,其次是联合肝细胞膜修复保护剂及解毒类保肝药,能迅速降低患者肝功能各指标水平。本研究显示,抗炎类保肝药的抗炎、保护肝细胞膜、抗生物氧化及促进肝细胞增殖作用联合利胆类保肝药物的保护细胞骨架、提高Na+-K+-ATP酶活性及促进胆汁流动作用的多重保护机制,在降低肝功能各指标水平的程度和速度方面,较其他保肝方案具有明显的优越性,在较短时间内即可改善肝功能,降低了PLC介入治疗的风险。笔者体会,栓塞是造成急性肝损伤的决定性因素,保肝治疗只是改善受损的肝细胞功能,要从根本上减轻TACE所致急性肝损伤,关键在于介入术中是否行超选择性栓塞[24]。
如何使患者受最小的创伤获得最大化的治疗收益,是TACE治疗PLC的重点探究项目。虽然保肝药物种类繁多,但目前缺乏针对TACE所致急性肝损伤的特异性保肝药物,如何选择保肝药物及选择哪几类保肝药物联合应用,最大限度发挥保肝作用又减少药物本身引起的肝损伤,使疗效最大化,不良反应最小化,促进TACE术后肝功能恢复是临床十分关注的问题。本研究显示,急性肝损伤是TACE术后暂时无法避免的并发症,抗炎类保肝药物为首选药物,联合利胆类效果最佳,其次是联合肝细胞膜修复保护剂及解毒类,能迅速降低患者肝功能各指标水平及改善肝功能,降低PLC介入治疗的风险,值得临床推广使用。
作者贡献:武中林进行课题设计与实施,撰写论文,成文并对文章负责;吴勇超、杨超、吴建华、李顺宗、杨光进行课题实施,临床资料收集及整理,统计学分析;李智岗进行课题设计,质量控制及审校。
本文无利益冲突。
[1]郭启勇,温锋.肝细胞癌介入治疗的现状与展望[J].临床肝胆病杂志,2013,29(10):721-725.DOI:10.3969/j.issn.1001-5256.2013.10.001. GUO Q Y,WEN F.Current situation and prospect of interventional treatment of hepatocellular carcinoma[J].Journal of Clinical Hepatology,2013,29(10):721-725.DOI:10.3969/j.issn.1001-5256.2013.10.001.
[2]FORNER A,LLOVET J M,BRUIX J.Hepatocellular carcinoma[J].Lancet,2012,379(9822):1245-1255.DOI:10.1016/S0140-6736(11)61347-0.
[3]武中林,李智岗,吴晓云,等.经导管肝动脉栓塞与肝动脉灌注化疗栓塞在原发性肝癌介入治疗中的远期疗效比较[J].中国全科医学,2016,19(11):1292-1296.DOI:10.3969/j.issn.1007-9572.2016.11.013. WU Z L,LI Z G,WU X Y,et al.Long-term efficacy of TAE and TACE in primary liver cancer interventional treatment[J].Chinese General Practice,2016,19(11):1292-1296.DOI:10.3969/j.issn.1007-9572.2016.11.013.
[4]MIN Y W,KIM J,KIM S,et al.Risk factors and a predictive model for acute hepatic failure after transcatheter arterial chemoembolization in patients with hepatocellular carcinoma[J].Liver Int,2016,33(2):197-202.DOI:10.1111/liv.12023.
[5]SEKI A,HORI S,KOBAYASHI K,et al.Transcatheter arterial chemoembolization with epirubioin-loaded superabsorbent polymer microspheres for 135 hepatocellular caroinoma pabents:single-center experience[J].Cardiovasc Intervent Radiol,2011,34(3):557-565.DOI:10.1007/s00270-010-9975-y.
[6]陈荔,滕皋军.TACE对原发性肝癌肝功能的损伤[J].东南大学学报(医学版),2012,31(5):643-647.DOI:10.3969/j.issn.1671-6264.2012.05.031. CHEN L,TENG G J.TACE to primary liver cancer liver function damage[J].Journal of Southeast University(Medical Science Edition),2012,31(5):643-647.DOI:10.3969/j.issn.1671-6264.2012.05.031.
[7]周霖,王华明,艾鼎伦,等.原发性肝癌患者肝动脉化疗栓塞术后肝功能失代偿的临床分析[J].解放军医学杂志,2014,39(2):149-153.DOI:10.11855/j.issn.0577-7402.2014.02.14. ZHOU L,WANG H M,AI D L,et al.Clinical analysis of hepatic dysfunction after transcatheter arterial chemoembolization in patients with primary liver cancer[J].Medical Journal of Chinese People′s Liberation Army,2014,39(2):149-153.DOI:10.11855/j.issn.0577-7402.2014.02.14.
[8]刘金明,张克勤,李涛.肝癌多次TACE术后的肝硬化分级及预后因素分析[J].实用癌症杂志,2014,29(1):68-71.DOI:10.3969/j.issn.1001-5930.2014.01.022. LIU J M,ZHANG K Q,LI T.Analysis of cirrhosis classification and prognostic factors of primary hepatic carcinoma after repeated transcatheter arterial chemoembolization[J].The Practical Journal of Cancer,2014,29(1):68-71.DOI:10.3969/j.issn.1001-5930.2014.01.022.
[9]张银华,马德强,康健,等.腺苷蛋氨酸对肝细胞肝癌TACE术后的护肝作用[J].肝脏,2014,19(11):862-864.DOI:10.3969/j.issn.1008-1704.2014.11.016. ZHANG Y H,MA D Q,KANG J,et al.The gland glucoside methionine protects the liver function after the liver cell liver cancer TACE technique[J].Chinese Hepatology,2014,19(11):862-864.DOI:10.3969/j.issn.1008-1704.2014.11.016.
[10]辛文娟,赵文静.异甘草酸镁对原发性肝癌患者介入治疗术后肝功能指标的影响[J].现代肿瘤医学,2016,24(9):1421-1423.DOI:10.3969/j.issn.1672-4992.2016.09.025. XIN W J,ZHAO W J.Effect of liver function in patients with primary liver cancer after interventional for treatment of postoperative with Magnesium isoglycyrrhizinate[J].Journal of Modern Oncology,2016,24(9):1421-1423.DOI:10.3969/j.issn.1672-4992.2016.09.025.
[11]高慧涛,王美玲,陈小冰,等.复方甘草酸苷联合舒肝宁对PLC肝动脉灌注化疗栓塞术后保肝作用的临床观察[J].中国药物与临床,2013,13(11):1487-1488.DOI:10.11655/zgywylc2013.11.052. GAO H T,WANG M L,CHEN X B,et al.The compound prescription glycyrrhizic acid glucoside unites Shu Ganning to guarantee the liver function after the PLC hepatic artery irrigation chemotherapy embolism technique the clinical observation[J].Chinese Remedies & Clinics,2013,13(11):1487-1488.DOI:10.11655/zgywylc2013.11.052.
[12]郑琳,肖金成,郭晨阳.丁二磺酸腺昔蛋氨酸联合异甘草酸镁对Ⅱ期原发性肝癌TACE治疗后保肝作用的研究[J].疑难病杂志,2011,10(8):600-602.DOI:10.3969/j.issn.1671-6450.2011.08.017. ZHENG L,XIAO J C,GUO C Y.The clinical study on the liver-protection of S-adenosy-methionine combined with magnesium isoglycyrrhizinate in stage Ⅱ hepatocellular carcinoma patients after TACE[J].Chinese Journal of Difficult and Complicated Cases,2011,10(8):600-602.DOI:10.3969/j.issn.1671-6450.2011.08.017.
[13]王莉,陆笼辉,钟春生.异甘草酸镁联合还原型谷胱甘肽防治肝癌TACE术后肝损害疗效观察[J].肝脏,2016,21(1):63-65.DOI:10.3969/j.issn.1008-1704.2016.01.019. WANG L,LU L H,ZHONG C S.After the different glycyrrhizic acid magnesium returns to original state jointly the glutathione preventing and controlling liver cancer TACE technique the liver harm curative effect observation[J].Chinese Hepatology,2016,21(1):63-65.DOI:10.3969/j.issn.1008-1704.2016.01.019.
[14]中华医学会感染病学分会,肝脏炎症及其防治专家共识专家委员会.肝脏炎症及其防治专家共识[J].中华肝脏病杂志,2014,22(2):94-103.DOI:10.3760/cma.j.issn.1007-3418.2014.02.006. Society of Infectious Dieases,Chinese Medical Association,Expert Committee for Prevenaon and Management of Liver Inflammation.Consensus statement by the expert commlttee for prevention and management of liver inflammation in China[J].Chinese Journal of Hepatology,2014,22(2):94-103.DOI:10.3760/cma.j.issn.1007-3418.2014.02.006.
[15]黎规丰,张周英,杨成密,等.常见保肝药的分类及作用[J].中国实用医药,2012,7(26):236-238.DOI:10.3969/j.issn.1673-7555.2012.26.187. LI G F,ZHANG Z Y,YANG C M,et al.The classification of the common protect liver medicine and action[J].China Practical Medicine,2012,7(26):236-238.DOI:10.3969/j.issn.1673-7555.2012.26.187.
[16]林胜利,陈燕萍.我院保肝药的种类与合理应用[J].海峡药学,2013,25(3):259-260. LIN S L,CHEN Y P.Protect liver medicine in our species and reasonable application[J].Strait Pharmaceutical Journal,2013,25(3):259-260.
[17]张继红,邓量,许峰峰.保肝药的种类与临床应用[J].广东肝脏,2012,1(1):50-53. ZHANG J H,DENG L,XU F F.The kinds of protect liver medicine and clinical applications[J].Guangdong Hepatology,2012,1(1):50-53.
[18]汤静,朱玲,胡珊珊,等.药物性肝病的发病类型及保肝药物的作用机制[J].世界华人消化杂志,2015,23(19):3046-3052. TANG J,ZHU L,HU S S,et al.Drug-induced liver disease:Types and mechanisms of action of liver-protecting drugs[J].World Chinese Journal of Digestology,2015,23(19):3046-3052.
[19]胡琴,刘维,邵宏.药物性肝损伤的药物治疗研究进展[J].中国临床药理学与治疗学,2016,21(2):231-236. HU Q,LIU W,SHAO H.Research progress of pharmacotherapy drug-induced liver injury[J].Chinese Journal of Clinical Pharmacology and Therapeutics,2016,21(2):231-236.
[20]UYGUN A,KADAYIFCI A,YESILOVA Z,et al.Serum leptin levels in patients with nonalcoholic steatohepatitis[J].Am J Gastroenterol,2000,95(12):3584-3589.DOI:10.1111/j.1572-0241.2000.03297.x.
[21]胡道予.中晚期肝癌的介入治疗[J].临床外科杂志,2008,16(9):581-582. HU D Y.Interventional therapy of hepatocellular carcinoma in middle and advanced stages[J].Journal of Clinical Surgery,2008,16(9):581-582.
[22]尹芝兰,肖恩华.原发性肝癌行TACE术后对乙型肝炎病毒影响[J].介入放射学杂志,2014,23(12):1114-1116.DOI:10.3969/j.issn.1008-794X.2014.12.024. YIN Z L,XIAO E H.The influence of TACE for primary hepatocellular carcinoma on hepatitis B virus[J].Journal of Interventional Radiology,2014,23(12):1114-1116.DOI:10.3969/j.issn.1008-794X.2014.12.024.
[23]王丽君,卜文哲,陈华,等.TACE联合恩替卡韦治疗乙型肝炎相关原发性肝癌回顾性分析[J].中华肿瘤防治杂志,2014,21(20):1617-1621. WANG L J,BU W Z,CHEN H,et al.Clinical study of TACE with or without antiviral treatment for hepatitis B virus related unresectable hepatocellular carcinoma[J].Chinese Journal of Cancer Prevention and Treatment,2014,21(20):1617-1621.
[24]武中林,谷铁树,康一鹤,等.精准TACE在原发性肝癌中的应用[J].实用放射学杂志,2016,32(6):933-937.DOI:10.3969/j.issn.1002-1671.2016.06.028. WU Z L,GU T S,KANG Y H,et al.Application of the accurate transhepatic arterial chemoembolization in primary liver cancer[J].Journal of Practical Radiology,2016,32(6):933-937.DOI:10.3969/j.issn.1002-1671.2016.06.028.
[25]广东省抗癌协会肝癌专业委员会.肝癌多学科综合治疗团队建立——广东专家共识(1)[J].临床肝胆病杂志,2014,34(11):112-115.DOI:10.3969/j.issn.1001-5256.2014.11.004. Society of Liver Cancer,Guangdong Provincial Anti-cancer Association.Establishment of multi-disciplinary team for comprehensive treatment of liver cancer-congsensus of experts in Guangdong,China(1)[J].Journal of Clinical Hepatology,2014,34(11):112-115.DOI:10.3969/j.issn.1001-5256.2014.11.004.
(本文编辑:张小龙)
Comparative Study of the Effect of Different Hepatoprotective Schemes for Primary Liver Cancer after Transhepatic Arterial Chemoembolization
WUZhong-lin,WUYong-chao,YANGChao,WUJian-hua,LIShun-zong,YANGGuang,LIZhi-gang*
DepartmentofRadiology,FourthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
*Correspondingauthor:LIZhi-gang,Professor;E-mail:fsklizhigang2013@163.com
Objective To explore the effects of different hepatoprotective schemes for primary liver cancer(PLC) after transhepatic arterial chemoembolization(TACE),in order to provide a theoretical basis for clinical hepatoprotective treatment.Methods We enrolled 180 PLC cases who
treatment in Fourth Hospital of Hebei Medical University between October 2013 and October 2016 and randomized them into six groups(groups A,B,C,D,E and F) with 30 cases in each based on the classification of hepatoprotective drugs injected intravenously,and the principle of combined use of hepatoprotective drugs.Each group of patients were given double-drug hepatoprotective therapy after TACE:group A received liver cell membrance repair agent and detoxification drugs(polyene phosphatidylcholine injection+reduced glutathione for injection);group B received liver cell membrance repair agent and anti-inflammation drugs(polyene phosphatidylcholine injection+magnesium isoglycyrrhizinate),group C received liver cell membrance repair agent and cholagogic drugs(polyene phosphatidylcholine injection+ademetionine 1,4-butanedisulfonate for injection),group D received detoxification drugs and anti-inflammation drugs(reduced glutathione for injection + magnesium isoglycyrrhizinate),group E received detoxification drugs and cholagogic drugs(reduced glutathione for injection + ademetionine 1,4-butanedisulfonate for injection),group F received anti-inflammation drugs and cholagogic drugs(magnesium isoglycyrrhizinate+ademetionine 1,4-butanedisulfonate for injection).Levels of liver function indexes(ALT,AST,TBIL,DBIL) measured three days before TACE and on the 1st,4th,6th days after TACE,and drug-induced adverse reactions and complications related to TACE were recorded and compared in the groups.Results The hepatoprotective scheme and its duration of action produced obvious interaction effect on the levels of ALT,AST,TBIL and DBIL(P<0.05).The hepatoprotective scheme and its duration of action exerted significant main effect on the levels of ALT,AST,TBIL and DBIL(P<0.05).Significant increase was noticed in the serum ALT,AST,TBIL and DBIL measured on the 1st,4th,6th days after TACE compared with that measured 3 days before TACE in the same group(P<0.05).The levels of ALT,AST,TBIL,DBIL measured 3 days before surgery as well as those measured on the 1st day after TACE did not differ significantly between all the groups(P>0.05).The levels of ALT,AST,TBIL and DBIL measured on the 4th day after TACE were lower in groups B,D and F than in groups A,C and E(P<0.05),and they were the lowest in group F(P<0.05).The levels of ALT,AST,TBIL and DBIL measured on the 6th day after TACE were lower in groups B,D and F than in groups A,C and E(P<0.05),and they were lower in group F than in groups B and D(P<0.05),and lower in group C than in groups A and E(P<0.05).The major adverse reactions occurred in the patients during treatment were digestive reactions( nausea,vomiting and loss of appetite),mild bone marrow suppression,syndrome after embolization(fever,liver discomfort or pain in the liver),but all were relieved after symptomatic treatment.There were no allergies,palpitations,skin rash and other drug-related adverse reactions.Conclusion Acute liver injury is an unavoidable complication after TACE.The anti-inflammation drugs are the first choice hepatoprotective drugs after TACE.But when they combined with cholagogic drugs,the efficacy will be increased.With improving liver function and decreasing the risk of interventional therapy for PLC,further clinical application should be promoted.
Liver neoplasms;Embolization,therapeutic;Liver injury;Hepatoprotective;Treatment outcome
河北省医学科学研究重点课题项目(20160181)
R 735.7
A
10.3969/j.issn.1007-9572.2017.07.y20
2017-01-03;
2017-06-20)
050011河北省石家庄市,河北医科大学第四医院放射科
*通信作者:李智岗,教授;E-mail:fsklizhigang2013@163.com
